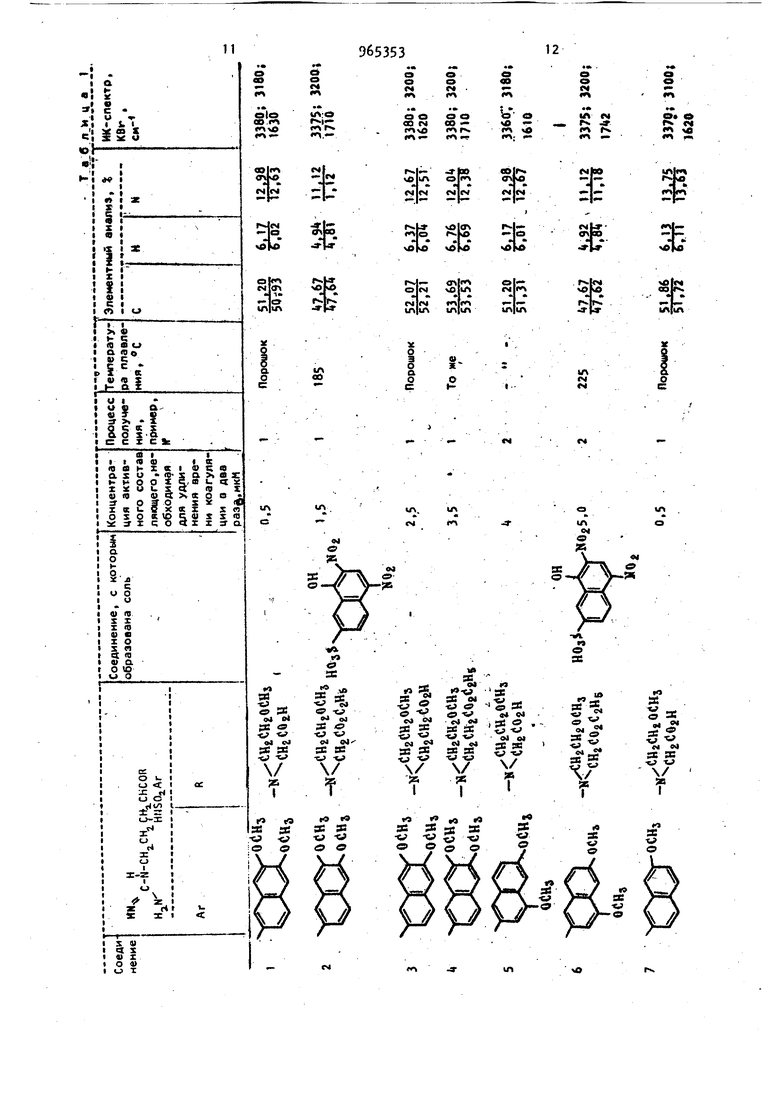
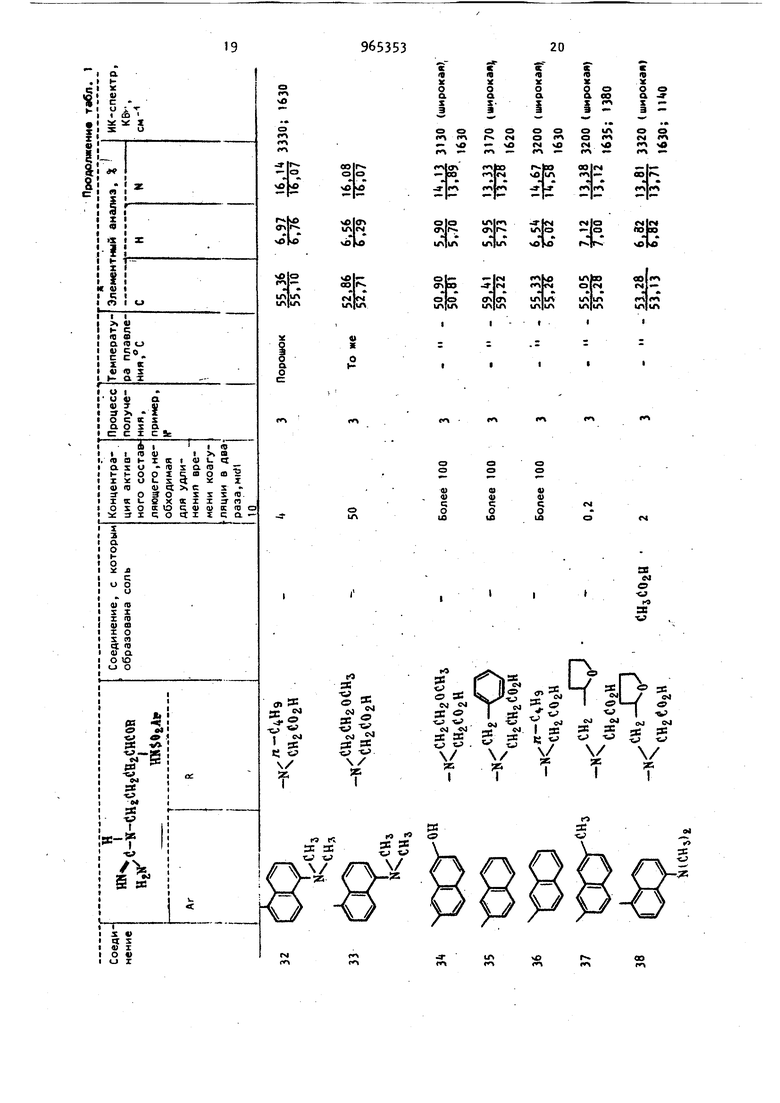
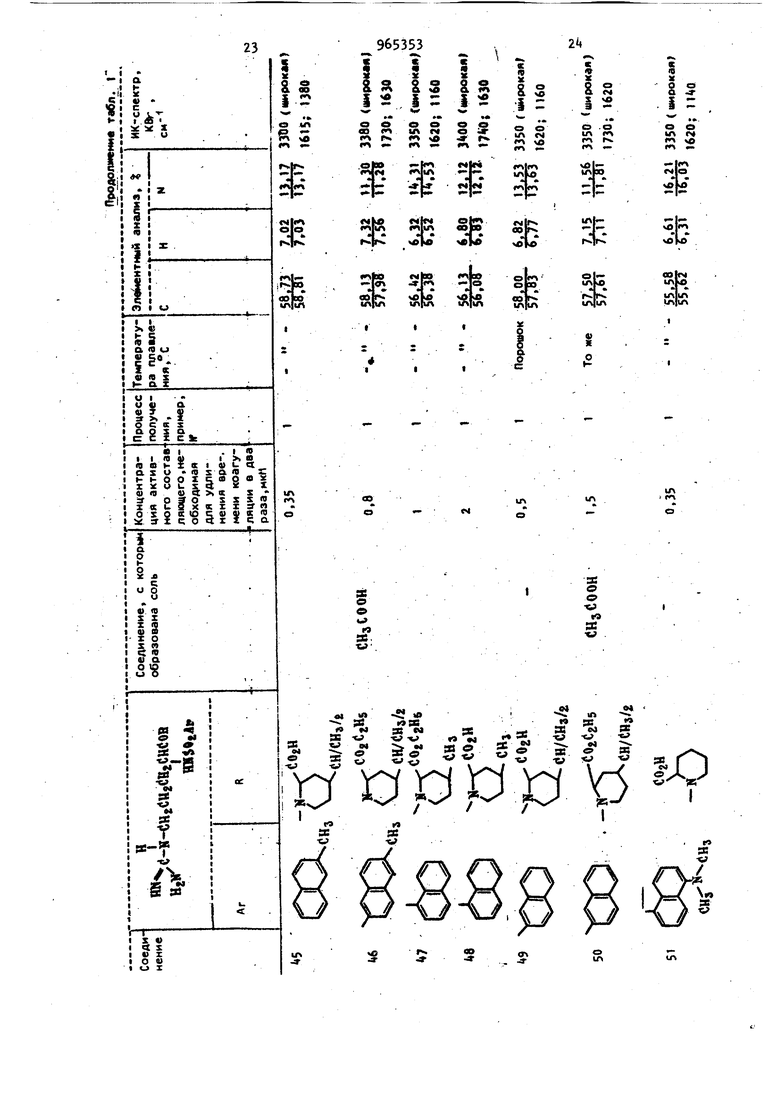
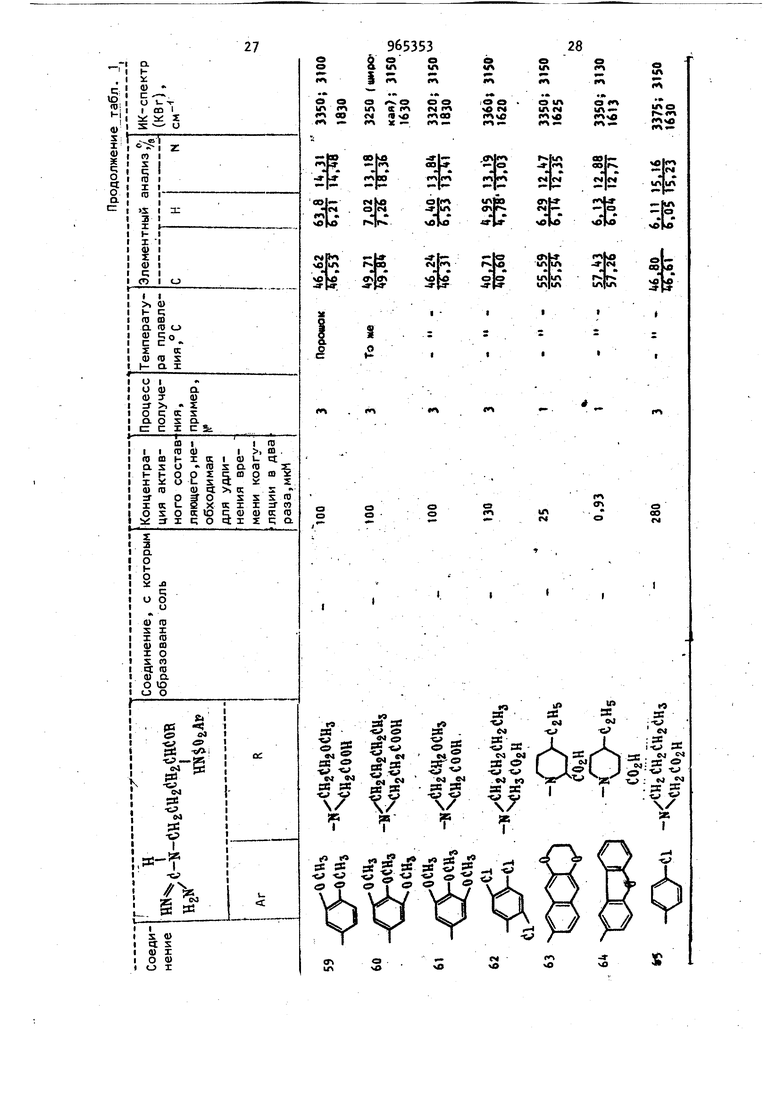
диагностических реагентов для опреде ления тромбина в крови, а также в ле чебных целях для регулирования или предотвращения тромбоза. д. Известны сложные эфиры N -(п-толи сульОонил)-2-аргинина, которые облад ют противотромбозными свойствами СО Однако их активность недостаточно велика. Так, концентрация метилового эфира N -(п-толилсульфонил)-2-аргини на, требуемая для удлинения времени коагуляции в два раза, составляет 1,1 мкМ. Цель изобретения - разработка спо соба получения новых Н арилсульфонил-2-аргининамидов общей формулы 1 обладающих более высокой противотромбозной активностью. Предлагаемый способ основан на из в стиой реакции гидрогенолиза zj и заключается в том, что N -замещензаключается2..-ный N -арилсуль нил-Е-аргининамид .общей формулы ™(i--N-( i I j C T R Ш- Ог-Агр где R и Ar имеют указанные значения. - водород и блокирующие R И R группы для гуанидиногруппы, такие как нитро или оксикарбонильная группа, при условии, чт R и R не могут оба обозначать атом водород подвергают взаимодействию с водородом о реакционно инертном растворите ле, выбранном из группы, включающей спирт, или простой эфир в присутствии водородоактивного катализатора, такого как никелевый, палладиевый или платиновый и, если необходимо, полученный при этом продукт подверга ют гидролизу. Н -Арилсульфонил-З-аргининамиды формулы I извлекают путем отфильтровывания катализатора с последующей отгонкой растворителя. Исходные N -замещенные N -арилсульОонил-1-аргинамиды формулы .. могут быть получены конденсацией N мещенного -Z-аргининамида с соответствующим арилсульфонилгалогенидом, предпочтительно хлоридом, в присутствии основания в растворителе. М Арилсульфонил-и-аргининамиды формулы I могут быть выделены в свободном виде или в виде солей. Кроме фармацевтически приемлемых солей с помощью реагирования свободных оснований с кислотбй (хлористоводородная, бромистоводородная, йодистоводородная , азотная, серная, фосфорная, уксусная, лимонная, малеиновая, янтарбензойная, метасульфоновая, этансульфоновая, бензолсульфоновая, п-толуол сульфоновая и т.п.). Аналогичным путем целевые продукты могут быть получены в виде фармацевтически приемлемых солей с помощью реагирования одной из свободных карбоксильных групп с основанием (гидроокись натрия, гидроокись калия, гидроокись аммония, триэтиламин, п-аминобензойнокислый эфир диэтиламиноэтанола, дибензиламин, Т эфенамин, Н,м-дибензилэтилендиамин, N-этилпиперидин и т.п.). Аналогично, обработка солей основанием или кислотой приводит к регенераи ии свободного амида. Пример «(3 А,Этиловый эфир N -нитро-N -(третбутоксикарбонил)-1-аргинил-М-(2-метоксиэтил)глицина. К перемешиваемому раствору 28,3 г N -нитро-Н -(тpeт.-бyтoкcикapбoнил)-L-apгининa в 50 мл сухого тетрагидрофурана поочередно добавляют 12,4 мл триэтиламина и 12,4 мл изобутилхлорформиата при Через 15 мин к этому добавляют 14,2 г этилового эфира N-(2-метоксиэтил)глицина и смесь перемешивают при -5 С в течение 15 мин. К концу этого периода реакционную смесь подогревают до комнатной температуры. Растворитель упаривают и остаток отбирают в 400 мл этилацетата с последующей промывкой вначале 200 мл воды, а затем 100 мл5 -ного раствора бикарбоната натрия, 100 мл 10 -ного раствора лимонной кислоты и 200 мл воды. Раствор в этилацетате осушают над безводным сульфатом натрия. После упаривания растворителя остаток растворяют в 20 мл хлороформа и раствор подают в колонку (80 см X 6 см) с 500 г силикагеля, набитого в хлороформе. Продукт элюируют вначале хлороформом, а затем смесью хлороформа с 3% метанола. Фракцию, элюированную из этой смеси, упаривают до сухого остатка с получением 25,8 г (63) этилового эфира N -нитро-N -(трет.-бутоксикарбонил)-г-арги59нил-(Н(2-метоксиэтил)глицина в виде сиропообразного продукта. ИК-спектр (КВг): 3300, и 1690 см. 6. Гидрохлорид этилового эфира N -нитро-М-аргинил-Н-(2-метоксиэтил) глицина. К перемешиваемому раствору 29,8 г полученного соединения N -(трет.-бут оксикарбонил)-2-аргинил-И-(2-метокси этил) глицина в 50 мл этилацетата до бавляют 80 мл смеси этилацетата с 10 сухого НС1 при . Через 3 ч к этом раствору добавляют 200 мл сухого эти лового эфира с высаживанием вязкого маслообразного продукта, который отфильтровывают и промывают сухим эти;ловым эбиром с получением 2, г гид хлорида этилового эфира М -нитро-г-аргинил-Н-(2-метоксиэтил)глицина в виде аморфного твердого вещества. В. Этиловый эфир tЯ-нитpo-N {6,7 -димстокси-2-на(Ьтилсульфонил) -L-apГинил-N-(2-метоксиэтил)глицина; К перемешиваемому раствору +,0 г полученного соединения в 20 мл воды н 20 мл диоксана добавляют поочередно 2,5 г бикарбоната натрия и г 6,7 ДИмeтoкcи-2-нaфтaлинcyлbфoнилxлopидa в 30 мл диоксана при 5С. Пе ремешивание продолжают в течение 3 ч при комнатной температуре, после чег растворитель упаривают и остаток растворяют в 0 мл хлороформа с последующей промывкой 10 мл 1 н. раствора хлористоводородной кислоты и 20 мл воды. Раствор в хлороформе осушают над безводным сульфатом натрия. Послеуп ривания растворителя остаток направляют на хроматографическое разделени е колонку с 50 г силикагеля, избитог в хлороформе, промывают хлороформом Vi элюируют смесью хлороформа и 3% метанола. Элюиррванную фракцию упари вают с получением 5,3 г ( этилового эфира м -нитрй-Н -(6,7-диметокси-2-нафтилсульфонил)-1.-аргинил-М-(2-метоксиэтил)глицина в виде аморф ного твердого вещества. ИК-спектр (КВг): , и 1630 СМ- i Г. Этиловый эфир N -(6,7-димeтoкcи -2-нaфтилcyльфoнил)-L-apгинил-N-(2-мe foкcиэтил) глицина. К раствору 3,00 г полученного соединения в 50 мл этанола и 0,5 мл. уксусной кислоты добавляют 0,5 г палла диевой черни. Смесь встряхивают в ат3«мосфере водорода в течение 100 ч при комнатной температуре, после чего раствор в этаноле фильтруют для удаления катализатора и упаривают с получением маслообразного продукта. По вторное высаживание с помощью этанолаэтилового эфира дает 2,53 г () этилового эфира N -(6,7 диметокси-2-нафтилсульфонил) - L-аргини-N- (2-метоксиэтил) глицина. Для анализа продукта часть его преобразована в флевизиат. Т.пл. (соединение 2 таблицы X Д. N -(6,7 Диметокси-2-нафтилсульфонил)-1-аргинил-Н-(2-метоксиэтил) глицин. . Раствор 2,5 г полученного соединения в 5 мл этанола и 7 мл 1 н. раствора гидроокиси натрия перемешивают в течение 30 ч при комнатной температуре. В кояце этого периода раствор концентрируют до 5 мл и подвергают хроматографическому разделению на 80 мл ионообменной смолы Dal а ion SK 102 (200-300 меш, H-, производство, фирмы Мицубиси Кеми1сл индастриз); набитой в воде, промывают водой и элюируют раствором гидроокиси аммония . Элюированную фракцию упаривают до сухого остатка и остаток очющают с помощью повторного высаживания этанолом-этиловым эфиром с получением 1,32 г (72) (6,7-диметокси-2-нафтилсульфонил)-1-аргинил-М-(2-метоксиэтил)глицина в виде аморфного твердого вещества (соединение 1 таблицы). Пример 2. . А. Гидрохлорид этило8ого эфира г-аргинил-Н-(2-метоксиэтил)глицина. К раствору ,0 г гидрохлорида этилового эфира N -нитро-1-аргинил-М-(2-метоксиэтил)глицина с 50 мл этанола добавляют 0,5 г палладиевой черни. Смесь встряхивают в атмосфере водорода в течение 150 ч при комнатной температуре, после чего раствор в этаноле фильтруют для удаления катализатора и упаривают с получением маслообразного продукта. Повторное выса ; ивание этанолом-этиловым эфиром дает 3,0 г (81) гидрохлорида этилового эфира-1-аргинил-:М- (2-метоксиэтил) глицина в виде порошка. Б. Этиловый эфир N -(4,6-диметокси-2-нафтилсульфонил)-1-аргинил-Н-(2-метоксиэтил)глицина. К хорошо перемешиваемому раствору 2,00 г полученного соединения и 1,95 г в 20 мл воды и 10 мл диоксана добавляют каплями раствор 2,17 г i ,6-диметокси-2-нафталинсульфонилхлорида в 30 мл диоксана, приче добавление проводят в течение 30 мин при поддержании ОС. Реакционную смесь перемешивают в течение 5 ч при комнатной температуре, после чего растворитель упаривают и остаток отбирают в 50 мл хлороформа. Раствор в хлороформе фильтруют для удаления нерастворимого материала и осушают над безводным сульфатом натрия. Добавление 150 мл этилового эфира к раствору в хлороформе приводит к образованию преципитата, который отделяют декантированием и очищают повто ным высаживанием с помощью этанолаэтилового эфира с получением 2,31 г (J2) этилового эфира N .-(,6-диметилокси-2-нафтилсульфонил)-L-аргинил-N-(2-метоксиэтил)глицина. Для анализа продукта его часть пр образовывают в флавианат. Т.пл. 225227 (соединение 6 таблицы). В. N -(,6-димeтoкcи-2-нaфтилcyль фoнил) -Z-аргинил-Н- (2-метоксиэтил) глицин. Получают в виде Аморфного твердог вещества с использованием методики, описанной в примере 1 (соединение 5 таблицы). I . , П р и м е р 3. А. (6,7 Диметокси-2-нафтилсуль фонил)-1-аргинил-Н-фенетилглииин. Бензиловый эфир Н -нитро-N -(6,7диметокси-2-нафтилсульфонил)-Л-аргинил-П-фенетилглицина получен с приме примера 1, имеет нением методики 133-135С. К раствору 3,00 г полученного соединения в 50 мл этанола и 0,5 мл ук сусной кислоты добавляют 0,5 г палла диевой черни. Смесь встряхивают в ат мосфере водорода в течение 100 ч при комнатной температуре, после чего раствор в этаноле фильтруют для удаления катализатора и упаривают до сухого остатка. Остаток промывают несколько раз сухим этиловым эфиром и подвергают хроматографическому раз делению на 80 мл ионообменной смолы Diaion SK 102, набитой в воде, про мывают водой и элюируют раствором гидроокиси аммония. Элюированную фракцию, упаривают до сухого остатка с получением 1,71 г - 46,7-диметокси-2-нафтилсульфонил)9Т.П 38 -Z-аргинил-Н-фенетилглицина в виде аморфного твердого вещества. ИК-спектр (КВг): 8860, 3200 и 1590 CM-f Элементный анализ: Вычислено, %: С 57, Н 6,02; N 11,97. : С2.вИ%5 Найдено, % С 57,09; Н 6,06; N 11,7.. В соответствии с методиками приведенных примеров синтезированы различные другие N -арилсульфонил-L-apгининамиды или же их соли, физикЪ-химические константы которых и данные элементного анализа приведены в таблице. П р и м е р 4. Этиловый эфир N (6 7-диметокси-2-нафтилсульфонил)-1-аргинил-М(2-метоксиэтил)глицина. К раствору 5,0 г Н дибензилоксикарбонил-N -(6,7-Диметокси-2-нафтилсуг ьфинил)-1-аргинил-М- (2-метоксиэтил глицинэтилового эфира в 5.0 мл этанола и 0,5 мл уксусной кислоты добавляют 0,5 г палладиевой черни. ;3атем смесь встряхивают в атмосфере водорода в течение 10.0 ч при комнатной температуре, после чего этанольный раствор фильтруют, чтобы удалить катализатор, и выпаривают, чтобы получить масляный продукт. Перёосаждение из смеси растворителей этанол-этиловый эфир;( дает 3,1 г этилового эфира (92) N -(6,7 Диметокси-2-нафтилсульфонил)-1-аргинил-М-(2-метоксиэтил)глицина. Противотромбозная активность N -арилсульфонил-1-аргининамидов формулы I оценивается путем определения времени коагуляции фибриногена. Измерение времени коагуляции фибриногена проводилось следующим образомТ Аликвотная порция раствора фибриногена в количестве 0,3 мл, который был получен растворением 150 мг бычьего фибриногена (фракция 1 по Cohn) поставляемого фирмой Армур инкорпорейтед, в 40 мл обратного солевого буферного раствора ( рН 7,О, контроль ным или испытуемым раствором в том ж.е буферном растворе, и 0,1 мл раствора тромбина (5 единиц/мл), поставляемого фирмой Иочида фармасетикл Ко. Смешивание производят на ледяной ванне. Непосредственно после смешивания реакционную смесь переносят с ледяной ванны в ванну с температурой 25 С. у96 Время коагуляции определяют как период между моментом переноса в ванну с и моментом первого появления фибринных нитей. В случаях, когда не добавляются образцы лекарственного препарата, время коагуляции составля т 50-55 с. Результаты экспериментов сведены в табл. 1.. ; Концентрация, требуемая для удлинения времени коагуляции в два раза, для известного противотромбозного препарата - метилового эфира N(п-то лилсульфонил)-1-аргинина - 1,100 мкМ Когда раствор, содержащий N -арилсульЛонил- L-аргининамид предписывался для внутривенного введения в тело животного, высокая антитромботическая активность в циркулирующей крови поддерживалась в течение 1-3 ч. Оказалось, что полупериод распада антитромбических соединений формулы 1 в циркулирующей крови, составляет приблизительно 60 мин, физиологическое состояние животного-хозяина (крысы, кролики, собаки и шимпанзе) поддерживалось хорошим. Экспериментальное сни жение содержания фибриногена у животных, вызванное влиянием тромбина, удовлетворительно регулировалось одновременным влиянием соединений формулы I. Значения острой токсичности (LC определяют с помощью внутрибрюшиичого введения веществ формулы I мышам (сам цы, 20 г) в количестве 1,000г10,000 M на 1 кг веса тела. Значения LC для ряда соединений формулы 1 приведены в табл. 2. Значения Ы) для N -дансил- -бутил-Ь-аргининамида и N-дансил-Ц-ме310тил-Н-бутил- -аргининамида составляют соответственно 75 и 70 мг/кг. Терапевтические препараты согласно изобретению могут быть предписаны в отдельности или в комбинации с фармацевтически приемлемыми носителями и наполнителями, пропорция которых определяется растворимостью и химической природой соединения, избранным методом введения и стандартной фармацевтической практикой. Например, соединения могут быть введены парентерально, т.е. внутримышечно, внутривенно или подкожно. Для парентерального введения соединения могут использоваться в виде стерильных растворов, содержащих другие растворенные вещества, например достаточное количество рассола или глюкозы для придания раствору изотоничности. Соединения могут быть использованы перорально в виде таблеток, капсул или гранул,содержащих подходящие индифферентные составляющие 4крахмал, лактозу, белый сахар и т.п.) : Соединения могут быть использованы для употребления под язык в виде таблеток или лепешек, в которых-каждый активный ингредиент смешан с сахаром или кукурузным сиропом, вкусовыми составляющими и красителями, а затем достаточно дегидр-:тированы для прида-; ния смеси качеств, обеспечивающих воз:можность прессования твердого препарата. Соединения могут быть использованы перорально в виде растворов, которые могут содержать подкрашивающие и вкусовые составляющие. Терапевтическая дозировка обычно составляет 10-50 мг/кг-активного составля- . ющего для парентерального введения и 10-500 мг/кг для перрорального (в расчете на 1 cyT.J.
и%:О
Г.|-
л г
«.(г
5
lO
o о
lA «4
e о
о о
н . 2 «ч со - o «fxm fs. «o
f
r
j- bt
Mto
§
М
csllcvf
-I-r-l-
Ш
vO|a
-e
l
ON
M
-
n
2g e
.r.
%0
IP1
(
lOIfO 1Л|
«A
tjinu
1Л 00
w
IN












n e ae
-s -W
ЯВ
rt Art
|4
a Sa
r«
..V
s «
,-
«4 04
rgj e
s
555 «
a:
01 ot
iv
e N «4
:s
l M
ffS Ж
я X
7 « B
xj -w
/
ЧГ
/
.
f
f
f oolrM
j-to
00 ko сч -j-O ILTV
г J 4f
j-jj- .
1 csto 001-
j-l«r
«M
LfN in M Ч 00 r voll -З
ip
. Г-ф volsD
-IrчоКо
м 1unl-
sO|- CTilcri
ool
u%|ir.
tnlirv
X
t
if
о
r
о
i
о о.
о r-«
a §
oo о
о
с; о
о о
о о
О)
0) 0)
Щ
О)
и
о
о tc
о ш
о
LD
ГЛ
10
1А
-О О.
о «О
о о
о о о rf о «п г О
СГ) ,)
mllA
о1ач
я
о - о
гр
001
orttM
л
т О|Г
ff slTL)
irt|/
о
tf
JTioj u
ilk/%
«
I m
CM
о
«A
«о
1Л
(Ч
«0
о
о
S I
о о
о го
rv
i «xiM
NOlcN - О
°р.
СЭ|(Т чО|и
Tf
C «0
ч )(
s
tn ««л
о о
о
a а rf
jNO
IvO
о
О о о
о о
1/4
об (П |/. о и ff
О - О ГО хО ю го
S5
is;
о lf sU
- -.
fv-to
jl/
о Jen oof
ivA
«Гко
.
ih
О11Л intlA
0Ко
«Ml
vrjpi
о
I
jl«4
о т
r in
I
«Ч tf
о о
о
о
s
ф
01
§
о ua
о гм
о сэ
из
eolr о|о
с
%0|(М
f
« I
10
.ж
к о a
о a
а
eo
I ::
о t/
о о о о о
Г РЧо « о
сч гл О
CS ЧВ
О - О (Ч «0
r.k0oolrsi-I чон/лг ч|-oolr
чО
1 Н ч
Jnlm
см1а
Л|
У
-10 0%
гч|ил о
-ICNглЬо
о Its
н н
o la vnltrv
tn|U VAJIA
trtltA
«
4
I
4)
§ Ш
м
о
S
IM
о -w
КЗ
3 W
ЭБ
« 5
S
tnоео
(
.- «чггч
о оо о и
в оо г
ff О« %
-г - .«П .
OI-;ф,ч|.-рi|i
m
сэ
I «ьЛ
|«А tf%|
1Л че
001
«Aim
«
О)
14
иа
2996535330- . Соединение| LD,o , мг/кг Vi 4 «r«rav «рявМ &« 1в N -(7 метил-2-нафтилсульфонил)-2-аргинил-Н-бутилглицин1,500 N(6,7-диметокси-2-нафтилсульфо- нил)-г-аргинил-М-{2-метоксиэтил), глицин1,900-2,ОО 2. N - (6,7димeтoкcи-2-нaфтилcyльЛoнил-Z-aprинил-N-(2-этoкcиэтил)-H-/ аланин660-1,000 N - ( ,6-диметокси-2 нафтилсульфо-у нил)-г-аргинил-М-(2-метоксиэтил) глицин660-1,000 N -(7-метокси-2-нафтилсульфонил)-2-аргинил-Н-(2 метоксиэтил) глицин 2,000 1. .N -(5,6,7,8-тетрагидро-1-нафтил сульйонил)-2-аргинил-Н-(2-метокси-: этил) глицин1,500 . N -(6,7-Димeтил-1-нaфтилcyльфoнил)-Z-apгинил-N-(2-мeтoкcиэтил)глицин1 ,.500 1. N - (7|Метил-2-нафтилсульфонил)-2-аргинил-М-тетрагидрофурфурилглицин6007. 1-(Н-{1-нафтилсульфонил)-И-аргинил - -метил-2-пиперидинкар6оновая кис-. лота700-1,000 t. 1-(N -(5-Диметиламино-1-нафтилсульфонил)-г-аргинил)-2-пиперидиикарбоновая кислота700-1,000 1. 2-(N -{6,7-Диметокси-2-нафтилсульфонил)-2-аргинил)-1-иэоиндолинкарбоновая кислота.1,000 а изобретения/Т 1/ - учения -арилсульфонил- дов общей формулы50 -(iHai Hailla tt Q ls402Ai „о цевтически приемлемых со-С- - циклогексил, цикпогекыбран из группы, включаю-силметил, тетрагидрофурфурил, .фенил, фенилалкил , Та бЛ и ц а 2 55где К-)- алкил ., метоксиалкил 31 RZ- водород, алкил С.-С,i И - 1,2 или 3; алкил С 4 водород, . R4- СООЯ,«г, где водород, ал кил , Af выбран из группы, включащей нафтил, тетрагидронаАтил, нафтил, замещенный оксигруппой, одной или двумя алкильными группами , одной или двумя алкоксигруппами диалкил аминогруппами галоидой. фенил, незамещенный или замещенный одной, двумя или тремя алкоксигруппа ми .; или галоидом, о т л и ч а ю щ J1 и с я , тем, что, N замещенный N -арилсульфонил-U-apгининамид общей формулы li-TJ-CU2(,(iOB В в Щ$02АР где R и имеют указанные значения; R и R- водород и блокирующие группы для гуанидиногруп пы, такие как нитрогруппа или оксикарбонильная группа, при условии, что Н -- R И R не могут оба . обозначать водород, Подвергают гидрогенолизу.в инертном растворителе, выбранном из группы, включающей спирт или простой эфир, в присутствии водородоактивного катали затора, такого как никелевый, паллаДиевый или. платиновый, в атмосфере водорода и, если необходимо, полученный при этом продукт подвергают гидро Приоритет по признакам09.12.75при R - алкил , метоксиалкили п - как указано; нафтил, замещенный алкоксигруппой CrCj фенилалкил ( 05.01.76 при R п - как указано; Аг - нафтил, замещенный алкоксигруппой 28.01.76при Рчо,-Пч5 - как указано; Аг - нафтил, замещенный алкоксигруппойCf-Cj 9 циклогексил, циклогексилметил;как-указано; нафтил, замещенный алкоксигруппой алкил , метоксиалкил С -С, фенилалкил С -С , циклогексил, циклогексилметил;п - как указано; нафтил, 5,6,7,8-тетрагидронафтия, нафтил, замещенный ок игруппой, диалкиламиногруппой С,,-С , галоидом. тетрагидрофурил; п - как указано; нафтил, ,7,8-тетрагидронафтил, нафтил, замещенный алкилом алкоксигруппой , диалкил ами но группой ,,, галоидом. - как указано; нафтил, 5,6,7,8-тетрагидронафтил, нафтил , замещенный оксй, С -С -алкилом, С/,-Сз-Диалкиламиногруппой, галоидом. Р« нафтил, ,7,8-тет-. рагидронафтил, нафтил, замещенный окси, С -Са-алкилом, ,-алкокси, С -С диалкиламиногруппой, галоидом. -1J нафтил, ,7,8-тетрагидронафтил, нафтил, замещенный окси, С -С -алкилом, С -С -алкокси, С -С -диалкиламиногруппой, галоидом. 08.12.76 при R - алкил Ц, метоксиалкил С, фенил; Лг - фенил, незамещенный или замещенный одной, двумя или тремя алкоксигруппами галоидом, 96 5353 нафтил,замещенный диалкиламиногруппой С . Источники информации, принятые во внимание при экспертизе 1. Патент США № Зб22б15, кл. , опублик. 1971. 10 2. Hoftnann К. Studies on Polypep,tides. Vfl. The Synthests of Peptldes Containing Arginlne. lACS, 78. 1955, P. 238-2 2.
Авторы
Даты
1982-10-07—Публикация
1978-02-23—Подача