Изобретение относится к органической химии, в частности к химии аминонафталинсульфониламидов (АНСА), и может быть использовано в химической промышленности при синтезе красителей, а также при синтезе субстратов для определения ферментов, обладающих аминопептидазной активностью.
Известен АНСА 5-(N-бензилоксикарбонил)-аминонафталин-(N'N'-3-оксапентаме-тилен) сульфониламид, применяемый в качестве полупродукта при синтезе одного из субстратов для определения ферментов, обладающих аминопептидазной активностью [1]
Однако для определения ферментов, обладающих амидазной активностью, необходимым широкий ассортимент субстратов, поскольку в природных материалах эти ферменты находятся в виде многокомпонентных смесей. Следовательно, для расширения ассортимента субстратов необходим широкий ассортимент полупродуктов их синтеза.
В технической и в патентной литературе не описаны АНСА общей формулы I
Известен способ получения АНСА 5-(N-бензилоксикарбонил)-аминонафталин-(N'N' -3-оксапентаметилен) сульфониламида путем проведения реакции взаимодействия соответствующего сульфонилхлорида с морфолином [1]
Однако данным известным способом можно получить только один полупродукт для синтеза лишь одного вида субстрата для амидаз.
Способ получения соединений общей формулы l не описан.
Техническим результатом, достигаемым при реализации настоящего изобретения, является получение новых АНСА общей формулы I и разработка последовательности приемов и режимных параметров, обеспечивающих получение соединений общей формулы I.
Достигается это тем, что получены новые соединения общей формулы I: где R СН3 при Х-нитро-, бензилоксикарбониламино- или фталимидогруппа; или
где R СН3 при Х-нитро-, бензилоксикарбониламино- или фталимидогруппа; или
R C2H5-, н,i C3H7-, i C4H9- или -С2Н4О-(С1-С2)алкил при Х-бензилоксикарбониламиногруппа.
Достигается это также тем, что в способе получения соединений общей формулы I, где Х-нитро-, бензилоксикарбониламино- или фталимидогруппа, R-низший алкил или -С2Н4О-(низший)алкил проводят реакцию взаимодействия соответственно 5-замещенного нафталин-1-сульфонилхлорида с этиленимином в среде низшего спирта в присутствии триэтиламина с последующим выделением полученного соответствующего 5-замещенного-1-(диметилен)сульфониламида и обработкой его соединением R-ОН, где R приведены выше, при температуре 60-110оС в присутствии ацетата BF3.
Ниже приведены примеры, иллюстрирующие изобретение.
П р и м е р 1. Синтез 5-(бензилоксикарбонил)аминонафталин-1-(диметилен)-суль- фониламида.
5,04 г (0,04 моль) 5-(бензиолксикарбонил)-аминонафталин-1-сульфонилхлорида при перемешивании на магнитной мешалке растворяют в 200 мл метанола, добавляют 3,7 мл (0,04 моль) триэтиламина и 1,72 мл (0,04 моль) азиридина (этиленимина). Через 30 мин начинается выпадение белого осадка. Перемешивание продолжают в течение 2 ч. Затем осадок отфильтровывают на вакуумном фильтре, промывают метанолом, сушат над КОН. Получают 5,01 г бесцветных кристаллов с т. пл. 107оС, выход 92,2% При использовании в качестве растворителя этанола, время реакции 3 ч, выход 91% Продукт хорошо растворим в органических растворителях (этилацетат, ацетонитрил).
См. табл.1.
П р и м е р 2. Синтез 5-фталимидонафталин-1-(диметилен)сульфониламида.
4,34 г (0,0115 моль) 5-фталимидонафталин-1-сульфонилхлорида при перемешивании на магнитной мешалке растворяют в 100 мл этанола, добавляют 1,08 мл (0,0115 моль) триэтиламина и 0,49 мл (0,0115 моль) азиридина (этиленимина). Через несколько минут начинается выпадение белого осадка. Спустя 2 ч осадок отфильтровывают на вакуумном фильтре, промывают этанолом, сушат над КОН. Получают 4,1 г бесцветных кристаллов с т.пл. 242оС, выход 93% Продукт хорошо растворим в органических растворителях (этилацетат, ацетонитрил).
См. табл.1.
П р и м е р 3. Синтез 5-нитронафталин-1-(диметилен)сульфониламида.
5,43 г (0,02 моль) 5-нитронафталин-1-сульфонилхлорида при перемешивании на магнитной мешалке растворяют в 100 мл этанола, добавляют 1,83 мл (0,02 моль) триэтиламина и 1,04 мл 0,02 моль азиридина (этиленимина). Через несколько минут начинается выпадение осадка. Спустя 2 ч осадок отфильтровывают на вакуумном фильтре, промывают этанолом, сушат над КОН. Получают 4,1 г бесцветных кристаллов с выходом 77% Продукт хорошо растворим в органических растворителях (этилацетат, ацетонитрил).
См. табл.1.
П р и м е р 4. Синтез 5-(бензилоксикарбонил)аминонафталин-1-(метоксиэтил)суль- фониламида.
5 г 5-(бензилоксикарбонил)аминонафталин-1-(диметилен)сульфониламида и 1 мл (моль) ацетата BF3 в 150 мл абсолютного метанола кипятят в плоскодонной колбе с обратным холодильником. Через час охлаждают до комнатной температуры, добавляют несколько капель воды до появления белой суспензии и оставляют стоять на 12 ч при температуре 10оС. Выпавший осадок отфильтровывают, промывают на фильтре водой, сушат на КОН. Получают 5,01 г бесцветных кристаллов с т. пл. 144оС, выход 92,2% Продукт хорошо растворим в органических растворителях (этилацетат, ацетонитрил).
См. табл.2-3.
Аналогичным способом были получены другие замещенные аминонафталиналкоксиэтилсульфониламиды соответственно из этилового, i-пропилового, n-пропилового, i-бутилового спиртов (см. таблицу 2-3).
П р и м е р 5. Синтез 5-(бензилоксикарбонил)аминонафталин-1-(3,6-диаксагептил) сульфониламида.
4 г 5-(бензилоксикарбонил)аминонафталин-1-(диметилен)сульфонамида в 150 мл метилцеллозольва нагревают в плоскодонной колбе с обратным холодильником на кипящей водяной бане. 1 мл (моль) ацетата BF3 добавляют в разогретую смесь, через 20 мин смесь охлаждают, добавляют избыток воды до расслоения смеси. Верхнюю фазу сливают, масло растворяют в горячем метаноле, добавляют 2 г активированного угля, перемешивают, уголь фильтруют, метанол частично упаривают, добавляют несколько капель воды до появления белой суспензии и оставляют стоять при 10оС. Выпавший осадок отфильтровывают, сушат над КОН. Получают 4,22 г бесцветных кристаллов с т.пл. 64оС, выход 88% Продукт хорошо растворим в органических растворителях (этилацетат, ацетонитрил).
См. табл. 2-3.
Аналогичным способом был получен 5-(бензилокасикарбонил)аминонафталин-1- (3,6-диаксаоктил)сульфонилид из этилцеллозольва.
См. табл.2-3.
П р и м е р 6. Синтез 5-фталимидонафталин-1-(метоксиэтил)сульфониламида.
2,21 г 5-фталимидонафталин-1-(диметилен)сульфониламида и 1 мл ацетата BF3 в 150 мл абсолютного метанола кипятят в плоскодонной колбе с обратным холодильником. Через 1,5 ч колбу охлаждают, добавляют воду до появления белой суспензии, оставляют стоять пари 10оС на 12 ч. Выпавший осадок отфильтровывают, промывают на фильтре водой, сушат над КОН. Получают 2,28 г бесцветных кристаллов, выход 97,8% Продукт хорошо растворим в органических растворителях (этилацетат, ацетонитрил).
См. табл.4.
П р и м е р 7. Синтез 5-нитронафталин-1-(метоксиэтил)сульфониламида.
3,97 г 5-нитронафталин-1-(диметилен)сульфониламида и 1 мл ацетата ВF3 в 150 мл абсолютного метанола кипятят в плоскодонной колбе с обратным холодильником. Через 1,5 ч колбу охлаждают, добавляют воды до появления белой суспензии, оставляют стоять при 10оС на 12 ч. Выпавший осадок отфильтровывают, промывают на фильтре водой, сушат над КОН. Получают 2,79 г бесцветных кристаллов с т.пл. 106оС, выход 62% Продукт хорошо растворим в органических растворителях (этилацетат, ацетонитрил).
См. табл.4.
П р и м е р 8. Получение бромгидрата 5-аминонафталин-1-(метоксиэтил)сульфониламида.
7,04 г (0,016 М) 5-(бензилоксикарбонил)аминонафталин-1-(метоксиэтил)сульфониламида перемешивают на магнитной мешалке с 17 мл (0,051 моль HBr) 3-молярного раствора HBr в уксусной кислоте. Через 2 ч выпавший осадок трижды промывают эфиром, отфильтровывают, промывают эфиром на фильтре, сушат над КОН. Получают 6,05 г продукта, выход 98,6% Продукт хорошо растворим в органических растворителях (этилацетат, ацетонитрил).
См. табл.5-6.
П р и м е р 9. Снятие фталимидной группы.
3,99 (0,01 моль) 5-фталимидонафталин-1-(метоксиэтил)сульфонамида заливают 50 мл метанола, прикапывают 0,5 мл (0,01 моль) гидразингидрата и кипятят 4,5 ч. Метанол отгоняют, остаток экстрагируют 2 раза по 20 мл кипящего хлороформа, экстракт упаривают и остаток перекристаллизовывают из метанола. Получают 2,74 г (выход 98%)хроматографически и аналитически чистого продукта с т.пл. 112оС.
ПМР (ДМСО) 2,90 (СН2), 3,01 (СН3), 3,22 (СН2).
Rf 0,34 (хлороформ:этилацетат).
Данные элементного анализа: (найдено/вычислено):
C Н N S
55,91 5,79 10,0 11,23
55,70 5,75 9,99 11,44.
Аналогично проводили снятие фталимидной группы в других полученных соединениях.
П р и м е р 10. Восстановление NO2-группы.
12,4 г (0,04 моль) 5-нитронафталин-1-(метоксиэтил)сульфонамида растворяют в 400 мл метанола и гидрируют водородом при Р 1, 20оС в присутствии каталитических количеств никеля Ренея. После поглощения рассчитанного количества водорода катализатор отфильтровывают, раствор упаривают досуха и получают 2,21 г (выход 81%) целевого продукта с т.пл. 112-114оС.
ПМР (ДМСО) 2,91 (СН2), 3,33 (СН2), 3,25 (СН2).
Rf 0,34 (хлороформ:этилацетат).
Данные элементного анализа (найдено/вычислено):
C Н N S
55,82 5,74 10,06 11,34
55,70 5,75 9,99 11,44.
Аналогично проводили восстановление нитрогруппы в других соединениях.
В табл. 7 приведены физико-химические свойства 5-(аргинил)аминонафталин-1-сульфопиламидов.
В табл. 8 приведены данные дифференциации продуктов ферментативного протеолиза субстратов/ полученных из полупродуктов.




Использование: для определения ферментов, обладающих аминопентадазной активностью. Сущность изобретения: продукт: 5-замещенные нафталин-1-сульфониламиды Х-нафталинил SO2NHCH2CH2OR, где R CH3, C2H5, C3H7 1- C4H9 низший алкил-0- C2H2 Х-нитро, бензилоксикарбониламиногруппа, фталимидо-группа. Реагент 1: 5-замещенный-нафталин-1-сульфонилхлорид. Реагент 2: этиленимин в среде низшего спирта и отработкой полученного продукта соединением P-OH в присутствии ацетата BF. 8 табл.

где R СН3 при X нитро-, бензилоксикарбониламиногруппа;
R C2N5, H-, i С3Н7, i С4Н9, (С1 С2)-алкил О С2Н4 при X - бензилоксикарбониламиногруппа.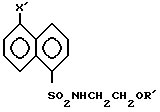
где X′ нитро-, фталимидо-, бензилоксикарбониламиногруппа;
R′ низший алкил или низший алкил-О-С2Н4-,
отличающийся тем, что проводят взаимодействие соответственно 5-замещенного нафталин-1-сульфонилхлорида с этиленимином с среде низшего спирта в присутствии триэтиламина с последующим выделением полученного соответствующего 5-замещенного-1-диметиленсульфониламида и обработкой его соединением
R′-OH, где R′ имеет указанные значения,
при 60 110oС в присутствии ацетата BF3.
| 5-(N-Карбобензокси)-аминонафталин-1-сульфохлорид в качестве полупродукта в синтезе замещенных 5-аминонафталин-1-сульфамидов,используемых в качестве детектируемых групп ферментных субстратов | 1985 |
|
SU1413103A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1995-12-27—Публикация
1991-06-28—Подача