циано-, окси- или алкоксигруппа, где алкил с 1-3 атомами углерода, карбок сил, этоксикарбонил, алканоил с 1-3 атомами углерода, диэтиламино, фенил или толил; аллил, циклогексил, незамещенный фенил или замещенный один или двумя заместителями из числа галоид, трифторметил, алкил с 1-3 атомами углерода или алкоксил с 1-3 ато мами углерода; или R и R2 совместно с общим атомом азота образуют 3-7членный азотсодержащий цикл, или мор фолин, 2,З-дициано-5-галоидпиразин Общей формулы 11 Yi ж где А имеет указанные значения, а X - галоид, подвергают взаимодействи с соединением общей формулы W, НВ где В имеет указанные знач ния. Реакцию обычно проводят в среде инертного растворителя из,числа кетонов, таких как ацетон, метилизобутиЛкетон; простых эфиров, таких как тетрагидрофуран, диоксан; сложных эфиров, таких как этилацетат, .бутилацетат хлорированных углеводородов, таких как хлороформ, трихлорэтилен, углеводородов, таких как гексан, геп тан, бензол, толуол. Предпочтительно использовать ацетон, тетрагидрофуран диокса.т или бензол в количестве 1-100 вес.ч. на в§с исходных соедине НИИ формулы 11, предпочтительно 2050 вес.ч. Реакцию можно проводить в гомоген ной или гетерогенной системах с использованием смеси воды и органичесjKoro растворителя. TeivmepaTypa реакции не является решающим фактором и может изменяться в широких пределах в зaвиcи юcти от типа используемых реагентов. Обычно используют температуру ниже , но можно проводить реакцию и при комнат ной и более низкой температуре. Количество соединения формулы 111 не ограничивается и может изменяться в широком диапазоне, обычно 1-2 моль предпочтительно до 1,5 моль на 1 мал соединения формульл 11. В качестве акцептора галоидводоро да используют эквивалентное или несколько большее количество (предпочтительно до 2 экв.) органического ос нования, такого как пиридин или третичный амин (например, триэтиламии или N,N-диметилформамид), или такого неорганического основания, как сидроокись щелочного металла (например, ,гидроокись натрия), или карбонат пелочного металла (например, карбонат натрия). Когда соединение формулы Ш представляет собой амин, оно может таюле выполнять функции акцептора галоидоводорода в случае применения такого соединения в количестве, равном по крайней мере 2 моль/моль соединения формулы и. Пример 1. Получение 2,3-дициано-5-хлорпиразина. 7,30 г (0,5 моль) 2,3-дициано -5-гидроксипиразина растворяют в 70 г (0,59 моль) тионилхлорида и полученный раствор охлаждают до . При переманивании к этой смеси по каплям 15 мин добавляют 4,80 г (0,06 моль) пиридина. Затем смесь перемеиивают при 70 С 2 ч. После завершения реакции избыток тионилхлорида отгоняют при пониженном давлении, а остаток экстрагируют 150 мл хлор офорг/га. Хлороформный раствор дважды прюмывают 50 мл воды и сушат безводным хлорисTbiM ксшьцием, после чего растворитель отгоняют, образуется красный твердый остаток. Перекристаллизацией тэердого вещества из бензола получшат 6,30 г .(выход 77%) 2,3-дициано-5-хлорпиразина, с т.пл. 89-900С. Вычислено, %: С 43,79; К 0,61; N 34,05. Найдено, %: С.43,75; И О,61; N 34,13. Пример 2. Получение 2,3-дициано-5-хлор-6-н-пентилпиразина. Этил-н-гексаноат и диэтилоксалат подвергают конденсации по Кляйзену и затем гидролизуют, получают 2-оксо-н-гексановую кислоту. Полученны продукт конденсируют с диаминомалеонитрилом, получают 9,1 г (0,042 моль) 2,2-дициано-5-окси-6-н-пентилпиразина (т.пл. 61-64°С). Этот продукт растворяют в 120 г оксихлорида фосфора и добавляют 3,32 г (0,042 моль) пиридина. Смесь кипятят 5 ч и обрабатывают по способу примера 1,. полученный в результате маслянистый продукт концентрируют при пониженном давлении, а затем хроматографируют на колонке с силикагелем, используя в ка честве элюента бензол, .1 Получают 6,0 г (выход 61%) 2,3-дициано-5-хлор-6-н-пентилпиразина в виде желтой жидкости. . Вычислено, %: С 56,3; Н 4,73; N 23,87. C.H./1N4 Найдено, %: С 56,57; Н 4,60; N 23,52. Пример 3. Получение 2,З- ициано-5-хлор-6-фенилпиразина. Синтез 2,3-дициано-5-окси-6-фенилпйразина. 5,40 г (0,05 моль) диамииог илео«нитрил а и 7,50 г (0,05 тпъ) бекэоилмуравьиной кислоты вносят в 50 нп 2N соляной кислоты. Пслтучекнуго слк;с перемешивают при 20-30 С 30 мин, а затем при 70-80 С 2 ч. Смесь.охлгтл ют при комнатной температуре. Образоиавшийся осадок отделяют фильтрацией, пробивают дважды 4С мл воды, суиат в вакууме. Получают 10,0 г (выход 90%) 2,3-дициано-5-окси-б-фенилпиразина с т.пл. 221-223 с (разл.). Вычислено, %: С 64,86; Н 2,72j. К 25,21. a,HeN40 Найдено, %: С 65,02; Н 2,54; N 25,20. Синтез 2,З-дициано-5-хлор-б-фени пиразина. 7,00 г (0,0315 моль) 2,3-дициано -5-окси-6-фенилпиразина растворяют в 40,00 г (0,26 моль) оксихлорида фосфора и при охлаждении раствора д по каплям 20 мин добавляют 3, г (0,035 моль) триэтиленина. Смесь перемешивают при 70-80С 1,5 Реакционную смесь обрабатывают по способу примера 1. - Перекристаллизацией из бензола получают 6,10 г (выход 80%) 2,3-дициано-5-хлор-6-фенилпиразина с т.пл 139-141 С. Вычислено, %: С 59,89; Н 2,09; N 23,28. С H5N4C1 НЪйдено, %: С 59,80; Н 2,20; N 23,41. Пример 4. Получение 2,3-ди циано-5-хлор-6-(м-хлорфенил)пиразин 25,07 г (0,10 моль) 2,3-дициано-5-ОКСИ-6-(м-хлорфенил)пиразина рас воряют в 46,2 г (0,30 моль), оксихлорида фосфора. Полученную смесь охлаж дают до 0-5°С и при перемешивании п каплям 30 мин добавляют 10,1 г (0,1 моль) триэтиламина. После доба ления смесь кипятят 3 ч. Реакционную смесь обрабатывают по. методике прим ра 1. К полученному маслянистому про дукту добавляют петролейный эфир (50 мл) и полученный осадок отделяют фильтрацией. Перекристаллизацией из четыреххло |ристого углерода получают 23,1 г (вы ход 83%) 2,3-дициано-5-хлор-6-(м-хло фенил)пиразина с т.пл. 87-88j. Вычислено, % С 52,39; Н 1,47;. N 20,37. Найдено, %: С 52,38; Н 1,61; N 20,24.. Пример 5. Получение 2,3-дициано-5-(п-метилфенокси)пиразИ на. v,83 г (0,005 моль) 2,3-дициано-5-хлорпиразина растворяют в 25 мл ацетона. Раствор охлаждают до и при перемешивании по каплям 15 мин добавляют раствор, полученный смешением 0,54 г (0,005 м) п-крезола, 0,21 г (0,005 моль) гидроокиси натрия, 1 мл воды и 15 мл ацетона. Полученную смесь перемешивЕцот при 1 ч. После завершения реакции растворитель удаляют отгонкой при пониженном давлении. Полученный остаток экстрагируют 100 мл хлороформа. Хлороформный раствор промлвают 30 мл IN водного раствора гидроокиси натрия и 30 мл воды и сушат, безводным хлористым кальцием. Затем растворитель отгоняют . Перекристаллизацией продукта из этанола получают 0,49 г (выход 41%) 2,З-дициано-5-(п-метилфенокси)пиразина с т.пл. 126-127 С. Вычислено, %: С 66,10; Н 3,41; N 23,72. C HgN40 Найдено, %: С 66,03; Н 3,40; N 23,55. Пример 6. Получение 2,3-дициано-5-(фенилтио)пиразина. 0,83 г (0,005 моль) 2,3-дициано-5-хлорпиразина растворяют в 25 мл ацетона. Раствор охлаждают до 0-5с и при перемешивании по каплям 10 мин добавляют смесь 0,55 г (0,005 моль) тиофенола, 0,21 г (0,005 моль) гидроокиси натрия, 1 мл воды и 20 мл ацетона. Затем реакционную смесь обрабатывают способом по примеру 5 и перекристаллизацией из бензола получают 0,57 г (выход 48%) 2,3-дициaнo-5-{фeнилтиo)пиpaзинa с т.пл. 109-112 С. Вычислено, %: С 69,49; Н 2,54; N 23,52. Найдено, % С 60,60; Н 2,43; N 23,71. Пример 7 . Получение 2,З-дициано-5- (карбоксиметилтио) пиразина. Тиогликолевую кислоту (92%, 0,01 моль) и 1,64 г 2,З-дициано-5-хлорпиразина (0,01 моль) раствортпот в 40 МП ацетона и при охлаждинии раство1эа до 0-5 с по каплям добавляют 2,12 г (0,021 моль) триэтиламина. Затем смесь перемешивают при 20-25с 2 ч. Полученный осадок отделяют фильтацией, фильтрат концентрируют при пониженном давлении и добавляют 100 мл 1%-ной соляной кислоты, образовавшийся маслянистый продукт экстагируют 50 мл этклацетата. Этилцетатный слой про«лвают дваж.цы 50 мл насыщенного водного раствора хлорисого натрия, сушат безводным сульфаом натрия и концентриругат при пониенном давлении. Перекристгшлизащией остатка из тоуола получают 1,65 г (выход 75%) 2,З-дициано-5-(карбоксипетилтио)пиразина с т.пл, 141-143 С. Вычислено, %: С 43,63; Н 1,83; N 25,44. найдено, %: С 43,60; Н 1,85, N 25,38. Пример 8. Получение 2,З-ди циано-5 -фенокси-6-н-пропил пиразина. 0,207 г (0,001 моль) 2,3-дициаио -5-хлор-б-н-пропилпиразина растворя в 15 мл ацетона и к нему добавляют смесь 0,094 г (0,001 моль) фенола, 0,040 г (0,001 моль) гидроокиси нат рия, 0,7 МП воды и 5. мл ацетона по каплям 5 мин. Затем смесь перемешив ют при 5-10с 10 мин. Реакционную смесь обрабатывают способом по прим ру 7 и остаток перекристаллиэовываю из бензола. Получают 0,15 г (выход 57%) 2,3-дициано-5-фенокси-6-пропилпиразина с т.пл. 130-132С. Вычислено, %: С 68,17; Н 4,58; N 21,20. q, S Найдено, %: С 68,27; Н 4,50; N 21,42. Пример 9. Получение 2,З-ди циано-5 -этилтио-6 -мети лпиразин а. 1,79 г (0,01 моль) 2,3-дициано-5-хлор-6-метилпиразина, 0,62 г (0,001 моль) этантиола и 0,40 г (0,01 моль) гидроокиси натрия обрабатывают способом по примеру 6. Пер кристаллизацией из этанола получают 0,91 г .(выход 45%) 2, З-дициано-5-этилтио-6-метилпиразина с т.пл. 91,5-92,. Вычислено, %: С 52,98; Н 3,95; А/27,43. Найдено, %: С 52,74; Н 3,88; 27,61. Пример 10. Получение 2,З-д циано-5- алли л окси -6- этилпиразин а. 1,35 г (О,007моля)2,3-дициано-5-хлор-6-этилпиразина растворяют в 30 мл и при охлаждении раствора до по каплям добавляют раствор, полученнЕлй из 20 мл аллилового спирта и 0,16 г (0,007 мол натри-я - Затем полученную смесь пере мешивают 30 мин. Реакционную смесь выливают в 200 мл воды и отделивший ся маслянистый продукт экстрагируют толуолом. Толуольный слой концентри руют при пониженном давлении о Полученный в результате сырой продукт хроматографируют на колонке с силикаг.елем с использованием в качестве элюента толуол. Получают 1,00 г (выход 67%) 2,3-11,ициано-5-аплилокси-6-этилпиразина ,п 1,5316. Вычислено, %: С 61,67; Н 4,71; N 26,15. С Н. О Найдено, %: С 61,46; Н 4,83; N 26,01. Согласно методикам примеров 5-10 синтезируют соединения W 1-30, 44-53, 71, 72, 82-88, 95, 97-99, 103, 105 и 112-130, представленные в табл. 1, Пример 11. Получение 2,З-дициано-5 -ди-н-пропиламино-6 -этилпиразина. 1,92 г (0,01 моль) 2,3-дициано-5-хлорг-б-этилпиразина растворяют в 30 мл ацетона, охлаждают до 0-5Р С и при перемешивании к нему по каплям добавляют г (0,02 моль) ди-н-пропиламина. Полученную смесь перемешивают 30 мин. Осадок отделяли фильтрацией. Фильтрат концентрируют при пониженном давлении, получают желтый маслянистый продукт. К маслянистому продукту (20 мл) добавляют воду, выпавший белый порошок перекристаллизовывают из этанола. Получают if 28 г (выход 50%) 2, З-дициано-5-ди-н-пропиламино-6-этилпиразина с т.пл. 58-60С. Вычислено, %: С 65,34; Н 7,44;. N 27,21. Найдено, %: С 65,15; Н 7,48; N 27,36. Пример 12. Получение 2,З-дициано-5 -метил амино-6-н-бутилпиразина. 2,21 г (0,01 моль)2,З-дициано-5-хлор-6-Н-бутилпиразина растворяют в 30 мл бензола и при перемешивании при добавляют 1,55 г (0,02 моль) 40%-ного водного раствора метиламина. Затем смесь перемешивают при 30-40 С 2 ч. Реакционную смесь обрабатывают способом по примеру 13. Получают 1,75 г (выход 81%) 2,З-дициано-5 -мети л а1чино-6-н-бутилпиразина. с т.пл. 143-145с. Вычислено, %: С 61,38; Н 6,09; N 32,54. ,«,Nr Найдено, %: С 61,60; Н 6,12; N 32,28. Пример 13. Получение 2,З-дициано-5- н-пропиламино-6 -и зобут илпиразина. 1,10 г (0,005 моля) 2,3-дициано.-5-хлор-6-изобутилпиразина раствс яют в 20 .мл тетрагидрофурана. Полученный раствор обрабатывают как в примере 11, используя 0,30 г (0,005 моль) н-пропиламина и 0,02 г (0,005 моль) гидроокиси натрия. Получают 1,04 г (выход 85%) 2,3-дициано-5-н-пропиламино-6-изо.бутилпиразина с т.пл. 107-110 с.
Вычислено, %: С 64,17} Н 7,04; N 28,78.
(ЗН|7
Найдено, %: С 64,13; Н 7,24;
N 28,63,
Пример 14. Получение 2,3-дициано-5-дизтиламино-6-бенэилпиразина
1,27 г (0,005 моль), 2,3-дициано-5-хлор-б-бензилпиразина растворяют в 30 МП бензола и полученный раствор охлаждают до . При перемешиваНИИ смесь обрабатывают способом по примеру 13 с использованием 0,80 г (0,01 моль) диэтиламина.
Перекристаллизацией из этанола получают 1,10 г (выход 75%) 2,3-дициано-5-днэтиламино-6-бензш1пиразина с т.пл. 73-74С..
Вычислено, %: С 70,08; Н 5,88 24,04.
,7М5
Найдено, % С 70,30; Н 5,75;.
У 23,95.
Согласно методикам примеров сиитезируют соединения №№ 31-43, 54-70, 73-81, 89-94, 96, 100-102, 104 и 106-111, представленные в ; табл. 1.
Пример 15о Получение 2,3-дициано-5-н-пропилакмно-6-фенилпиРазина.
12,03 г (0,05 моль 2,3-дициано-5-хлор-6-фенилаиразина растворяют в 400 мл толуола. Раствор охлаждают до и при перемешивании по каплям добавляют 10 мин 3,25 г (0,055 моль) н-пропиламина. После этого по каплям 10 мин добавляют 55 мл 1Н водного раствора гидроокиси |натрия. Затем смесь перемешивают при 5-10 с 30 мин. После завесшения реакции реакционную смесь разделяют на два слоя. Толуольный слой концентрируют при пониженном давлении и получают твердое вещество, которое дважды промывают 200 мл воды, сушат при пониженном давлении и последовательно перекристаллизовывают из топу ола в этаноле.
Получают 12,1 г (выход 92%) 2,3-дициано-5-н-пропиламиио-6-фенилпираэииа с т.пл. 136-137®С.
Вычислено, %: С-68,43;) И 4,38 V26,60:
1.Н«МчНайдено, % С 68,42; Н 5,01; 26,58.X .
Пр и м е р 16. Получение 2,3-дициано-5-этиламино-6-фенилпиразина. I 12,03 t (0,05 моль)- 2,3-дшдаано-5-зшор-6-фенилпиразина и 7,07 г (0,11 моль) 70%-ного водного раствора этиламина обрабатывают способом по примеру 11 и перекристаллизовывают из толуола.
Получают 10,98 г (выход 88%) 2,3-диц1:ано-5-этил-амино-6-феиилпиразина с т.пл. 180-181°С.
Вычислено, %: С 67,45; Н 4,45; N 28,10.
C,,
H-l
йдено, %: С 67,51; Н,52; N 27,07.
Пример 17. Получение 2,3-ди циано-5-этиламино-6-(м-бромфенил)пиразина. .
1,15 г (0,0036 моль) 2,3-дициано-5-хлор-6-(м-бромфенил)пиразин растворяют в 20 мл тетрагидрофурана. Расвор охлаждают до идобавляют 0,50 г 70%-ного водного раствора этиеьмина. Смесь обрабатывают способом по примеру 13 и перекристаллизовываю из этанола.
Получают 0,95 г (выход 80%) 2,3-дициано-5-этиламино-6-(м-бромфенил) пиразина с т.пл. 127-127,.
Вычислено, %1 С 51,24 Н 3,07; М 21,34.
Е1айдено, %: С 51,55; Н 3,04;.
N 21,17.
Пример 18. Получение 2,3-дициано-5-н-пропиламино-6-(м-хлорфе- . нил)пиразина. ,
1гО г (0,0036 моль) 2,3-;щциано-5-хлор-6-(м-хлорфенил)пиразина 0,24 г (0,004 моль) н-пропиламиНа и 40 мл 0,1 N водного раствора гидроокиси натрия обрабатывают как в примере 15 и перекристаллизовывают из метанола. .
Получают 0,54 г (выход 78%) 2,3-,-дициано-5-н-пропиламино-6- (i/t-xnopфенил)-пиразина с т.пл. 120-121 0,
Вычислено, %: С 60,51; Н 4,06;. N 23,52.
С,Н,С .
Найдено, %г С 60,75; Н 4,04; N 23,41.
Пример 19..Получение 2,3-ди.циано-5-этиламино-6-(м-фторфенил)пиразина.
1,00 г (0,0039 моль) 2,3-дициано-5-хлор-6- мЧфторфенил)пиразина растворяют в 30 мл толуола. Полученный раствор охлаждают до и по каплям добавляют 0,65 г 70%-ногр водного раствора этиламина. Смесь перемешивают при-5-0 0 Зб мин. Реакционную смесь обрабатывсоот способом по приглеру 11 и перекристаллизовывают из этанола..
Получают 0,63 г (выход 61%) 2,3-дициано-5-этиламино-6- м-фторфенил ьиразина с т.пл. 126-127 С.
Вычислено, %: С 62,91; Н 3,77; N 26,21.
C,.RnNrF
, %: С 62,90; Н 3,51; N 26,02. Пример 20. Получение 2,3-ди циано-5-н-пропиламино-С-п-толилпиразина. 1,00 г {0,0039 моль) 2,3-дициано-5-хлор-6-п-толилпиразина и 0,46 г (0,0076 моль) ы-пропиламина обрабатывают способом по примеру 11 и перекристаллизовывают из толуола. Получают 0,80 г (выход 74%) 2,3-дии,иано-5-н-пропиламино-6-п-толилпиразина с т.пл. 115-116 0. Вычислено, %: С 69,29} Н 5,45; N 25,25. C-f6%V 1айдено, %: С 69,02; Н 5,00; N 25,23, Согласно методике, описанной в примерах 15-20, получают соединения №№ 131-144, 152, 153, 155-161, 163, 172, 174-179, 181-188, 191-193, 195 212, 224 и 225, представленные в табл. 1. Пример 21. Получе ще 2,3дициано-5-(1-карбокси-н-пропил с1МИно-6-фенилпиразина. 2,41 г (0,01 моля) 2,3-ди11иано-5-хлор-6-фенилпиразина растворяют в 30 мл тетрагидрофурана и при пере мешивании при 15-20 с по каплям 5 мин добавляют смесь 2,04 -С (0,02 моль) 01-с -амино-н-масляной кислоты, 1,12-г (0,02 моль) гидроокиси калия и 40 мл воды. Затем сме перемешивают при 30 мин. После завершения реакции реактор -охлаждаю льдом и в реакционный раствор с-доба ляют 2 мл концентрированной серной кислоты. Затем раствор экстрагируют 100 мл толуола. Толуольный слой про мывают 50 мл насьвценного водного ра Bdpa хлористого натрия и 30 мл воды и растворитель удаляют упариванием . пониженном давлении, получают желтовато-белое твердое вещество. Перекристаллизацией из этанола получают 2,63 г (выход 36%) 2,3-дициано-5-(1-карбокси-н-пропил амино-6-фенилпиразина с т,пл. 210-217 С (разл.). Вычислено, %: С 62,53; Н 4,26; N 22,72. «NpOi Найдено, %: С 62,33; Н 4,15; N 22,86, Пример 22, Получение 2,3-д циано-5-(1-карбоксиэтил)амино-6-фенилпиразина, 4,82 г (0,02 моль) 2,3-дициано-5-хлор-6-фенилпиразина растворяют в 50 мл ацетона, охлаждают до О-г 5 С и при перемешивании по каплям 30 ми добавляют смесь 1,78 г (0,02 м6лв)1 DL- -аланина, 1,64 г (0,02 моль) ги роокиси натрия и 40 мл воды. Затем смесь обрабатывают способом по примеру 21 и перекристаллизовывают из бензола. Получают 2,46 (выход 4,%) 2,3-дициано-5-(1-карбоксиэтил)амино-6-фенилпиразина с т,пл. 200-203С (разя,). Вычислено, %: С 61,43; Н 3,78; 23,88. C,(L Найдено, %: С 61,48; Н 3,84; 23,72. Согласно методикам примеров 21 и 22 получают соединения № 67, 145151, 154, 162, 173, 180, 189, 190, 194 и 213, представленные в табл. 1, П р и ме р 23, Получение 2,3-дициано-5-хлор-6-изопропоксипиразина, 50 мл изопропанола добавляют к 1,99 г (0,01 моль; 2гЗ-дициано-5,6-дихлорпиразина и полученную смесь кипятят 10 ч. После завершения реакции изопропанол отгоняют при пониженном давлении, Полученный продукт (1,14 г) хроматографируют на колонке с силикагелем, используя в качестве элюента смесь бензола-н-гексана, Получают 1,00 г (выход 45%) 2,.3-дициано-5.-хлор-6-изопропоксипиразина с т,пл, 48,. Вычислено, %: С 48,55; Н 3,17; 25,П, C9H-,N40Ce Найдено, %:С 48,51; Н 3,17; N 25,20, Пример 24, Получение 2,3-дициано-5-хлор-6-феноксипираэина, 1,00 г (0,005 моль) 2,3-дициано-5,6-дихлорпиразина растворяют в 50 мл тетрагидрофурана и раствор охлаждают до (-15)-(-10)С, Затем добавляют смесь 0,47 г (0,005 моль) фенола, 0,21 г (0,005 моль) гидроокиси натрия и . 25 мл воды 30 мяк. Смесь перемешивают при (-15) -(-10) 1ч. Затем реакционную смесь выливают в 100 мл ледяной водда и осадок отделяют фильтрацией, ПолученнЕйй осадок растворяют в 50 мЛ хлороформа, промывают 20 мл разбавленного водного раствора гидроокиси натрия и 3Q мл воды, сушат безводным хлористым кальцием и концентрируют при пониженном давлении. Сырой продукт хроматогра мруют на колонке, содержащей - 60 г силикагеля, используя, в качестве элюента бензол. Получают 0,65 г (выход 50% 2,3-дициано-5-хлор-б-феноксипиразина с т.пл. 115-118«С. Вычислено, %5 С 56,16; Н 1,36; N 21,83. C HeNxOCl Найдено, %: С 56,12; Н 1,97; ;N 21,86. Пример 25. Получение 2,3-диииано-5-хлор-6-этилтиопиравина. 1,00, г (0,005 моль),2,3-дициано-5,6-дахлорпиразина и 0,47 г этантиола растворяют в 50 мл ещетона. Радт.вор охлаждают до (-15) - (-10 ) С и п каплям 30 мин добавляют раствор 0,40 г (0,005 моль) пиридина в 40 м воды. Смесь обрабатывают способом п примеру 24. Получают 0,33 г (выход-29%) 2,3-дициано-5тхлор-6-этилтиопиразина с т.пл. 55,0-58,5С. Вычислено, %: С 42,77; Н 2,24; N 24,94. Cgft-N SCI Найдено, % G 42,75; Н 2,25; N 24,98. Пример 26. Получение 2,3-д циано-5-этиламино-6-феноксипиразина. 2,07 г (0,01 моль) 2,3-дициано-5-этиламино-6-хлорпиразина растворяют в 40 мл тетрагидрофурана и рас вор охлаждают до , затем к нем при перемешивании по каплям 10 мин добавляют смесь 0,94 г (0,01 моль) нола, 0,56 г (0,01 моль) гидроокиси калия, 5 мл воды и 20 мл тетрагидро фурана и перемешивают при 1 ч Посаде завершения реакции осадок отделяют фильтрацией. Фильтрат концен рируют при понизкенном давлении и ос таток выливают в 80 мл водвл. Выпавшие кристаллы отделяют фильтрацией и перекристаллизовьшают из бензола. Получают 2,22 г (выход 84%) 2,3-дициано-5-этиламино-6-феноксипиразна с т.пл. 197-198 с. Вычислено, %: С 63,89; Н 4,18; N 26,40. Найдено, %: С 63,40; Н 4,08;,N 26,40. Согласно методике, описанной в примере 26, синтезируют соединения 216-220, представленные в табл.1 Пример 27. Получение 2,3-дициано-5-н-пропиламино-6-(бензиятио)пиразина. 1,11 г (0,005 моль) 2,3-дициано -6-н-пропиламино-6-хлорпиразина и 0,87 г (0,007 моль) бензилтиола растворяют в 50 мл ацетона. Раствор охлаждают до . При перемешиван 30 мин по каплям добавляют смесь 0,40 г (0,005 моль) пиридина и 20 воды. Смесь перемешивают при ао-30 1 ч и концентрируют при пониженном давлении. Остаток экстрагируют 1001 хлороформа. Экстракт дваждь) прокыва 50 МП воды, сушат безводным хлористьвл кальцием и концентрируют при по ниженном давлении. Перекристаллизацией твердого остатка из этанола получают 0,47 г (выход 30%) 2,3-дициаКо-5-н-прО1ШЛалино-б-Сбензилтио пиразина с т.пл. 153-155,. Вычислено, %: С 62,11; Н 4;39| N 22,64. « bUtfN S Найдейо, %: С 62,44; Н 4,80; N 22,50. Согласно методике примера 27 синтезируют соединения 221-225,представленные в табл. 1. Пример 28. Получение 2,3-дициано-5,6-бис(метилтио/пиразина, 1,89 г (О,01 моль; 2,3-дициаио-5,6-дихлорпиразина растворяют в 30 мл ацетона. Полученный раствор охлаждают до и при перемешивании 10 мин по каплям добавляют к нему 7 г 20%-ного водного раствора натриевой соли метилмеркаптана. Смесь перемииивают при етце1 ч. После завершения реакции реакционную смесь концентрируют при пониженном давлении. Полученное желтовато-белое твердое вещество двгшды промывают 50 мл вода, сушат и перекристаллизовывают из этанола. Получают 1,64 г (выход 74%) 2,3-дициано-5,б-бис(метилтио пиразина с т.пл. 139-142,. Вычислено, %: С 43,23; Н 2,72; N 25,20. СвНбМ45 1 Найдено, %: С 43,40; И 2,70; N 25,03. По методике примера 28 получгиот соединения 226-234, представленные в тавл. 1. 2,3-Дицианопиразиновые производные общей формулы I обладают способностью ингибировать прорастание семян, с ч няков и/или способствуют увяданию.их стеблей и листьев и, таким образом, проявляют гербицидное д ёйствие в качестве активного ингредиента предвсходовых гербицидов и/или после всходовых гербицидов при обработке почвы, затопленной водой, при обработке листьев в стадии роста сорняков, при суходольной обработке почвы и т.п. В частности эти соединения обладают гербицидной активностью в затопляемых низинных полях или посевах риса, содержащих избыток воды, и могут, быть выгодно использованы в качестве активного ингредиента гербицидов, наносимых на рисовые посевы. Соединения формулы 1 обладгдат; селективной гербицидной активностью и могут эффективно контролировать вредные сорные травы, по существу не оказывай повреждающего эффекта на полезные сельскохозяйственные или садовые культуры, такие как рис, ячмень, пшеницу и OBOtw. Например,при обработке затопленной почвы псд посевами риса соединения формулы 1 могут селективно уничтожать Echlnochrt. Ipa oryzicola.. типичный сорняк семейства Gramlneous без существенного повреждения риса, который также относится к семейству Gramineous. Соединения формулы i проявляют гербицидное действие по отношению к следуюгцим сорнякам рисовых посево ComposItae (вtdens trlpartlta, etc.)j ScrophularIaceae (Oopatrlum Janceum, Vandellla angustlfolta, Oe)c jnostema violaceum Llndernlca procumbens , eta .) ; Lythraceae (Ammannla multlflora, Rotala l,ndlc&, Lythrum anceps, et8. Elattnaceae (Elatlne triandra, etc.fl,: Ca1 1 1 tr Ichaceae (CallltrHha ver n a, e t с .) ; Onagraceae (Ludwigia prostrata, etcj ; Polygonaceae (Polygonum Hydropiper, etc) , Ponteder1aceae (Monochoria vaglnalis,etc.) Erlocaulaceae (Eriocaulon Sleboldtianura, Eriocaulon Miquellanum, etc.);. Lemnaceae (SpJirodela poyrhlza, Lemna pauc1 costate, Lemna trlsulca, etc.), Cyperaceae (Сурегиз difformis, Eleocharls acicuiarls, Flmbrlstylia mtliaceae, Cyperussbrotlnus, Eclrpus}uncoldes,etc.){ Gramlneae (Echlnochloa oryzlcola Hymenachuc -Indlca, etc.)j Hydrocharttaceae (BIyxa ceratosperma, ottelia aHsmoldes, etc.), Allsmataceae (Allsma canallculatum, S.agittaria trifolla, S.agittar pygmaea, Sagittar a aglnashi, etc.) ., MarsMeaceae (Marsllea quadrifolla, etc.); Zygnemataceae (Spirogyra arela, e t с . ) i e t с, и сорнякам неэатопляемой почвы, «таким как Composltae (Ertgeron annus, ErIgeron phI 1ade1phicus, Qallnsoga clIlata, Erigeron canadensls, Taraxacum offlclnale, etc.), Rublaceae (Gallam Aparlne, etc.) Serophu1 ariaceae (Veronica dtdyma, etc,)/ Solanaceae (Solanum nigrum, etc. Convolva1aceae (Calystegia hederacea, etc.), Euphorblaceae (Euphorbia suplna, etc.); Oxalldaceae (Oxalls cornlculate, Oxatis Martiana, etc.); Cructferae (Capsella bursa-pasto rls, Raphanus raphanIstrum, Brassic n i gra, etc.) ; Caryfiphy)1aceae (Stellarla Alsln Cerastium hoiosteoIdes , Stellarla Media, etc.) , Ama ran thaceae (Amaranthus v i r I d I .Amaranthas llvldus, etc.) Chenopod i aceae (Chenopodlum a1bum, Chenopodlam facj foil urn, etcT), Polygonaceae (Polygonum perslaria, Rumex japonlcus, etc.)} Cyperace,ae (Cyperus cotundus, Cyperus Znia, etc,), Gramlneae (Alopecurus aegualls, DIgltaria adscendens, Poa annua, Eleuslne Indica, Echlnochloa crusgallI , etc . ) . Следующие примеры показывают гербицидную активность соединений формулы 1 на растениях. Пример 1. Обработка затопленной почвы. Заполняют полиэтиленовые горшки (1/5;000,ар) почвой для посевов риса (суглинистойу и заделывают семена Echlnochloa oryzicola, широколиственных сорняков Monochoria vaglnalls, Rotata tndica, Lendernia procumbens И Sclrpus junco ides на глубину 2 см и пересаживают два проростка Eleocharlaaclcularis. В то же время пересаживают ростки риса в стадии 2-3 листа группами каждая из двух ростков на глубину 2 см и заливают до ;у1эовня на 3 см выше поверхности почвы, Взвешивают смачивающийся порошок, содержащий одно из соединений формулы 1, разбавляют 10 кш воды и каплями нанося на поверхность воды. Затем рисовые растения выдерживают в стеклянной камере и через 3 нед. после обработки оценивают гербицидное действие активного соединения и их влияние на рис, результаты которого приведены в табл. 3. Гербицидная активность оценивается по схеме, . приведенной в табл. 2. Пример 2..Листовая обработка. , Семена риса, пшеницы. Pan I cum - cru S-gaHi, Olgltaria adscendens, Amaran thus vlrldis и редиса сеют в неглазированные горшки, наполненные jсуходольной почвой и покрывают слоем почвы толщиной В.1 см. Когда растения всходят и достигают.стадии 3-4 листьев, распыляют разбавленный смачивающийся порошок, который содержит одно из соединений формулы i, при дозе 100 л/1р ар. На 15-й. день после обработки оценивают степень повреждения каждого растения (оценка результатов проводилась так,же, как в примере 1), результаты чего приведены в табл. 4. пример 3. Обработка почвы в условиях возвышенности. Почву с возвышенности помещают в полиэтиленовые горшки, сеют пшеницу, рис, редис, кукурузу и соевые бобы и закрывают их почвой, содержащей, семена:-О fg 1 tar 1а adscendes, EchlnochJ oa crus-gain и Amaranthus vlrldesTOJOn1799760818
щиной 2 см. Сразу за этим распыляют росшие 3 нед. в стеклянной камере,,
смачиваклцийся порошок, содержащий со-Результаты приведены в табл. 5 (герединение формулы 1 при дозе 200 л/ .бицидную активность оценивают так
/ 10 ар. Затем исследуют растения,же, как в примере 1).
Таблица,
Продолжение табл. 1
Продолжение табл. 1
Продолжение табл. 1
Продолжение табл. 1
Продолжение табл. 1
Продолжение табл. 1
Продолжейие табл. 1
Продолжение табл. 1
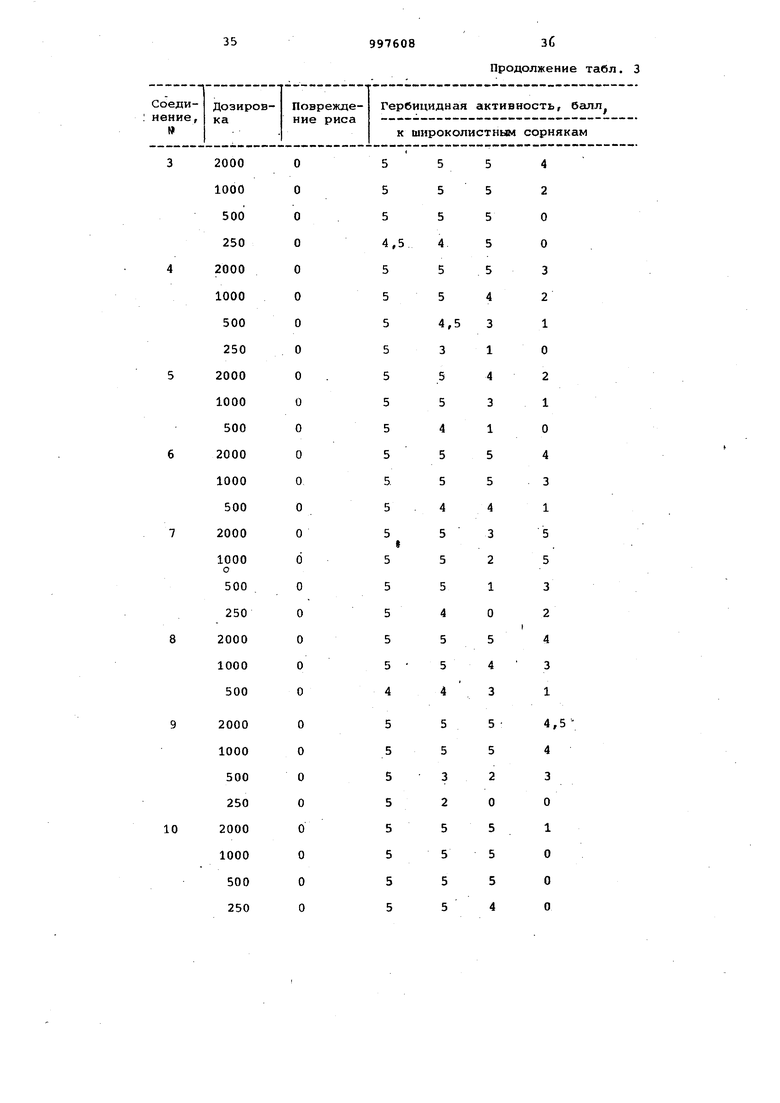
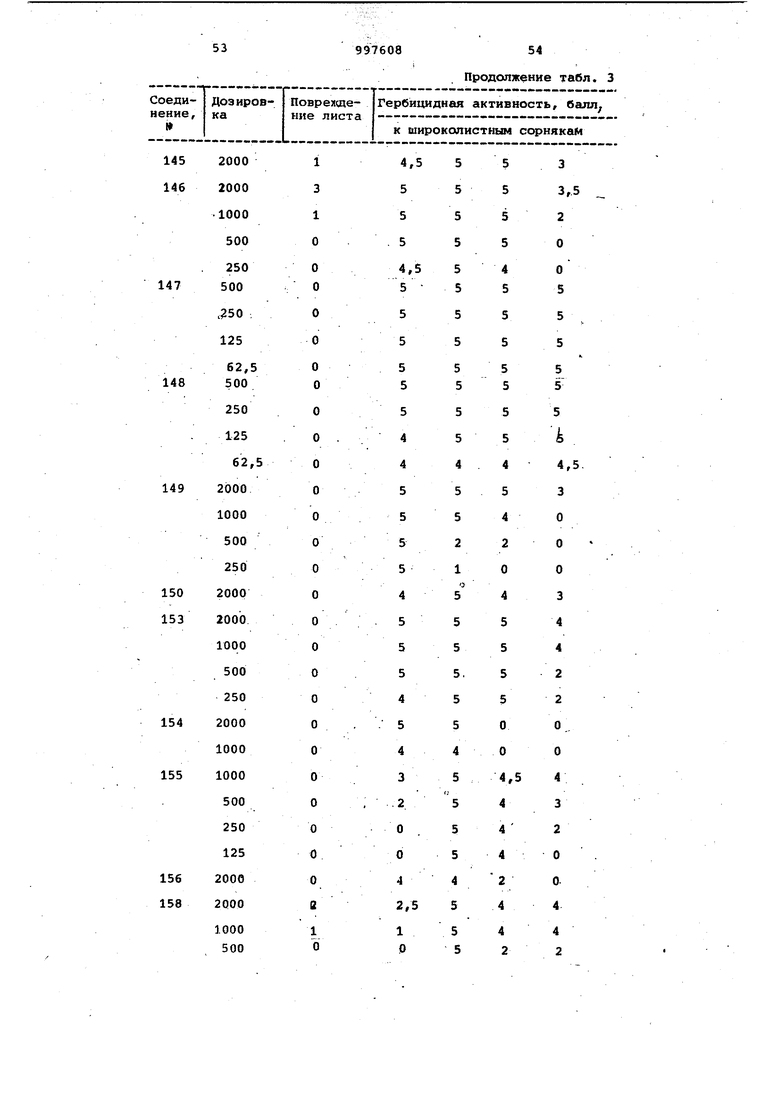
Продолжение табл. 3
37
38
997608 Продолжение . 3




























| название | год | авторы | номер документа |
|---|---|---|---|
| ПИРРОЛОИНДОЛЫ, ПИРИДИНОИНДОЛЫ И АЗЕПИНОИНДОЛЫ В КАЧЕСТВЕ АГОНИСТОВ 5-НТ2С | 1999 |
|
RU2232162C2 |
| Способ получения производных 1,2-диаминоциклобутен-3,4-диона или их хлоргидратов | 1982 |
|
SU1375127A3 |
| Способ получения производных амида 4-оксо-4Н-пиридо /1,2- @ /пиримидин-3-карбоновой кислоты или их кислотно-аддитивных солей | 1989 |
|
SU1820909A3 |
| Способ получения геминальных дигалоидных производных конденсированных пиримидин-4-онов,рацематов или оптически активных антиподов | 1980 |
|
SU1151210A3 |
| Способ получения 3,4-дигидрокарбостирильных производных или их солей | 1973 |
|
SU580835A3 |
| Способ получения производных пиримидо-(4,5-в)(1,4)-тиазина и пиразино-(2,3-в)-(1,4)-тиазина | 1973 |
|
SU459073A1 |
| Способ получения 4,5-диарил-2-(замещенный тио)-пирролов или их солей | 1979 |
|
SU1005657A3 |
| Способ получения производных азепина или их солей | 1982 |
|
SU1091858A3 |
| ПРОИЗВОДНЫЕ ДИАЗЕПИНОНА, СМЕСИ ИХ ИЗОМЕРОВ И ИХ СОЛИ | 1992 |
|
RU2017740C1 |
| Способ получения карбоксанилидов или их аммониевых солей | 1986 |
|
SU1561822A3 |

О О О
2000
1
1000
500
2000
2 1000 500 2000
13 1000 500 250 2000
14 1000 500 250 2000
15 1000 500 250 2000
16 17 2000 1000 2000
18 19 20 1000 2000 1000 2000 1000 500 250
2
55
1 О 5 5 5 4
О О
1
5
О
4,5
о
О
4
4,5
5
5 5 5 5 5 5 5
4
5
4
4,5
3
4
4,5
5
2
5
О
3
О
О
4,5
4,5
5 5 3 5 5 5
4
5
4
5
3
5
4,5
Q 2 1
2
2
5
5
4 5 5 5
4
,2 1 3 2 2 1 О О
4
4
2
3
4
- 5 5 5 5 5 5
3
г
3
5
4
5 5 4
4
3
2,5.
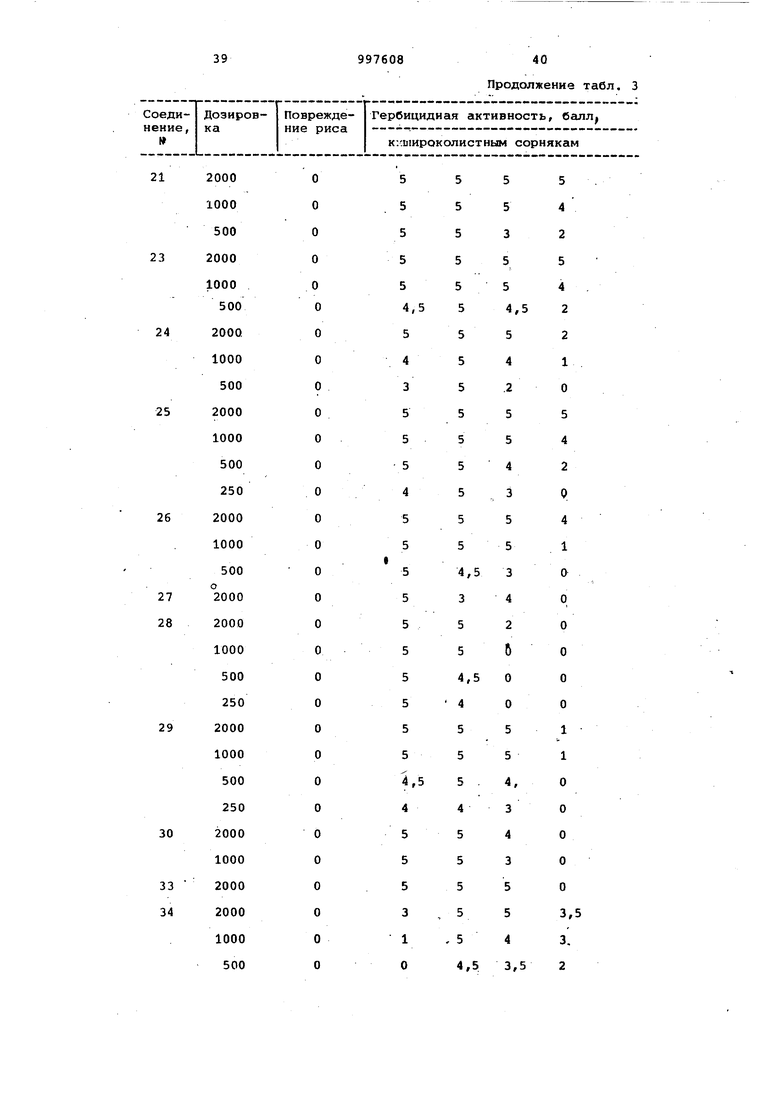
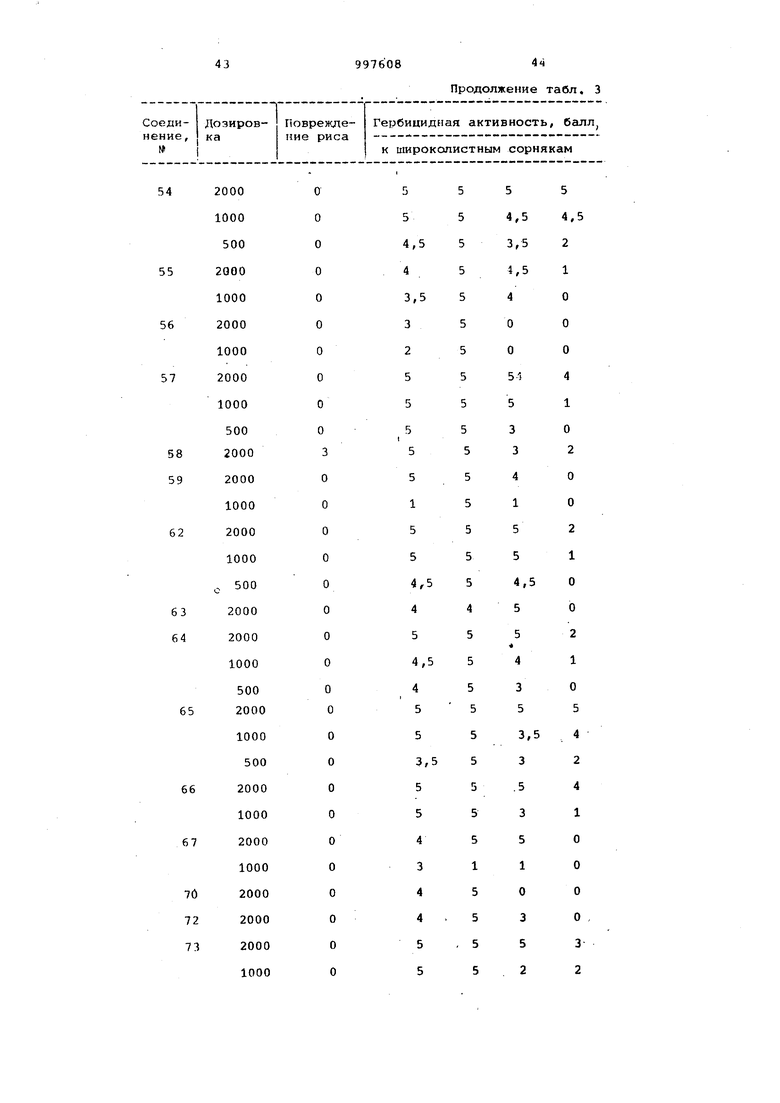
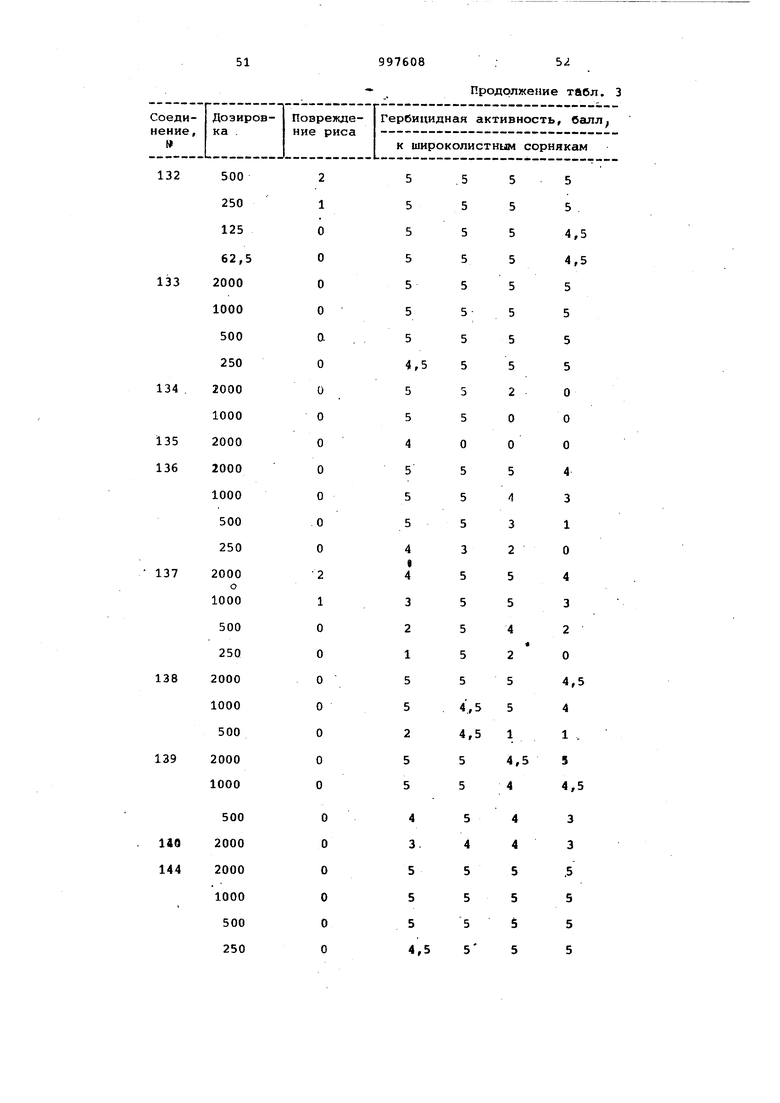
Продолжение табл. 3
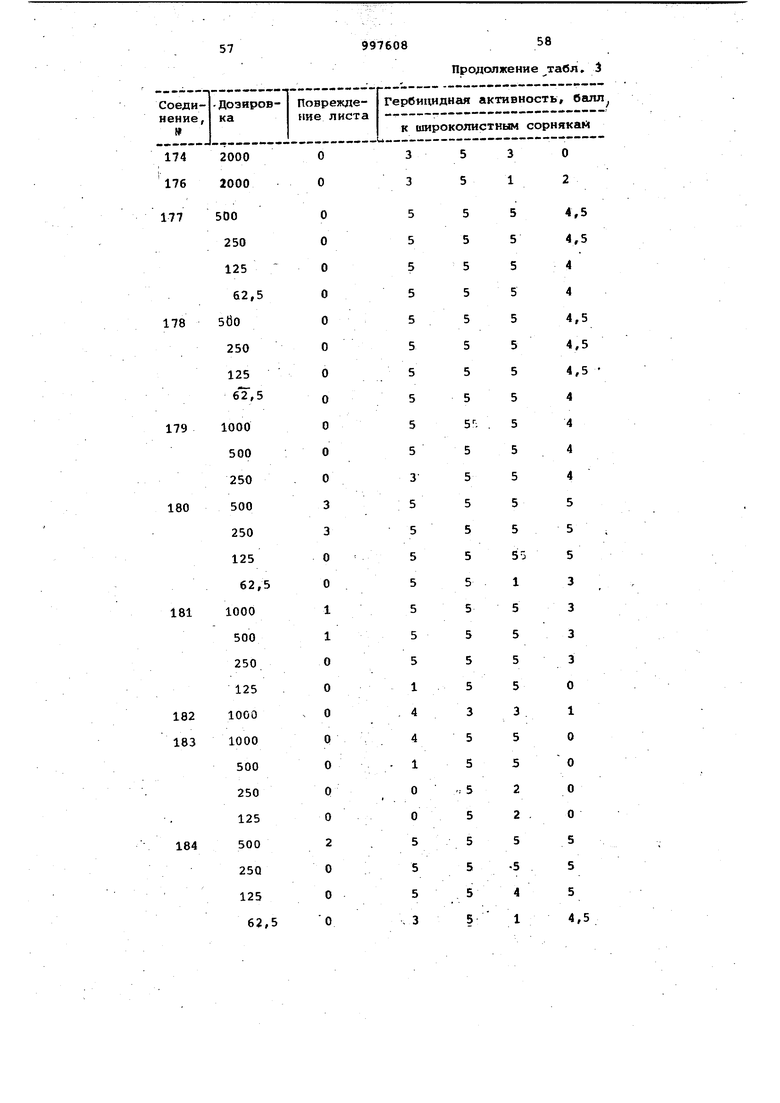
Продолжение табл. 3
Продолжение табл. 3
Продолжение табл. 3
Продолжение табл. 3
Продолжение табл. 3
Продолжение табл. 3
Продолжение табл. 3
Продолжение табл. 3
Продолжение табл, 3
Продолзхение табл. 3
Продолжение табл. 3
Продолжение табл. 3
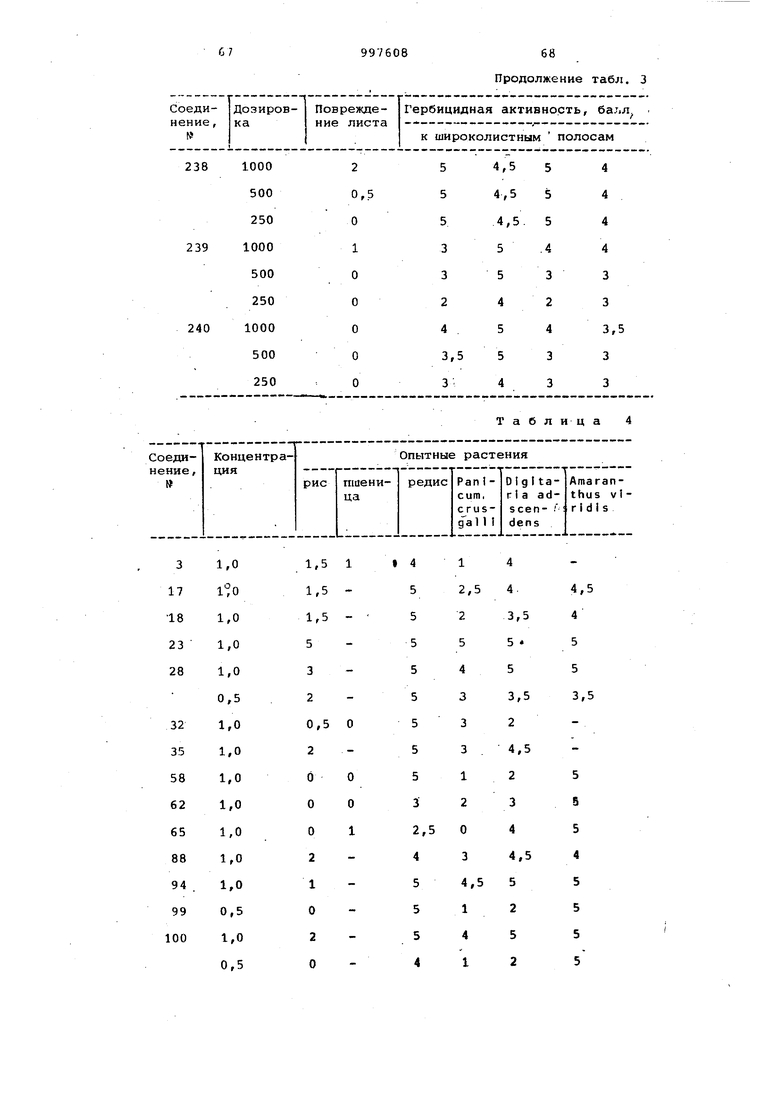
Продолжение табл. 3
Продолжение табл. 3
Таблица
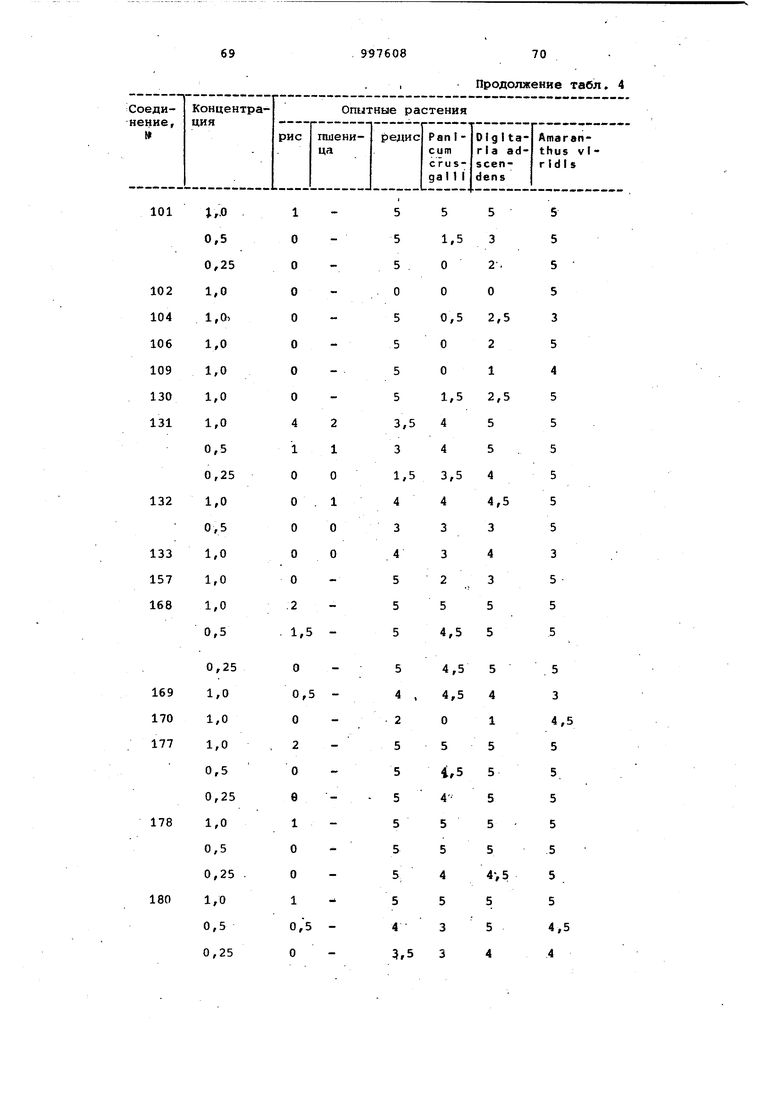
Продолжение табл. 4
1,0
о
1,0
о
1,0
о
0,5
о
0,25
о
1,0
о
0,5
о
1,0
о1,0
о
1,0
о
1,0
о
1,0
о
1,0
о
1,0
о
Продолжение табл. 4
0,5
4 5 5 4 4 5 3 4 3 3 4 3 1 4
4
О
3,5
5
5
4
5
4
4
5
5
3
5
2
5
2
3
1
4
5
5
4
О
5
0,5
5
2
2Т а б л и ц- а
Продолжение табл. 5
метенная одним или двумя заместителями из числа галоид, нитрогруппа, метил, метоксигруппа, карбоксиалкоксй-т алкоксикарбокси-, алкокси- или апканоилоксигруппа, в которых алкил с 1-3 атомами углерода, метиламииокарбонилокси-, Н-метилуреидогруппа или. группа форкч/лы , где R и П - водород, незамещенный алкил с 1-6 атомами углерода или замещенный одним или двумя заместителями из числа галоид, циано-, окси- или алноксигруппа, где алкил с 1-3 атомак углерода, карбоксил, этоксикарбонил, алканоил с 1-3 атомами углерода, диэтия амино, фенил или толил/ алпил, циклогексил, незамещенный фенил или замещенный одним или двумя заместителями из числа галоид, трифторметил, ,
алкил с 1-3 атомами углерода или алкоксил с 1-3 атомами углерода, или
4 совместно с общим атомом азота образуют 3-7-членный азотсодержащий цикл или морфолин.
А - все значения;
В - незамещенная гшкилтиогруппа с 1-3 атомами углерода или замещенная карбоксилом, или этоксикарбонилом, незамещенная фенилтиогруппа или замешенная галоидом или метилом, бензил тиогруппа,галоидбензилтиогруппа. I Источники информации, принятые во внимание при экспертизе

Авторы
Даты
1983-02-15—Публикация
1980-05-14—Подача