Изобретение относится к способу получения новых соединений - геминальных дигалоидных производных кон денсированных пиримидин-4-онов, рацематов или оптически активных ан типодов, которые могут найти примен ние в качестве промежуточных продук тов в синтезе 9-фениламино- или 9аминопиридо (1,2-а) пиримидинов, биологически активных соединений, обладающих антиаллёргической, антиастматипеской активностью. Известен способ галоидирования различных органических соединений, например циклических алкилов, путем замещения водорода на галоид. Процесс ведут в органическом растворителе, например хлороформе, уксусной кислоте, в качестве галогенирукицих агентов используют галоиды, N -галоИ сукцинимиды, сульфурилхлорид, пиридиний бромид пербромид ГО. Цель изобретения - способ получе ния новых геминальных дигалоидных производных конденсированных пиримидин-А-онов-, являющихся промежуточ ными продуктами в синтезе биологически активных пиридо (1,2-а) пиримидинов, обладающих антиаллергической и антиастматической активностью Поставленная цель достигается способом получения геминальных дигалоидных производных конденсирован ных пиримидин-4-онов общей формулы I XX V . О где X - хлор, бром; п - О, 1, 2; R, - водород, метнп, этил, который может находиться в поло жениях 6, 7 и 8; R, - карбокси-, карбоэтокси груп па, карбамоил, карбонитрил бром, метил, этил, фенил, R,, - водород, метил, этил, рацематов или оптически активных ан типодов, заключакяцимся в том, что рацемическое или оптически активное соединение общей формулы II У , Yf м, О где У - водород, хлор или бром, п, R, R, и Rj имеют указанные значения, подвергают взаимодействию с галоидлруюлшм агентом, причеьт если У-хлор или бром, галоидирующий агент берут в эквимолярном количестве, если У-водород, галоидирующий агент берут в двух.эквимолярном количестве, процесс ведут в инертном органическом растворителе, целевой продукт выделяют в виде рацематов или оптически активных антиподов. В качестве галоидирующего агента используют бром, хлор, сульфурилхлорид, N-бром- (или хлор)сукиинимид, пербромид пиридиний бромида. В качестве органического растворителя используют хлороформ, дихлорметан, ледяную уксусную кислоту. Процесс ведут в присутствии связывающего кислоту средства - ацетата щелочного металла. Пример 1. К раствору 1,4 г (0,005 моль) 9-бром-6-метил-4-кето6,7,8,9-тетрагидро-4Н-пиридо (1,2-а) пиримидин-3-карбоновой кислоты в 15 мл хлороформа, высушенного над сульфатом натрия, прибавляют по каплям раствор 0,3 мл (0,005 моль) брома в 5 мл хлороформа при перемешивании при комнатной температуре. Затем реакционную смесь перемешивают при комнатной температуре в течение получаса и оставляют на ночь. Вьтавшие кристаллы отфильтровывают и промывают небольшим количеством хлороформа . К осадку прибавляют 10 мл воды и lie МП хлороформа, устанавливают рН водной фазы равным 2 с помощью 3 вес.%-ного раствора бикарбоната натрия при перемешивании, отделяют органическую фазу, водную фазу обрабатывают хлороформом (2x10 мл). Объединенные органические фазы сушат над безводным сульфатом натрия, отго.няют растворитель при пониженном давлении. Остаток перекристаллизовывают из метанола. Получают 0,3 г (16,4%) 9 9-дибром-6-метил-4-кето6,7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-3-карбоновой кислоты, т.пл. 165-16бС. Вычислено, %: С 32,81; Н 2,75; N 7,65; Вг 43,65. С,оН,,К20зВГг Найдено, %: С 33,22; Н 2,78; N 7,65; Вг 43,58. Пример 2. К раствору 1,5 г (0,005 моль) 9-бром-6-метил-4-кето- , 6,7,8,9-тетрагидро-4Н-пиридо-(1,2-а)3пиримидин-З-карбоновой кислоты в 30 мл ледяной уксусной кислоты прибавляют раствор 0,3 мл (0,005 моль) брома в 2 мл ледяной уксусной кисло ты по каплям при перемешивании при комнатной температуре. Реакционную смесь затем перемешивают при 40-60 в течение получаса, после чего уксу ную кислоту отгоняют при пониженном давлении. К остатку прибавляют 10 м воды и 10 мл хлороформа и устанавли вают рН водной фазы равным 2 с помощью 10%-ного раствора бикарбоната натрия при перемешивании. Отделяют органическую фазу,.водную фазу обра батывают хлороформом (2x10 мл). Объединенные органические фазы суша над безводным сульфатом натрия, рас воритель отгоняют при пониженном давлении. Остаток перекристаллизовывают из метанола. Получают 0,8 г (53,8%) 9,9-дибром-6-метил-4-кето-6,7,8,9-тетрагидро-4Н-пиридо-(1,2-а)-пиримидин-З карбоновой кислоты, плавящейся при 164-166 С. Продукт не дает какойлибо депрессии температуры плавления при смешивании с продуктом примера 1. I Пример 3. К раствору 14 г кристаллического ацетата натрия и 10,4 г (0,05 моль) 6-метил-4-кето6,7,8,9-тетрагидро-4Н-пиридо (1,2-а пиримидин-З-карбоновой кислоты в 100 мл ледяной уксусной кислоты при бавляют по каплям 5,4 мл (0,1 моль) брома медленно при перемешивании пр комнатной температуре. Перемешивани реакционной смеси продолжают 2 ч пр комнатной температуре, после чего растворитель отгоняют при пониженном давлении. К остатку прибавляют 50 мл воды и 50 мл хлороформа и устанавливают рН водной фазы равным 2 с помощью 5%-ного раствора би-карбоната натрия при перемешивании. Отделяют органическую фазу, водную фазу обрабатывают хлороформом (2x50 мл). Объединенные органически фазы сушат над безводным сульфатом натрия, отгоняют растворитель при пониженном давленииi Остаток кристаллизуют из метанола. Получают 9,4 г (51,3%) 9,9-дибром-6-метил-4-кето-6,7,8,9-тетрагидро-4Н-пиридо-(1,2-а)пиримидин-Зкарбоновой кислоты, плавящейся при 165-166 С. Продукт не дает какой04либо депрессии температуры плавления при смешивании с продуктом примера 1 или 2. Пример 4. Процесс ведут в условиях примера 2, заменив рацемическую /1/-9-бром-6-мет1ш-4-кето-6, 7,8,9-тетрагидро-4Н-пиридо-(1,2-а)пиримидин-3-карбоновую кислоту на оптически активную (+) 9-бром-6метил-4-кето-6,7,8,9-тетрагидро-4Нпиридо- (1, 2-а) пиримидин-3-карбоно-, вую кислоту, получают (+)-9,9-дибром-6-метил-4-кето-6,7,8,9-тетрагидро-4Н-пиридо-(1,2-а)пиримидин-3карбоновую кислоту, плавящуюся при 157-159 0. Выход 49,0% (о). ,5°(, метанол). Вычислено, %: С 32,81; Н 2,75; N 7,65; Вг 43,66. МоН,о 20зВГ2 Найдено, %: С 33,11; Н 2,60; N 7,56; Вг 43,44. Пример 5. Процесс ведут в условиях примера 3, заменив рацемическую (1)-6-метил-4-кето-6,7,8,9тетрагидро-4Н-пиридо-(1,2-а)-пиримидин-3-карбоновую кислоту на оптически активную (-)-6-метил-4-кето-6,7,8,9тетрагидро-4Н-пиридо-(1,2-а)-пиримидин-3-карбоновую кислоту, получают (+)-9,9-дибром-6-метил-4-кето-6,7, 8, 9-тетрагидро-4Н-пиридо-( 1,2-а)-пиримидин-3-карбоновую кислоту, плавящуюся при 157-158 С. Продукт не дает какой-либо депрессии температуры плавления при смешивании с продуктом примера 4. -, Выход 51,2% (ci) +47,, метанол) . Примерб. Процесс ведут в условиях примера 2, заменив рацемическую (1)-9-бром-6-метш1-4-кето-6, 7,8,9-тетрагйдро-4Нгпиридо-(1,2-а)пиримидин-3-карбоновую кислоту на оптически активную (-)-9-бром-6-метил-4-кето-6,7,8,9-тетрагидро-4Н-пиридо (1,2-а)-пиримидин-3-карбоновую кислоту, получают (-)-9,9-дибром-6метил-4-кето-6,7,8,9-тетрагидро-4Нпиридо( 1, 2-а)-пиримидин-3-карбоновую кислоту, плавящуюся при 157-159 С. Выход 49,5% (f.),, метанол) . Вычислено, %: С 32,81; Н 2,75; N 7,65; Вг 43,65. CioHieN2.03Brt Найдено, %: С 33,21; Н 2,72; 7,60; Вг 43,62 Пример 7, Процесс ведут в условиях примера 3, заменив рацемическую (1)6-метип-4-кето-6,7,8,9тетрагидро-4Н-пиридо-(1,2-а)-пиримидин-3-карбоновую кислоту на оптически активную (+)-6-метш1-4-кето-6,7, 8,9-тетрагидро-4Н-пиридо-(1,2-а)-пиримидин- 3-карбоновую кислоту, получают (-)-9,9-дибром-6-метил-4-кето6,7,8,9-тетрагидро-4Н-пиридо-(1,2-а) пиримидин-3-карбоновую кислоту, получают (-)-9,9-дибром-6-метш1-4-кето-6,7,8,9-тетрагидро-4Н-пиридо(1,2-в)-пиримидин-3-карбоновую кислоту, плавящуюся при 157-159 С. Выход 51,5% (0) -47,5 (, метанол). Продукт не дает какойлибо депрессии температуры плавлени при смешивании с продуктом примера 6 Примеры 8-11. К раствору 1,4 г кристаллического ацетата натрия и 0,005 моль исходного соединения, показанного в табл. 1, в 10 мл ледяной уксусной кислоты прибавляют по каплям 0,54 мл (0,01 моль) брома медленно при перемешивании при комнатной температуре. Реакционнзто смес перемешивают 2 ч при комнатной температуре, после чего уксусную кислоту отгоняют при пониженном давлеНИИ. К остатку прибавляют 10 мл хлороформа и суспензию перемешивают 15 мин при комнатной температуре. Выпавший в ocaдok кристаллический продукт отфильтровывают и промьюают хлороформом, фильтрат упаривают, остаток кристаллизуют из растворите ля, указанного в табл. 1. Примеры 12-17. К раствору 1,4 г кристаллического ацетата натрия и 0,005 моль исходного соеди нения, показанного в табл. 1, в 10 мл ледяной уксусной кислоты прибавляют 3,2 г (0,01 моль) пириднний бромид пербромида порциями при пере мешивании при ксмяатпой температуре Затем реакционную смесь перемешиваю при комнатной температуре в течение 2 ч и отгоняют уксусную кислоту при пониженном давлении. К остатку прибавляют 10 мл вода и обрабатьгоают хлороформом (3x10 мм). Объединенные органические фазы сушат над беэводным сульфатом натрия растворитель отгоняют в какууые. Остаток кристал лизуют из метанола. Примеры 18-20. Растворяют (суспендируют) 0,05 моль исходно го соединения, показанного в табл. 1, в 80 мл дихлорметана и к полученному раствору суспензии) прибавляют при комнатной температуре раствор 13,5 мг (0,1 моль) сульфурилхлорида в 20 мл дихлорметана. Реакционную смесь кипятят до прекращения выделения газа (3-4 ч), отгоняют растворитель и остаток перекристаллизовывают из этанола. Выход 70-80%. Полученные соединения представлены в табл. 1. Пример 21. К раствору 2,2 г кристаллического ацетата натрия и 0,8 г (0,005 моль) 6-метш1-6,7,8,9тетрагидро-4Н-пиридо-(1,2-а)-пиримидин-4-она в 10 мл ледяной уксусной кислоты прибавляют по каплям 1,0 мл (0,018 моль) брома при комнатной температуре- при перемешивании. Реакционную смесь перемешивают при 50-60 С полчаса, после чего кислоту отгоняют при пониженном давлении. К остатку прибавляют 10 мл хлороформа и суспензию перемешивают 10 мин при комнатной температуре. Кристаллы отфильтровывают и промывают хлороформом. Фильтрат выпаривают в вакууме. При перекристаллизации остатка из метанола получают 1,5 г (74,8%) 3,9,9трибром-6-метил-6,7,8,9-тетрагидро4Н-пиридо-(1,2-а)-пиримидин-4-она, плавящегося при 157-159 С. Вычислено, %: С 26,96; Н 2,26; iN 6,98; Вг 59,79. CjHjNjOBrj Найдено, %: С 26,80; Н 2,06; N 7,00; Вг 59,00. Пример 22. Процесс ведут в условиях примера 8, но исходя из 3,6-диметил-6,7,8,9-тетрагидро-4Нпиридо-(1,2-а)-пиримидин-4-она, получают 9,9-дибром-Э,6-диметш1-6,7,8, 9-тетрагидро-4Н-пиридо-(1,2-а)-пиримвдин -4-он, плавяищйся при 114115°С. Выход 30,0%. Вычислено, %: С 35,75; Н 3,39; N 8,34; Вг 47,56. С1вН,вНгОВг2 Найдено, %: С 35,74; Н 3,72; N 8,22; Вг 47,85. Пример 23. К раствору 2,1 (0,01 моль) 6-метил-4-кето-6,7,8,9тетрагидрр.-4Н-пиридо-(1,2-а)-пиримидии-3-карбоновой кислоты в 20 мл хлороформа прибавляют частями 3,6 г (0,02 моль) N-бромсукцинимида при перемешивании. Реакционную смесь ки пятят с обратным холодильником 5 ч и отгоняют хлороформ при пониженном давлении. К остатку прибавляют 20 мл воды и перемешивают суспензию 15 мин при комнатной температуре. Отфильтровывают нерастворимые кристаллы, сушат и перекристаллизовывают из метанола. Получают 1,5 г (41,0%) 9,9 дибром-6-метил-4-кето-6,7,8,9тетрагидро-4Н-пиридо - (1, 2-в) -пиримидин-3-карбоновой кислоты, плавящейся при 163-164 С. Продукт не дает какой-либо депрессии точки пла ления при смешивании с продуктом примера 1. П-р и м е р 24. К раствору 0,4 (0,005 моль) 6-метил-4-кето-6,7,8,9 тетратидро-4Н-пиридо-(1,2-а)-пиримидин-3-карбоновой кислоты в 10 мл хлороформа прибавляют порциями 1,33 (0,01 моль) N-хлорсукцинимида при перемешивании. Затем реакционную смесь кипятят с обратным холодильником 5 ч, после чего отгоняют хлор форм при пониженном давлении. К остатку прибавляют 10 мл воды и перемешивают суспензию при пониженном давлении. К остатку прибавляют 10 м воды и перемешивают суспензию при комнатной температуре в те чение 15 мин. Отфильтровывают кристаллы, сушат и перекристаллизо вывают из метанола,. Получают .0,7 г (50,5%) 9,9-дихлор-6-метйл-4-кето-6,7,8,9-тетрагидро-4Нпиридо (1,2-а)-пиримидин-3-карбоновой кислоты, плавящейся при 190-191 Продукт не дает какой-либо депресси температуры плавления при смешивании с продуктом примера 18. Пример 25. Процесс ведут в условиях примера 8, заменив 6-метил 4-кето-6,7,8,9-тетрагидро-4Н-пиридо (1,2-а)-пиридин-3-карбоновую кислот на 3-этил-2,6-диметил-6,7,8,9-тетра тидро-4Н-пиридо-(1,2-а)-пиримидин-4 он, и при перекристаллизации сырого продукта из 50%-ного водного этанол получают 9,9-дибром-3-этил-2,6-диме тил-6,7,8,9-тетрагидро-4Н-пиридо(1,2-а)-пиримидин-4-он, плавящийся при 90-92°С. Выход 57,2%. Вычислено, %: С 39,59; Н 4,43; N 7,69; Вг 43,9. .NjOBrr Найдено, %: С 39,21; Н 4,24: N 7,59; Вг 43,76. Пример 26. Процесс ведут в условиях примера 8, заменив 6-метил4-кето-6,7,8,9-тетрагидро-4Н-пиридо(1,2-а)-пиримидин-3-карбоновую кислоту на 3-фенил-6-метил-6,7,8,9тетрагидро-4Н-пиридо-(1,2-а)-пиримиДИН-4-ОН, и при перекристаллизации сырого продукта из этанола получают 9,9-дибром-3-фенил-6-метил-6,7,8,9тетрагидро-4Н-пиридо-(1,2-а)-пируМИДИН-4-ОН, плавящийся при 154-156 0. Выход 70,4%. Вычислено, %: С 45,26; Н-3,54; N 7,04; Вг 40,14. с,5 Найдено, %: С 45,26; Н 3,54; N 7,21 ; Вг 40,25. Пример27. К раствору 2,08 г (0,01 моль) этилового эЛира 4-кето-4,6,7,8-тетрагидропирроло(1,2-а)-пиримидин-3-карбоновой кислоты в 10 мл 75%-ного (обьем/объем) водного раствора уксусной кислоты и прибавляют 2,12 г (0,02 моль) ацетата натрия. После этого прибавляют по каплям раствор 3,2 г (0,02 моль) брома в 10 мл 75%-ной (объем/объем) водной уксусной кислоты. Затем реакционную смесь перемешивают при 60°С в течение получаса, разбавляют ее 250 мл воды и встряхивают с тремя порциями по 4 мл хлороформа. Объединенные хлороформные фазы сушат над сульфатом натрия и выпаривают. Желтый маслянистый остаток кристаллизуется при стоянии. При перекристаллизации сырого продукта из этанола получают 2,2 г (60%) этилового эфира 8,8-дибром-4-кето-6,7,8,9-тетрагидропирроло-(1,2-а)-пиримидин-3карбоновой кислоты, плавящейся при 97-100°С. Вычислено, %: С 32,81; Н 2,75; N 7,65; Вг 43,66. CioHioN OiBrj Найдено, %: С 33,28; Н 2,62; N 7,52; Вг 43,27. Пример 28. Процесс ведут в условиях примера 27, заменив этиловый эфир-4-кето-4,6,7,8-тетрагидропирроло-(1,2-а)-пиримидин-3-карбоновой кислоты на этиловый эфир 4-кето-5,6,7,8,9,10-гексагидро-4Нпиримидо-(1,2-а) азепин-3-карбоновой кислоты, и проводят реакцию при 90°С в течение часа, получают 2,1 г (53%) этилового эфира 10,10дибром-5,6,7,8,9,10-гексагидро-АНпиридо-(1,2-а)-азепин-3-карбоновой кислоты. Вычислено, %: С 36,57; Н 3,58; N 7,10; Вг 40,35. , Найдено, %: С 36,32; Н 3,49; N 7,02; Вг 41,02. Пример 29. Проводят в условиях примера 21, но вместо б-метил6,7,8,9-тетрагидро-4Н-пиридо(1,2-а)пиримидин-4-она применяют 2-фенил6-метил-6, 7,8,9-тетрагидро-4Н-пиридо (1,2-а)пйримкдин-4-он. Получают 3,9, 9-трибром-2-фенил-6-метш1-6,7,8,9тетрагидро-4Н-пйридо(1,2-а) пиримиДИН-4-ОН, выход 54,5%. Т. пл. 164166С. Вычислено, %: С 37,77; Н 2,75; N 5,87; Вг 50,26. С,5Н,,НгОВгз Найдено, %: С 38,04; Н 2,88; N 5,95; Вг 49,80. Пример 30. 1,0 г (0,005 мол 6-метил-4-кето-6,7,8,9-тетрагидро-4Н пиридо(1,2-а) пиримидин-3-карбоновой кислоты, 0,3 г (0,005 моль) гидроокиси калия и 2,7 г (0,02 моль) ацетата натрия суспендируют в 1 мл безводного этанола. К суспензии при перемешивании при комнатной температуре по каплям добавляют 1,0 мл (0,02 моль) брома. Смесь продолжают перемешивать еще 1 ч и испаряют в вакууме. К остатку добавляют 10 мл воды и трижды встряхивают с кпорофор мом, взятом порциями по 5 мл. Объединенные органические фазы сушат над сульфатом натрия,, растворитель отгоняют при пониженном давлении. Остаток перекристаллизовывают из метанола. Получают 0,4 г (выход 20,0 %) 3,9,9-трибром-6-метил-6,7,8,9-тетрагидро-4Н-пиридо (1,2-а)пиримидин-4она, т.пл. 156-157С. Проба смешения с соединением примера 21 не дает депрессии температуры плавления. Пример 31. 1,6 г (0,01 мол 6-метил-6,7,8,9-тетрагидро-4Н-пиридо (1,2-а) пиримидин-4-она и 2,8 г (0,02 моль) ацетата натрия растворяют в 20 мл ледяной .уксусной кислоты. При перемешивании при комнатной температуре добавляют частями 6,4 г (0,02 моль) комплекса бромид пириди ний бромида. Смесь продолжают перемешивать в течение 30 мин при комнатной температуре и отгоняют раств ритель при пониженном давлении, К о татку добавляют 10 МП воды и переме шивают при комнатной температуре в 1 1010 течение 30 мин. Кристаллы отсасывают и промывают небольшим количеством воды. Получают 0,5 г (выход 15,6%) 9,9-дибром-6-метил-6,7,8,9-тетрагилро-4Н-пиридо(1,2-а)пиримидин-4-она. Т. пл. 130-132 С. Вычислено,%: С 33,58; Н 3,13; N 8,70; Вг 49,63. СдН,о NjOBrj Найдено, %: С 33,76; Н 3,09; N 8,67; Вг 49,49. Пример 32. 3,2 г (0,01 моль 9,9-дибром-6-метил-6,7,8,9-тотрагидро-4Н-пиридо-(1,2-а)пиримидин-4она и 1,4 г (0,01 моль) ацетата натрия растворяют в 20 мл уксуснор1 кислоты. При перемешивании при комнатной температуре по каплям добавляют 54 г (0,01 моль) брома. Смесь продолжают перемешивать при комнатной температуре в течение 30 мин, растворитель отгоняют при пониженном давлении. К остатку добавляют 10 мл воды и продукт экстрагируют хлороформом (3x5 мл). Объединенные экстракты сушат над сульфатом натрия, упаривают в вакууме. Остаток перекристаллизовывают из метанола. Получают 2,2 г (вьпсод 55,0%) 3,9,9-трибром-6-метш1-6,7,8,9-тетрагидро-4Н-пиридо(1,2-а) пиримидин-4-она, т.пл. 156-159 С. Проба смешения с соединением примера 21 не дает депрессии температуры плавления. В примерах 33-61 показана возможность получения 9-фениламино- или 9-аминопиридо (1,2-а) пиримидинов биологически активных соединений. обладающих антиаллергической, антиастматической активностью, с использованием в качестве исходных производных пиридо (1,2-а) пиримидин-4онов общей формулы I. Пример 33. 1,83 г (5 ммоль) 9,9-дибром-6-метил-4-кето-6,7,8,9тетрагидро-4Н-пиридо ( 1,2-а) пиримидин-3-карбоновой кислоты растворяют в 5 мл диметилсульфоксида. К раствору добавляют 0,5 мл (5,5 моль) анилина и 1,3 мл (10 ммоль) Ы,Ы-диметиланилина. Реакционную смесь выдерживают в течение 3 сут, затем выливают в 20 мл воды. Продукт отфипьтровьюают, промываютнебольшим количеством воды, сушат и перекристаллизовьюают из ацетонитрила. Получают 0,83 г (55,8%) 9-анш1ино-6метил-4-кет6-6,7-дигидро-4Н-пиридо . (1,2-а) пиримидин-3-карбоновой кисleg-ITO C. лоты,т.пл. %: С 64,64; Н 5,09; Вычислено, 14,13 a,,H,,N,0, С 64,22; Н 5,08; Найдено, N 14,14. Пример 34. В соответствии с методикой примера 33, но используя пиридин вместо Н,Ы-диметиланилина в качестве акцептора галогенводорода, получают 9-анш1ино-6-метил-4-кето-6,7-дигидро-4Н-пиридо (1,2-а) пиримидинтЗ-карбоновую кислоту, т.пл. 170-17ГС, выход 47,1%. Пример 35. 1,83 г (5 ммоль) 9,9-дибром-6-метил-4-оксо-6,7,8,9тетрагидро-4Н-пиридо (1,2-а) пиримидин-3-карбоновой кислоты растворяют в 10 мл хлороформа. К этому раствору добавляют 1,5 мл (15 ммоль) н-бутиламина. Реакционную смесь выдерживают -в течение 3 сут, после чего добавляют 5 мл воды. Доводят рН водной фазы до значения 2,0 с помощью 5 вес.% соляной кислоты при перемешивании. Отделяют органическую фазу, водную фазу экстрагируют двумя порциями по 5 мл хлороформа. Объе диненные органические фазы высушивают безводным сульфатом натрия, после чего растворитель отгоняют в вакууме Остаток перекристаллизовывают из метанола. Получают 0,5 Г (36,1%) 9-(н-бутиламино)-6-метнл-4-оксо-6,7дигидро-4Н-пиридо (1,2-а)-пиримидинЗ-карбоновбй кислоты, т.пл. 135-137° %: С 60,63; Н Вычислено, N 15,15. . Найдено, %: С 60,92; Н 7,00; N 15,20. И р им е р 36. В 15 мл метанола суспендируют 1,83 г (5 ммоль) 9,9дибром-6-метил-4-оксо-6,7,8,9-тетрагидро-4Н-пиридо (1,2-а).-пиримидин-3 карбоновой кислоты и мп (15 ммол анилина. Смесь нагревают при перемешивании, пока не получат раствора Этот раствор охлаждают до комнатной температуры и перемешивают в течение 3 сут. Выпавшие кристаллы от фильтровывают и промывают метанолом Получают 0,8 г (53,8%) 9-анилино6-метил-4-оксо-6,7-дигидро-4Н-пиридо (1, 2-а)-пиримидин-3-карбоновой кисло ты, т.пл. 172-173 С. 1 012 Пример 37. Растворяют в 30 млабсолютного этанола 3,9 г этилового эфира (10 ммоль) 9,9-дибром6-метил-4-оксо-6,7,8,9-тстрагидро-4Нпиридо-(1,2-а)пиримидин-3-карбоновой кислоты. К этому добавляют 3,3 мл (30 ммоль) N-метиланилина, после чего реакционную смесь кипятят с обратным холодильником в течение 8 ч. Когда реакция завершается, растворитель отгоняют при пониженном давлении. К остатку добавляют 40 мл 5%-ной соляной кислоты, продукт экстрагируют двумя порцияьпг по 15 мл хлороформа. Объединенные органические фазы высушивают над безводной гидроокисью натрия и выпаривают в вакууме. Остаток перекристаллизовьгоают из метанола. Получают 2,6 г (76,6%) этилового эфира 6-метил-9-(М-метиланилино)-4-ОКСО-6,7,-дигидро-4Н-пиридо (1,2-а) пиримидин-3-карбоновой кис141-142С. лоты, т.пл. С 67,24; Н 6,23; Вычислено, N 12,38. Ci3H2 N30i %: С 67,50; Н 6,36; Найдено, 12,41. Пример 38. Следуя методике примера 37, но используя вместо этилового эфира 9,9-дибром-6-метнл-4оксо-6,7,8,9-тетрагидро-4Н-пиридо (1,2-а) пиримидин-3-карбоновой кислоты 9,9-дибром-6-метил-4-оксо-6,7, 8,9-тетрагидро-4Н-пиридо (1,2-а) пиримидин-З-карбоновзпю кислоту полу чают 6-метил-9-(Н-метиланилино)-4оксо-6,7-дигидро-4Н-пиридо (1,2-а) пиримидин-3-карбоновую кислоту, т.пл. 170-17ГС. Вычислено, %: С 65,58; Н 5,50; N 13,49. С,Н, NjO Найдено, %: С 65,22; Н 5,62; N 13,37. Пример 39. Растворяют в 40 мл диметилсульфоксида 19,7 г (50 ммоль) этилового эфира 9,9-дибром-6-метил-4-оксо-6,7,8,9-тетрагидро-4Н-пиридо (1,2-а) пиримидин3-карбоновой кислоты, после чего добавляют 13,7 мл (150 ммоль) анилина. Этот раствор вьщерживают в течение 3 cyTi После выдерживания раствор разбавляют . 100 мл воды и встряхивают с тремя порциями по 30 мл бензола..Объединенные органические фазы высушивают безводным
сульфатом натрия и выпаривают в вакууме. Перекристаллизация остатка из.этанола дает 9,5 г (58,4%) этилового эфира 9-анилино-6-метил4-ОКСО-6,7-дигидро-4Н-пиридо (1,2-а) пиримидин-3-карбоиовой кислоты, т.пл. 119-120 0.
Вычислено, %: С 66,45; Н 5,89; N 12,91.
Ci,H,,N,03
С 66,28; Н 5,81;
Найдено, %; N 12,82.
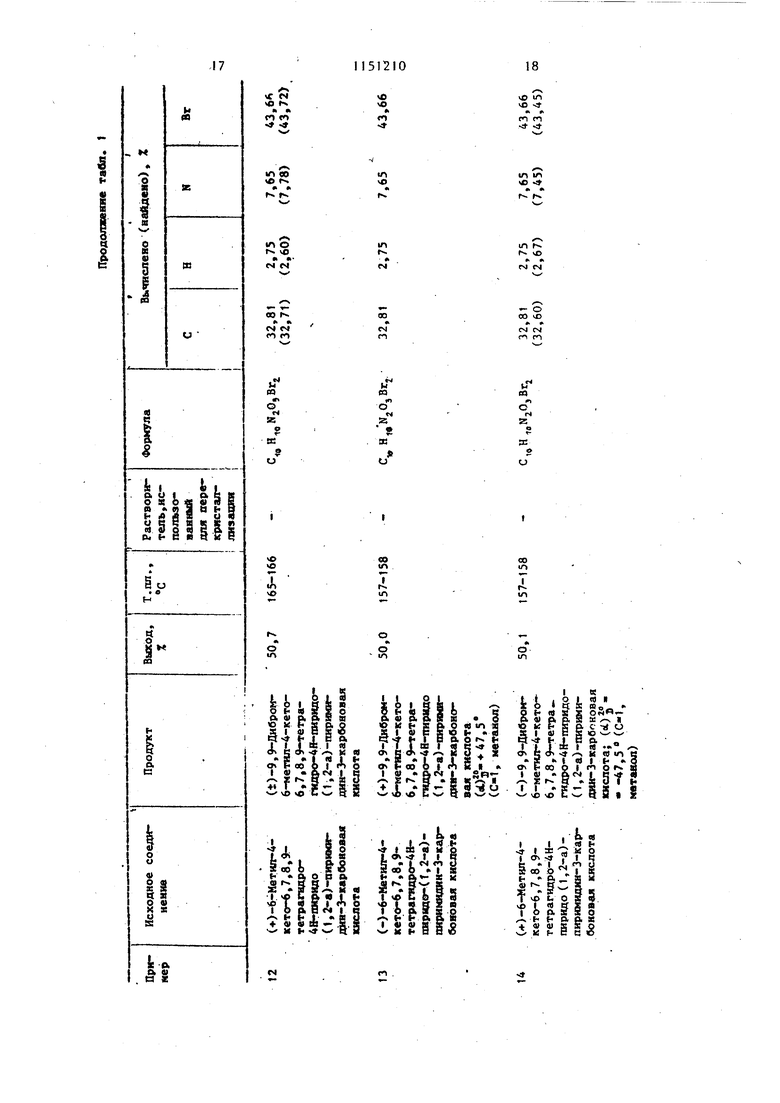
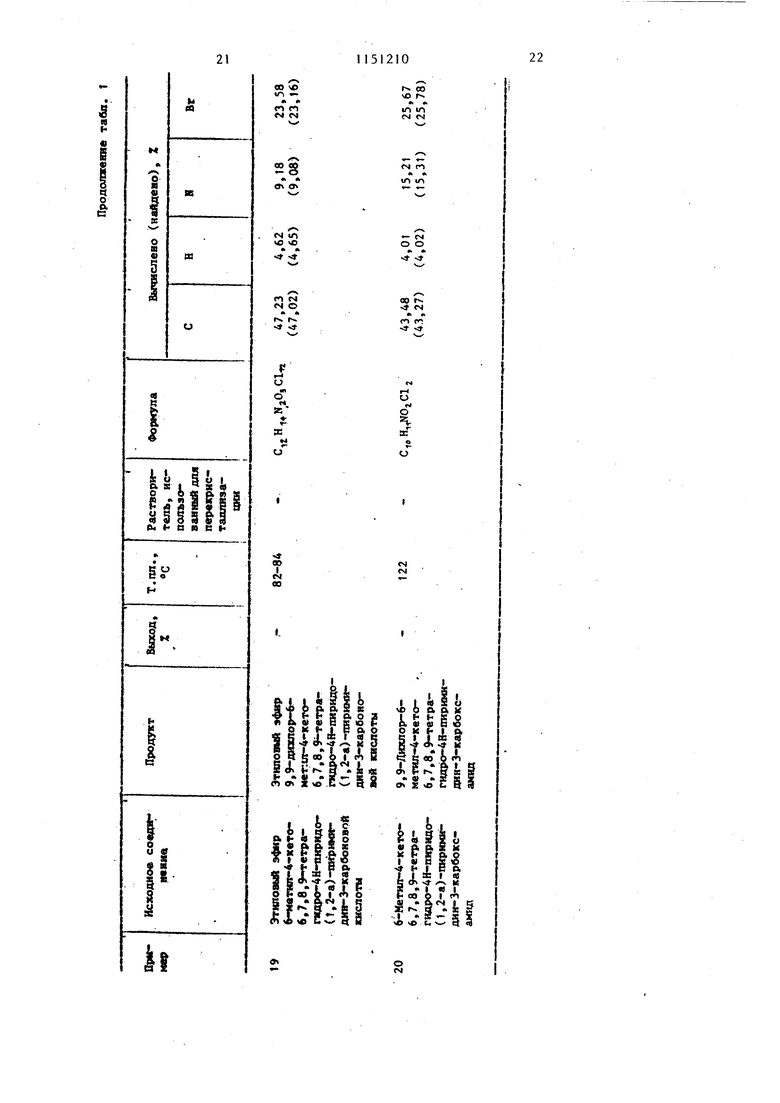
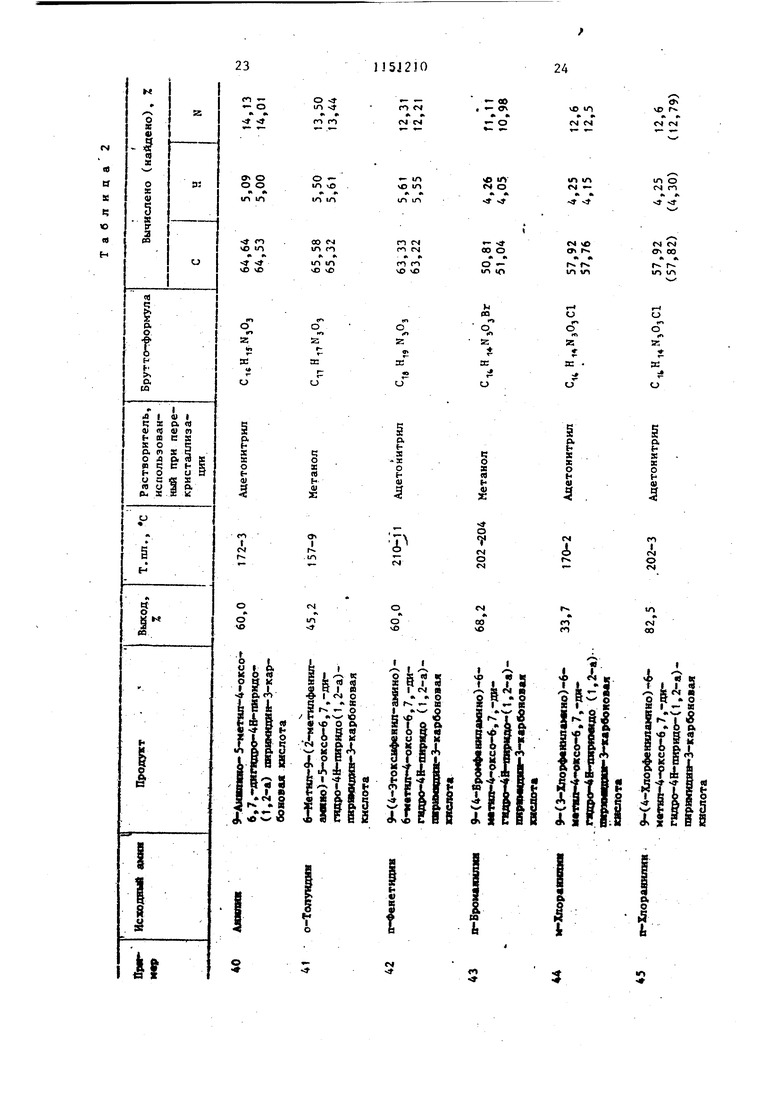
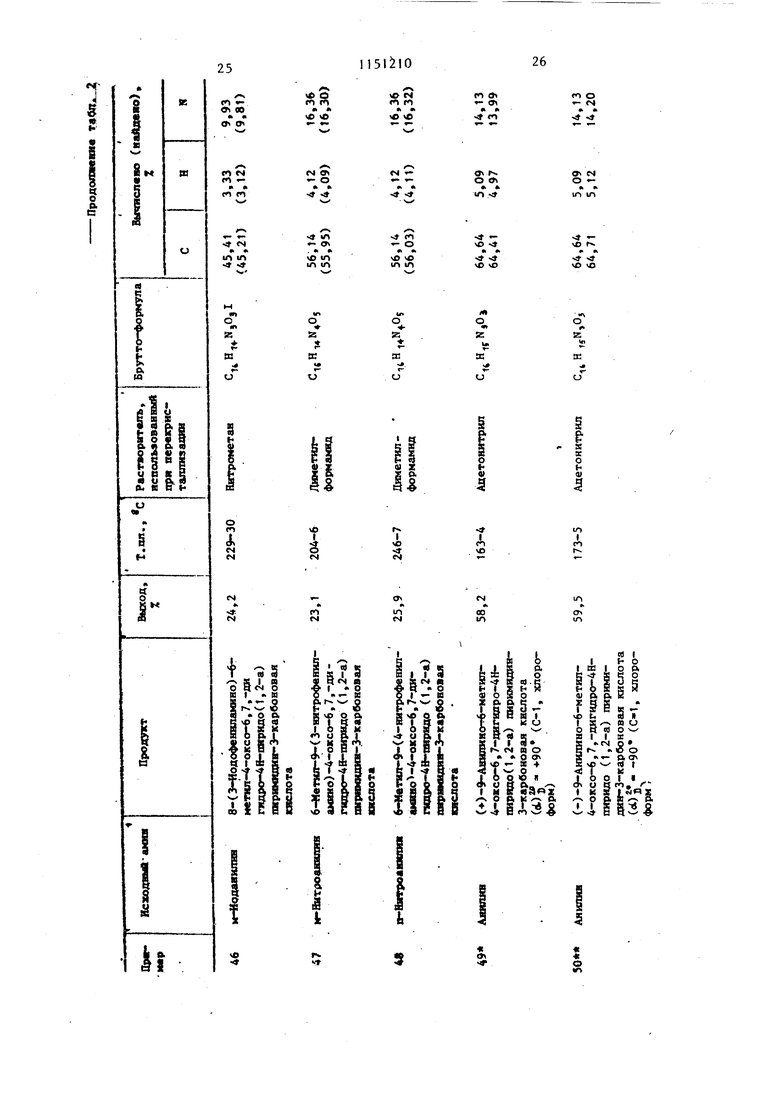
Примеры 40-51. Растворяют в 5 мл диметилсульфоксида 3,7 г (10 мколь) 9,9-дибром-6-метил-4оксо-6,7,8,9-тетрагидро-4Н-пиридо (1,2-а). пиримидин-3-карбоновой кислоты. К этому раствору добавляют 30 ммоль ароматического амина (табл. 2). Реакционную смесь выдерживают при комнатной температуре в течение 3 сут. Выпавшие в осадок кристаллы отфильтровывают (если кри таллизация не происходит, то продукт осаждают из реакционной смеси путем добавления 20 мл воды шти 20 ил метайола). Продукт перекристаллизовывают из растворителя, указанного в табл. 2.
В табл. 2 даны дигалоидные производные 9-аминопиридо(1,2-а)пиримиДИН-4-ОНОВ, полученные при использовании в качестве исходных 9-дибромпиридо(1,2-а)пиримидин-4-онов.
Пример 52. Следуя методике примера 40, но заменяя 9,9-дибром6-метил-4-оксо-6,7,8,9-тетрагидро4Н-пиридо (1,2-а) пиримидин-3-карбоновую кислоту на 9,9-дибром-4-оксо6,7,8,9-тетрагидро-4Н-пиридо (1,2-а) пиримидин-3-карбоновую кислоту, получают 9-(фенил-амино)-4-оксо-6,7-дигвдро-4Н-пиридо (1,2-а) пиримидин3-карбоновую кислоту, т.пл. 197198С (ацетонитрил). Выход 60,5%.
Вычислено, %: С 63,60; Н 4,63; N 14,83.
Ct,H,,N,,03
С 63,42; Н 4,59;
Найдено, %i N 14,70.
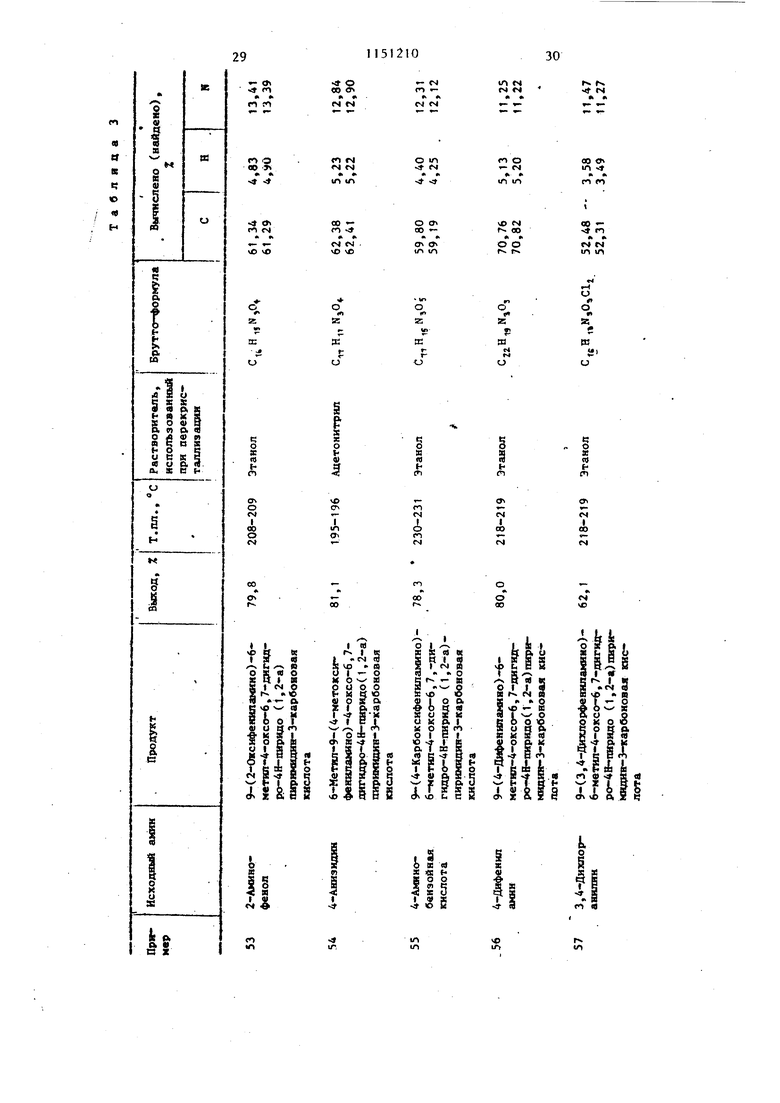
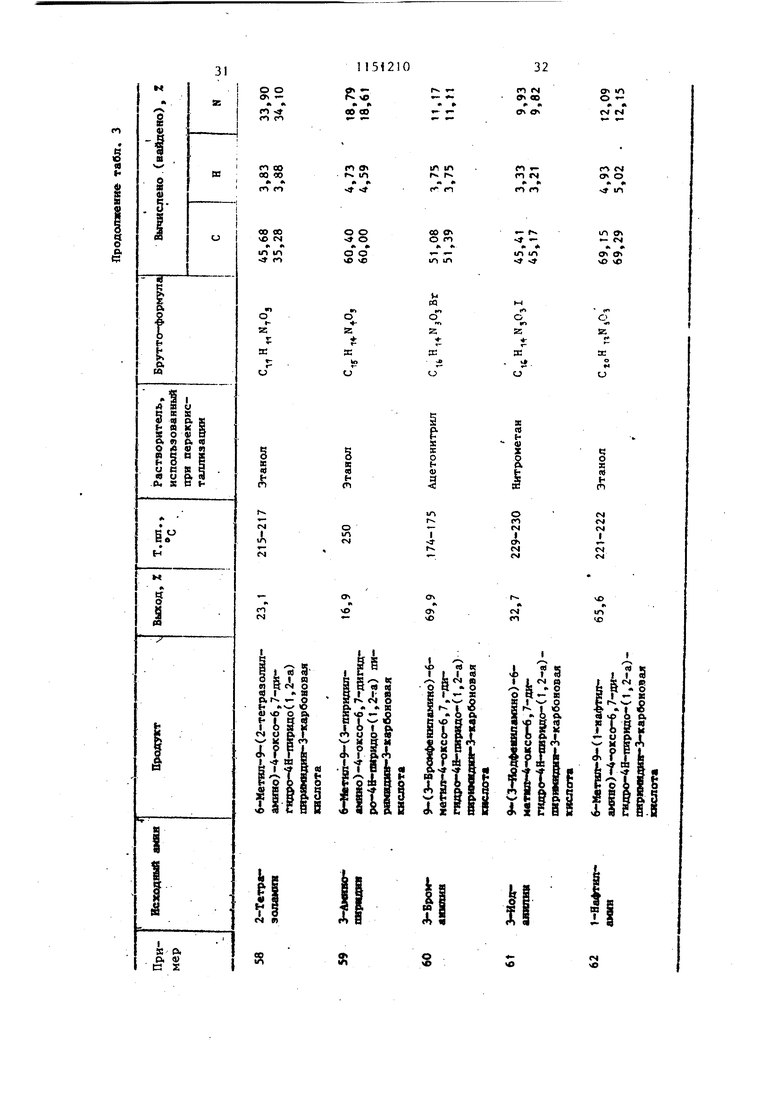
Примеры 53-62. Используя метод примеров 40-51, получают соединения, указанные в табл. 3 (производные 9-фениламинопиридо(1,2-а)пиримидин-4-онов).
in CM
vO
I H
;1 m
I OQ
-
r
in yi
vO Л
О 41
in о
О « r чО
д:
5
X
§
to
.- (M OO (N; f
ri r
CJ
,.. I
u
CO
о
tit I
(Si
z
o.
I
и
IIi
Xи«I
asIo-5 B
о
оо fC01(иIs
n n3ehя
Е-д eSи.n
се
иt;с;sкsn
fl)Vо Eo.s
ф к
Cufсfflцb €
чО
i.
U-I vD
О
« p,
со
fO o. Ia vo ч Mrt
л o
GO 00
со о rg r OO гл
vO vO
ro m vt t
- o
Ci «- о
vc о
r- vO
r vO OO О S
О t-1
r
-4 vo r
0 О
00
--t -
f4 n
n n
га d
Wi &
V4
pa О
1
г; ж
SB
о
о
p
я n
tf fH
Ю
VO
О
l
cs
Ю eo n ь
о о t vo
u-1 1Л
kl vt -
m
1
VO vO 0 О
о
I
n
x
ON vO
-
О
SB
s
V .
5
1
О ON
CO
r ю
о О
m n
CO гЛ
vO Ю Л D vO 1Л
Ю n
n ГО M CM
- «
- in
1Л CM -- о VO r
о о
о ш
1Л оf 00
О NO
oo
«- M
- о п гм
00 tn 1
tM CV
m СЛ
S









| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения производных пиридо/1,2-а/пиримидина или их солей с щелочными металлами или их оптических изомеров | 1980 |
|
SU1024007A3 |
| Способ получения производных пиридо /1,2-а/ пиримидина или их оптических изомеров, или их гидратов, или их солей | 1980 |
|
SU980622A3 |
| Способ получения конденсированных производных пиримидина в виде рацематов или оптических изомеров | 1978 |
|
SU1181546A3 |
| Способ получения производных пиридо-(1,2-а) пиримидина или их фармацевтически приемлемых солей,или их оптически активных изомеров | 1978 |
|
SU999972A3 |
| Способ получения конденсированных производных пиримидина или их солей | 1980 |
|
SU1082324A3 |
| Способ получения производных пиридо (1,2- @ ) пиримидина или их кислотно-аддитивных солей | 1978 |
|
SU1022659A3 |
| Способ получения 9-формилпроизводных пиридо @ 1,2- @ пиримидина или их оптически активных антиподов | 1982 |
|
SU1245260A3 |
| Способ получения производных пиридо (1,2-а) пиримидина или их фармацевтически приемлемых солей или их оптически активных изомеров | 1978 |
|
SU999973A3 |
| Способ получения производных пиридо/1,2-а/пиримидинов или их солей,или их оптически активных изомеров | 1978 |
|
SU906379A3 |
| Способ получения производных пиридо/1,2-а/пиримидина или их солей | 1978 |
|
SU906378A3 |
1.Способ получения геминальных дигалоидных производных конденсированных пиримидин-4-онов общей формулы I Д (СИ где X - хлор, бром; п - О, 1, 2; R - водород, метил, этил, который может находиться в положениях 6, 7 и 8; Rj - карбокси-,.карбоэтоксигруп-па, карбонитрил, бром, метил, этил, фенил; R3 - водород, метил, STIW, рацематов или оптически активных антиподов, отличающийся тем, что рацемическое или оптически активное соединение общей формулы II Y Y« где У - водород, хлор 1ти бром. R, RX и RJ имеют указанные значения подвергают взаимодействию с галоидирующим агентом, причем если У - хлор или бром, галоидирунщий агент берут в эквимолярном количестве, если У - водород, галорщирующий агент берут в двухэквимолярном колиОТ честве, процесс ведут в инертном органическом растворителе, целевой продукт выделяют в виде рацематов или оптически активных антиподов. 2.Способ ПОП.1, отличающийся тем, что в качестве галоидирующего агента используют бром, сд iS хлор, сульфурилхлорид, N-бром (хлор);сукцинимид, пербромид пиридиний бро;мида. 3.Способ ПОП.1, отличающийся тем, что в качестве инертного йрганического растворителя используют хлороформ, дихлорметан, ледяную уксусную кислоту. 4.Способ ПОП.1, отличающийся тем, что процесс ведут в присутствии связыванмдего кислоту средства - ацетата щелочного металла.
« p
О
2-.
I
О
-J
и I
«; S n)
G ft (П
ч X
3 4J M
X с ь
CO
n
§0
vO ro о
н
о
ft
о
ем
К
о
о
г го сч
-
ON
ш n см
SI
СО NO
1Л
м о «ч f4
00 g
в л
S 1Л VO VO
ш
СП см f4 о
Гч Г
t -
р
1-1
о
о
Г4
SK
-
ж
ы
го
г ео
VO f
in in
fM М
CM го
«k « 1Л «л
- сч
о о
00 Г -
го m .
вГ
Q
о
А
00
I
о
|А Vr.
о ot ж о
€Ч
J
И
о р
О t
СП - - О
in
4t
о а о о о
lA хС
Ю
С1
VO U-1 in f
st
in in
JO v vC
о
О n
ю
г
:
r- ttn
I-
o
о
X
X
о и
rt I
f
о
in
ло
tf
- 00
o «n
vO Г
- CV
СЧ t4
«- о
in о
О 1Л
in n
in
ч о
tS| n
(M -
in
-
S CM
CM «e
- ч
M 00 о CT r
O OO
CS
о -
r 1
r r in ri
in lO «n in
ц ю
и
«J
l«
о
о
к
f
S5
г
S:
#
Ж
ас
л
го
о
о
a
I
X
о ь
4)
«1
5
см
ел
А
i
о
г
с
м
«л
00
fO
б.
I
t.
м
ю
t
г г
in
«S fM
П о
00 0
ю «
- м
00 -
чО (М
f ОО
- п
о о
г см
1Л Л
Гх г
о
tl
г 5 X
т ш
с4 |
«1 о
О
I
ж
М
п
9« сч г
i
00
|
v
О
v
ао
g
S
о к «I
- к
1ё
ffi в
,«5
g
-
«
Г
1Г «Л
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Вейганд-Хильгетаг | |||
| Методы эксперимента в органической химии | |||
| М., Химия, 1968, с | |||
| Способ получения нерастворимых лаков основных красителей в субстанции и на волокнах | 1923 |
|
SU132A1 |
Авторы
Даты
1985-04-15—Публикация
1980-05-08—Подача