Изобретение относится к органической химии, к классу гетероциклических соединений - приводных дигидрофурана с одной карбонильной группой в цикле и фосфорсодержащим фрагментом в боковой цепи, а именно к новому способу получения неизвестных ранее соединений - 5-арил-2-гидрокси-2-(трифенилфосфоранилиден)метоксикарбонилметил-2,3-дигидр -3-фформулы  HBr которые могут найти применение в медицине в качестве лекарственных препаратов с противомикробным действием.
HBr которые могут найти применение в медицине в качестве лекарственных препаратов с противомикробным действием.
Известен способ получения 2-гидрокси-2-фенацил-5-фенил-2,3-дигидро-3-фуранона, заключающийся во взаимодействии 1,6-дифенил-1,3,4,6-гексантетраона с гидроксидом натрия в среде метанола с последующим разложением образующегося динатриевого производного соединения III 5% -ным водным раствором серной кислоты [1] . Целевое соединение, полученное с выходом 2,5% , является очень неустойчивым и при стоянии, а также при нагревании и перекристаллизации быстро переходит в нециклическую форму III [1] .
Известен способ получения 5-арил-2-гидрокси-2-метоксикарбонилметил-2,3-дигидро-3-фуранонов, заключающийся в том, что 5-арил-2-метоксикарбонилметилен-2,3-дигидро-3-фураноны подвергают нагреванию с соляной кислотой в среде ацетона при температуре 45-50оС [2] .
Известен также способ получения 1-трифенилфосфоранилиден-4-арил-5-карбэтокси-4-циклопентен-2,3-дионов, заключающийся в том, что 5-арил-2,3-дигидро-2,3-фурандионы подвергают нагреванию с этоксалилметилентрифенилфосфораном в среде бензола [3] . Этот способ-аналог взят нами за прототип.
К недостаткам приведенных способов-аналогов, в том числе и способа-прототипа относятся:
невозможность получения 2-гидрокси-2(трифенилфосфоранилиден)алкоксикарбонилметил-2,3-дигидро-3-фура оновтак как исходные фосфорсодержащие карбонильные соединения неизвестны и не могут быть получены известными способами;
необходимость нагревания реакционной смеси;
недостаточно высокий выход целевых соединений.
Целью изобретения является разработка простого по выполнению, свободного от указанных недостатков способа, позволяющего с высоким выходом получать 5-арил-2-гидрокси-2-(трифенилфосфоранилиден)метоксикарбонилметил-2,3-дигидр -3-фформулы 1. Ожидаемый от использования изобретения положительный эффект заключается в том, что лежащий в основе изобретения способ синтеза целевых соединений является препаративным и может найти широкое применение в лабораторных и промышленных условиях синтеза биологически активных веществ, в том числе лекарственных препаратов с проти- вомикробным действием.
Указанная цель достигается тем, что 5-арил-2,3-дигидро-2,3-фурандионы подвергают взаимодействию с метоксикар- бонилметилентрифенилфосфораном в среде инертного органического растворителя при комнатной температуре по следующей схеме  + (C6H5)3P = CHCOOCH3
+ (C6H5)3P = CHCOOCH3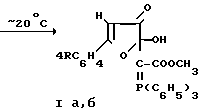 и выделяют целевые продукты известными приемами.
и выделяют целевые продукты известными приемами.
Полученные соединения представляют собой бесцветные кристаллические вещества, растворимые в этаноле, хлороформе, ацетоне, диметилсульфоксиде, трудно растворимые в бензоле, эфире и не растворимые в воде и гексане.
Такое протекание реакции, лежащей в основе заявляемого способа, является неожиданным, так как известно, что карбонильные соединения реагируют с фосфоранами с образованием продуктов реакции Виттига - олефинов и фосфиноксида [4] .
П р и м е р 1. 2-Гидрокси-2-(трифенилфосфоранилиден)метоксикарбонилметил-5-фенил-2,3-дигид о-3-(1а).
К раствору 0,87 г (0,005 моля) 5-фенил-2,3-дигидро-2,3-фурандиона в 50 мл бензола при комнатной температуре добавляют при перемешивании раствор 1,67 г (0,005 моля) метоксикарбонилметилентрифенилфосфорана в 100 мл бензола, через час осадок отфильтровывают и перекристаллизовывают из бензола. Получают 2,10 г (83% ) кристаллического соединения 1а с т. разл. 124-125оС.
Найдено, % : C 73,01; Н 5,23; Р 6,27;
С31Н25O5P ˙М 508,53.
Вычислено, % : C 73,22; Н 4,96; Р 6,09.
ИК спектр, ν, см-1, CHCl: 1700 (С3= O), 1660, 1600 (P--C--C--O). Спектр ЯМР1Н, 300 МГц, δ, м. д. , CDCl3: 3,17 с, 3,25 с (3Н, OCH3), 4,35 с (1Н, OH), 6,30 с (1Н, С4Н), 7,35-7,85 м (2O H, 4С6Н5).
Спектр ЯМР13С, 300 МГц, δ, м. д. , J, Гц, CDCl3: 49,85 с, 49,95 с (OCH3), 49,9 д, Jср 4 (Р= СС), 66,7 д, Jср 111, 67,9 д, Jср 111 (Р= С), 123,3 д, Jср 94, 125,3 д, Jср 94 [PC(C6H5)] , 128,68, 128,84, 129,06, 129,32, 133,85, 133,97, 134,06, 134,17 (С6Н5), 137,38, 137,44 (С6Н5), 131,5 с, 132,9 с (С= СН), 168,16 с, 168,43 с (С= СН), 189,69 д, Jср 4,8, 191 д, Jср 4,8 (С= O), 195,6 д, Jср 11,5, 197,2 д, Jср 11,5 (C= O).
Спектр ЯМР31Р, 300 МГц, δp, м. д. , СНСl3: 15,5 с, 16,9 с.
При проведении реакции с теми же количествами реагентов, но:
П р и м е р 2. При использовании в качестве растворителя толуола - выход целевого продукта 1а составляет 88% .
П р и м е р 3. При использовании в качестве растворителя хлороформа - выход продукта 1а составляет 85% .
П р и м е р 4. 2-Гидрокси-2-(трифенилфосфоранилиден)метоксикарбонилметил-5-п-хлорфенил-2,3 диги(1б).
К раствору 1,04 г (0,005 моля) 5-п-хлорфенил-2,3-дигидро-2,3-фурандиона в 100 мл бензола при комнатной температуре добавляют при перемешивании раствор 1,67 г (0,005 моля) метоксикарбонилметилентрифенилфосфорана в 100 мл бензола, через час осадок отфильтровывают и перекристаллизовывают из бензола. Получают 2,15 г (79% ) кристаллического соединения 1б с т. разл. 125-126оС.
Найдено, % : С 68,42; Н 4,63; Cl 6,37; P 5,58.
С31Н24ClO5P. М 542,98.
Вычислено, % : С 68,58; Н 4,46; Cl 6,53; Р 5,70.
П р и м е р 5. При проведении реакции 0,87 г (0,005 моля) 5-фенил-2,3-дигидро-2,3-фурандиона с 1,67 г (0,005 моля) метоксикарбонилметилентрифенилфосфорана в 100 мл бензола при температуре 80оС в течение 5 мин. образуется 2-метоксикарбонилметилен-5-фенил-2,3-дигидро-3-фуранон с выходом 1,05 г (91% ), т. пл. 163-164оС.
ИК спектр, ν, см-1 (кристаллы): 1670 (С3= O), 1550-1590 (P--C--C--O).
Спектр ЯМР1Н, 60 МГц, δ, м. д. , CDCl3: 3,12 с, 3,20 с (3Н, OCH3). 4,30 с (1Н, OH), 6,18 с (1Н, C4H), 7,25-7,70 м (19 Н, 3С6Н5, С6Н4).
Строение целевых соединений доказано с помощью ИК и ЯМР спектров. В спектрах ЯМР1Н имеется сигнал протона гидроксильной группы при 4,30-4,35 м. д. , исчезающий при добавлении в среду дейтерированного спирта (вследствие дейтерообмена), что свидетельствует в пользу предложенной для этих соединений структуры. С помощью спектров ЯМР13С, снятых с применением методики АРТ (Attached Proton Test) установлено, что при атоме углерода фрагмента P= C отсутствуют протоны и это свидетельствует о том, что соединения не могут иметь структуру бетаинов или солей фосфония. Все сигналы в спектрах ЯМР удвоены, что указывает на существование двух устойчивых коформеров вследствие заторможенного вращения вокруг связи С-С.
Практическая значимость целевых соединений заключается в их протикомикробной активности. Так, соединение 1б обладает выраженным бактериостатическим действием по отношению к эталонным штаммам золотистого стафилококка (грамоположительные бактерии) и кишечной палочки (грамоотрицательные бактерии), что выражается в задержке роста этих бактериальных культур при минимальной ингибирующей концентрации (МИК) вещества 500 и, соответственно, 250 мкг/мл. Соединение 1а активно при МИК 500 мкг/мл.
Заявляемый способ получения 5-арил-2-гидрокси-2-(трифенил-фосфоранилиден)метоксикаронилметил-2,3-дигидр -3-фформулы 1а, б по сравнению с прототипом имеет следующие преимущества.
Заявляемый способ простой по выполнению не требует нагревания реакционной смеси; целевые продукты 1а, б образуются с количественным выходом, побочные продукты отсутствуют.
Заявляемый способ предоставляет возможность получения широкого ряда ранее не известных 5-арил-2-гидрокси-2-(трифенилфосфоранилиден)метоксикарбонилметил-2,3-дигидр -3-фкоторые невозможно получить известными способами.
Таким образом, способ получения 5-арил-2-гидрокси-2-(трифенилфосфоранилиден)метоксикарбонилметил-2,3-дигидр -3-фможет найти применение как в лабораторных, так и промышленных условиях синтеза биологически активных веществ. (56) Poje M. , Balenovic K. // J. Heterocycl. Chem. 1979. Vol. 16. N 4. Р. 417-420.
Авторское свидетельство СССР N 1606510, кл. C 07 D 307/56, 1989.
Авторское свидетельство СССР N 960185, кл. C 07 D 9/50, 1981.
Бартон Д. , Оллис У. Д. Общая органическая химия. М. : Химия, 1983. Т. 4. С. 173.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 1,6-ДИАРИЛ-3,4-ДИГИДРОКСИ-2,4-ГЕКСАЛИЕН-1,6-ДИОНОВ | 1990 |
|
SU1767835A1 |
| СПОСОБ ПОЛУЧЕНИЯ 2,3-БИС-АРОИЛМЕТИЛЕН-1,2,3,4-ТЕТРАГИДРОХИНОКСАЛИНОВ | 1991 |
|
RU2009136C1 |
| Способ получения 2-алкоксикарбонилметилен-5-арил-2,3-дигидрофуран-3-онов | 1982 |
|
SU1077891A1 |
| Способ получения 5-арил-2-гидрокси-2-метоксикарбонилметил-2,3-дигидрофуран-3-онов | 1989 |
|
SU1606510A1 |
| 2-МЕТОКСИКАРБОНИЛМЕТИЛЕН-4-БРОМ-5-АРИЛ-2,3-ДИГИДРОФУРАН-3-ОНЫ, ПРОЯВЛЯЮЩИЕ АНТИСТАФИЛОКОККОВУЮ АКТИВНОСТЬ | 1987 |
|
SU1455617A1 |
| СПОСОБ ПОЛУЧЕНИЯ 5-АРИЛ-2,3-ДИГИДРО-2,3-ФУРАНДИОНОВ | 1990 |
|
SU1727378A1 |
| Способ получения N @ -(1-адамантил)-N @ -(2,4-динитрофенил)-3-бром-4-(п-R-фенил)-2,4-диоксобутанамидразонов | 1990 |
|
SU1728234A1 |
| СПОСОБ ПОЛУЧЕНИЯ E-2-АРОИЛМЕТИЛЕН-1-ФЕНИЛ-1,2,3,4-ТЕТРАГИДРОХИНАЗОЛИН-4-ОНОВ | 2006 |
|
RU2306315C1 |
| N-[4-(4-бромфенил)-2-гидрокси-4-оксобут-2-еноил]-2-гидроксибензогидразид, проявляющий противогрибковую активность | 2024 |
|
RU2840395C1 |
| Способ получения 2,9-диарил-6,12-бис(алкоксикарбонил)-1,8-диоксадиспиро[4.1.4.1]додека-2,9-диен-4,11-дионов | 1985 |
|
SU1343770A1 |
Использование: в медицине в качестве лекарственных препаратов с противомикробным действием. Сущность изобретения: продукт 2-гидрокси-2- (трифенилфосфоранилиден) метоксикарбонилметил-5-фенил- 2,3-дигидро-3-фуранон ф-лы 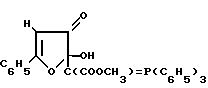 БФ C31H25O5P, выход 83% , т. разл. 124 - 125 С, 2-гидрокси-2-(трифенилфосфоранилиден) метоксикарбонилметил-5-n-хлорфенил- 2,3-дигидро-3-фуранон ф-лы
БФ C31H25O5P, выход 83% , т. разл. 124 - 125 С, 2-гидрокси-2-(трифенилфосфоранилиден) метоксикарбонилметил-5-n-хлорфенил- 2,3-дигидро-3-фуранон ф-лы  БФ C31H24ClO5P, выход 91% , т. пл. 163 - 164С. Реагент 1:
БФ C31H24ClO5P, выход 91% , т. пл. 163 - 164С. Реагент 1:  где R - H, Cl. Реагент 2: (C6H5)3P=CHCOOCH3. Условия реакции: в среде инертного органического растворителя при комнатной температуре.
где R - H, Cl. Реагент 2: (C6H5)3P=CHCOOCH3. Условия реакции: в среде инертного органического растворителя при комнатной температуре.
СПОСОБ ПОЛУЧЕНИЯ 5-АРИЛ-2-ГИДРОКСИ-2-(ТРИФЕНИЛФОСФОРАНИЛИДЕН)-МЕТОКСИКАРБОНИЛМЕТИЛ-2,3-ДИГИД О-3-общей формулы /
/
где R-H или Cl,
заключающийся в том, что 5-арил-2,3-дигидро-2,3-фурандион подвергают взаимодействию с метоксикарбонилметилентрифенилфосфораном в среде инертного органического растворителя при комнатной температуре.
Авторы
Даты
1994-03-15—Публикация
1990-12-29—Подача