Изобретение относится к медицинской микробиологии, в частности к методам идентификации и дифференциации культур с использованием бактериофагов.
Известны различные способы идентификации микроорганизмов с использованием бактериофагов, исключающие:
- приготовление взвеси культуры соответствующей концентрации в физиологическом бульоне (растворе), посев ее газоном на агаровую пластинку с последующим подсушиванием и нанесением бактериофага каплями или "дорожкой" на газон культуры [1] (Руководство по микробиологии чумы. : Саратов, 1972. - с. 132). Данный способ позволяет идентифицировать на одной чашке 1-2 культуры;
- приготовление взвеси культуры соответствующей концентрации в физрастворе (бульоне), посев ее "дорожкой" на агаровую пластинку с последующим подсушиванием и нанесением каплями бактериофага на "дорожку" культуры. Данный способ позволяет идентифицировать на одной чашке 3-5 культур одновременно.
Недостатками данного способа являются трудоемкость при одновременной идентификации значительного количества штаммов и связанный с ней материальный расход большого объема питательных сред, относительно невысокая чувствительность при исследовании культур с различной степенью фаголизабельности.
Наиболее близко к предполагаемому изобретению относится способ идентификации культур с использованием бактериофага, который включает приготовление взвеси соответствующей концентрации, после культуры "дорожкой" на плотную питательную среду, подсушивание и нанесение бактериофага каплями на "дорожку" культуры: инкубацию и идентификацию культуры по наличию или отсутствию лизиса ее бактериофагом [2] .
Недостатком этого способа является трудоемкость при одновременной идентификации значительного количества штаммов и связанный с ней материальный расход большого объема питательных сред, относительно невысокая чувствительность при исследовании культур с различной степенью фаголизабельности.
Целью предполагаемого изобретения является расширение объема исследования при сокращении материальных затрат с одновременным повышением чувствительности метода.
Сущность изобретения заключается в том, что культуру с фагом наносят на плотную питательную среду и по наличию или отсутствию лизиса проводят идентификацию культуры. Причем культуру, приготовленную в фосфатном буфере с pH 7,2-7,4, содержащем дополнительно сернокислый калий и сернокислый магний в концентрации 10-2-10-3 М каждой, предварительно в матрице смешивают с бактериофагом в соотношении 1: 3-1: 4. Полученную смесь инкубируют в течение 20-30 мин при 36-38оС, после чего наносят одномоментно репликатором на плотную питательную среду.
Отличительные признаки заявляемого объекта состоят в том, что культура перед нанесением на плотную питательную среду предварительно смешивается с бактериофагом в соотношении 1: 3-1: 4. Взвесь культуры готовят в фосфатном буфере (pH 7,2-7,4), содержащем дополнительно сернокислый кальций и сернокислый магний в концентрации 10-2-10-3 М каждой. Смесь инкубируют в течение 20-30 мин при 36-38оС, нанесение смеси на плотную питательную среду осуществляют одномоментно репликатором.
Предварительное смешение бактериофага со взвесью культуры, приготовленной в соответствующем буфере с последующей инкубацией, осуществляют для обеспечения достаточной адсорбции бактериофага на поверхности микробной клетки, при этом жидкая среда, в которой происходит смешение, способствует большей возможности контакта бактериофага с клеточными рецепторами; инкубацию смеси фаг-культура в течение 20-30 мин при температуре 36-38оС обеспечивает необратимость абсорбции: при высокой концентрации бактерий большая часть фаговых корпускул прикрепляется к клеточным рецепторам обратимо, при увеличении же количества фаговых частиц, приходящихся на одну микробную клетку до соотношения 3: 1-4: 1, степень необратимости абсорбции возрастает.
Значительно влияние на процесс адсорбции оказывает также присутствие катионов в среде взаимодействия фаг-бактерия, поскольку начальной ступенью адсорбции фага является образование электростатических связей между соответствующими конфигурациями ионных зарядов на поверхности бактериофага, так и микробной клетки. Катионы, присутствующие в среде, в частности, кальция и магния, определяют формирование электростатических зарядов на обоих телах, что обеспечивает эффективность столкновения между фаговыми частицами и бактериальными клетками.
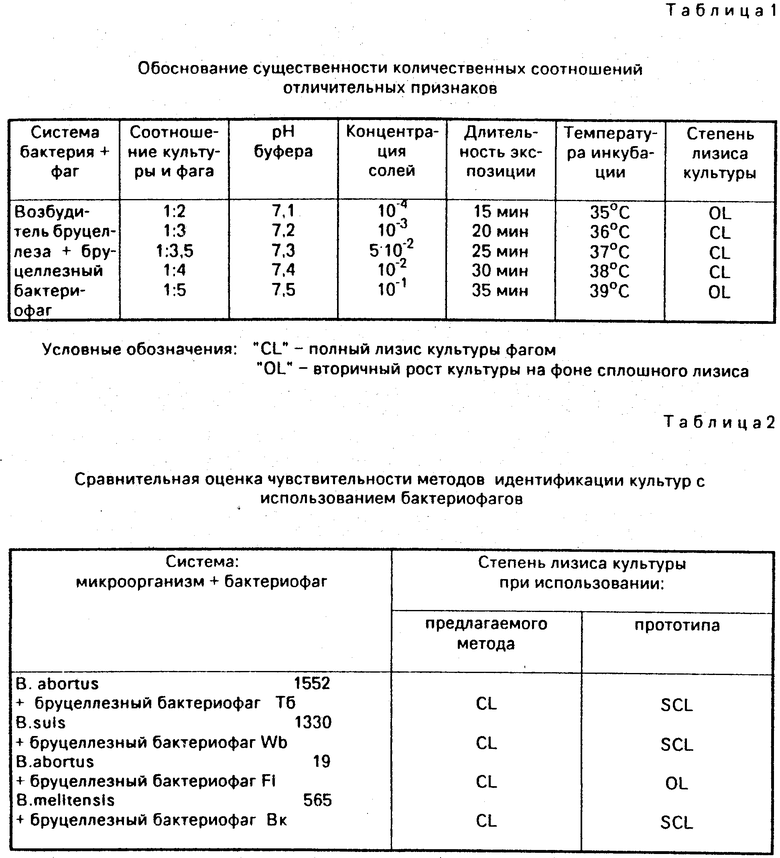
Способ осуществляется следующим образом: готовят взвесь исследуемых штаммов в концентрации 1.109 микробных клеток (м. к. )/мл в фосфатном буфере (pH 7,2-7,4), содержащем дополнительно сернокислый кальций и сернокислый магний в концентрации 10-2-10-3 М каждой. В лунки стерильной матрицы вносят 1 ч. (10 мкл) взвеси культуры исследуемых штаммов, сюда же добавляют 3-4 ч. (30-40 мкл) бактериофага. Параллельно в лунки также вносят в том же объеме (1 ч. - 10 мкл) взвесь культуры, куда бактериофаг не добавляют (контроль культуры). Матрицу накрывают чашкой Петри и помещают в термостат при 36-38оС на 20-30 мин, после чего штампом-репликатором делают отпечатки на агаровые пластинки. На одной чашке, таким образом, можно исследовать до 25 штаммов. Чашки с посевами инкубируют в течение 24-36 ч при 36-38оС. Идентификацию культур осуществляют по степени лизиса бактериофагом. При этом возможны следующие уровни колебаний чувствительности:
"СL" - полный лизис культуры бактериофагом
"SCL" - единичные колонии на фоне сплошного лизиса
"OCL" - вторичный рост культуры на фоне сплошного лизиса
"+++, ++, +" - единичные негативные бляшки на фоне сплошного роста культуры
"-" - отсутствие лизиса
Описанные отличительные признаки позволяют обеспечить более высокую степень лизиса соответствующих культур бактериофагом.
П р и м е р 1. В качестве системы микроорганизм - бактериофаг были использованы:
1. B. abortus 1552 + бруцеллезный бактериофаг Тб
2. B. suis 1330 + бруцеллезный бактериофаг Wb
3. B. abortus 19 + бруцеллезный бактериофаг Fi
4. B. melitеusis 565 + бруцеллезный бактериофаг Вк
Готовят взвесь указанных культур до конечной концентрации 1.109 м. к. /мл в фосфатном буфере pH 7,2, содержащем дополнительно сернокислый кальций и сернокислый магний в концентрации 10-3 М каждой. В лунки матрицы вносят 10 мкл взвеси культур исследуемых штаммов, сюда же добавляют 30 мкл (1: 3) соответствующих бактериофагов. Параллельно в лунки вносят взвесь культур в том же объеме (10 мкл) - контроль культуры. Матрицу помещают в термостат на 20 мин при 36оС, после чего штампом-репликатором наносят данную взвесь на агаровую пластинку. Чашку с посевом инкубируют в течение 24-36 ч при 36-38оС.
При просмотре чашки на фоне роста культуры в контроле наблюдается ее лизис в опыте - рост культуры отсутствует.
П р и м е р 2. Использованы те же системы микроорганизм-бактериофаг, что и в примере 1.
Готовят взвесь культуры до концентрации 1.109 м. к. /мл в фосфатном буфере pH 7,3, содержащем дополнительно сернокислый кальций и сернокислый магний в концентрации 5.10-3 М каждой. В лунки матрицы вносят 10 мкл взвеси культур, сюда же добавляют 35 мкл (1: 3,5) соответствующих бактериофагов. Параллельно в лунки вносят взвесь культур в том же объеме (10 мкл) - контроль культуры. Матрицу инкубируют в течение 25 мин при 37оС, после чего штампом-репликатором наносят данную смесь на агаровую пластинку. Чашку с посевом инкубируют в течение 24-36 ч при температуре 36-38оС. При просмотре чашки на фоне роста культуры в контроле наблюдается ее лизис в опыте - рост культуры отсутствует.
П р и м е р 3. Использованы те же системы фаг-микроорганизм, что в примере 1 и 2.
Готовят взвесь агаровой культуры до конечной концентрации 1.109 м. к. /мл в фосфатном буфере, содержащем дополнительно сернокислый кальций и сернокислый магний в концентрации 10-2 М каждой. В лунки матрицы вносят взвесь культур по 10 мкл, сюда же добавляют 40 мкл (1: 4) соответствующих бактериофагов. Параллельно в лунки вносят культуру в том же объеме (10 мкл) - контроль культуры. Матрицу инкубируют в течение 30 мин при 38оС, после чего штампом-репликатором наносят данную смесь на агаровую пластинку. Чашку с посевами инкубируют в течение 24-36 ч при температуре 36-38оС. При просмотре чашки на фоне роста культуры в контроле наблюдается ее лизис в опыте - рост культуры отсутствует.
Таким образом, предлагаемый способ позволяет расширить объем исследования в 4-5 раз при сокращении расхода питательных сред в 4-5 раз, при этом повышается чувствительность метода в 1,2-1,5 раза. (56) 1. Методические рекомендации по профилактике и лабораторной диагностике бруцеллеза. М. , 1980, с. 33.
2. Carbel M. I. , Thomas E. L. "The Brucella-phage: their propеrties, characterisation and application", Weybridge, 1980, p. 25.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ РЕПРОДУКЦИИ БРУЦЕЛЛЕЗНОГО БАКТЕРИОФАГА | 2003 |
|
RU2249616C2 |
| СПОСОБ ПОЛУЧЕНИЯ БРУЦЕЛЛЕЗНОГО БАКТЕРИОФАГА | 1997 |
|
RU2126833C1 |
| СПОСОБ ОЦЕНКИ ПОРОГОВОЙ ЧУВСТВИТЕЛЬНОСТИ БАКТЕРИАЛЬНЫХ КУЛЬТУР НА БИОЛОГИЧЕСКИЕ И ХИМИЧЕСКИЕ ПРЕПАРАТЫ | 1998 |
|
RU2147610C1 |
| СПОСОБ ПОЛУЧЕНИЯ АНТИГЕНА ДЛЯ ДИАГНОСТИКИ БРУЦЕЛЛЕЗА | 1997 |
|
RU2133470C1 |
| СИНТЕТИЧЕСКАЯ ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ВЫРАЩИВАНИЯ БРУЦЕЛЛ | 1998 |
|
RU2148638C1 |
| СПОСОБ ФАГОТИПИРОВАНИЯ БАКТЕРИАЛЬНЫХ КУЛЬТУР | 1997 |
|
RU2137838C1 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ РЕЗИСТЕНТНОСТИ ПОПУЛЯЦИОННОГО СОСТАВА ШТАММОВ BACILLUS ANTHRACIS К СИБИРЕЯЗВЕННОМУ БАКТЕРИОФАГУ | 2004 |
|
RU2266963C1 |
| СПОСОБ ДИФФЕРЕНЦИАЦИИ КУЛЬТУР Candida albicans ВАГИНАЛЬНОГО БИОТОПА ЖЕНЩИН НА НОРМАЛЬНУЮ И ПАТОГЕННУЮ МИКРОФЛОРУ | 2015 |
|
RU2595370C2 |
| Способ лечения инфекции, связанной с оказанием медицинской помощи, вызванной возбудителем или возбудителями с множественной лекарственной устойчивостью | 2017 |
|
RU2664681C1 |
| СПОСОБ ВЫЯВЛЕНИЯ БАКТЕРИЙ И НАБОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2000 |
|
RU2265061C2 |
Использование: медицинская микробиология. Сущность изобретения: способ идентификации бактерий рода Brucella с использованием бактериофага включает приготовление взвеси культуры, нанесение ее и бактериофага на плотную питательную среду, инкубацию посевов с последующим учетом результатов по степени лизиса культуры бактериофагом, при этом взвесь культуры готовят в фосфатном буфере с рН 7,2 - 7,4, содержащем сернокислый кальций и сернокислый магний в концентрации 10-2-10-3M каждый, перед нанесением на плотную питательную среду взвесь культуры смешивают с бактериофагом в соотношении 1: 3 - 1: 4, инкубируют в течение 20 - 30 мин при 36 - 38С, нанесение на питательную среду осуществляют одномоментно репликатором. табл. 2.
СПОСОБ ИДЕНТИФИКАЦИИ БАКТЕРИЙ РОДА BRUCELLA С ИСПОЛЬЗОВАНИЕМ БАКТЕРИОФАГА, включающий приготовление взвеси культуры, нанесение ее и бактериофага на плотную питательную среду, инкубацию посевов с последующим учетом результатов по степени лизиса культуры бактериофагом, отличающийся тем, что взвесь культуры приготавливают в фосфатном буфере с pH 7,2 - 7,4, содержащем сернокислый кальций и сернокислый магний в концентрации 10-12 - 10-3 М каждого, перед нанесением на плотную питательную среду взвесь культуры смешивают с бактериофагом в соотношении 1 : 3 - 4, инкубируют в течение 20 - 30 мин при 36 - 38oС, нанесение на питательную среду осуществляют одномоментно репликатором.
Авторы
Даты
1994-04-15—Публикация
1991-07-16—Подача