Изобретение относится к способам получения нового производного гризеоловой кислоты формулы I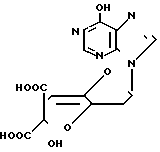 или его сложного эфира, способных ингибировать активность фосфодиэстеразы, специфической к различным циклическим нуклеотидам.
или его сложного эфира, способных ингибировать активность фосфодиэстеразы, специфической к различным циклическим нуклеотидам.
Известны гризеоловая кислота 1 и ее производные 2, проявляющие способность ингибировать активность фосфодиэстеразы, специфической к различным циклическим нуклеотидам, например 3', 5'-циклический аденозин монофосфат (сАМР/фосфодиэстеразы (РDE) или 3', 5'-циклический гуанозин монофосфат (с GMP) PDE и может таким образом увеличить уровень циклического нуклеотида, например сАМР или сGМР, в клетках пациента, к которому применено такое соединение.
Целью изобретения является синтез новых производных гризеоловой кислоты, которые проявляют увеличенную активность против сGMP РDE, чем против сАМР РDE.
Цель достигается синтезом новых производных гризеоловой кислоты формулы 1, который заключается в том, что соединение общей формулы II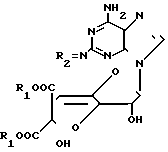 где R1- карбоксизащищающая группа;
где R1- карбоксизащищающая группа;
R2 - защищенная метиленовая группа, подвергают взаимодействию с солью азотистой кислоты в водном растворе уксусной кислоты при комнатной температуре в течение 17 ч и в полученном соединении общей формулы III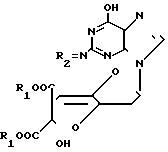 где R1 и R2 - имеют приведенные значения, удаляют защитные группы обработкой основанием в присутствии водного растворителя при комнатной температуре в течение 3 ч.
где R1 и R2 - имеют приведенные значения, удаляют защитные группы обработкой основанием в присутствии водного растворителя при комнатной температуре в течение 3 ч.
П р и м е р 1. Диметиловый эфир 6-дезамино-2-(N',N'-диметиламинометилен)- амино-6-гидроксигризеоловой кислоты.
477 мг диметилового эфира 2-(N',N'-диметиламинометилен)-аминогризеоловой кислоты растворяют в 50 мл водного раствора уксусной кислоты (80 об.% ). При охлаждении льдом добавляют 1,34 г нитрита натрия и смеси дают выдержку 17 ч при комнатной температуре. После исчезновения исходного вещества, что контролируется методом тонкослойной хроматографии, растворитель отгоняют при пониженном давлении. Добавляют этанол и затем его отгоняют, причем эти операции добавления и отгонки повторяют до тех пор, пока не исчезнет запах уксусной кислоты. Остаток растворяют в смеси 50 мл хлористого метилена, 20 мл воды и 5 мл водного раствора бикарбоната натрия (5 г в 100 мл). Органический слой отделяют и экстрагируют 3 раза порциями по 30 мл хлористого метилена и экстракты объединяют. Растворитель отгоняют при пониженном давлении. Остаток очищают, используя хроматографическую колонку (Ф.Мерк), предварительно заполненную силикагелем и элюируемую хлористым метиленом, содержащим 10 об.% метанола. Основные фракции собирают и подвергают лиофильной сушке из бензола, получая 310 мг указанного в заготовке вещества в виде белого порошка.
Спектр УФ-поглощения (в метаноле) λмакc, нм: кислотный - 292, нейтральный - 300, основной 279.
П р и м е р 2. 2-Амино-6-дезамино-6-гидроксигризеоловая кислота.
130 мг диметилового эфира 6-дезамино-2-(N', N'-диметиламинометилен)амино-6-ги- дроксигризеоловой кислоты растворяют в 20 мл концентрированного водного аммиака и смеси дают выдержку при комнатной температуре в течение 3 ч. Раствор выпаривают насухо при пониженном давлении, и остаток растворяют в 10 мл воды. Полученный раствор подкисляют до значения рН 2,3 и затем подвегают хроматографической очистке на предварительно заполненной колонке РР-8 (Ф.Мерк), которую промывают водой и затем элюируют водой, содержащей 5 об. % ацетонитрила. Основные фракции собирают и подвергают лиофильной очистке, получая 67 мг указанного в заголовке соединения в виде белого порошка.
Спектр УФ-поглощения (в воде) λмакс, нм: кислотный 255, 273 (плечо), нейтральный - 253, 278 (плечо); основной 264.
ЯМР-спектр (в дейтродиметилсульфоксида), м.д.: 4,48 (1Н, синглет), 4,53 (1Н, дублет, I = 4,9 Гц), 5,07 (1Н, д, I = 2,4 Гц), 5,79 (1Н, дд, I = 2,4 и 4,9 Гц), 6,25 (1Н, с) 7,87 (1Н, с).
Тонкослойная хроматография (относительное значение Rf для гризеоловой кислоты Rf (принято за 1,0): для силикагелевой пластинки (Ф.Мерк) - 0,80 (элюирующий растворитель - вода, метанол: ацетонитрил - 70:15:15 по объему (для пластинки РР-8 с обратной фазой (Ф.Мерк) - 1,44 (элюирующий растворитель - вода, содержащая 2 об.% ацетонитрила и 0,02 об.% уксусной кислоты).
Ингибирующая активность фосфодиэстеразы (ФДЭ).
Было испытано соединение примера 2 изобретения наряду с гризеоловой кислотой в качестве сравнительного соединения.
Испытание проводили практически в соответствии со способом, аналогичным методу A. Z. Pichard, W.I.Cheung - Journad of Biological Chemistry, (251, 5726-5737, (1976). Неочищенный ферментный раствор полученный из крысиного мозга, использовали в качестве источника сАМР ФДЭ. В качестве субстрата использовали 14С-меченый сАМР. Его использовали в буферном 0,2М растворе Трис-соляной кислоты рН 8,0 в количестве, достаточном для получения окончательной концентрации 0,14 мкМ. "Трис" является трис-(гидроксиметил)аминометаном. Раствор субстрата смешивают с соответствующим количеством используемого соединения, растворенного в объеме 2,0-5,0 мкл диметилсульфоксида и с 20 мкл раствора змеиного яда и 40 мкл неочищенного раствора фермента. Добавляют достаточное количество буфера Трис-соляной кислоты до получения полного объема 100 мкл. Полученной смеси дают реагировать при 30оС в течение 20 мин. К концу этого промежутка времени реакционную смесь обрабатывают смолой "Амберлит" (торговая марка) 1РР-58 и определяют уровень оставшейся радиоактивности аденозина в продукте. Эксперимент проводят для ряда различных концентраций для каждого активного соединения и отсюда рассчитывают значения 50% ингибирования (l50).
Эксперимент повторяют, за исключением того, что вместо сАМР используют циклический гуанозинмонофосфат (сGМР) в качестве субстрата. Снова рассчитывают значения I50 в зависимости от сGМР ФДЭ.
Полученные результаты представлены в таблице, где значения I50 представлены в мкмолях.
Из данных таблицы видно, что активность соединения по изобретению в качестве ингибитора ФДЭ исключительно велика. Различие в активностях против сАМР ФДЭ и сGМР ФДЭ также отчетливо видно.
Таким образом, возможны различные терапевтические применения соединений, например при лечении сердечно-сосудистых заболеваний; в качестве противоастматических агентов; как релаксанты гладкой мускулатуры, в качестве психотропных или невротропных агентов; в качестве противовоспалительных агентов при лечении рака и при лечении диабетов.
Соединения по изобретению могут соответственно также быть использованы в качестве терапевтических агентов при различных церебральных циркуляторных расстройствах, таких как церебральных последствий инсульта, и в качестве активаторов метаболизма в мозге, например при лечении старческого паралича или травматических поражений мозга.
Соединения по изобретению можно вводить орально в форме твердых препаратов, которые могут при необходимости содержать различного родах обычные добавки. Эти добавки включают такие разбавители, как сахара и препараты целлюлозы; такие связующие как крахмал, смолы и метиленцеллюлозу; и распределяющие агенты. Дозы могут изменяться в зависимости от симптомов заболевания, возраста и массы пациента.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ГРИЗЕОЛЕВОЙ КИСЛОТЫ | 1988 |
|
RU2024539C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ГРИЗЕОЛОВОЙ КИСЛОТЫ | 1989 |
|
RU2007405C1 |
| Способ получения 6-дезамино-6-гризеоловой кислоты | 1985 |
|
SU1468421A3 |
| Способ получения производных гризеоловой кислоты | 1985 |
|
SU1604158A3 |
| Способ получения производных гризеоловой кислоты | 1984 |
|
SU1600632A3 |
| Способ получения производных гризеоловой кислоты | 1985 |
|
SU1468422A3 |
| СПОСОБ ПОЛУЧЕНИЯ ОПТИЧЕСКИ АКТИВНОГО ПРОИЗВОДНОГО ИНДОЛОБЕНЗОХИНОЛИНА ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫХ СОЛЕЙ | 1990 |
|
RU2045528C1 |
| ПРОИЗВОДНЫЕ БЕНЗОПИРАНА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1991 |
|
RU2038354C1 |
| ГЕКСАГИДРОНАФТАЛИНОВЫЕ СЛОЖНОЭФИРНЫЕ СОЕДИНЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1993 |
|
RU2104997C1 |
| КРИСТАЛЛИЧЕСКИЙ ПИВАЛОИЛОКСИМЕТИЛ (IR, 5S, 6S)-[(4R)-2-ОКСО-4-ПИРРОЛИДИНИЛТИО]-6-[(IR)-1-ГИДРОКСИЭТИЛ]-1-МЕТИЛ-1-КАРБАПЕН-2-ЕМ-3-КАРБОКСИЛАТ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1993 |
|
RU2090567C1 |

Сущность изобретения: продукт ф-лы 1 или его сложный эфир. Реагент 1: диметиловый эфир 5-дезамино -2- (N',N'-диметиламинометилен) -амино-6- гидроксигризеоловой кислоты. Реагент 2: соль азотистой кислоты. Условия реакции: в водном растворе уксусной кислоты при комнатной температуре. Соединения ингибируют активность фосфодиэтеразы. Ф-ла 1: 1 табл.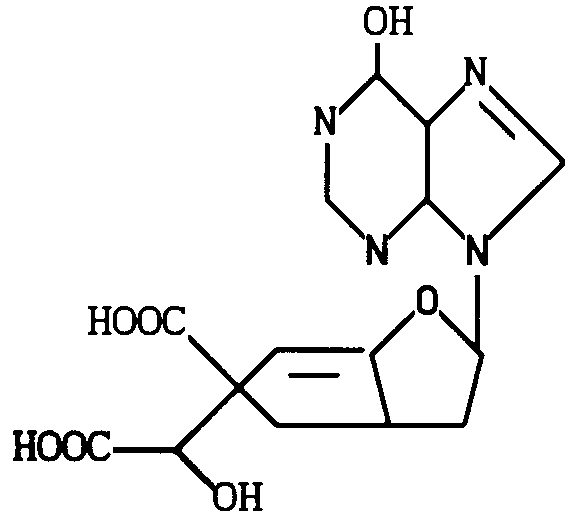
Способ получения производного гризеоловой кислоты формулы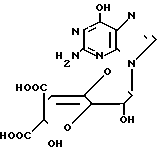
или его сложного эфира, отличающийся тем, что соединение общей формулы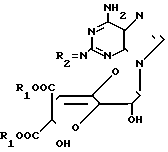
где R1 - карбоксизащищающая группа;
R2 - защищенная метиленовая группа,
подвергают взаимодействию с солью азотистой кислоты в водном растворе уксусной кислоты при комнатной температуре в течение 17 ч и в полученном соединении общей формулы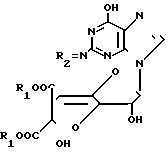
где R1 и R2 имеют указанные значения,
удаляют защитные группы обработкой основанием в присутствии водного растворителя при комнатной температуре в течение 3 ч.
| Приспособление для заделки концов комплектов шин | 1931 |
|
SU29329A1 |
Авторы
Даты
1994-10-15—Публикация
1988-03-30—Подача