Изобретение относится к способам переработки отходов производства и может быть использовано для получения фторида кальция из отходов производства экстракционной фосфорной кислоты: фосфогипса и фторсиликатных растворов.
Известные способы переработки и использования фосфогипса который является многотоннажным отходом производства экстракционной фосфорной кислоты, как правило, предусматривают получение в качестве целевых продуктов нерастворимых солей кальция, сульфатов натрия или аммония и сернистого газа. Способы комплексной переработки включают извлечение из фосфогипса лантаноидов, фосфатов и некоторых других продуктов [1].
Реже в литературе рассматривается получение фторида кальция. По способу [2] фторсодержащие компоненты испаряются в процессе сушки фосфогипса при 400-600оС и при взаимодействии с известью образуется СаF2. Сухой продукт в дальнейшем прокаливается при 1200-1250оС в восстановительной атмосфере с получением извести и SO2. В известном способе СаF2 получают из фторсодержащих компонентов, которые являются примесью фосфогипса, т.е. источником фтора является сам фосфогипс, а кальция - специально добавляемая известь.
Недостатком известного способа переработки фосфогипса с целью получения СаF2 является только частичное использование отходов производства фосфорной кислоты, необходимость использования дополнительных компонентов и как следствие - высокая стоимость целевого продукта.
Наиболее близким способом получения СаF2 по химической сущности является способ получения фторидов щелечноземельных металлов, который выбран в качестве прототипа [3].
Если опустить отдельные операции в этом способе, которые необходимы при получении препаративно чистого, а не технического продукта, то схему получения можно представить уравнением реакции нерастворенной соли кальция с фтористоводородной кислотой в стехиометрическом соотношении:
CaCO3 + 2HF = CaF2 + CO2 + H2O
Практически способ осуществляется следующим образом. Рассчитанное количество СаСО3 растворяют в платиновой чашке при добавлении разбавленной горячей уксусной кислоты и добавляют эквимолярное количество 40%-ной плавиковой кислоты. Раствор упаривают досуха и получают белый мелкокристаллический порошок СаF2.
Недостаком известного способа является использование сырья и высокие энергетические затраты в связи с необходимостью упаривания растворов.
Целью заявляемого технического решения является расширение сырьевой базы и уменьшение энергозатрат при получении фторида кальция.
Цель достигается тем, что при получении фторида кальция путем перемешивания в водной среде нерастворимой соли кальция и фторсодержащего соединения в качестве нерастворимой соли кальция и фторсодержащего соединения, используют отходы производства экстракционной фосфорной кислоты: фосфогипс и фторсиликатные растворы, смесь которых в стехиометрическом соотношении в пересчете на сульфат кальция и фторсиликат-ион обрабатывают раствором гидроксида натрия до получения рН 9-10.
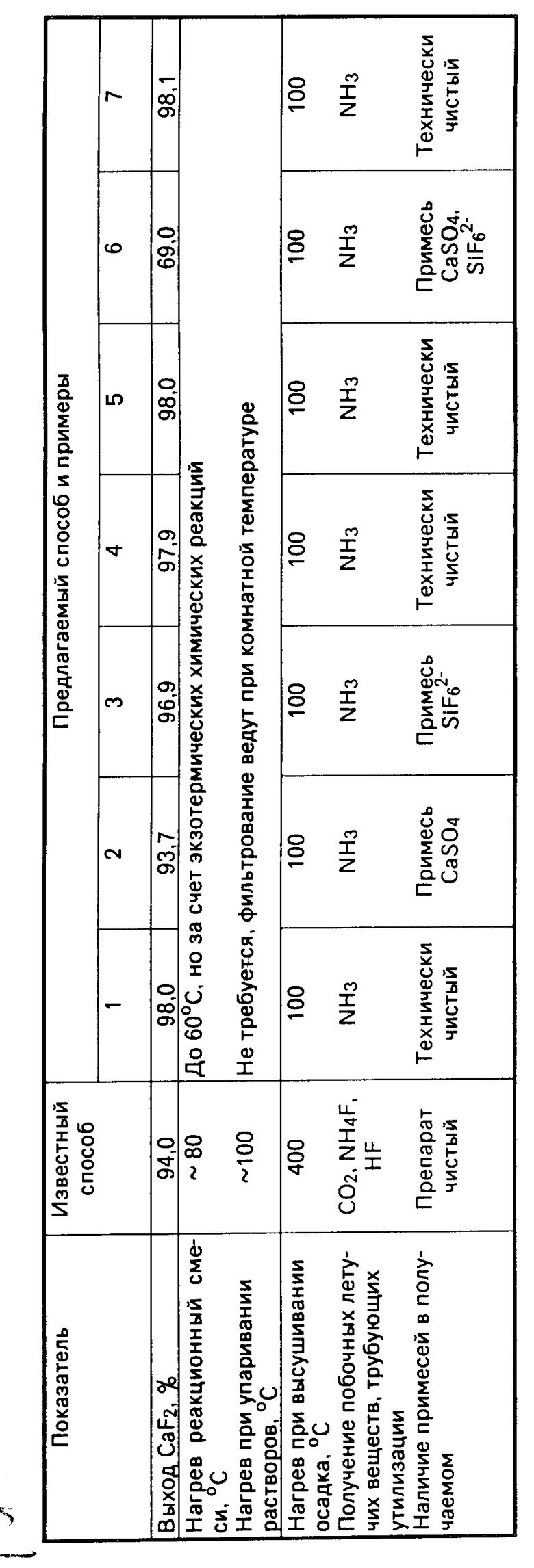
Преимущества заявляемого способа получения СаF2 иллюстрируются примерами конкретного выполнения, для которых использованы отходы производства экстракционной фосфорной кислоты на Винницком ПО "Химпром". Исходный фосфогипс в качестве основного вещества содержал 94,5-95,0% СаSO4 и примеси (% мас. ): общее Р2О5 - 0,34-0,35, растворимое Р2О5 - 0,1-0,14, общее F - 0,08-0,15 и влаги 4,5-5,5. Кислые фторсиликатные растворы образуются после получения бифторида аммония и белой сажи и содержат переменные количества (NH4)2 SiF6 (8-10)% и H2SiF6 (5-6)%. Общее содержание фторсиликатов обычно близкое к 15%. рН кислых растворов около 1.
П р и м е р 1. В химический стакан емкостью 1 дм3 вносят 143,2 г фосфогипса, содержащего 136 г СаSO4 и приливают 360 г, 15%-го раствора H2SiF6 + (N2H4)2 SiF6 (стехиометрическое соотношение CaSO4 и SiF6). При включенной мешалке порциями прибавляют 3%-ный раствор NaOH в течение, 0,5 ч до получения рН нейтрализованной смеси равной 9,5. Расход раствора в пересчете на NaOH составляет 76 г. Нейтрализованную смесь продолжают перемешивать до ее остывания (комнатная температура).
Полученный мелкокристаллический белый осадок фторида кальция переносят на воронку Бюхнера, фильтруют и промывают водой до исчезновения запаха аммиака. Отмытый осадок высушивают при температуре около 100оС до постоянной массы.
П р и м е р 2. Как пример 1, но приливают 308,6 г 15%-ного раствора H2SiF6 + (NH4)2 SiF6 (соотношение CaSO4 и SiF62- меньше стехиометрического. П р и м е р 3. Как пример 1, но приливают 411,4 г 15%-ного раствора H2SiF6 + (NH4)2SiF6 (соотношение CaSО4 и SiF62- больше стехиометрического).
П р и м е р 4. Как пример 1, но нейтрализацию щелочью ведут до рН 9 (заявляемое нижнее значение).
П р и м е р 5. Как пример 1, но нейтрализацию щелочью ведут до рН 10 (заявляемое верхнее значение).
П р и м е р 6. Как пример 1, но нейтрализацию щелочью ведут до рН 8,7 (меньше нижнего значения).
П р и м е р 7. Как пример 1, но нейтрализацию щелочью ведут до рН 10,3 (больше верхнего значения).
П р и м е р по прототипу. К 10 г СаСО3 при перемешивании и нагревании приливают разбавленную уксусную кислоту до растворения навески. К полученному раствору прибавляют 10 г 40%-ной HF и упаривают досуха. Полученный мелкокристаллический порошок перемешивают с 4 г NH4F и нагревают до постоянной массы сначала при 100, а затем при 400оС. Выход CaF2 составил 7,3 г. Синтез СаF2 по указанному способу ведут в платиновой посуде.
Получение СаF2 по примерам 1-7 основано на взаимодействии исходных компонентов, которое можно представить следующим уравнением: + 3CaSO4+8NaOH __→ 2CaF2+Na2SiO3+3Na2SO4+2NH3+5H2O
+ 3CaSO4+8NaOH __→ 2CaF2+Na2SiO3+3Na2SO4+2NH3+5H2O
Полученное по примерам 1-7 и по прототипу вещество исследовалось на выход СаF2 (отношение в % к теоретическому выходу) наличие примесей, учитывалось наличие побочных летучих веществ в процессе получения и температуры, необходимые для реализации способа. Полученные данные позволили провести сопоставительный анализ известного и предлагаемого способа, количественно и качественно представленный в таблице ниже.
Анализ полученных данных показывает в примерах 1-5, в которых соблюдается предлагаемое стехиометрическое соотношение между CaSO4 и SiF62- и предлагаемое значение рН, получают технически чистый продукт с высоким выходом СаF2, наличием только одного побочного летучего продукта и процесс проводится со снижением температуры на отдельных этапах.
Пpи меньшем, чем стехиометрическое, соотношении (пример 2) снижается степень превращения CaSO4 и целевой продукт загрязняется. При большем, чем стехиометрическое соотношение (пример 3) фторсиликаты не полностью используются и загрязняют CaF2. Практически то же, а также снижение выхода СaF2 наблюдается при рН < 9 (пример 6) при pH > 10 (пример 7) нерационально расходуется щелочь, а образование в реакционной смеси кремнегеля затрудняет фильтрование и промывание осадка.
Таким образом поставленная цель в заявляемом способе получения фторида кальция достигается при использовании отходов производства с уменьшением энергозатрат при соблюдении стехиометрического соотношения между СаSO4 и SiF62- и при нейтрализации реакционной смеси щелочью в пределах рН 9-10.
Приведенные выше примеры и схема показывают, что во всех случаях возможно получение CaF2 с применением фторсиликатов, которые ранее не использовались для этой цели и тем более из отходов, которые еще недостаточно перерабатываются и требуют значительных затрат для утилизации. Реализация заявляемого способа позволяет использовать нетрадиционные виды сырья для синтеза СаF2, т.е. расширяет сырьевую базу для их получения. Из трудно- или неперерабатываемых отходов по заявляемому способу удается получить ценный продукт, который находит широкое применение в различных отраслях. Растворы, которые образуются при этом (Na2SiO3, Na2SO4) могут быть использованы в производстве порошкообразных моющих средств.
Предлагаемый способ не требует специального оборудования.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ УТИЛИЗАЦИИ ПОБОЧНЫХ ПРОДУКТОВ, ПОЛУЧАЕМЫХ ПРИ ПРОИЗВОДСТВЕ ЭКСТРАКЦИОННОЙ ФОСФОРНОЙ КИСЛОТЫ | 2011 |
|
RU2462419C1 |
| Способ переработки натрий-фтор-углеродсодержащих отходов электролитического производства алюминия | 2023 |
|
RU2814124C1 |
| Способ получения синтетического флюорита | 2024 |
|
RU2837568C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФТОРИДА КАЛЬЦИЯ | 2014 |
|
RU2574256C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФТОРИДА ВОДОРОДА | 2003 |
|
RU2226497C1 |
| СПОСОБ ПОЛУЧЕНИЯ МИНЕРАЛИЗАТОРА НА ОСНОВЕ ФТОРИДА КАЛЬЦИЯ | 2020 |
|
RU2736038C1 |
| Способ получения синтетического флюорита и раствора каустической соды | 2023 |
|
RU2816485C1 |
| СПОСОБ ОЧИСТКИ СТОЧНЫХ ВОД ОТ ФТОРА | 2014 |
|
RU2570467C2 |
| СПОСОБ ПОЛУЧЕНИЯ СИНТЕТИЧЕСКОГО ФЛЮОРИТА | 2011 |
|
RU2472705C1 |
| СПОСОБ УДАЛЕНИЯ ФТОРА ИЗ ФТОРСОДЕРЖАЩИХ РАСТВОРОВ | 1992 |
|
RU2042626C1 |
Изобретение относится к способам переработки отходов производства и может быть использовано для получения фторида кальция из отходов производства экстракционной фосфорной кислоты: фосфогипса и фторсиликатных растворов. Фторид кальция получают путем взаимодействия при перемешивании в водной среде нерастворимой соли кальция и фторосодержащего соединения, в качестве взаимодействующих компонентов используют такие отходы экстракционной фосфорной кислоты, как фосфогипс и фторсиликатные растворы, смесь которых в стехиометрическом соотношении в пересчете на сульфат кальция и фторсиликат-ион обрабатывают раствором гидроксида натрия до получения pH 9 - 10. Выход продукта 98% . Продукт получают технически чистый. Рееализация способа позволит использовать нетрадиционные виды сырья, получить ценный продукт с низкой себестоимостью из отходов и сократить расход энергии. 1 табл.
СПОСОБ ПОЛУЧЕНИЯ ФТОРИДА КАЛЬЦИЯ, включающий взаимодействие при перемешивании в водной среде нерастворимой соли кальция и фторсодержащего соединения, отличающийся тем, что в качестве нерастворимой соли кальция и фторсодержащего соединения используют соответственно фосфогипс и фторсиликатные растворы, являющиеся отходами производства экстракционной фосфорной кислоты, смесь которых в стехиометрическом соотношении в пересчете на сульфат кальция и фторсиликат-ион обрабатывают раствором гидроксида натрия до получения рН 9 - 10.
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Руководство по неорганическому синтезу/Под ред | |||
| Брауэра Т.Б | |||
| - М.: Мир, 1985, с.269. | |||
Авторы
Даты
1995-02-27—Публикация
1992-07-06—Подача