Изобретение относится аддуктам-альдегидам, способу их получения и их использованию в качестве полупродуктов для получения производных витамина D.
Известно, что производные витамина D обладают высокой биологической активностью и могут использоваться во всех тех случаях, когда возникают проблемы с метаболизмом кальция. Несколько лет тому назад было установлено, что различные активные производные витамина D обладают, кроме того, и другими фармакотерапевтическими свойствами и могут с успехом использоваться для лечения, например, некоторых кожных и костных заболеваний, а также болезней, связанных с дифференциацией клеток. Поэтому крайне важно иметь набор активных производных витамина D для различных областей применения, для того чтобы можно было выбрать наиболее подходящее из них для каждого конкретного случая.
Производными витамина D, представляющими интерес для указанных областей применения, являются гидроксилированные производные витамина D, например 1 α-гидроксивитамин-D3 или 1α -гидроксихолекалциферол, 24R-гидроксивитамин-D3, 1 α, 25-дигидроксивитамин-D3, 25-гидроксивитамин-D3, 24R, 25-дигидроксивитамин-D3, 1 α,24R-дигидроксивитамин-D3, 1 α, 24R, 25-тригидроксивитамин-D3, 1 α, 25-дигидроксивитамин-D3, -26, 23-лактон, 25-гидроксивитамин-D3-26,23-лактон, 22-оксо-1α гидроксивитамин-D3, 22-оксо-1 α,25-дигидроксивитамин-D3, 24-оксо-1α гидроксивитамин-D3, 24-оксо-1α, 25- дигидрокси- витамин-D3, производные витамина D2, гидроксилированные в 1α24- и/или 25-положении(ях), 22-окса-замещенные производные витамина D3 и производные витамина D, имеющие удлиненные Сп боковые цепи, такие как 24,24-дигомо- и 24,24,24-тригомопроизводные с или без двойных связей и/или гидроксилов в этих полях, а также соответствующие производные витамина D с С3-С6-циклоалкилом, например С24-циклопропилом, в Сп-боковой цепи. Примером соединений этого последнего типа является (1S, 1E, 3R, 5Z, 7E, 20R)-9,10-секо-20- (3'-циклопропил-3'-гид- роксипроп-1'-енил)-1,3-дигидроксипрегна-5, 7,10(19)-триен. Кроме того, важное значение благодаря своей биологической активности имеют фторированные производные витамина D, которые могут быть дополнительно гидроксилированы.
Удобный способ введения гидроксигруппы в 1 α-положение производного витамин D описан в европейском патенте 70588 авторов настоящей заявки. Однако до сих пор не существует способа модификации С17 боковой цепи производных витамина D, удовлетворительного во всех отношениях. В принципе оба исходных соединения, необходимые для получения таких производных витамина D с модифицированной боковой цепью, выпускаются промышленностью или легко могут быть получены, и многостадийный процесс обеспечивает достижение поставленной цели с достаточно высокими выходом и селективностью. Следует еще раз подчеркнуть, что указанной целью является получение не какого-то определенного соединения, а самых различных, по выбору, производных витамина D с модифицированной С17-боковой цепью. Это означает, что способ без каких-либо существенных изменений должен обеспечивать возможность получения как можно большего числа производных витамина D.
Описанные в литературе способы синтеза обладающих активностью производных витамина D, в частности, активных метаболитов витамина D, не удовлетворяют, однако, одному или нескольким из указанных требований. Для удовлетворения последнего требования ряд исследователей предложил использовать для синтеза производных витамина D с модифицированной С17-боковой цепью альдегида в качестве "универсального полупродукта", а именно использовать его реакционноспособную альдегидную функциональную группу для получения нужной С17-боковой цепи. Однако и Salmond и др. (J. Org. Chem. 43, 1978, 790-793) и Kutner и др. (Tetrahedron Letters 28, 1987, 6129-6132) использовали в качестве исходных материалов труднодоступные соединения или соединения, которые не легко получить. Кроме того, при использовании предложенных ими в качестве "ключевых полупродуктов" альдегидов целевые производные витамина D, в частности, метаболиты 25-гидроксивитамина D, получались лишь с низким выходом. Andrews и др. (J.Org. Chem. 51, 1986, 4819-4828) в качестве "ключевого полупродукта" при синтезе метаболитов 25-гидроксивитамина D использовали С22-альдегид витамина D, в котором чувствительная триеновая система витамина D была защищена 4-фенил-1,2,4-триазолин-3,5-дионом или фталазин-1,4-дионом, причем указанный диенофил присоединился в положения 6 и 19 молекулы витамина D. Однако при таком способе для регенерации системы витамина D в конечном счете необходима дополнительная стадия фотоизомеризации, приводящая к потерям дорогостоящего целевого соединения и его загрязнению.
Целью изобретения является получение альдегида, который можно было бы использовать в качестве полупродукта при получении производных витамина D и который не обладал бы вышеуказанными недостатками.
В соответствии с изобретением эта задача может быть решена с помощью С22-альдегида, который может быть получен из производного провитамина D и имеет следующую общую формулу
в которой R означает атом водорода или гидроксигруппу, которая может этерифицирована (простой или сложной эфирной группами); R1 гидроксигруппу, которая может быть этерифицирована простой или сложной эфирными группами, а Z сульфонильную группу или группу общей формулы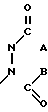
в которой А и В могут быть одинаковыми или различными и означают С1-С4- алкоксигруппы, или А и В вместе образуют фенилимино- или о-фениленовую группу.
Производные превитамина D описаны в литературе. Так Vellur с сотрудниками (Bull. Soc. Ch. Fr. 1949, 501) открыл превитамин D3 еще в 1949 году, а Koevoet и др. посвятили этому соединению статью в 1959 году (Recueil 74, 1955, 788-792). Из этой публикации следует, что превитамин D3 может быть получен в равновесных условиях из витамина D3, но очень легко может снова переходить в исходное соединение. Кроме того, превитамин D3 является некристаллическим и поэтому его почти невозможно получить в чистом виде. По-видимому, такая нестабильность и трудности при работе явились причиной того, что производным превитамина D уделялось так мало внимания, как к исходным соединениям для различных синтезов. То же самое относится и к стереоизомеру превитамин D3, а именно тахистеролу, также описанному Koevoet и др. в Recueil 74, 1955, 788-792.
В качестве исходного соединения для получения указанного альдегида можно использовать производное превитамина D2, которое может быть получено из производного витамина D2 таким же образом, как и превитамин D2, а именно в равновесных условиях. Скорость равновесной реакции зависит от температуры. Повышение температуры способствует образованию производного превитамина D2.
В качестве исходного соединения для этой цели можно использовать и тахистерол2. К образованию целевого производного превитамина D2 приводит также облучение эргостерола при низких температурах. После защиты (при необходимости) присутствующей в молекуле гидрокси-группы (или групп) можно осуществлять присоединение подходящего диенофильного соединения, как это описано в вышеупомянутом европейском патенте 70588. В результате образуется аддукт превитамина D2 общей формулы
Подходящими диенофильными соединениями для вышеуказанной реакции присоединения являются SO2 и соединения общей формулы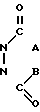 в которой А и В имеют указанные определения.
в которой А и В имеют указанные определения.
В качестве примеров диенофильных соединений, отвечающих указанной формуле, можно упомянуть 1,2,4-триазолин-3,5-дионы, замещенные в 4-положении незамещенным или замещенным фенилом, 1,4-фта- лазиндион и ди(С1-С4)-алкилазодикарбоксилаты. Благодаря простоте получения продукта присоединения и последующего удаления предпочтительно в качестве диенофильного соединения использовать 4-фенил-1,2,4-триазолин-3,5-дион, диметилазодикарбоксилат, диэтилазодикарбоксилат или 1,4-фталазиндион. После синтеза целевого производного витамина D диенофильная группа Z легко может быть удалена из аддукта, в котором в отличие от упомянутого и синтезированного Andrews с сотр. аддукта витамина D сохраняется стерическая конфигурация, и в результате непосредственно образуется целевое производное цис-витамина D.
Гидрокси-группы в продукте присоединения, которые могут вступать в реакцию, могут быть защищены перед или после образования аддукта путем взаимодействия с этерифицирующим (простым или сложным) агентом. Подходящими этерифицирующими агентами (для защиты сложной эфирной группой) являются алкилхлоркарбонаты с 2-5 атомами углерода или ароматические карбоновые кислоты, насыщенные алифатические карбоновые кислоты с 1-4 атомами углерода, п-толуолсульфокислота, метансульфокислота, трифторуксусная кислота или производные перечисленных кислот, которые могут вступать в реакцию этерификации. Для защиты нестабильных гидрокси-групп простой эфирной группой в принципе подходит любой этерифицирующий агент, использующий для этой цели, например, трифенилметилгалоид, 2,3-дигидропиран, триалкилсилил- или триалкилсилилоксиметилгалоид, алкильные группы которых содержат 1-6 атомов углерода. Подходящими для этой цели, в частности, являются триметилсилилхлорид, третбутилдиметилсилилхлорид или триметилсилилэтоксиметилхлорид, поскольку они легко вступают в реакцию с защищаемой гидрокси-группой, образуя простую эфирную функциональную группу, которая, с одной стороны, является достаточно стабильной в условиях реакции, а с другой стороны, ее легко можно удалить для получения исходной гидрокси-группы. Наиболее предпочтительным для защиты гидрокси-группы является трет-бутилдиметилсилилхлорид, поскольку было установлено, что третбутилдиметилсилил является прекрасной защитной группой.
Аддуктами превитамина D2, которые легко могут быть получены путем присоединения диенофильных соединений с образованием в результате сырых материалов, являются аддукты общей формулы II, у которых R означает атом водорода. Эти аддукты легко могут быть переведены в соответствующие соединения, гидроксилированные в 1-, предпочтительно в 1 α-положении, с помощью способа, описанного в упомянутом европейском патенте 70588. В результате образуются аддукты превитамина D2 общей формулы II, у которых R означает незамещенную или замещенную гидрокси- группу. Разумеется, совсем необязательно вводить 1 гидрокси-группу на этой стадии синтеза целевого производного витамина D. Реакцию гидроксилирования или получения 1-гидроксизамещенных производных витамина D, описанную в европейском патенте 70588, можно проводить и на более поздней стадии синтеза, а именно, когда путем формирования С17-боковой цепи синтезируется целевое производное витамина D, но перед удалением диенофильной группы А.
Было установлено, что С22-альдегиды общей формулы I могут быть легко получены путем окисления описанного аддукта превитамина D2, в ходе которого происходит селективное окисление по двойной связи С22-С23. Такую инверсию можно осуществить с высоким выходом путем взаимодействия аддукта превитамина D2 с озоном, предпочтительно в присутствии органического основания (например, пиридина), и последующего восстановления образующегося озонида. Совершенно неожиданно было установлено, что при этом сохраняется стерическая конфигурация у атома С20, хотя при аналогичных процессах, например, в случае, описанном Salmond and Sobola (Tetrahedron Letters 20, 1977, 1695-1698), у С20происходит эпимеризация.
Образующийся в результате С22-альдегид общей формулы I является необыкновенно удобным полупродуктом для синтеза целого ряда различных производных витамина D с С17-боковой цепью разной структуры. В частности, С22-альдегид может использоваться для получения производных витамина D общей формулы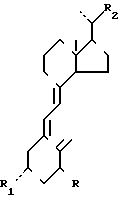 в которой R и R1 имеют приведенные определения, а R2 означает прямой или разветвленный, насыщенный или ненасыщенный алифатический гидрокарбил или гидрокарбилокси-группу с 1-14 атомами углерода, которые могут быть замещены одним или несколькими заместителями, выбранными из гидроксила, простых эфирных групп, циклоалкилов с 3-6 атомами углерода, оксо-групп, лактонных групп и/или атомов фтора, для чего альдегид общей формулы I подвергают реакции удлинения цепи, как правило, в несколько последовательных стадий, в ходе которых альдегидная функциональная группа переводится в группу R2 с последующим удалением группы Z обычным способом.
в которой R и R1 имеют приведенные определения, а R2 означает прямой или разветвленный, насыщенный или ненасыщенный алифатический гидрокарбил или гидрокарбилокси-группу с 1-14 атомами углерода, которые могут быть замещены одним или несколькими заместителями, выбранными из гидроксила, простых эфирных групп, циклоалкилов с 3-6 атомами углерода, оксо-групп, лактонных групп и/или атомов фтора, для чего альдегид общей формулы I подвергают реакции удлинения цепи, как правило, в несколько последовательных стадий, в ходе которых альдегидная функциональная группа переводится в группу R2 с последующим удалением группы Z обычным способом.
Диенофильная группа Z может быть удалена очень просто, например, путем обработки соединения основанием в среде протонного или апротонного полярного растворителя или их смеси, как это описано в упомянутом европейском патенте 70588. Подходящими системами для этой цели являются гидроокиси щелочных металлов в спирте, например, в метаноле или н-бутаноле, гидриды металлов, например, литийалюминийгидрид, в среде инертного апротонного растворителя, или алкоксид щелочного металла в спиртовой среде. Удаление защитных групп, защищающих функциональную гидрокси-группу или группы также может осуществляться известными, использующимися для этой цели способами. Так, например, защитные силилэфирные группы могут быть удалены с помощью соединений фтора, например, фтористого тетрабутиламмония, в среде инертного органического растворителя, например простого эфира, такого как тетрагидрофуран. Возможно и использование для этой цели кислоты, при желании адсорбированной на носителе, например, на двуокиси кремния.
Было установлено, что С22-альдегид приведенной формулы I является прекрасным реагентом, который может использоваться в реакции для удлинения цепи. В этой реакции нужная боковая цепь соединяется с молекулой у семнадцатого атома углерода. Обычно реакция проводится в несколько последовательных стадий. При этом альдегидная функциональная группа С22-альдегида может быть переведена в группу R2 (формула III) по реакции Гриньяра или Виттига (см. прилагаемую схему А). Было установлено, что для взаимодействия с С22-альдегидом можно, в частности, использовать реактивы Гриньяра и Виттига. Таким образом можно легко сформировать углеводородный скелет нужной С17-боковой цепи. Модификацию же такой боковой цепи, например, введение в нее гидрокси-, оксо-групп, атомов фтора и т.п. можно при желании осуществить в ходе последующих стадий. Подходящим для взаимодействия с С22-альдегидом общей формулы I реактивом Виттига является, в частности, соединение общей формулы
Ph3P CH-R3, в которой
Ph означает фенил, а
R3 атом водорода или прямой или разветвленный, насыщенный или ненасыщенный алифатический гидрокарбил, который может быть замещен одной или несколькими этерифицированными (простыми или сложными эфирными группами) гидрокси-группами или атомами фтора и который содержит 1-13 атомов углерода, поскольку такой реагент легко вступает в реакцию с альдегидом, оставляя целыми другие его функциональные группы.
Другой реакцией, с помощью которой можно удлинить цепь, является перевод С22-альдегида в сульфоновое промежуточное соединение, предпочтительно в 22-арилсульфонил-24-гидрокси- или 23-арил- сульфонил-22-гидрокси-замещенное производное, осуществляемый известным при получении такого типа соединений способом, с последующим десульфонированием. Примеры таких реакций удлинения цепи приведены в прилагаемой схеме А.
И, наконец, предметом настоящего изобретения является способ получения производных витамина D общей формулы III, по которому в качестве полупродукта используется С22-альдегид общей формулы I. Для осуществления этого способа вначале (а) аддукт превитамина D2приведенной общей формулы II подвергают селективному окислению по двойной связи С22-С23, предпочтительно путем взаимодействия его с озоном и последующего восстановления образующегося озонида, и затем (в) полученный в результате альдегид общей формулы I подвергают реакции удлинения цепи, в результате которой формируется нужная С17-боковая цепь, после чего известным способом удаляют диенофильную группу Z.
Более подробно изобретение поясняется с помощью приведенных примеров. Описанные в них реакции приведены в прилагаемых схемах В и С, в которых указаны номера соответствующих соединений.
П р и м е р 1. Получение продукта присоединения ацетата превитами D2 и 4-фенил-1,2,4-триазолин-3,5-диона и окисление его до целевого С22-альдегида
(а) К раствору 22,5 г витамина D2 в 200 мл сухого пиридина добавляют 40 мл уксусного ангидрида и оставляют стоять реакционную смесь при комнатной температуре в течение 16 ч. После этого раствор выливают в ледяную воду и добавляют к нему 1 л диатилового эфира. После разделения слоев органический слой трижды промывают водой и затем последовательно 2-нормальной соляной кислотой, раствором бикарбоната натрия и насыщенным раствором NaCl до нейтральной реакции. После высушивания и упаривания при пониженном давлении полученный остаток растворяют в небольшом количестве ацетона. При охлаждении раствора до -20оС получают целевой ацетат витамина D2 (2) в количестве 22,3 г, т.пл. 88оС.
(в) 22,3 г полученного ацетата витамина D2 (2) плавят и выдерживают расплав при температуре около 100оС в течение примерно 45 мин. При этом примерно 30% исходного соединения переходит (по данным ЯМР) в ацетат превитамина D2. После охлаждения 10,8 г непрореагировавшего ацетата витамина D2 выделяют путем кристаллизации из ацетона. Из маточного раствора в количестве 11,4 г после упаривания получают 6,7 г ацетата превитамина D2 (3).
(с) К раствору ацетата превитамина D2 (3), полученному на стадии (в), в 330 мл дихлорметана добавляют при перемешивании, при 0оС, в атмосфере азота, раствор 7,25 г 4-фенил-1,2,4-триазолин-3,5-диона в 90 мл сухого дихлорметана. Ацетат превитамина D2 берется в количестве 18,14 г, т.е. в эквимолярном по отношению к исходному триазолиндиону.
После упаривания остаток перекристаллизовывают из этанола, получая в результате целевой продукт присоединения (4) ацетата превитамина D2 и 4-фенил-1,2,4-триазолин-3,5-диона с выходом 65% Идентификацию полученного продукта осуществляли с помощью ЯМР. Т.пл. 126,3-128оС.
(d) Раствор 13,33 г полученного чистого продукта присоединения (4) в 200 мл сухого метанола с суспендированными в нем 12 г карбоната калия кипятят в течение 45 мин с обратным холодильником. После упаривания при пониженном давлении остаток растворяют в смеси воды и диэтилового эфира. Органический слой отделяют, промывают последовательно разбавленной кислотой, раствором Na2CO3 и раствором NaCl и высушивают. После отгонки растворителя и перекристаллизации из ацетона получают целевой спирт (5) в количестве 12,04 г. Идентификацию полученного продукта осуществляли с помощью ЯМР и ИК.
(е) Раствор 12,04 г полученного спирта (5), 1,98 г имидазола и 3,70 г трет-бутилдиметилсилилхлорида в 100 мл диметилформамида перемешивают в течение 18 ч при комнатной температуре в атмосфере аргона. Затем к смеси добавляют гексан до полного растворения, после чего разделяют диметилформамидный и гексановый слои и диметилформамидный слой подвергают экстракции гексаном. Объединенные гексановые фракции промывают последовательно 0,1-нормальной соляной кислотой, водой, раствором бикарбоната натрия и раствором NaCl и высушивают. После упаривания и перекристаллизации из этанола получают целевой третбутилдиметиловый эфир (6) с выходом 83% в расчете на исходный ацетат (4). Идентификацию полученного продукта осуществляли с помощью ЯМР. Температура плавления 147,4-148,5оС.
(f) 40 г полученного продукта присоединения третбутилдиметилсилилового эфира превитамина D2 и 4-фенил-1,2,4- триазолин-3,5-диона растворяют в 470 мл метиленхлорида с добавкой 4,7 мл сухого пиридина. Через полученный раствор при (-70)-(-75)оС пропускают озон со скоростью 0,6 ммоля О3/мин. Протекание реакции контролируют с помощью тонкослойной хроматографии (элюент: смесь толуола с ацетоном в соотношении 95:5). Продувку озоном прекращают через 140 мин, после чего к реакционной смеси добавляют 23 г цинковой пыли и 116 мл ледяной уксусной кислоты при (-70)-(-75)оС. Реакционную смесь затем медленно нагревают до комнатной температуры, продувая ее при этом азотом, после чего кипятят в течение 8 мин с обратным холодильником. Избыток цинка отфильтровывают и фильтрат промывают последовательно раствором NaCl, раствором Na2CO3, 2-нормальным раствором гидроксидом натрия и еще раз раствором NaCl. После высушивания и очистки с помощью колоночной хроматографии на силикагеле (элюирование смесью метиленхлорида и ацетона) получают целевой аддукт С22-альдегида (7) в количестве 28,04 г (78%). При желании полученный продукт может быть подвергнут дополнительной очистке путем перекристаллизации из ацетона. Идентификацию осуществляли с помощью ЯМР. Температура плавления 195,7-197,7оС.
П р и м е р 2. Модификация С22-альдегида (7) с помощью реакции Гриньяра.
К 2,6 г магния добавляют сухой диэтиловый эфир в таком количестве, чтобы магний был покрыт эфиром. После этого к смеси добавляют 10,5 г 3-хлор-1,1-диметилпропилтриметилсилилового эфира, необходимого для получения реактива Гриньяра. Реакцию инициируют путем добавления небольшого количества дибромэтана, после чего ее поддерживают путем постепенного добавления раствора вышеуказанного силилового эфира в 10 мл сухого диэтилового эфира при температуре около 38оС. После добавления всего количества силилового эфира реакционную смесь кипятят с обратным холодильником при перемешивании в течение 30 мин.
После этого к реакционной смеси добавляют по каплям раствор 10 г С22-альдегида (7), полученного таким же образом, как это описано в примере 1, в 20 мл сухого тетрагидрофурана и затем кипятят ее с обратным холодильником при перемешивании в течение 15 мин. Реакционную смесь затем охлаждают до комнатной температуры и добавляют к ней 50 мл насыщенного раствора NH4Cl. После промывки раствором NaCl и высушивания реакционную смесь упаривают и разделяют на адсорбционной колонке (Элюент: смесь толуола и ацетона в соотношении 95:5). Выход целевого продукта (8) составляет 3,13 г. Для получения 25-оксивитамина D3 продукт (8) подвергают взаимодействию с толуолсульфонилхлоридом, в результате чего С22-окси-группа переходит в тозилокси-группу (9). Триметилсилиловый эфир целевой С17-боковой цепи получают путем восстановления LiAlH4 в среде сухого диэтилового эфира. В результате получают продукт присоединения третбутилдиметилсилилового эфира 25-триметилсилилоксипревитамина D3 и 4-фенил-1,2,4-триазолин-3,5-диона (10). После удаления защитных силиловых эфирных групп и диенофильной группы может быть получен целевой 25-оксивитамин D3. Более подробно эти реакции расщепления будут описаны в примере IV.
П р и м е р III. Модификация С22-альдегида (7) с помощью реакции Виттига.
(а) 3,0 г С22-альдегида (7), полученного таким же образом, как это описано в примере 1, подвергают взаимодействию с 2,9 г соли Виттига, трифенилфосфина и 4-хлор-2-метилбутена-2 в растворе тетрагидрофурана. Образующееся соединение перекристаллизовывают из диэтилового эфира. В результате получают целевой аддукт 22,24-диен-витамина D3 (II) с выходом 79% (соотношение между 22-цис- и 22-транс-изомерами равно 1:3). Идентификацию осуществляли с помощью ЯМР.
(в) Полученный аддукт 22,24-диено-витамина D3 эпоксидируют селективно по двойной связи С24-С25 с помощью смеси дибензоилпероксида и гексаметилдисилазана в растворе метиленхлорида. По данным ЯМР 24,25-эпоксид (12) состоит из смеси стереоизомеров. Аддукт 22-ен-24-эпокси-витамина D3 (12) подвергают очистке с помощью колоночной флэш-хроматографии (элюент: смесь гексана и ацетона в соотношении 7:3). Выход 60%
(с) Раствор 1,0 г эпокси-соединения (12) в этилацетате встряхивают при атмосферном давлении в атмосфере водорода с 0,22 г никеля Ренея. По данным ЯМР при этом протекает реакция гидрирования и в результате образуется целевой аддукт 25-оксивитамина D3 (13). Выход 50%
С помощью реакции Гриньяра между эпокси-соединением (12) и магнийметилхлоридом после разделения образующейся смеси изомеров получают аддукт 25-оксивитамина D2 (16), из которого после удаления защитных групп, как это будет описано ниже, в примере IV, получают 25-оксивитамин D2.
П р и м е р IV. Получение 25-гидроксивитамина D3 путем удаления защитных групп.
(а) Аддукт 25-гидроксивитамина D3 (13), полученный по способу в соответствии с примером III, подвергают дисилилированию путем растворения 9,80 г его в 90 мл ацетонитрила и добавления к приготовленному раствору 15 мл водного раствора (40-45%) фтористоводородной кислоты. Реакционную смесь перемешивают при комнатной температуре в атмосфере азота в течение 3 ч. Реакцию отщепления эфирной группы контролируют с помощью тонкослойной хроматографии. После выливания реакционной смеси в 300 мл воды и добавления 100 мл метиленхлорида органический слой отделяют, последовательно промывают 5%-ным раствором NaHCO3 и раствором NaCl и высушивают. После отгонки растворителя целевой продукт (14) подвергают очистке с помощью колоночной хроматографии на силикагеле (элюент: смесь метиленхлорида и ацетона). Выход 86% Идентификацию осуществляли с помощью ЯМР.
Аналогичным образом подвергают десилилированию бис(силиловый эфир), полученный по способу в соответствии с примером II, получая в результате продукт присоединения (14).
(в) Полученный аддукт 25-гидроксивитамина D3 (14) растворяют в количестве 500 мг в 25 мл метанола. После добавления 25 мл 15-нормального водного раствора КОН реакционную смесь кипятят с обратным холодильником в течение 24 ч. Затем ее выливают на смесь льда и воды и подвергают экстракции диэтиловым эфиром. После промывки последовательно раствором NaHCO3 и раствором NaCl органическую фазу упаривают, получая в результате целевой продукт, а именно 25-оксивитамин D (15), с выходом 50% Полученный продукт может быть затем перекристаллизован из смеси ацетона и воды. Температура плавления 108,4-111,4оС. Идентификацию осуществляли с помощью ЯМР.  где LDA литий-диизопропиламин
где LDA литий-диизопропиламин
R4 защищенная гидрокси-группа
R5 гидрокарбил
X галоген 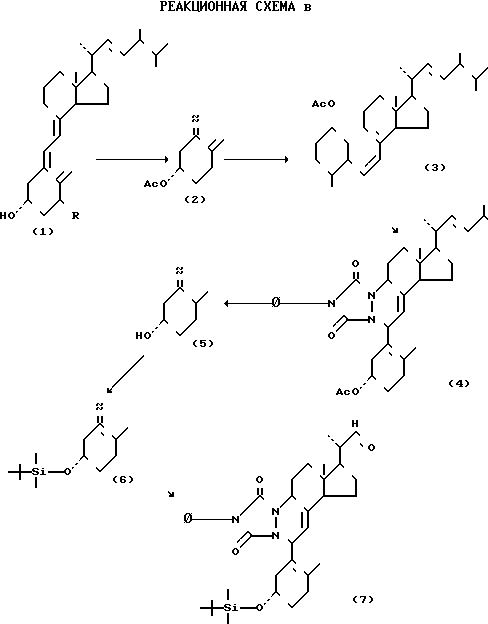





Использование: в качестве промежуточных продуктов в синтезе производных витамина Д. Сущность изобретения: аддукт-альдегид ф-лы 1, где R1 и R2-H, ОН, возможно замещенная C2-C5 алкилхлоркарбонатом, ароматической карбоновой кислотой C1-C4 алифатической насыщенной карбоновой кислотой или три C1-C6 -алкилсилилгалоидом или три- C1-C6 -алкилсилилэтоксиметилгалоидом, причем R1 - не может быть Н, Z - сульфонил или группа ф-лы 2, где А и В - C1-C4 -алкокси, или А и В вместе -фенилимин, орто-фенилен. Структура ф-л 1 и 2 
 .
.
Аддукты-альдегида общей формулы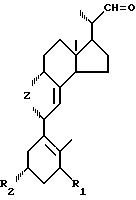
где R1 и R2, одинаковые или различные, водород или гидроксигруппа, которая может быть этерифицирована С2-С5-алкилхлоркарбонатом, ароматической карбоновой кислотой, С1-С4-алифатической насыщенной карбоновой кислотой, или три-(С1-С6)-алкилсилилгалоидом, или три-(С1-С6)-алкилсилилэтоксиметилгалоидом, причем R1 не может быть водородом, Z-сульфонильная группа или группа общей формулы
где А и В, одинаковые или различные, -С1-С4-алкокси или А и В вместе образуют фенилиминовую или ортофениленовую группу,
в качестве промежуточных продуктов в синтезе производных витамина D.
| Bull | |||
| Sos | |||
| Ch/.Tr | |||
| Автоматическое или полуавтоматическое телефонное устройство | 1925 |
|
SU1949A1 |
| Приспособление в центрифугах для регулирования количества жидкости или газа, оставляемых в обрабатываемом в формах материале, в особенности при пробеливании рафинада | 0 |
|
SU74A1 |
Авторы
Даты
1995-06-09—Публикация
1990-06-11—Подача