Изобретение относится к органической химии, конкретно к синтезу новых фторированных производных 4-арил-1,4-дигидропиридина, проявляющих свойства агонистов кальция, общей формулы I
R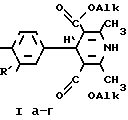 где Ia R= CF3-CHF-CF2O-, R'=CH3O-, Alk=C2H5(K-2);
где Ia R= CF3-CHF-CF2O-, R'=CH3O-, Alk=C2H5(K-2);
Iб R=CHF2O-, R'=CH3O-, Alk=C2H5 (K-3);
Iв R=CH3O-, R'=CF3-CHF-CF2O-, Alk=CH3 (K-6);
Iг R=CH3O-, R'=CHF2O-, Alk=CH3 (K-7).
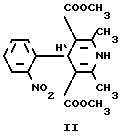
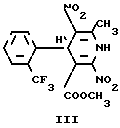
В настоящее время известно, что большинство соединений 1,4-дигидропиридинового ряда обладают свойствами антагонистов кальция и применяются в клинике как гипотензивные, антиаритмические и противоишемические средства нифедипин (II), нитрендипин, форидон и др. [1] В то же время среди соединений аналогичной структуры обнаружены вещества, проявляющие свойства агонистов кальция CIP 28392, YC 170, Bay K 8644 (III), которым присуща также кардиотоническая активность. Наиболее эффективный из них Bay K 8644 (III), содержащий фторированный радикал трифторметильную группу, является ближайшим аналогом заявляемых соединений как по структуре, так и по типу действия [2]
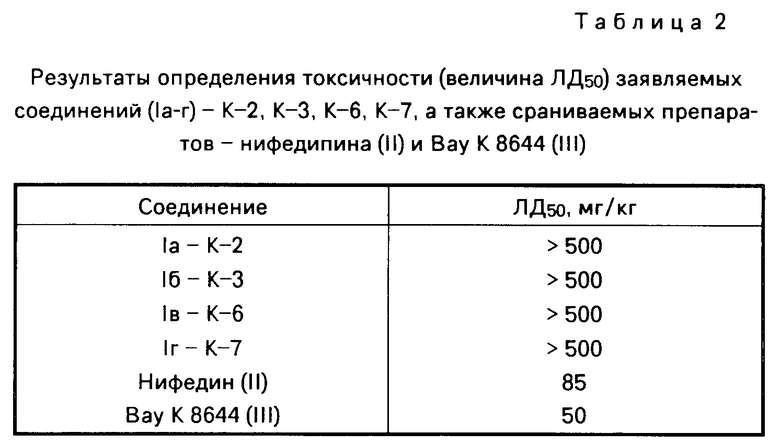
Следует отметить, что круг препаратов, обладающих подобной фармакологической активностью, ограничен, а известные имеют существенный недостаток высокую токсичность, как, например, Вау К 8644 (III) см. табл.2.
Кроме того, агонисты кальция вызывают сужение сосудов, что неблагоприятно сказывается при лечении сердечной недостаточности. Вместе с тем, по мнению ряда авторов [2,3] именно препараты с подобным механизмом действия в ближайшие годы станут наиболее перспективными кардиотониками.
Целью изобретения являются новые производные 1,4-дигидропиридина, проявляющие кардиотоническую активность при умеренном гипертензивном действии, а также обладающие низкой токсичностью по отношению к теплокровным животным и человеку.
Поставленная цель достигается новыми фторированными производными 4-арил-1,4-дигидропиридина-2,6-диметил-3,5-бис- (алкоксикарбонил)-4-[полифторалкокси(ме- токси)фенил]-1,4-дигидропиридинами соединениями (1а-г).
Заявляемые соединения получаются простым одностадийным способом конденсацией соответствующих фторированных производных бензальдегида с ацетоуксусным и β-аминокротоновым эфирами в спиртовой среде по схеме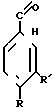 + CH
+ CH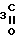 CH2C
CH2C + CH
+ CH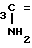 CHC
CHC R
R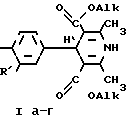
Ниже приводятся конкретные примеры синтеза заявляемых соединений. Для сравнения и установления влияния замены атомов водорода на фтор в алкоксильных радикалах на биологические свойства описанных в заявке веществ синтезирован также на основе 3,4-диметоксибензальдегида (вератрового альдегида) не содержащий фтора аналог 2,6-диметил-3,5-бис(метоксикарбонил)-4-(3,4-диметоксифенил)-1,4-ди- гидропиридин (К-8) (IV).
H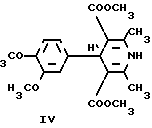
П р и м е р 1. 2,6-Диметил-3,5-бис(этоксикарбонил)-4-[3-метокси-4-(2-гидропер- фторпропокси)фенил]-1,4-дигидропиридин (Ia) (К-2).
CF3CFHCF2O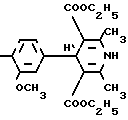
В двугорлую колбу емкостью 100 мл, снабженную мешалкой и обратным холодильником, помещают 18,12 г (0,06 г-моль) 3-метокси-4-(2-гидроперфторпропокси)бен- зальдегида, 7,8 г (0,06 г-моль) этилацетоуксусного эфира, 7,74 г (0,06 г-моль) этил-β -аминокротонового эфира и 60 мл этанола. Кипятят с перемешиванием 4 ч. Реакционную смесь охлаждают, выпавшие кристаллы отфильтровывают, сушат и кристаллизуют. Выход 28 г (89% ), т.пл. 151-153оС (бензол-гексан, 1:1).
ИК-спектр: 1720 см-1 (СО), 3330 см-1 (NH).
ЯМР19F спектр, δ (м.д.): мультиплет -74,69 (CF3); дублет квартетов -76,51, -79,95 (CF2); мультиплет -212,46 (CFH), IFH 50 Гц.
Найдено, C 52,65; H 4,90; F 21,90; N 2,85.
C23H25F6NO6.
Вычислено, C 52,57; H 4,76; F 21,71; N 2,67.
П р и м е р 2. 2,6-Диметил-3,5-бис(это-ксикарбонил)-4-(3-метокси-4-дифторметокси- фенил)-1,4-дигидропиридин (Iб) (К-3).
CF2HO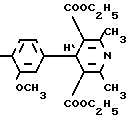
В двугорлую колбу емкостью 100 мл, снабженную мешалкой и обратным холодильником, помещают 12,12 г (0,06 г-моль) 3-метокси-4- дифторметоксибензальдегида, 7,8 г (0,06 г-моль) этилацетоуксусного эфира, 7,8 г (0,06 г-моль) этил-β -аминокротонового эфира и 60 мл этанола. Кипятят с перемешиванием 4 ч. Охлаждают, выпавший продукт отфильтровывают, сушат и кристаллизуют. Выход 22 г (86%), т.пл. 143-145оС (бензол-гексан, 1:1).
ИК-спектр: 1720 см-1 (СО), 3370 см-1 (NH).
ЯМР19F спектр: дублет -81,11 м.д. IFH 73,2 Гц.
Найдено, C 59,26; H 6,13; F 9,42; N 3,40
C21H25F2NO6
Вычислено, C 59,29; H 5,88; F 8,94; N 3,29.
П р и м е р 3. 2,6-Диметил-3,5-бис(мето-ксикарбонил)-4-[3-(2-гидроперфторпропо- кси)-4-метоксифенил]-1,4-дигидропиридин (Iв) (К-6).
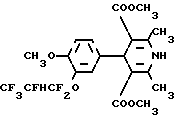
В двугорлую колбу емкостью 100 мл, снабженную мешалкой и обратным холодильником, помещают 18,12 г (0,06 г-моль) 3-(2- гидроперфторпропокси)-4-метоксибензальдегида, 6,96 г (0,06 г-моль) метилацетоуксусного эфира, 6,9 г (0,06 г-моль) метил- β-аминокротонового эфира и 60 мл этанола. Кипятят с перемешиванием 4 ч. Реакционную смесь охлаждают, выпавший продукт отфильтровывают, сушат и кристаллизуют. Выход 23 г (77%), т.пл. 143-145оС (бензол-гексан, 1:1).
ИК-спектр: 1700 см-1 (СО), 3340 см-1 (NH).
ЯМР19F спектр, δ (м.д.): мультиплет -74,69 (CF3), дублет квартетов -76,87, -79,67 (CF2), мультиплет -212,51 (CFH), IFH 50 Гц.
Найдено, С 50,57; H 4,26; F 22,91; N 2,66.
C21H21F6NO6.
Вычислено, C 50,70; H 4,23; F 22,94; N 2,82.
П р и м е р 4. 2,6-Диметил-3,5-бис(мето-ксикарбонил)-4-(3-дифторметокси-4-мето- ксифенил)-1,4-дигидропиридин (Iг) (К-7)
H3CO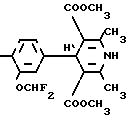
В двугорлую колбу емкостью 100 мл, снабженную мешалкой и обратным холодильником, помещают 12,12 г (0,06 г-моль) 3-дифторметокси-4-метоксибензальдегида, 6,96 г (0,06 г-моль) метилацетоуксусного эфира, 6,9 г (0,06 г-моль) метил- β-аминокротонового эфира и 60 мл этанола. Кипятят с перемешиванием 4 ч. Реакционную смесь охлаждают, выпавший продукт отфильтровывают, сушат и кристаллизуют. Выход 20,5 г (86%), т.пл. 163-165оС (бензол-гексан, 1: 1).
ИК-спектр: 1720 см-1 (СО), 3360 см-1 (NH).
ЯМР19F спектр: дублет -80,89 м.д. IFH 73 Гц.
Найдено, C 57,17; H 5,38; F 9,38; N 3,38.
C19H21F2NO6.
Вычислено, C 57,43; H 5,29; F 9,57; N 3,53.
П р и м е р 5. 2,6-Диметил-3,5-бис(метоксикарбонил)-4-(3,4-диметоксифенил)-1,4-ди- гидропиридин (IV) (К-8)
H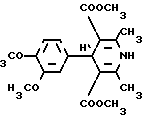
В двугорлую колбу емкостью 100 мл, снабженную мешалкой и обратным холодильником, помещают 9,96 г (0,06 г-моль) 3,4-диметоксибензальдегида (вератрового альдегида), 6,96 г (0,06 г-моль) метилацетоуксусного эфира, 6,9 г (0,06 г-моль) метил- β-аминокротонового эфира и 60 мл этанола. Кипятят с перемешиванием 4 ч. Реакционную смесь охлаждают, выпавший осадок отфильтровывают сушат и кристаллизуют. Выход 19,28 г (89%), т.пл. 152-154оС (бензол-гексан, 1:1).
ИК-спектр: 1710 см-1 (СО), 3370 см-1 (NH).
Найдено, C 62,98; H 6,63; N 3,45.
C19H23NO6.
Вычислено, C 63,16; H 6,37; N 3,88.
П р и м е р 6. Экспериментальное исследование влияния заявляемых соединений на сердечно-сосудистую систему проводили на наркотизированных тиопенталом натрия (0,2 мг/кг) крысах линии Wistar обоего пола, массой 150-250 г. Производилась синхронная регистрация пульсового артериального давления при его прямом, электроманометрическом измерении в сонной артерии, электрокардиограммы во II стандартном отведении и дифференцированной тетраполярной реограммы на Polygraph system 6000 со скоростью 1 и 50 мм/с.
Для оценки системной гемодинамики и насосной функции сердца использовались следующие показатели:
Систолическое артериальное давление.
Диастолическое артериальное давление.
Среднее артериальное давление.
Общее периферическое сопротивление (ОПС) по формуле
ОПС 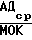 · 1333, где АДср среднее артериальное давление МОК (минутный объем крови) УОК х ЧСС,
· 1333, где АДср среднее артериальное давление МОК (минутный объем крови) УОК х ЧСС,
где УОК ударный объем крови;
ЧСС частота сердечных сокращений.
Ударный объем крови (методом тетраполярной реографии) по формуле Кубичека:
УОК К·ρ· 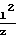 · Ag· Tизг. где К поправочный коэффициент (0,8),
· Ag· Tизг. где К поправочный коэффициент (0,8),
ρ электропроводность крови,
l расстояние между грудными электродами,
z базовый импеданс,
Ag амплитуда дифференцированной реограммы,
Тизг время изгнания.
Влияние заявляемых соединений на сократимость миокарда оценивали в экспериментах на изолированном миокарде. Папиллярную мышцу сердца крысы помещали в проточную камеру и перфузировали оксигенированным раствором (95% О2 и 5% СО2) раствором Тироде при 29оС. Электрическую стимуляцию осуществляли с помощью платиновых электродов, расположенных параллельно мышце. Использовали прямоугольные импульсы от электростимулятора КЗМО длительностью 5 мс, напряжением, превышающим пороговое на 10-25% с частотой 1 Гц. Для оценки сократительной способности миокарда принимали сокращения близкими к изометрическим и использовали показатели развиваемого напряжения Т (мг) и скорость развития и спада напряжения (dT/dt). Перфузию мышц раствором Тироде осуществляли с содержанием исследуемых соединений в концентрациях 10-8-10-3 М в 1 л. Внутривенное введение исследуемых соединений (в яремную вену) производили в дозе 0,01, 0,1, 0,5 мг/кг. Полученные результаты обрабатывались вариационно-статистическим методом с использованием критерия Стьюдента.
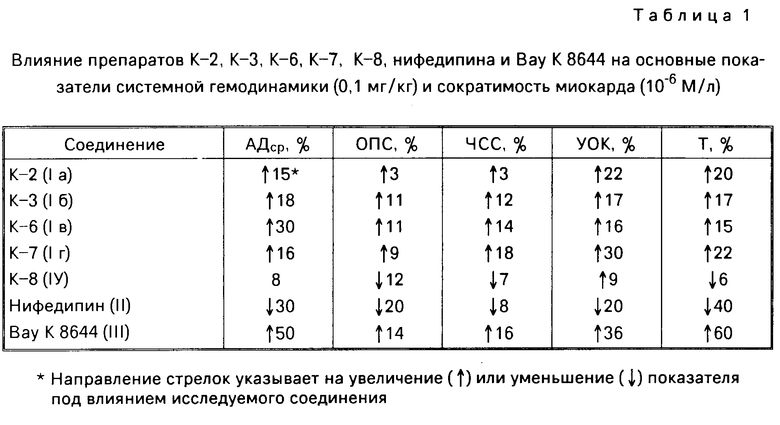
Сравнение проводили с аналогами по структуре и действию антагонистом кальция нифедипином (II) и агонистом кальция Вау К 8644 (III). Для оценки фармакологической активности и анализа механизма действия исследуемых соединений производили сравнение направленности и количественных изменений показателей сократительной способности миокарда и системной гемодинамики (табл. 1).
Представленные в табл. 1 данные, показывают, что соединения К-2, К-3, К-6, К-7 обладают выраженными кардиотоническими и гипертензивными свойствами. Наибольшую активность из них проявляют соединения К-2 и К-6. В концентрации 10-6 моль/л они усиливают сократимость миокарда на 20-22% одновременно повышая артериальное давление на 15-16% Несколько уступают по активности соединения К-3 и К-7 (увеличение сократимости миокарда на 15-17%). Фармакодинамические свойства (увеличение сократимости, повышение артериального давления, общего периферического сопротивления насосной функции сердца) и уровень активности сопоставимы с ближайшим структурным аналогом Вау К 8644 (III) (см. табл.1), известным активатором входа ионов кальция. Учитывая изложенное можно предположить, что заявляемые соединения и Вау К 8644 обладают однотипным механизмом действия. Вместе с тем заявляемые соединения обладают значительно меньшей токсичностью по сравнению с эталонным. Для Вау К 8644 ЛД50 составляет 50 мг/кг, а для соединений К-2, К-3, К-6, К-7 свыше 500 мг/кг (см. табл.2). Это может иметь существенное значение при рассмотрении этой группы химических веществ в качестве потенциальных кардиотоников.
Характерно, что соединение К-8, у которого в бензольном кольце находятся в положениях 3 и 4 две метоксильные группы и в отличие от заявляемых соединений (Iа-г) не содержатся атомы фтора в алкоксильных радикалах, проявляет противоположные фармакологические свойства и вызывает снижение артериального давления, а также обладает слабым кардиодепрессивным действием. Такой же фармакодинамический профиль имеет известный антагонист кальция нифедипин (II).
Из сказанного следует, что специфичность фармакологической активности заявляемых фторированных производных 4-арил-1,4- дигидропиридина (Ia) К-2; (Iб) К-3; (Iв) К-6; (Iг) К-7 их положительное инотропное действие обусловлены наличием атомов фтора в алкоксильных радикалах бензольного кольца, что является неожиданным и заранее не предсказуемым эффектом.
П р и м е р 7. Определение токсичности заявляемых соединений проводили на белых беспородных мышах массой тела 20-25 г. Исследуемые соединения и эталонные препараты вводили внутрижелудочно в дозах 30-500 мг/кг массы тела. Наблюдения проводили в течение 24 ч после введения. Результаты опытов подвергались статистической обработке по методике Личфилда-Уилкоксона в модификации Рота и приведены в табл.2.
Таким образом, заявляемые соединения обладают значительно меньшей токсичностью по сравнению с эталонными препаратами.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЭТИЛОВЫЙ И 3-(N,N-ДИМЕТИЛАМИНО)-2,2-ДИМЕТИЛПРОПИЛОВЫЙ ДИЭФИР 2,5-ДИМЕТИЛ-4-(3-НИТРОФЕНИЛ)-1,4-ДИГИДРОПИРИДИН-3,5-ДИКАРБОНОВОЙ КИСЛОТЫ ГИДРОХЛОРИД, ОБЛАДАЮЩИЙ ПРОЛОНГИРОВАННЫМ АНТИГИПЕРТЕНЗИВНЫМ ЭФФЕКТОМ | 1991 |
|
RU2043341C1 |
| 4,5-ДИМЕТИЛ-2-Н-ПРОПИЛТИО-2-ω-Н-ПЕРФТОРБУТИЛ -3Н, 6Н-ТИАИН, ОБЛАДАЮЩИЙ ИНОТРОПНЫМ ДЕЙСТВИЕМ, И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1992 |
|
RU2054426C1 |
| N`-БИС-(ЭТИЛЕНИМИНО)ФОСФОНИЛ-N``-АРИЛМОЧЕВИНЫ, ОБЛАДАЮЩИЕ АНТИБЛАСТИЧЕСКОЙ АКТИВНОСТЬЮ, N`-ДИХЛОРФОСФОНИЛ-N``-АРИЛМОЧЕВИНЫ ДЛЯ СИНТЕЗА N`-БИС-(ЭТИЛЕНИМИНО)ФОСФОНИЛ-N``-АРИЛМОЧЕВИН- И ФТОРСОДЕРЖАЩИЕ АНИЛИНЫ ДЛЯ СИНТЕЗА N`-ДИХЛОРФОСФОНИЛ-N``-АРИЛМОЧЕВИН | 1988 |
|
SU1839443A1 |
| 7-АЛКОКСИ-4-ОКСА-1,2,6-ТРИНИТРАТГЕПТАНТРИОЛЫ, ОБЛАДАЮЩИЕ КАРДИОТОНИЧЕСКОЙ АКТИВНОСТЬЮ | 1991 |
|
RU2027700C1 |
| Адамантиловые эфиры 2,6-диметил-1,4-дигидропиридин-3,5-дикарбоновой кислоты, обладающие радиозащитной активностью | 1980 |
|
SU1680696A1 |
| N,N-БИС-(ПОЛИФТОРАЛКИЛ)АМИДОСУЛФОФТОРИДЫ, ПРОЯВЛЯЮЩИЕ ИНСЕКТИЦИДНУЮ АКТИВНОСТЬ ФУМИГАЦИОННОГО ДЕЙСТВИЯ | 1989 |
|
SU1746664A1 |
| 1,3-БИС-(2,3-ДИАКРИЛОИЛОКСИПРОПИЛ) -5,5-ДИМЕТИЛ-2,4-ИМИДАЗОЛИДИНДИОН В КАЧЕСТВЕ МОДИФИКАТОРА ФОТОПОЛИМЕРИЗУЮЩИХСЯ АКРИЛАТНЫХ КОМПОЗИЦИЙ | 1991 |
|
RU2032672C1 |
| ФУНКЦИОНАЛЬНЫЕ ФТОРСОДЕРЖАЩИЕ СИЛАНЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2008 |
|
RU2398775C2 |
| СПОСОБ ПОЛУЧЕНИЯ АМИНОФЕНИЛПЕРФТОРАЛКИЛСУЛЬФИДОВ | 1990 |
|
RU2030397C1 |
| ПЕНТАФТОРБЕНЗИЛ 1R,3S -2,2- ДИМЕТИЛ-3- (2-ХЛОРПРОПЕНИЛ) ЦИКЛОПРОПАНКАРБОКСИЛАТ В ВИДЕ СМЕСИ ИЗОМЕРОВ, ПРОЯВЛЯЮЩИЙ ИНСЕКТИЦИДНУЮ АКТИВНОСТЬ | 1991 |
|
RU2005716C1 |
Использование: в качестве веществ, проявляющих кардиотоническое и гипертензивное действие. Сущность изобретения: продукт: 2, 6-диметил-3, 5-бис(алкоксикарбонил)-4-полифторалкокси(метокси) фенил - 1, 4-дигидропиридины общей формулы 1, где 1а - CF3-CHF-CF2O-; R1-CH3O-; Аlк - C2H5, 1б - CHF2O-, R1-CH3O-, Аlк - C2H5, 1в CH3O-, R1-CF3-CHF3-CHF-CF2O, Аlк - CH3, 1г CH3O-, R1-CHF2O-, Аlк - CH3.  2 табл.
2 табл.
2,6- Диметил-3,5-бис (алкоксикарбонил)-4-[полифторалкокси (метокси) фенил]-1,4-дигидропиридины общей формулы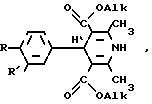
где а) R CF3-CHF-CF2O-; R1 CH3O-, Alk C2H5;
б) R CHF2O-; R1 CH3O-; Alk C2H5;
в) R CH3O-; R1 CF3 CHF CF2O-, Alk CH3;
г) R CH3O-; R1 CHF2O-; Alk CH3,
проявляющие кардиотоническое и гипертензивное действие.
| Патент DE 3130041, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1995-06-09—Публикация
1992-04-07—Подача