Изобретение относится к селективному электролитическому удалению хлора из водных растворов двуокиси хлора и хлора.
Двуокись хлора интенсивно применяется в качестве отбеливающего химикалия для древесных масс и может быть получена рядом способов. Большинство операций крупносерийного производства основано на восстановлении хлората натрия в водно-кислотной реакционной среде. Двуокись хлора обычно растворяют в воде и используют в качестве водного раствора.
Хлор обычно получают совместно с двуокисью железа в результате применения дополнительных ионов хлорида в качестве восстановления либо вследствие недостатков способа образования двуокиси хлора.
Часто желательно получать водный раствор двуокиси хлора, который в сущности не имеет хлора, например, при операциях отбеливания целлюлозы, где требуется применять высокое соотношение двуокиси хлора.
Известное техническое решение по выделению хлора из водных растворов двуокиси хлора включает способы селективного десорбирования.
В настоящее время найдено, что хлор может селективно удаляться электрически из водных растворов двуокиси хлора и хлора. В соответствии с предлагаемым изобретением предусмотрен способ обработки водного раствора хлора и двуокиси хлора, который состоит из селективного катодного восстановления по меньшей мере части хлора с рН водного раствора примерно до 4 без значительного уменьшения концентрации двуокиси хлора в полученном обработанном растворе. Концентрация двуокиси хлора не подвергается воздействию и лишь хлор восстанавливается до иона хлорида. Электролитический способ может применяться для осуществления удаления части или всего растворенного хлора по желанию. Хлор может восстанавливаться прямо либо косвенно в зависимости от условий процесса.
Для осуществления селективного удаления хлора из водного раствора хлора и двуокиси хлора необходимо регулировать ряд параметров.
Одним из таких наиболее важных параметров является рН водного раствора хлора и двуокиси хлора. Для прямого восстановления хлора требуется величина рН не более 2. При величинах рН ниже 2 хлор присутствует в жидкой фазе в виде Cl2 и, следовательно, может прямо восстанавливаться. При высоких величинах рН примерно до 4 хлор присутствует в состоянии равновесия с другими формами "активного хлора", в основном НОСl, который позволяет осуществлять косвенно восстановление хлора до иона хлорида.
По этим причинам необходимо работать при максимальном рН примерно 2 для прямого восстановления, тогда как косвенное восстановление может осуществляться при рН примерно 4. При величинах рН свыше 4 "активный хлор" не включает свободный Сl2 и, следовательно, селективное восстановление Сl2 до иона хлорида невозможно.
рН среды представляет рН раствора по мере его поступления на электрод. Локально высокие отрицательные потенциалы электрода в электроде могут привести к превышению требуемой величины рН, хотя это не оказывает влияния на общую эффективность способа.
Материалы для изготовления таких электродов с низким перенапряжением известны. Такие электроды обычно содержат основу из титана, циркония, тантала или гафния, причем на основе имеется электропроводящее покрытие, которое может быть выполнено из благородного металла, например платины, сплава благородного металла, например окиси рутения или двуокиси титана, платины, например платината лития или платината кальция, или смесей двух или больше таких металлов. Можно применять любой из этих материалов для получения материала конструкции катода с низким перенапряжением. Платиновая поверхность обычно имеет перенапpяжение для реакции Сl2/Cl-, равное примерно 40 мВ.
Применение электродов с высоким перенапряжением, например угольных электродов, также является полезным при значениях рН примерно 2, причем они также являются предпочтительными при высоких значениях, например примерно 4. При применении таких электродов происходящие реакции включают не прямое электрическое восстановление хлора, которое отмечается с катодами с низким перенапряжением, а косвенное восстановление, при котором хлор химически восстанавливается до хлорида посредством иона хлорита, который получают электрохимическим путем из двуокиси хлора.
Физическая форма катода, применяемого в данном способе, не является критической и может представлять собой плоский пластинчатый электрод или более предпочтительно катод с высокой площадью поверхности, имеющий трехмерную поверхность, контактирующую с электролитом. Последний тип электрода допускает продолжительное время контакта между раствором двуокиси хлора и хлором.
Термин "высокая площадь поверхности" катода относится к электроду типа, когда электролит соприкасается с большой площадью поверхности электрода в сравнении с физическими размерами электрода. Электрод образован с промежутками, через которые проходит электролит и таким образом имеет трехмерную поверхность контакта с электролитом.
Катод с высокой площадью поверхности может быть так называемого "проточного" типа, причем электрод изготовлен из электропроводящего пористого материала, например слоев электропроводящего полотна, электролит проходит через пористую конструкцию обычно параллельно потоку тока, при этом он подвергается электролизу и экспонируется на высокой площади поверхности сетки электрода.
Катод с высокой площадью поверхности может быть также так называемого "обтекаемого" типа, в котором электрод содержит уплотненный слой отдельных электропроводящих частиц, электролит обычно проходит через уплотненный слой перпендикулярно к потоку тока, при этом он подвергается электролизу и, следовательно, экспонируется на высокой площади поверхности электропроводящих частиц в уплотненном слое.
Катод с высокой площадью поверхности позволяет электролиту контактировать с катодом в течение продолжительного времени, таким образом достигается электролитическое восстановление хлора в ионы хлорида. Применяемая площадь поверхности и условия работы электролизера зависят от концентрации хлора, присутствующего в водном растворе двуокиси хлора. В зависимости от производительности электролизера электролит может циркулировать несколько раз через катод с высокой площадью поверхности для восстановления растворенного хлора.
Электролизер, в котором осуществляют электролиз в соответствии с настоящим изобретением, может иметь любую обычную конструкцию. Он разделен на отделения для анолита и католита посредством ионообменной мембраны, в частности катионообменной мембраны для предупреждения взаимодействия газов, образующихся на аноде, например кислород с двуокисью хлора, и электролитического восстановления на катоде. В таком разделенном электролите анолит может быть любого требуемого электролита, обычно кислотная среда, например серная кислота. Анод электролизера может быть изготовлен из любого требуемого электропроводящего материала, например графита или металла.
Другим важным отличительным признаком изобретения является электродный потенциал, который прилагается к катоду. Наиболее предпочтительным является осуществление способа при значениях рН вплоть примерно до 2, т.е. пpямое восстановление, чтобы потенциал электрода с низким перенапряжением равнялся примерно от 0,8-1,2 В в сравнении с насыщенным каломельным электродом предпочтительно примерно +1 В в сравнении с насыщенным каломельным электродом. При отрицательных потенциалах электрода свыше +0,8 В электролитическое восстановление больше не является избирательным для водных растворов двуокиси хлора и хлора, имеющих рН примерно 2, и может проходить электpическое восстановление двуокиси хлора. При более положительных электродных потенциалах свыше 21,2 В электролитическое восстановление хлора не происходит.
Для примера воплощения изобретения при значениях рН, равных примерно 4, т. е. косвенное восстановление, важно, чтобы электродный потенциал электрода с высоким перенапряжением равнялся от примерно +0,8 до примерно -0,6 В в сравнении с насыщенным каломельным электродом.
Электродный потенциал электрода относится к потенциалу растворения, измеренному на токоподводе, аналогичном плоскому пластинчатому электроду. Трехмерный электрод, например, применяемый в настоящем изобретении, имеет свойственное ему распределение потенциала внутри конструкции, причем истинный потенциал зависит от места определения и он может быть более отрицательным чем -0,6 В.
Напряжение, которое прилагается между анодом и катодом для образования заданного электродного потенциала, зависит от материалов конструкции катода и анода, но обычно оно меньше чем примерно 2 В. Предпочтителен способ приложения электрода при постоянном напряжении, хотя можно применять другие способы.
Водный раствор двуокиси хлора и хлора, который обрабатывают в соответствии с настоящим изобретением, обычно представляет собой раствор, образованный посредством растворения в воде двуокиси хлора в потоке отходящего газа из генератора двуокиси хлора. Такой раствор содержит различную концентрацию хлора в зависимости от скорости потока воды в абсорбционную колонну и температуры воды, проходящей в абсорбционную колонну, а также различную концентрацию хлора, также зависящую от указанных факторов и парциального давления хлора в потоке отходящего газа из генератора. Обычно водный раствор двуокиси хлора и хлора содержит примерно от 0,01 до примерно 10 г/л хлора.
Катодное восстановление хлора, содержащегося в водном растворе двуокиси хлора и хлора, может осуществляться до любой заданной степени удаления в зависимости от конечного применения раствора. Обычно катодный электролиз является эффективным для быстрого уменьшения концентрации хлора до очень низких уровней.
Применяя критическую комбинацию параметров, можно избирательно, а если это требуется, то и полностью, удалять хлор из водного раствора двуокиси хлора и хлора прямо или косвенно при помощи электрохимического средства. Способ является ускоренным, причем он не требует больших капитальных затрат в сравнении с известным способом.
П р и м е р 1. Вольт-амперометрические исследования были проведены на водном растворе, содержащем примерно 1,5 г/л двуокиси хлора и имеющем рН 1,1; применяли вращающийся платиновый дисковый электрод, имеющий площадь поверхности 0,196 см3, для реакции Сl2 ->> 2Cl-. Электрод вращался со скоростью 400 об/мин, во время электролитического восстановления.
На фиг. 1 представлен график зависимости тока для восстановления от приложенного потенциала и результаты.
Как можно видеть, потенциал, при котором происходит восстановление хлора, достаточно отличается от потенциала, при котором происходит восстановление двуокиси хлора при применении платинового материала с низким перенапряжением.
Из этих данных можно также увидеть, что избирательное удаление хлора происходит при этих значениях рН при применении катода с низким перенапряжением только в узком пределе приложенного потенциала от +0,8 до 1,2 В в сравнении с насыщенным каломельным электродом.
П р и м е р 2. Вольт-аперометрические исследования из примера 1 повторили для различных значений рН раствора.
Как можно увидеть, изменение значения рН в сторону более щелочных значений смещает потенциал, при котором происходит электролитическое восстановление хлора, до более отрицательных значений (в сравнении с насыщенным каломельным электродом), тогда как потенциал для электролитического восстановления двуокиси хлора остается неизменным. Это данные также демонстрируют проведение прямого восстановления предпочтительно при значениях рН меньше 2.
П р и м е р 3. Вольт-амперометрические исследования из примера 1 повторили, применяя стекловидный угольный катод с перенапряжением для реакции Сl2 __→ 2Сl- примерно 0,5 В при различных значениях рН.
Как можно увидеть, применение катода с высоким перенапряжением не позволяет проводить прямое электролитическое восстановление хлора, хотя химическое восстановление хлора посредством электролитически образованного хлорита может достигаться при достаточно различных условиях электродного потенциала.
П р и м е р 4. В этом примере показано косвенное удаление хлора из водных растворов двуокиси хлора и хлора при применении катода с высоким перенапряжением.
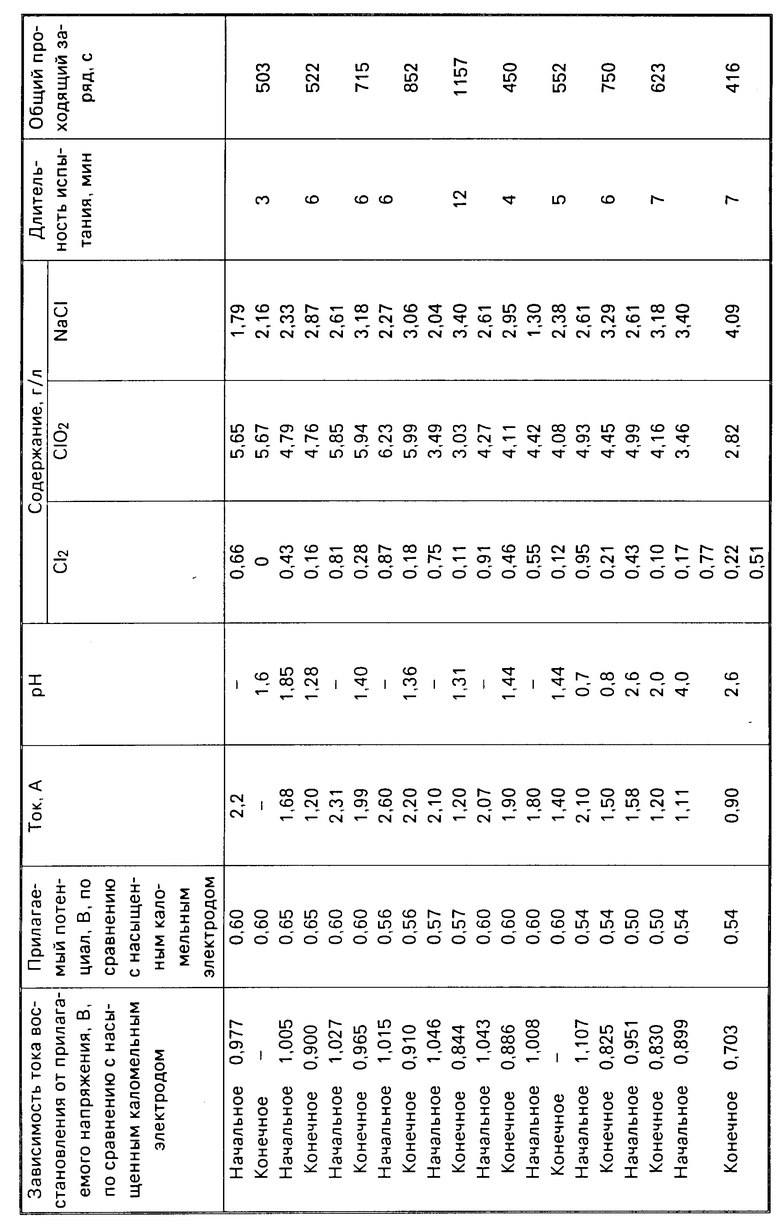
Провели ряд электролитических экспериментов, в которых водный раствор из двуокиси хлора и хлора обработали в катодной камере с разделенной катионообменной мембраной электролитической ячейкой, работающей в обтекаемом режиме. Катодная камера имела трехмерный сетчатый стекловидный угольный электрод, снабженный токоподводом ПSA. Катод имел поверхностные размеры: длина 17, ширина 3,3 и толщина 0,3 см. Анодная камера имела стекловидный угольный анод и электролиз проводили в потенциостатическом режиме при катодном потенциале, установленном в диапазоне ограничения образования тока для процесса восстановления СlO2.Анолит представляет собой серную кислоту 0,5 н. при этом скорость каждого анолита и католита составляла 140 мл/мин. Мембрана была изготовлена из NAFION (торговая марка Дю Понт материала для мембраны типа перфторированной сульфокислоты).
Полученные результаты представлены в таблице. Как можно видеть из представленных в таблице данных, удаление хлора достигалось быстро и эффективно, особенно при высоком содержании двуокиси хлора и низком значении рН. Потери двуокиси хлора изменялись от нуля до примерно 10% демонстрируя избирательность процесса электролиза.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения диоксида хлора | 1988 |
|
SU1836493A3 |
| Электрохимический способ получения двуокиси хлора | 1988 |
|
SU1836492A3 |
| СПОСОБЫ ПОЛУЧЕНИЯ ДИОКСИДА ХЛОРА | 1991 |
|
RU2112817C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВОДНОГО ПОДКИСЛЕННОГО РАСТВОРА, СОДЕРЖАЩЕГО ХЛОРАТНЫЕ ИОНЫ, СПОСОБ ЭЛЕКТРОХИМИЧЕСКОЙ ОБРАБОТКИ ВОДНОГО РАСТВОРА СМЕСИ СОЛЕЙ ЩЕЛОЧНЫХ МЕТАЛЛОВ, СПОСОБ ПОЛУЧЕНИЯ ДВУОКИСИ ХЛОРА | 1991 |
|
RU2108413C1 |
| ЭЛЕКТРОД ДЛЯ ЭЛЕКТРОХИМИЧЕСКИХ ПРОЦЕССОВ, ЭЛЕКТРИЧЕСКАЯ ЯЧЕЙКА, СПОСОБ ПОЛУЧЕНИЯ ХЛОРА И ЩЕЛОЧИ И МНОГОКАМЕРНЫЙ ЭЛЕКТРОЛИЗЕР | 1990 |
|
RU2092615C1 |
| АНОД ДЛЯ ВЫДЕЛЕНИЯ ХЛОРА | 2012 |
|
RU2561565C1 |
| СЕЛЕКТИВНОЕ ЭЛЕКТРОХИМИЧЕСКОЕ ВОССТАНОВЛЕНИЕ ГАЛОГЕНИРОВАННЫХ 4-АМИНОПИКОЛИНОВЫХ КИСЛОТ | 2001 |
|
RU2254401C2 |
| СПОСОБ ПОЛУЧЕНИЯ ДВУОКИСИ ХЛОРА | 1991 |
|
RU2067552C1 |
| Способ получения хлора и гидроокиси натрия | 1978 |
|
SU1584752A3 |
| СПОСОБ ПОЛУЧЕНИЯ ХЛОРА И ХЛОРСОДЕРЖАЩИХ ОКИСЛИТЕЛЕЙ И УСТАНОВКА ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2005 |
|
RU2315132C2 |
Хлор селективно электролитически удаляется посредством катода из водных растворов хлора и двуокиси хлора, используя потенциал электрода при рН водного раствора примерно до 4. Хлор электролитически восстанавливается до ионов хлорида, в то время как концентрация двуокиси хлора остается такой же в обработанном растворе. Восстановление хлора осуществляется прямо при величинах рН примерно до 2, используя катод с низким перенапряжением, и косвенно при величинах рН примерно до 4, используя катод с высоким перенапряжением. 1 табл.
СПОСОБ ОЧИСТКИ ВОДНОГО РАСТВОРОВ ДВУОКИСИ ХЛОРА ОТ ХЛОРА, отличающийся тем, что, с целью увеличения степени очистки, очистку ведут электрохимически с подачей исходного раствора при рН 0,7 4 на пористом катоде при потенциале последнего -0,6.+1,2 В относительно каломельного электрода сравнения.
| Патент США N 3854901, кл | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Планшайба для точной расточки лекал и выработок | 1922 |
|
SU1976A1 |
Авторы
Даты
1995-08-27—Публикация
1987-10-28—Подача