Изобретение относится к органической химии, а именно к 2-пропил-3-(5-нитрофурфурилиден)амино-4(3Н) хиназолону формулы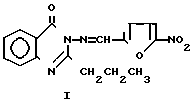
(I) проявляющему противостафилококковую и анальгетическую активность, что позволяет предполагать возможность его применения в медицине в качестве препарата комбинированного действия.
Ближайшим структурным аналогом заявляемому соединению формулы I является 2-бензилоксиметил-3-(3-толил)-4(3Н)-хина- золон, проявляющий противомикробную активность на штаммы золотистого стафилококка и спороносной культуры, общей формулы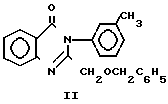
(II)
Вещество аналог II получают при взаимодействии 2-хлорметил-3-(3-толил)-4(3Н)-хинозолона с бензилатом натрия при кратковременном нагревании по следующей схеме: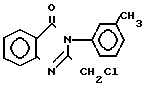 +NaOCH2C6H5 ___→
+NaOCH2C6H5 ___→ 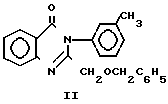
Целью изобретения является поиск соединений, обладающих высокой противостафилококковой и анальгетической активностью в ряду 4(3Н)-хиназолона.
Указанная цель достигается синтезом 2-пропил-3-(5-нитрофурфурилиден)амино-4-(3Н)-хиназолона формулы I при взаимодействии 2-пропил-3-амино-4(3Н)-хиназолона, полученного по известным способам, с 5-нитрофурфуролом при кратковременном нагревании на водяной бане в течение 1 ч по следующей схеме: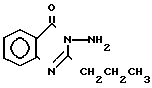 +
+  C
C NO2___→
NO2___→ 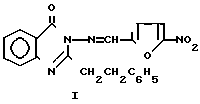
Соединение I представляет собой кристаллическое вещество желтого цвета, хорошо растворимо в диоксане, изопропаноле, диметилсульфоксиде, не растворимо в воде.
П р и м е р. 2-Пропил-3-(5-нитрофурфурилиден)амино-4(3Н)-хиназолинон.
К раствору 0,01 моль (2,03 г) 2-пропил-3-амино-4(3Н)-хиназолона в 15 мл изопропанола добавляют 0,01 моль (1,41 г) 5-нитрофурфурола в 10 мл изопропанола, 4 капли концентрированной HCl. Реакционную смесь нагревают на водяной бане в течение 1 ч, после охлаждения выпадает обильный желтый осадок, который отфильтровывают, сушат, перекристаллизовывают из смеси изопропанола и диоксана (4:1).
Выход 53%
Найдено, С 58,81; Н 4,44; N 17,3.
С16H14N4O4.
Вычислено, С 58,89; Н 4,32; N 17,17.
Т.пл. 156-8оС.
ИК-спектр, см-1 (вазелиновое масло) 1660, 1600, 1485, 1460, 1400, 1376, 1330.
ПМР-спектр (σ, м.д. внутренний стандарт ГМДС, растворитель d-ДМСО); 0,9 (СН3); 1,63 (СН2); 2,7 (СН2); 7,67 (Ar); 9,1 (=СН).
Изменения в структуре предлагаемого соединения формулы I по сравнению с веществом аналогом II приводит к появлению высокой противостафилококковой активности в отношении эталонных штаммов золотистого стафилококка и появлению нового вида действия анальгетической активности. Соединения с сочетанием таких видов активности являются перспективными и могут быть использованы при лечении воспалительных заболеваний микробной этиологии.
Полученное соединение I было исследовано на противостафилококковую, анальгетическую активности и острую токсичность.
Противостафилококковую активность вещества определяли методом последовательных разведений. Исследуемое вещество 1 растворяли в диметилсульфоксиде в соотношении 1:100 и разводили мясопептонным бульоном до соотношения 1:500.
Бактериостатическую активность изучали методом последовательных разведений полученного раствора в МПБ по отношению к эталонным штаммам золотистого стафилококка. При этом использовали смыв суточной культуры выращенной на мясопептонном агаре стерильным физиологическим раствором хлорида натрия и готовили исходное разведение с концентрацией 500 млн. микробных тел в 1 мл смыва. Полученную смесь разводили таким образом, чтобы бактериальная нагрузка на 1 мл жидкости составляла 250 000 микробных тел, с соответствующим разведением исследуемого вещества. Через 18-20 ч (tо 36-37оС) регистрировали наличие роста или отсутствие такового за счет бактериостатического действия препарата. За действующую дозу принимали минимальную ингибирующую концентрацию (МИК) препарата (мкг/мл), которая задерживала рост бактериальных культур (см. табл.1).
Острую токсичность заявляемого соединения I изучали экспресс-методом по В. Б. Прозоровскому на белых мышах массой 16-22 г при внутрибрюшинном введении. Испытывались различные дозы: от доз, не вызывающих гибели животных до доз, дающих 100%-ный смертельный исход. Соединение вводили в виде взвеси в 2%-ной крахмальной слизи. Наблюдение за животными проводилось в течение суток, регистрировалось количество погибших животных. Установлено, что ЛД50 соединения I равна 890,0 (650,4 1196,8) мг/кг (см. табл.1-2).
Анальгетическая активность исследуемого соединения I оценивалась по двум тестам: методике "горячая пластинка" и "уксусным корчам". Исследование проведено на белых мышах обоего пола, массой 16-23 г. О наличии анальгетической активности по тесту "горячей пластинки" судили по изменению чувствительности животных к термическому раздражению лап. Тестирование проводили через 30, 60, 120 и 180 мин после введения исследуемого вещества. Результаты опытов подвергались статистической обработке. В качестве препарата сравнения взят анальгин, широко применяемый в медицине в дозе 50 мг/кг. Данные эксперименты представлены в табл.2, из которой видно, что заявляемое соединение I обладает выраженным анальгетическим действием по данному тесту. Это действие проявляется уже через 30 мин после введения вещества, достигает своего максимума пика действия через 1 ч и продолжается в течение 3 ч.
Заявляемое соединение I статистически достоверно удлиняет время оборонительного рефлекса у животных на пике действия (через 1 ч) в сравнении с анальгином. Сравнение проводилось по методу однофакторного дисперсионного анализа на "Электронике ДЗ-90".
Влияние заявляемого вещества I на болевую чувствительность при химическом раздражении изучалось по методике "уксусные корчи". Мышам внутривенно вводится 3% -ный раствор уксусной кислоты из расчета 0,1 мл на 10 г массы. При этом у животных возникали судорожные сокращения брюшных мышц, сопровождающиеся вытягиванием задних конечностей и прогибанием спицы. Соединение I вводили перорально в дозе 50 мг/кг за 1 ч до исследования. Эффективность анальгетического действия соединения I оценивалась по способности его уменьшать количество корчей у животных в сравнении с контролем 3%-ным раствором уксусной кислоты. Подсчет велся в течение 20 мин.
Данные эксперимента представлены в табл.3, из которой видно, что соединение I вызвало защиту уксусных корчей у 50% взятых в опыт животных и уменьшило количество этих "корней" в сравнении с контролем в 3,2 раза.
Из табл. 1 видно, что заявляемое соединение I превосходит по противостафилококковой активности эталон сравнения этакридина лактат в 8333,3 раза; аналог по структуре в 260 раз, кроме того оно менее токсично, чем аналог по стpуктуpе в 1,14 раза, эталона сравнения в 12,7 раза.
Из табл.2, 3 видно, что заявляемое соединение I обладает выраженным анальгетическим действием и достигает пика через 1 ч и продолжается в течение 3 ч, превосходя по этому показателю медицинский препарат анальгин в 1,5 раза на пике действия по тесту "горячей пластинки". Кроме того, оно оказывает действие и по тесту "уксусные корчи", что говорит о выраженности анальгетического эффекта.
Исходя из изложенного, заявляемое соединение 2-пропил-3-(5-нитрофурфурилиден) амино-4(3Н)-хиназолинон проявляет высокую противостафилококковую и анальгетическую активность и может найти практическое применение в медицине в качестве лекарственного средства, при лечении заболеваний микробной этиологии.
| название | год | авторы | номер документа |
|---|---|---|---|
| 5-Нитрофурфурилиденгидразид 5-бром-N-ацетилантраниловой кислоты, проявляющий анальгетическую и противостафилококковую активность | 1987 |
|
SU1499890A1 |
| Перхлораты 1-бензил-2-метил-3-арил-4(3Н)-хиназолинония, обладающие анальгетической и противомикробной активностью | 1981 |
|
SU1014231A1 |
| Диметоксибензилсульфопроизводное хиназолин-4(3Н)-она, обладающее анальгезирующей, противопаркинсонической, анксиолитической, психостимулирующей активностью | 2021 |
|
RU2758333C1 |
| ПРИМЕНЕНИЕ 4,7-ДИМЕТИЛ-2-(ПРОП-1-ЕНИЛ)-3,4,4a,5,8,8a-ГЕКСАГИДРО-2Н-ХРОМЕН-4,8-ДИОЛА В КАЧЕСТВЕ АНАЛЬГЕЗИРУЮЩЕГО СРЕДСТВА | 2009 |
|
RU2418578C1 |
| Перхлораты 1-[(2 @ ,4 @ )- или (3 @ ,4 @ )-диметоксибензил)]-2-метил-3-(4 @ -хлорфенил)-4(3Н)-хиназолинония, проявляющие анальгетическую, противосудорожную и противомикробную активность | 1983 |
|
SU1110140A1 |
| 2-бензилпроизводное 4-(3Н)хиназолинона, обладающее анальгезирующим, противопаркинсоническим, антигипоксантным, транквилизирующим действием | 2019 |
|
RU2715884C1 |
| 3-МЕТИЛ-6-(ПРОП-1-ЕН-2-ИЛ)ЦИКЛОГЕКС-3-ЕН-1,2-ДИОЛ В КАЧЕСТВЕ АНАЛЬГЕЗИРУЮЩЕГО СРЕДСТВА | 2009 |
|
RU2409351C1 |
| 1-ГЕКСАДЕЦИЛ-4,6-ДИМЕТИЛ-2-ОКСОНИКОТИНАМИД, ПРОЯВЛЯЮЩИЙ ПРОТИВОВОСПАЛИТЕЛЬНУЮ И АНАЛЬГЕТИЧЕСКУЮ АКТИВНОСТЬ | 2008 |
|
RU2396258C2 |
| Применение 4-[1-(4-метилфенил)аминоэтилиден]-5-фенил-1-цианометилтетрагидропиррол-2,3-диона в качестве анальгетического средства | 2023 |
|
RU2806330C1 |
| 3-МЕТИЛ-6-[1-ЭТИЛ-2- α -(5-НИТРОФУРФУРИЛИДЕН)]-ГИДРАЗИНОУРАЦИЛ, ОБЛАДАЮЩИЙ ДЕЙСТВИЕМ ПРОТИВ СТАФИЛОКОККОВ И БАЦИЛЛ | 1988 |
|
SU1547275A1 |
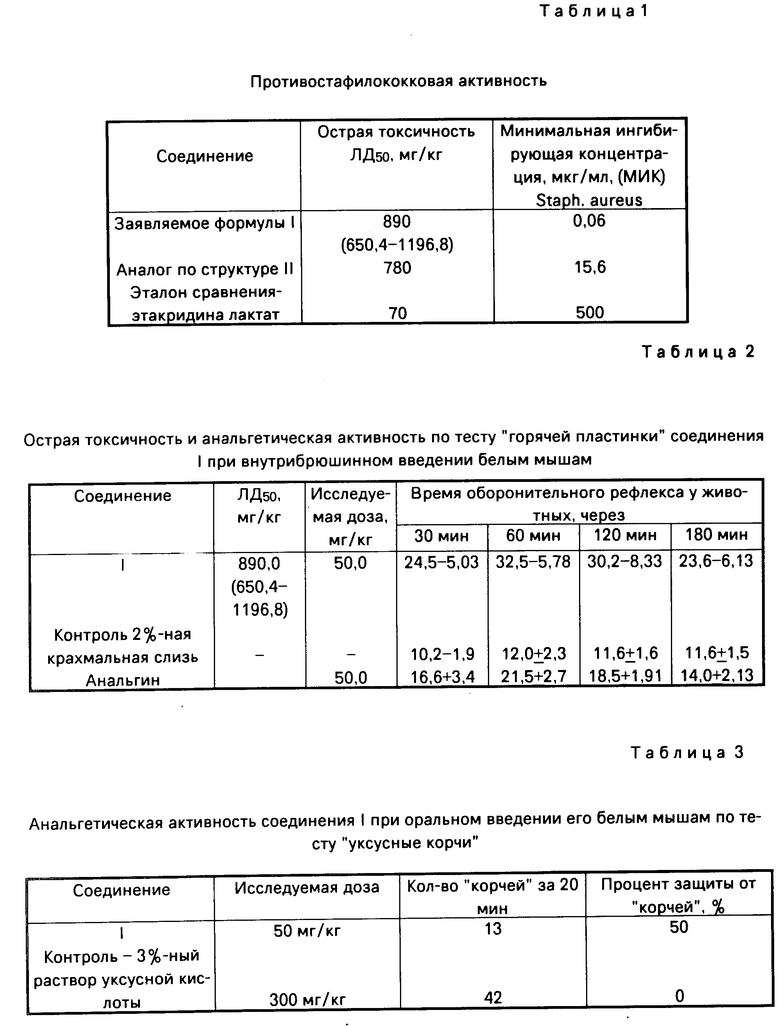
Использование: в медицине для лечения воспалительных заболеваний микробной этиологии. Сущность изобретения: продукт: 2-пропил-3- (5-нитрофурфилден)амино- 4(3H)-хиназолинон формулы I 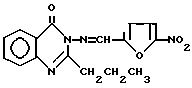 . Б. Ф. C16H14N4O4. Выход 53% Т. пл. 156 8°С. Реагент 1: 2-пропил-3-амино-4-(3H)хиназолон, реагент 2: 5-нитрофурфурол. Условия: нагревание в среде изопропанола в присутствии концентрированной HCl. 3 табл.
. Б. Ф. C16H14N4O4. Выход 53% Т. пл. 156 8°С. Реагент 1: 2-пропил-3-амино-4-(3H)хиназолон, реагент 2: 5-нитрофурфурол. Условия: нагревание в среде изопропанола в присутствии концентрированной HCl. 3 табл.
2-Пропил-3(5-нитрофурфурилиден)амино-4(ЗН)-хиназолинон формулы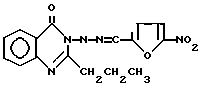
проявляющий противостафилококковую и анальгетическую активность.
| М.Л | |||
| Беленький | |||
| Элементы количественной оценки фармакологического эффекта | |||
| Рига | |||
| Из-во АН Латв | |||
| ССР | |||
| Устройство станционной централизации и блокировочной сигнализации | 1915 |
|
SU1971A1 |
Авторы
Даты
1995-09-10—Публикация
1991-07-01—Подача