Целью изобретения являются новые производные перхлоратов 1-Г(2 ,4 )иди (3,4)г-диметоксйбензш1)1-2-метил-3-арнл-4(ЗН)-хиназапинония, обладающие более высокой анальгетической активностью и наряду с этим противо1кикробной и противосудорожной активностью о Поставленная цель достигается соединениями общей формулы 1, обладающими анальгетической,;, противосудорожной и противомикробной активностью, которые получают внутримолекулярной циклизацией А-хлорфениламида N-Pueтил-Н-(2 ,4)-или (З ,4) -диметокси бензилантраниловой кислоты при 30-ми нутном нагревании в метиловом спирте в присутствии 48-57%-ной хлорной 1агслоты. Целевые продукты представляют .собой желтого цвета кристаллические вещества, трудно растворимые в спирте, толуоле, хлороформе, хорощо - в диметилсульфоксиде. Строение получен ных соединений подтверждается спект..роскопическими данными. В ИК-спектpaix соединений прописываются следующие характеристически,е полосы: 17151735 см ( группа у ароматичест кого цикла), 1300-1310 (), интенсивная полоса в области 1110 см обусловлена валентными колебаниями перхлоратаниона. П р и Ч.М е р 1. 4-Хпорфениламид N-(2 ,4 )-диметоксибензилиденантраниловой кислоты. К раствору 2.,47 г (0,01 моль) 4-хлорфениламида антраниловой кислоты в 10 мл этанола при перемешивании в 2 приема приливают 1,66 г (0,01 моль 2,4-диметоксибе нзальдегида в 7 мл этанола, поддерживая температуру реакционной смеси 36°С, оставляют пр комнатной температуре на 30 мин, затем вьщепивщийся осадок отсасывают,i промывают на фильтре 10 мл охлажденн го этанола, рушат. Длинные иглы, окрашенные в желтый цвет, с . 192194°С. Вькод 98,2%. Найдено,%: С 67,02; Н 4,91; .N.7,04. .. C H jClNgO. Вьгчислено,%: С 66,92; Н 4,85; N 7,09. IlK-cneKTp, (вазелиновое масло): 1678, 1615, 1552, 1500, 1470, 1330, 1287, 1220. П р и м е р 2. 4-Хлорфениламид N-(3 ,4 )-диметоксибензнлиденантраниловой кислоты. К раствору 2,47 г (0,01 моль) 4-хлорфениламида антраниловой кислоты в 10 ма этанола при перемешивании в 2 приема приливают раствор 1,66 г (0,01 моль) 3,4-димеГоксибензальдегида в 7 мл этанола, поддертшвая температуру реакционной смеси , оставляют при комнатной температуре на 30 мин, вьшавший осадок отфильтровывают, промывают на фильтре 10 мл охлажденного этанола, сушат. Бесцветные кристаллы с т.пл, 132-134С. Выход 74,5%. Найдено,%: С 67,03; Н 4,99; N 7,02. C2.,gClNiO 3. Вычислено,%: С 66,92; Н 4,85; N 7,09. ИК-спектр,см (вазелинове масло): 1675, 1638, 1605, 1522, 1470 1322,. . 1280, 1165. Пример 3. 4-Хлорфениламид -(2,4)-диметоксибензилантраниловой.. кислоты. 1,95 г (0,005 моль) 4-хлррфенш1амида N-(2,4)-диметоксибензилиденантраниловой кислоты и 0,2 г (0,605i5 моль) боргидрида натрия хорощо перемешивают до получения однородной массы в сухом виде, затем добавляют 25 мл этанола, охлажденного до . Реакционную смесь перемепивают при комнатной температуре 2 ч, затем .нагревают на водяной бане 15 мин, фильтруют. Фильтрат подкисляют 10%-ным раствором уксусной кислоты до слабокислой реакции по лакмусу. Выпавший осадок отфильтровывают перекристаллизовьшают из этанола. Бесцветные иглы с т.пл. 118-120 С. Выход 68,6%. Найдено,%: С 66,61; Н N 7,11. C 2Hz|ClN203. Вычислено,%: С 66,58; Н 5,33/ , ИК-спектр, см (вазелинове масло): 3425, 1642, 1515, 1478, 1305, 1218, 1162. П р и м е р 4. 4-Хлорфениламид N-(3 ,4)-диметоксибензилантрашшовой кислоты. 1,95 г (0,005 моль) 4-хлорфениламида Н-(3,4)-диметоксибензш1иден антраниловой кислоты и 0,2 г
(0,0055 моль) боргидрида натрия хорошо перемешивают до получения однородной массы в сухом виде, затем добавпют 25 МП этанола, охлалденного до О С. Реакционную смесь перемекивают при комнатной температуре 2 ч, затем нагревают на водяной бане 15 мин, фильтруют о Фильтрат подкисляют 10%ным раствором уксусной кислоты до слабокислой реакции по лакмусу. Вы пав1ний осадок отфильтровывают, перекристаллйзовывают из этанола. Бесцвеные иглы с т.пл. 170-173Ci Выход 53., 7%..
Найдено,%: С 66,71; Н 5,20, N 7,18.ч
СггН.
Вычислено,%: С 66,58; Н 5,33; N 7,06.
ИК-спектр, см (вазелиновоемасло) 3263, 1632, 1580, 1520, 1471, 1423, 1270, 1165. .
П р и м а р 5. 4-Хлорфениламид К-ацетил-Ы-(2,4 )-диметоксибёнзилантран11г.авой кислоты.
3,96 г (0,01 моль) 4-Хлорфе НИЛ амида N-(2,4)-диметоксибензиланТраниловой кислоты в 10 МП уксусного ангидрида нагревают на водяной бане 45 мин, после охлаждения приливают 50 МП .воды и нейтрализуют безводным :карбонатом натрия до щелочной реакции среды по лакмусу. Выпавший осадок отфип.ьтровывают, промывают на фильтре 150 МП воды, сугаат, перекристаллизовывают из этанопа. Бесцветные кристалпы с т.пп. 180-182 0. Выход 57,6%.
Найдено,%: С 65,7; Н 5,35;
N 6,41.
С24Н2эС1Н204.Вычислено,%: С 65,68; Н 5t28; N 6,38.
ИК-спёктр, (вазелиновое масло :3260, 1648, 1543, 1500, 1470, 1410, 1320.
Прим ер 6. 4-Хлорфениламид -Ы-ацетил-Ы-(3,4)-димeтoкcибeнзшIaнтipaнилoвoй кислоты.
3,96 г (0,01 моль) 4-хлорфениламида N-(3,4)-диметоксибензилантр аниловой кислоты в 8 мп уксусного ан гидрида нагревают на водяной бане 45 hMH, после охлаждения приливают 50 МП воды и нейтрализуют безводным карбонатом до щелочной реакции среды по лакмусу. Выпавший осадок отфильтрвывают, промывают на фильтре 150 мд
воды, сушат, перекрис.таллизор1л1в.1ют из этансжа. Бесцветные призмы с т.пл. 143-145°С. Выход 67,5%,
НайденоД: С 65,66; Н 5,25; N 6,37.
С24Н„С1Ы2,04.
Вычислено,%: С 65,68; Н 5,28; N 6,38.
ИК-спектр, .см (вазелиновое масло 3282, 1645, 1510, 1.483, 140(0, 1300, 1282.
Пример 7. Перхлорат | (2 ,4 )-диметоксибеияилТ-2-ме1ил-3- (4 -хлорфенил)-4(ЗН)-хиназолинония.
4,38 г (0,01 моль) 4-хлорфениламида Ы-ацвтил-М-(2 ,4)-диметоксибензилантраниловой кислоты растворяют в 30 МП метанола, добакпяют 1,76 г (0,01 моль) 57%-ной хлорной кислоты и выдерживают на водяной бане при температуре 70-80 с в течение 30 мин Затем отгоня-ют 15 мп метанола, выделившийся осадок отфильтровывают, промывают на фильтре 2 раза по 5 МП метанола. Кристаллизуют из абсолютного метанола. Призмы, окрашенные в желтый цвет, с т.пл. 236-238 0. Выход 90%.
Найцено,%: С 55,48; Н 4,13; N 5,49.
с 4 ггС1гК20г..
Вычислено,%: С 55,29; Н 4,25; N 5,37.
ИК-спектр, см (па.-елинове масло) 1722, 1660, 1590, 1498, 1470, 1305, 1110.
П р и м ё р 8. Перхлорат 1-(3 ,4 диметоксибензил -2-метил-3-(4. -хлорфенил)-4(ЗН) хиназопинония.
4,38 г (0,01 моль) 4-хлорфениламида Ы-ацетил-Ы-(3,4) 2-диметоксибензилантраннповий кислоты растворяют в 30 мл метапопа, добавпяют 1,76 (0,01 моль) 57%-ной Х1 орной кислоты и выдерживают на водяной бане при темп;ературе 70-80С в течение 30 мин Затем отгоняют 15 МП метанола, вьщелившийся осадок отфильтровывают, промывают на фильтре 2 раза по 5 мп метанола. Кристаллизуют из абсолютного метанола. Призмы, окрашенные в, желтый цвет, с т.пл. 268-270 с. Выход 83f,7%.
Найдено,%: С .55,36; Н 4,32; N 5,21.
C,j,Hi4ClzN207.
Вычислено,%: С 55,29; Н 4,25; N 5,37.
Предлагаемые соединения испытаны на острую токсичность, анальгетическую активность по известной.методике, противосудорожную активность - по тесту максимального электрошока и коразояовых судорог, антимикробную активность Методом последовательных разведений.
Для опредепения бактериостатической активности исследуемое вещество растворяли. в этиловом сгщрте в соотношении 1:100 и разводили мясопептонным бульоном (МПБ) до соотношения 1.:500. Бактериостатическую активность изучали по Отношению к эталонным штамм М золотистого стафилококка (грам.положительные бактерии) и кишечной палочки (грамотрицательные бактерии)i При этом использовали смыв суточной культуры, вьгращенной на мясопептонном агаре, стерильным физиопогическим раствором хлорида натрия и готовили исходное разведение с концентрацией 500 мпн. микробных тел в 1 мл смьша по бактериальному стандарту. Полученную смесь разводшти стерильным МПБ в 100 раз. Это разведение бакте:риальной культуры с концентрацией 5 кйн. микробньк тел в 1 мп и было рабочим раствором. 0,1 мл рабочего раствора вносили в 2 мл МПБ, содержащего соответствующее разведение исследуемого вещества. Таким образом, бактериальная нагрузка на 1 мл жидкости составляет 250000 микробных .тел. Результаты опытов учитьюалй после 18-20-часовой вьщержки контрольньк и опытных пробирок в термостате при Зб-ЗУ С, Регистрировали наличие роста бактериальных культур или отсутствие lero за Счет бактерИостатического;
действия препарата. За действующую дозу принимали минимальную ингибиру- К1Щую концентрацию (МРЖ) препарата (в мкг/мл)/которая задерживает рост ; бактериальньк культур.
Результаты исследований представлены В таблице, из которой следует:
Оба предлагаемых соединения малотоксичны, однако уступают аналогу по структуре..
Предлагаемые соединения обладают анальгетическими свойствами, превышающими таковые аналоги по структуре в 1,7 (для соединения 1) и в 1,3 (для соединения II), При этом соединения испытывали.в 2 раза меньшей дозе (1,5 от ЛД5о), чем аналог по структуре (2/5 от ). У предлагаемых соединений пик анальгетическогр действия приходится на первые 30-60 мин, в то время как у аналога по структуре максимальный эффект наблюдается только через 3 ч после введения препарата.
Соединения I и II в отличие от аналога по структуре проявляют вьфаженную противосудорожную активность при этом условная фармакологическая широта (УФШ - ЛДдо/ЕЯзо) для соединений I и it по ТМЭ равна 5,4 и 6,5; по коразоловому тесту - 7,5 и 11,2 соответственно.
Соединения I и II, как и аналог п структуре, в равной степени обладают антимикробной активностью в отношении грамположительных и грамотрицательных бактерий.
Таким образом, впервые синтезированные 1-р 2 ,4 )-диметоксибензил 2-метил З-(4 -хлорфенил)-А(ЗН)-хиназолинония и i:-P(3,4)-димeтoкcибeн:зилJ -2-метил-3-(4 -хлорфеннл) -4(ЗН)хиназолинония, несмотря на некоторое увеличение токсичности по сравнению с аналогом по структуре (перхлораты 1-бензил-2-метил-3-арил-4(ЗН)-хи назопинония) обладают более высокой анальгётичес ой активностью, .проявляющейся во вдвое меньшей дозе, чем у аналога по структуре таким же антимикробгалм ДвЙств1Ием. Изменения в химической структуре привели к появлению нового вида активности - противосудорожной которая у аналога по структуре отсутствует.
91110140
Бмопогическая активяость перхлоратов 4(ЗН)-хнкаэ.сшиноиия
10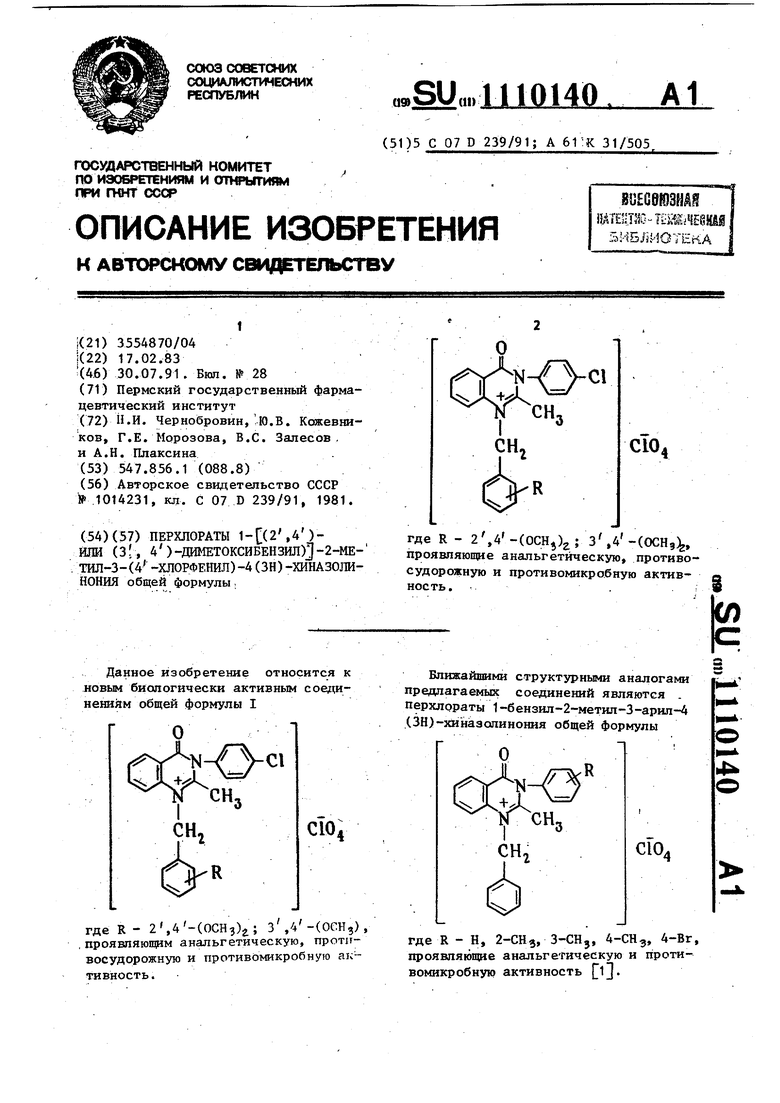




ПЕРХЛОРАТЫ 1-
8046
500 500
(63-124) (35-60)
В дозе 2/5 ЛП
SO
| Перхлораты 1-бензил-2-метил-3-арил-4(3Н)-хиназолинония, обладающие анальгетической и противомикробной активностью | 1981 |
|
SU1014231A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1991-07-30—Публикация
1983-02-17—Подача