Изобретение относится к вирусологии, биотехнологии и может найти применение при изготовлении различных тест-систем, предназначенных для диагностики вируса иммунодефицита человека 1-типа (ВИЧ-1).
К настоящему времени в лабораториях мира выделены десятки вариантов ВИЧ, отличающихся не только организацией генома, но и своими биологическими свойствами. В нашей стране выдано авторское свидетельство на штамм ВИЧ-1Zmb (ГКВ-878), выделенный в Белорусском НИИ эпидемиологии и микробиологии г. Минска. В производстве вирусного антигена также использовалась хронически инфицированная ВИЧ-1, перевиваемая моноцитарная линия клеток человека (ГКВ-4005). Тем не менее задача выделения высокопродуктивного штамма ВИЧ-1 остается актуальной, поскольку природные вирусные белки до настоящего времени используются в качестве основного компонента диагностических тест-систем, применяемых как для скрининга сывороток, так и для верификации диагноза.
Фирмы "Du Pont", "Аbbott" в США используют для тест-систем природный высокоочищенный антиген ВИЧ-1, получаемый при культивировании продуктивного штамма ВИЧ-1 (Н9/НТLV-IIIВ), депонированного в Американской коллекции АТСС под N СР18543. Этот штамм получен путем инфицирования предварительно отселектированных высокочувствительных к ВИЧ-1 клеток НТ концентрированной культуральной жидкостью, собранной после культивирования Т-лимфоцитов, полученных от больного СПИД. Н9/HТLV-IIIВ-штамм клеток, хронически инфицированный ВИЧ-1, может в течение длительного времени продуцировать вирус, но при снижении пролиферации клеток необходимо подсевать неинфицированные клетки. При культивировани и этого штамма существует риск вытеснения из культуры инфицированных ВИЧ-1 неинфицированными. Это требует постоянного контроля соотношении инфицированных и неинфицированных клеток в культуре.
Целью изобретения является получение отечественного штамма, пригодного для изготовления диагностических тест-систем. Цель достигается путем получения нового штамма ВИЧ-1, отличающегося от описанных ранее.
Получение штамма.
Штамм ВИЧ-1 N 1 (Л-88) выделен в 1988 году из мононуклеарных клеток периферической крови инфицированного ВИЧ-1 мужчины 40 лет с симптоматикой лимфоаденопатии (до применения химиотерапии). Клинический материал получен на базе клиники ЦНИИ эпидемиологии г. Москвы (инфекционная больница N 2), изоляция штамма проведена в отделе культивирования и диагностики ретровирусов НПО "Вектор". Штамм депонирован в Государственной коллекции вирусов Института вирусологии им. Д.И. Ивановского АМН СССР г. Москвы под номером ГКВ-4046 (удостоверение о депонировании от 08.02.91 N 68-12/206).
При получении данного штамма использованы методы сокультивирования первичной культуры лимфоцитов, выделенной из периферической крови инфицированного ВИЧ-1 человека по известному методу, и первичной культуры лимфоцитов, выделенной из периферической крови здорового донора, а также сокультивирования перевиваемой лимфоидной культуры клеток МТ-4 с первичной культурой лимфоцитов, выделенной из периферической крови инфицированного ВИЧ-1 человека.
После подтверждения вирусной продукции в сокультиватах по данным иммуноферментного анализа, непрямой иммунофлюоресценции, определения активности обратной транскриптазы и электронной микроскопии полученный материал исследовали путем заражения перевиваемых лимфоидных культур клеток МТ-4, Н-9, Hut-78, в которых также отмечалась вируспродукция, подтвержденная вышеназванными методами. На хранение заложены образцы на 14,27,34 пассажах.
Морфология штамма ГКВ-4046.
Штамм ГКВ-4046 относится к семейству ретровирусов, подсемейству лентивирусов, имеет характерный для ВИЧ морфогенез, обусловленный почкованием вирусных частиц через клеточную мембрану, размер зрелых вирусных частиц 110-120 нм с конусовидным нуклеоидом.
Свойства штамма.
По данным непрямой иммунофлюоресценции процент вируссодержащих клеток в популяции (при одноцикловом заражении) МТ-4 на 3-4-е cутки составляет 60-100% при жизнеспособности 60-45% в линии Н-9 на 4-5-е cутки 30-50% при жизнеспособности 54% в линии Hut-78 на 3-4-е cутки 50-75% при жизнеспособности клеток 60-56%
Специфичность ВИЧ-1 продукции в культурах лимфоидных линий клеток МТ-4, Н-9, Hut-78, инфицированных штаммов ГКВ-4046, подтверждена данными иммуноблота и электронной микроскопии.
Наиболее чувствительной культурой клеток для данного штамма вируса является перевиваемая лимфоидная культура клеток МТ-4. Так, по данным иммуноферментного анализа содержание антигена в культуральной жидкости на 4-е cутки культивирования составляет 1:512 1:1028.
Электрофоретический профиль вирусных белков штамма ГКВ-4046, наработанного на культуре клеток МТ-4, соответствует белковому спектру ВИЧ-1. Плотность вирусных частиц в градиенте сахарозы 1,16-1,18 г/см3, культуральная жидкость и препараты очищенного вируса проявляют активность обратной транскриптазы в присутствии ионов Mg++, cинтетической матрицы poli (rА) и праймера оligo (dТ). На перевиваемой культуре клеток МТ-4, инфицированной штаммом ГКВ-4046, проведено 55 пассажей (с периодическими заморозками).
В отличие от штамма ГКВ-878, где накопление до 10-8 происходит на 7-е cутки культивирования, средний титр штамма ГКВ-4046 в культуре клеток МТ-4 cоставляет 10-7-10-8 на 3-4-е cутки культивирования. В сравнении с хронически инфицированной ВИЧ-1 культурой клеток ГКВ-4005 штамм ГКВ-4046 также отличается более высоким уровнем накопления антигена на различных клеточных культурах и пригодностью для получения препаративных количеств очищенного вирусного антигена (табл.1).
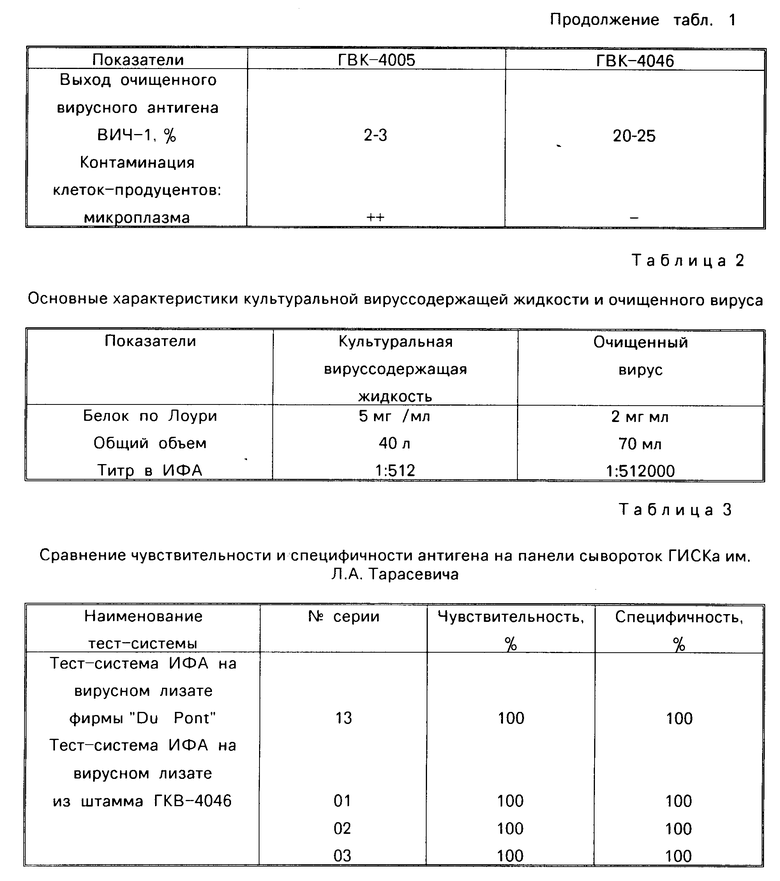
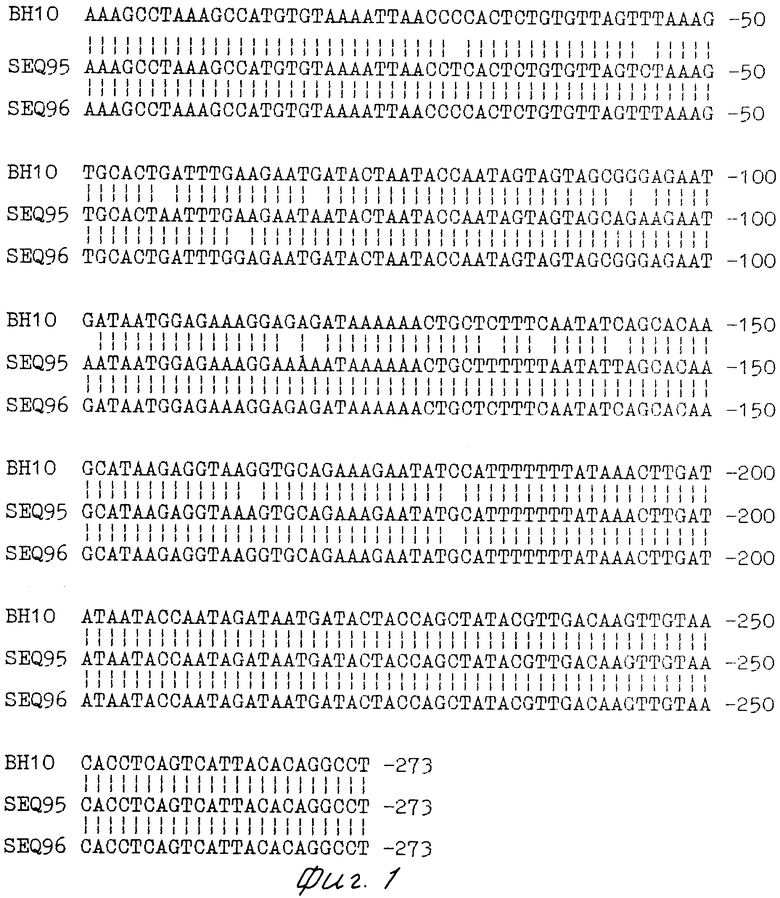
Первичная структура V1-, V2 и V3-областей гена ЕNV штамма ГКВ-4046 отличается от известных ранее штаммов ВИЧ-1 (фиг. 1 и 2). Условия хранения: температура жидкого азота.
Штамм ГКВ-4046 может использоваться для получения вирусного антигена, пригодного для использования в диагностических тест-системах.
Положительный эффект достигается благодаря следующим свойствам полученного штамма вируса: штамм вируса обеспечивает высокий и стабильный уровень вируспродукции, обеспечивает получение высокоочищенного вирусного антигена в препаративных количествах, не требует постоянного культивирования клеток-продуцентов и может храниться в течение длительного времени в замороженном состоянии.
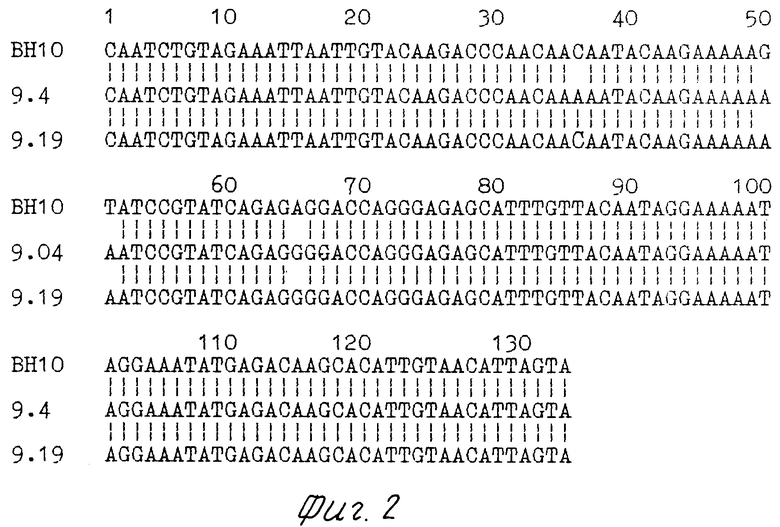
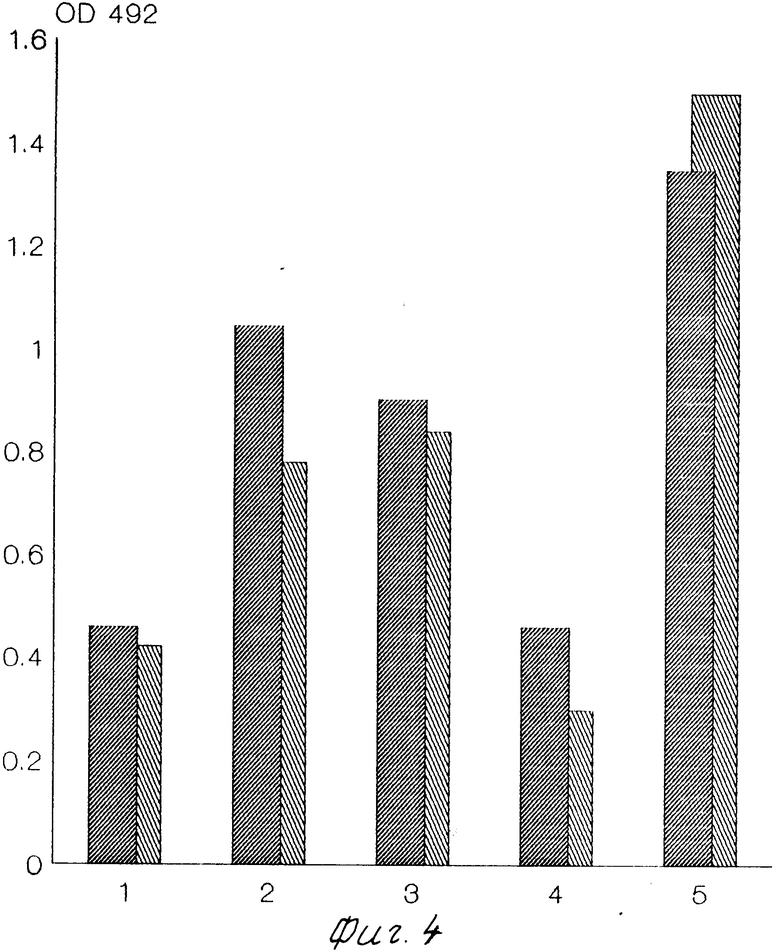
На фиг.1 приведено сравнение первичных структур гипервариабельных районов VI и V2 гена ЕNV изолята ВИЧ-1 ГКВ-4046; на фиг.2 сравнение первичных структур гипервариабельного района V3 гена ЕNV изолята ВИЧ-1 ГКВ-4046; на фиг.3 сравнение чувствительности и специфичности тест-систем на основе вирусного лизата фирмы "Du Pоnt"  и штамма ГКВ-4046
и штамма ГКВ-4046  панель сывороток составлена из двух негативных (NN 1,2), девяти ложнопозитивных (NN 4-12) и 29-ти позитивных сывороток (NN 13-41); на фиг.4 сравнение чувствительности тест-систем на основе вирусного лизата фирмы "Du Pоnt"
панель сывороток составлена из двух негативных (NN 1,2), девяти ложнопозитивных (NN 4-12) и 29-ти позитивных сывороток (NN 13-41); на фиг.4 сравнение чувствительности тест-систем на основе вирусного лизата фирмы "Du Pоnt"  и штамма ГКВ-4046
и штамма ГКВ-4046  на фиг.5 показано связывание антител эталонных анти-ВИЧ-1-сывороток с белками вируса иммунодефицита человека 1-типа ГКВ-4046.
на фиг.5 показано связывание антител эталонных анти-ВИЧ-1-сывороток с белками вируса иммунодефицита человека 1-типа ГКВ-4046.
Приведенные примеры раскрывают сущность изобретения.
П р и м е р 1. Определение накопления вируса в различных клеточных культурах.
Клетки МТ-4 в концентрации 1,9-2,1˙106 мл инфицируют штаммом ГКВ-4046 с множественностью 10-30 инфекционных вирусных частиц на клетку. Адсорбцию проводят при 37оС в течение 1 ч. После этого клетки разводят культуральной средой (RPMI 1640 c 10% сыворотки плода коров) до конечной концентрации 0,9-1,1˙106 мл и культивируют роллерно-суспензионным способом при скорости вращения 1 об/мин и температуре 37оС.
По данным непрямой иммунофлюоресценции максимум вируспродукции (70-100% инфицированных клеток при жизнеспособности 45-80%) достигает на 3-4-е сутки после заражения в отличие от культуры клеток МТ-4, зараженной инокулятом из ГКВ-4005 или ГКВ-878, в которой максимум вируспродуцирующих клеток (60-75%) наблюдается лишь на 6-7-е сутки культивирования. По данным иммуноферментного анализа (тест-системы "Вектор" и "Аbbоtt") содержание антигена в клеточной фракции МТ-4, инфицированной штамм ГКВ-4046, на 3-и cутки культивирования при раститровке обнаруживаются в разведении осадка из 1 мл суспензии 1:512 (в отличие от прототипа, где содержание антигена обнаруживается в разведении 1: 128 на 5-е cутки при тех же условиях культивирования и тестирования). По данным электронной микроскопии в образцах культуры клеток МТ-4, инфицированной ВИЧ-1, обнаружен высокий уровень вирусной продукции: продуцируют вирус 80-90% клеток, представленных на ультратонком срезе. Вирусные частицы имеют характерную для ВИЧ-1 морфологическую структуру: округлую форму, диаметр 100-130 нм, конусовидную сердцевину. Внутреннее пространство вириона, окружающее нуклеоид, содержит материал низкой электронной плотности (его плотность существенно ниже плотности нуклеоида).
При инфицировании клеточных линий Н-9, Hut-78 штаммом ГКВ-4046 при тех же условиях, что и для клеток МТ-4, по данным непрямой иммунофлюоресценции процент вируссодержащих клеток составляет для линии Н-9 на 4-5-е cутки 30-50% при жизнеспособности 54% и для линии Hut-78 на 3-4-е cутки 50-75% при жизнеспособности клеток 60-56%
П р и м е р 2. Определение первичной структуры провирусной ДНК.
Для получения фрагментов провирусной ДНК изолята ВИЧ-1 применяют цепную полимеразную реакцию (ЦПР). Были выбраны гипервариабельные районы V1, V2, V3 гена ЕNV, в нуклеотидных и аминокислотных последовательностях которых зарегистрированы значительные межштаммовые вариации. Использованные праймеры содержат на своих 5-концах сайты узнавания для рестриктаз BamHI, PstI и BglII, HindIII, обеспечивающие возможность эффективного клонирования амплифицированных фрагментов. В качестве вектора для клонирования используют плазмиду pMТL21, содержащую протяженный полилинкер и позволяющую проводить высокоэффективную селекцию рекомбинантных клонов.
Для проведения ЦПР используют набор "Амплификация" производства НПО "Ферментас" и пары праймеров:
для района V1-V2
5/ GAGGATCCAATCAGTTTATGGGATC 3/ и 5/ GGCTGCAGGTCAAAGGATACCTTTGGAC 3/,
для района V3
5/ AТAGATCTGTAGCAATTAACTGTACAAGGCC 3/ и 5/ AATCAAGCTTACTAATATTACAATGTGCTTG 3/.
ДНК из культуры клеток выделяют по известной методике с дочисткой изопикническим центрифугированием в градиенте плотности СsCl/ЕtBr. Клонирование амплифицированных фрагментов проводят по BamHI-PstI- и BglII-HindIII-сайтам соответственно в векторе рMТL21. После электропорации клеток Е.coli и отбора рекомбинантных клонов плазмидную ДНК выделяют методом Бирнбойма-Доли. Первичную структуру проклонированных фрагментов определяют методом Сэнгера с использованием набора "Сиквенс II" производства НПО "Ферментас". Обработку полученных данных проводят с помощью программных пакетов "PC/Gene" (Intelligenetics), "Dnasis" и "Prosis" (Pharmacia-LKB).
Результаты секвенирования двух независимых клонов, полученных после амплификации и клонирования района V1-V2, представлены на фиг.1. При сравнении полученных структур с данными литературы обнаружено, что структуры проклонированных фрагментов отличаются от ранее описанных. По сравнению со штаммом ВН10 в клоне 9.6 содержатся две точечные замены (в положении 113 замена А на G и в положении 180 замена С на G), приводящие к заменам аминокислот Lys на Glu и Pro на Alа соответственно.
Клон 9.5 содержит 14 точечных замен по сравнению с ВН10:
С на Т в положении 30, Т на С в положении 45,
G на А в положении 57, G на А в положении 69,
G на A в положении 93, G на A в положении 95,
G на А в положении 101, G на А в положении 117,
G на А в положении 119, С на Т в положении 133,
С на Т в положении 137, С на Т в положении 143,
G на А в положении 164, С на G в положении 180, приводящих к восьми заменам аминокислот:
Prо на Ser в положении 10, Asp на Asn в положении 19,
Asp на Asn в положении 23, Gly на Arg в положении 31,
Met на Ile в положении 33, Glu на Lys в положении 39,
Ser на Phe в положении 44, Pro на Alа в положении 60.
Результаты секвенирования района V3 в клонах 9.4 и 9.19 представлены на фиг. 2. Оба клона содержат замены GТ на АА в положении 50 и 51, приводящие к аминокислотной замене Ser на Lуs; А на G в положении 66, не приводящая к аминокислотной замене. Кроме того, в структуре клона 9.4 имеется замена С на А, которая приводит к аминокислотной замене Аsn на Lys.
Полученные данные показывают, что изолят ВИЧ-1 ГКВ-4046 является оригинальным штаммом ВИЧ-1.
П р и м е р 3. Получение препарата очищенного вируса.
Для очистки используют культуральную жидкость на 4-е cутки после инфицирования клеток МТ-4 штаммом ГКВ-4046 с множественностью 10-30 инфекционных вирусных частиц на клетку. Посевная концентрация клеток составляет 0,9 1,1˙106 мл. Очистку проводят по стандартной методике в линейном градиенте сахарозы 0-60% при 70000 g, длительность центрифугирования 18 ч.
Выход вируса составляет около 20% от общего содержания вирусного антигена в культуральной жидкости (табл.2). Электрофоретический профиль вирусных белков штамма ГКВ-4046 соответствует белковому спектру ВИЧ-1.
Полученные результаты демонстрируют пригодность штамма ГКВ-4046 для полученного очищенного вирусного антигена в препаративных количествах.
П р и м е р 4. Пригодность антигена для диагностических тест-систем.
Для определения пригодности штамма ГКВ-4046 в диагностических тест-системах проводят оценку чувствительности и специфичности диагностикума, изготовленного с использованием лизата вирусных белков (получение описано в примере 3). Чувствительность диагностикума оценивают на нескольких панелях серопозитивных к ВИЧ-1 сывороток, а также по сравнительному определению титров эталонных анти-ВИЧ-1-сывороток. Специфичность системы определяют на панели донорских сывороток, не содержащих антител к ВИЧ.
Для сравнения используют вирусный лизат фирмы "Du Pоnt" (фиг.3). Сорбцию лизатов на планшеты из полистирола проводят в разведении 1:1000 в 0,05 М карбонатном буфере рН 9,6. Полученные данные показывают, что тест-система на основе вирусного лизата из предлагаемого штамма по чувствительности (100%) и специфичности (100%) не уступает антигену фирмы "Du Pont". Данные по сравнению чувствительности антигена, полученного при использовании штамма ГКВ-4046, c антигеном фирмы "Du Pont" представлены на фиг.4. Оценка чувствительности двух антигенов в коммерческой тест-системе "Антиген" (использовали все компоненты набора, кроме планшет) была проведена на микропанели из пяти референс сывороток в разведении 1:400 (разведение антигена 2 и антигена Du Pont при сорбции 1:1000).
При сравнении с тест-системой "Антиген" (изготовленной на вирусном лизате фирмы "Du Pоnt") c использованием стандартной панели ГИСКа установлено, что вирусный лизат, приготовленный на основе этого штамма, позволяет получить тест-систему с аналогичной чувствительностью и специфичностью (табл.3). Это демонстрирует пригодность полученного антигена для производства коммерческой тест-системы.
Также проведена оценка пригодности антигена, полученного при культивировании штамма ГКВ-4046, для изготовления тест-системы иммуноблот. Полоски с иммобилизованными белками вирусного лизата получают по традиционной схеме, включающей разделение вирусных белков электрофорезом в 13%-ном полиакриламидном геле и перенос их на нитроцеллюлозную мембрану. Исследование проводят с использованием панели аттестованных на наличие антител к ВИЧ-1 положительных сывороток. Отмечено полное совпадение картины распределения специфически окрашенных зон (фиг.5) с паспортными данными эталонных анти-ВИЧ-1-сывороток.

Использование: в вирусологии, медицине. Сущность изобретения: Штамм ВИЧ 1 ГКВ 4046 выделен в 1988 г. из мононуклеарных клеток периферической крови инфицированного ВИЧ 1 мужчины 40 лет с симптоматикой лимфоаденопатии (до применения химиотерапии). Наиболее чувствительной культурой клеток для данного штамма вируса является перевиваемая лимфоидная культура клеток МТ 4. По данным иммуноферментного анализа содержание антигена в культуральной жидкости на 4-е сутки культивирования составляет 1:512 1:1028. Штамм может стабильно пассироваться на перевиваемой культуре клеток МТ 4, инфицированной штаммом ГКВ -4046, проведено 55 пассажей. Средний титр штамма ГКВ 4046 в культуре клеток МТ 4 составляет 10-7-10-8 на 3 4-е сутки культивирования. Штамм ГКВ 4046 характеризуется высоким уровнем накопления антигена на различных клеточных культурах Н 9, Hut 78 и пригодностью для получения препаративных количеств очищенного вирусного антигена. Продемонстрирована пригодность полученного антигена для производства коммерческой тест-системы для диагностики ВИЧ-инфекции. Электрофоретический профиль вирусных белков штамма ГКВ 4046, наработанного на культуре клеток МТ 4, соответствует белковому спектру ВИЧ 1. Первичная структура V1-, V2- и V3-областей гена ENV штамма ГКВ 4046 отличается от известных штаммов ВИЧ 1. 3 табл. 5 ил.
Штамм вируса иммунодефицита человека I типа ГКВ 4046, используемый для приготовления диагностических тест-систем.
| Popovic M., Sarngadharan M.G., Real E., Gallo R.E | |||
| Detection, isolation and continuos production of cytopathic retroviruses HTLVIII from pateint with AIDS and pre-AIDS | |||
| Science, 1984, v.224, p.497 - 500. |
Авторы
Даты
1995-10-20—Публикация
1992-07-31—Подача