Изобретение относится к медицинской микробиологии, генетической инженерии, биотехнологии и может быть использовано для обнаружения патогенных энтеробактерий, обладающих фактором колонизации CFA I, методом молекулярной гибридизации.
Известны рекомбинантные плазмиды, содержащие фрагменты генов оперона СFA I, но ДНК-зонды на фактор колонизации CFA I, аналогичные CFb-фрагменту при патентно-информационном поиске не выявлены.
Для получения CFb-фрагмента выделяют методом Birnboim, Dolly тотальную плазмидную ДНК штамма Escherichia coli H10407 (штамм из коллекции Государственного института стандартизации и контроля иммуно-биологических препаратов). Плазмидную ДНК гидролизуют эндонуклеазой рестрикции Pst I, полученные фрагменты воссоединяют с Pst I гидролизатом плазмиды pGEM4Z (коммерческим вектором фирмы Promega, США) с помощью ДНК-лигазы фага Т4, лигированной смесью трансформируют клетки лабораторного штамма Е.соli ТG I. Штаммы, содержащие рекомбинантную плазмиду с фрагментом ДНК оперона CFA I, отбирают по результатам гибридизации со специфическим олигонуклеотидным зондом СF I. Рекомбинантную плазмиду выделяют, гидролизуют эндонуклеазой Pst I, продукты гидролиза разделяют в агарозном геле. Фрагмент плазмидной ДНК с размером около 0,9-1 тысяч пар нуклеотидов извлекают из геля методом электроэлюации и очищают методом фенольной депротеинизации.
Изобретение иллюстрируется следующими примерами.
П р и м е р 1.
1.1 Конструирование плазмиды pCFA 1-226-источника получения фрагмента CFb.
Синтез ДНК-зонда происходит в процессе репликации рекомбинантной плазмиды за счет репликона pGEM4Z.
1 мкг ДНК вектора pGEM4Z гидролизуют рестриктазой Pst I (1 ед. акт.) 1 ч при 37оС в буфере VII следующего состава: 0,01 М трис pH 8,0; 0,006 М MgCl2; 0,006 М меркаптоэтанол; 0.4 М NaCl. Полноту гидролиза контролируют электрофорезом аликвоты (1/10 части) реакционной смеси в 0,8%-ном агарозном геле.
3 мкг суммарной плазмидной ДНК штамма Е.соli Н10407 гидролизуют рестриктазой Рst I (3 ед акт) 1 ч при 37оС в буфере VII.
Плазмидную ДНК (1 мкг) и суммарную плазмидную ДНК Е.соli Н1047 (3 мкг) лигируют в 30 мкл буфера (0,66 мМ трис-HCl pH 7,6; 50 мМ MgCl2; 10 мМ АТФ; 50 мМ дитиотреитола; ДНК-лигаза 3-10 ед активности) в течение 15-18 ч при 12-14оС. Реакцию лигирования контролируют электрофорезом в 0,8%-ном агарозном геле.
Лигазной смесью трансформируют штамм Е.сoli TG 1. Выбор штамма обусловлен тем, что в присутствии плазмиды pGEM4Z он способен синтезировать фермент β-галактoзидазу за счет комплементации дефектного хромосомного гена 5'-концевым фрагментом гена, находящегося на плазмиде. Эта способность штамма не проявляется в присутствии рекомбинантных плазмид со встроенным по Hind III сайту фрагментом ДНК, длина которого не кратна трем, из-за сдвига рамки считывания β-галактозидазы. Клоны с такими рекомбинантными плазмидами, не обладающие β-галактозидазной активностью, отбирают на индикаторной среде с хромогенным субстратом ХgaI по отсутствию голубой окраски.
После трансформации E. сoli TG 1 лигазной смесью культуру высевают на чашки с LB агаром, содержащим 200 мкг/мл ампициллина, 40 мкг/мл XgaI и 240 мкг/мл индуктора β-галактозидазы ИПТГ. Через 14-20 ч на чашках вырастают голубые и белые колонии трансформантов.
1.2. Отбор и анализ рекомбинантных клонов со специфическими последовательностями оперона СFA I.
Поиск клонов, несущих рекомбинантную плазмиду с Pst I фрагментом ДНК оперона CFA I размером 950 пар нуклеотидов, осуществляют по результатам гибридизации со специфическим олигонуклеотидным зондом CF I (данный олигонуклеотид выбран на основании результатов сиквенса фрагмента оперона CFA I). Для этого белые колонии транcформантов с помощью репликатора пересевают на капроновые фильтры, находящиеся на поверхности МПА в чашках Петри. Фильтры с выросшими колониями бактерий денатурируют в растворе 0,5 М NaOH, 1,5 М NaCl, нейтрализуют в растворе 0,5 М трис-HCl, 1,5, М NaCl pH 8,0, отмывают в растворе 2хSSC и отжигают в вакуумном шкафу при 80оС и давлении -1 атмосфера. После этого фильтры гибридизуют с олигонуклеотидным зондом CF I, гомологичным первым 20 нуклеотидам кодирующей области гена cfa B. Последовательность зонда 5'-АТGAAATTTAAAAAAACTAT-3'. Зонд предварительно метился изотопом фосфора Р-32 с помощью полинуклеотидкиназы фага Т4. Из штаммов, гибридизовавшихся с олигонуклеотидным зондом, выделяют методом Birnboim, Dolly плазмидную ДНК и проводят определение нуклеотидных последовательностей вставок методом Сэнгера в модификации Мак-Гро. Секвенирование Pst I фрагмента показало, что он представляет собой часть оперона CFA I, нуклеотиды с 1 по 484 относятся к некодирующей части оперона, нуклеотиды с 485 по 950 к кодирующей области гена cfaB.
П р и м е р 2. Использование CFb-фрагмента в качестве зонда для выявления ДНК оперона фактора колонизации CFA I и бактерий, продуцирующих фактор колонизации CFA I.
2.1. Получение радиоактивного зонда для выявления штаммов энтеробактерий, продуцирующих фактор колонизации CFA I.
Выделяют рекомбинантную плазмиду pCFA 1-226 методом Birnboim и Doly. Штамм Е. coli TG I с рекомбинантной плазмидой выращивают в колбе со 100 мл мясо-пептонного бульона с ампициллином в концентрации 200 мкг/мл на качалке при аэрации 200 об/мин, температуре 37оС до концентрации 3˙108 клеток в 1 мл (оптическая плотность 0,6 о.е.), добавляют хлорамфенекол до концентрации 170 мкг/мл и инкубируют еще 18-20 ч. Бактериальные клетки осаждают центрифугированием 6 тыс. об/мин 15 мин. Осадок промывают 10 мл 0,9% раствора NaCl, после чего переосаждение повторяют. Осадок ресуспендируют в 10 мл раствора 20 mM Tris HCl pH 8,0; 10 mM ЭДТА; 50 mM глюкоза, добавляют 10 мл раствора 0,2 N NaOH; 1% SDS и осторожно перемешивают 10-15 мин до полного лизиса бактериальной массы. К лизату добавляют 15 мл 5 М ацетата К (pH 4,8) перемешивают, переворачивая центрифужную пробирку (должен выпасть белый хлопьевидный осадок). Центрифужную пробирку помещают на 1 ч в лед, затем лизат центрифугируют 40 мин при 5-5,5 тыс. об/мин и температуре 4оС. Супернатант отбирают в чистую центрифужную пробирку и добавляют к нему 2 объема 96% этилового спирта, перемешивают и сразу центрифугируют при 5-5,5 тыс. об/мин 15 мин. Спирт сливают (осторожно, чтобы не выпал осадок). Осадок растворяют в 10 мл 0,3 М ацетата Na pH 8,0, добавляют 2 объема 96%-ного этилового спирта, выдерживают 1 ч при 4оС и центрифугируют при 5-5,5 тыс. об/мин. Спирт сливают, после испарения остатков спирта осадок растворяют в 3 мл бидистиллированной воды. Для удаления примесей РНК к раствору плазмидной ДНК добавляют СаСl2 до конечной концентрации 50 mM и выдерживают во льду 1 ч (должен выпасть осадок), центрифугируют при 10 тыс, об/мин 10 мин. Супернатант отбирают, ДНК переосаждают добавлением ацетата калия (pH 4-8) до концентрации 0,1 М и 2 объемов 96% этилового спирта. Осадок ДНК растворяют в 3 мл буфера 0,1 М Tris HCl pH 8,0; 50 mM NaCl; 2,5 mM ЭДТА и добавляют равный объем фенола, насыщенного аналогичным буфером, перемешивают на миксере или вручную 10 мин и центрифугируют при 4оС, 10 тыс. об/мин 5 мин. Верхнюю фракцию, содержащую плазмидную ДНК, отбирают в чистую центрифужную пробирку, ДНК переосаждают ацетатом К и 96%-ным этиловым спиртом, центрифугируют при 4оС, 10 тыс. об/мин 5 мин, спирт сливают, осадок промывают 3 мл 96%-ного этилового спирта. Центрифугирование повторяют, спирт сливают, после испарения остатков спирта осадок растворяют в 5 мл 0,1 М ацетата К, добавляют 2-3 объема этилового спирта и выдерживают при (-20)оС 1,5 ч. Пробирку с осадком плазмидной ДНК центрифугируют при 4оС, 10 тыс. об/мин 5 мин, супернатант сливают. Осадок ДНК дважды по 5 мин промывают 5 мл 80%-ного этилового спирта и один раз 5 мл 96% этилового спирта (между промывками и после третьей промывки проводят центрифугирование), спирт сливают, осадок подсушивают до испарения спирта и растворяют 1 мл ТЕ-буфера или бидистиллированной воды.
Для выделения зонда 10 мкг плазмидной ДНК гидролизуют в объеме 100 мкл рестриктазой Pst I (20-40 ед акт) в буфере VII в течение 1 ч при 37оС. Полноту гидролиза проверяют электрофорезом аликвоты 0,2 мкг рестрикционной смеси в 0,8% агарозном геле. Затем оставшуюся рестрикционную смесь разделяют электрофоретически в 0,8% агарозном геле. Извлечение из агарозного геля нужного фрагмента ДНК проводят электроэлюцией, для этого перед нужной полосой ДНК скальпелем вырезают в геле ванночку. Она должна быть на 2 мм больше длины и ширины полосы ДНК. Заполняют ванночку свежим электрофорезным буфером и продолжают электрофорез, через каждые 2-3 мин буфер из ванночки отбирают, заполняют ее свежим буфером. Электрофорез продолжают до тех пор, пока вся ДНК из геля не переместится в буфер. Элюат экстрагируют дважды насыщенным фенолом и по одному разу смесью 1х1 насыщенный фенол хлороформ и хлороформом (процедуры экстракции аналогичны экстракции насыщенным фенолом плазмидной ДНК, описанной выше). ДНК осаждают добавлением 2 объемов 96%-ного этилового спирта. Осадок растворяют в 200 бидистиллированной воды, добавляют 25 мкл 3 М ацетата Na, pH 5,2, и снова осаждают 2 объемами 96% этилового спирта. Осадок промывают 1 раз 70% этиловым спиртом, просушивают и растворяют в 100-200 мкл бидистилированной воды или ТЕ-буфера, pH 7,6.
Мечение зонда изотопом Р-32 проводят методом ник-трансляции. Для этого упаривают водно-спиртовый раствор 32 Р dNTP, содержащий 100 пмоль вещества в 1,5 мл микроцентрифужной пробирке. В пробирку добавляют раствор ДНК зонда, содержащий 1 мкг ДНК; 1 нмоль каждого из немеченных dNTP (1 мкл 1 мМ раствора); 5 мкл 10х кратного буфера для ник-трансляции состава 0,5 М трис-HCl, pH 7,2, 0,1 M Mg2SO4, 1 мМ дитиотрейтол и 500 мкг/мл бычьего сывороточного альбумина, бидистиллированную воду из расчета, чтобы общий объем реакционной смеси после добавления всех компонентов составил 50 мкл; 0,5 мкл раствора ДНКазы 1 концентрации 0,1 мкг/мл (ДНКазу разводят 1х буфером для ник-трансляции, содержащим 50% глицерин). После этого реакционную смесь перемешивают, добавляют к ней 5 единиц активности ДНК-полимеразы 1 и перемешивание повторяют. Инкубируют при 16оС 1 ч. Реакцию останавливают добавлением 2 мкл 0,5 М ЭДТА. Ник-транслированную ДНК отделяют от невключившейся метки на микроколонке с сефадексом G-50 medium обычной хроматографией. Радиоактивность разных фракций, полученных после хроматографии, измеряют на счетчике β-радиоактивности и определяют процент включившихся 32-Р dNTP.
2.2. Выявление с помощью CFb-фрагмента ДНК оперона CFA I и энтеробактерий, продуцирующих фактор колонизации CFA I.
В связи с тем, что в СНГ не имеется коммерческих тест-систем для выявления бактерий, обладающих фактором колонизации CFA I, основанных на ИФА или ДНК-зондах, результаты, полученные при гибридизации с созданным ДНК-зондом сравнивали с результатами, полученными при выявлении фактора адгезии методом Д-маннозорезистентной гемагглютинации. Данный метод не может рассматриваться как альтернатива методам, основанным на использовании ДНК-зондов или иммунодиагностикумам, поскольку он позволяет лишь косвенно судить о наличии адгезивной активности по способности бактерий агглютинировать эритроциты в присутствии Д-маннозы. Данный методом применим для изучения чистых культур, довольно трудоемок и не позволяет исследовать большое количество образцов.
CFb-фрагмент апробирован при изучении распространения оперона CFA I на коллекции штаммов энтеробактерий различных по видовой принадлежности и происхождению. Исследовано 148 штаммов.
18-ти часовые культуры исследуемых микроорганизмов в объеме 100 мкл вносят в лунки плашки репликатора и штампом делают реплики на круглые нитроцеллюлозные фильтры диаметром 80 мм, предварительно помещенные в чашки Петри на поверхность 2% мясо-пептонного агара. Чашки с фильтрами инкубируют при 37оС в течение 16-18 ч. Бактериальные колонии на фильтре денатурируют, помещая фильтр в раствор 0,5 М NaOH, 1,5 M NaCl на 5 мин, для нейтрализации щелочи фильтр переносят в раствор 1,5 М NaCl, 0,5 M трис-HCl, pH 8,0 на 5 мин, после чего фильтр промывают в двукратном SSC (30 мМ цитрат Na; 0,3 M NaCl) 5 мин. Фильтры переносят на фильтровальную бумагу и просушивают при комнатной температуре, затем помещают между двумя листами сухой бумаги и прогревают 2 ч при 80оС в вакуумной печи. Отожженные фильтры помещают в кювету с промывающим раствором 50 мМ трис-HCl, pH 8,0; 1 M NaCl; 1 мМ ЭДТА; 0,1% SDS и инкубируют 1-2 ч при 42оС со слабым перемешиванием (количество промывающего раствора должно быть таким, чтобы фильтры свободно перемещались относительно друг друга и не слипались). Отмытые от остатков питательной среды и бактерий фильтры помещают по 1-2 шт в чистые полиэтиленовые пакеты, в каждый пакет добавляют по 2 мл раствора для предгибридизации состава 5х раствора Денхардта (0,5 г фикола, 0,5 г поливинилпирролидона, 0,5 г бычьего сывороточного альбумина на 500 мл воды); 6х SSC (90 мМ цитрат Na, 0,9 М NaCl) 0,1% SDS, 100 мкг/мл денатурированной высокомолекулярной эукариотической ДНК. Из пакетов удаляют воздух, пакеты герметизируются. Фильтры в пакетах инкубируют 4 ч при 68оС. Из пакетов удаляют выдавливанием раствор для предгибридизации, добавляют по 1 мл свежего раствора для предгибридизации и денатурированную кипячением радиоактивную ДНК зонда (не менее 200 тыс. импульсов/мин на фильтр). Проводят удаление воздуха и герметизацию пакетов, фильтры в пакетах инкубируют при 68оС 18 ч. После завершения гибридизации фильтры извлекают из пакетов, для удаления невключившейся радиоактивной метки фильтры промывают: 3-4 раза по 5-10 мин в буфере 2х SSC; 0,1% SDS при комнатной температуре и 2 раза по 1 ч в буфере 1х SSS; 0,1% SDS при 68оС. Фильтры переносят на лист фильтровальной бумаги и высушивают при комнатной температуре. Фильтры заворачивают в лавсановую пленку и прикрепляют к одному из усиливающих экранов в рентгеновской кассете. В кассету закладывают рентгеновскую пленку и экспонируют ночь (при необходимости более продолжительное время) при (-70)оС. После проявления высушенную пленку совмещают с фильтрами в кассете и определяют месторасположение положительных проб, давших засветку.
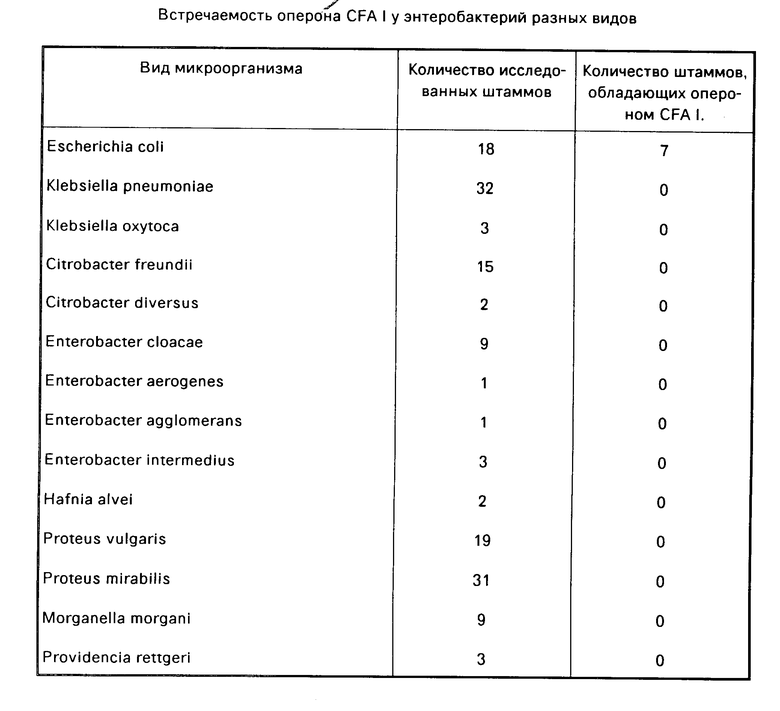
Результаты исследования энтеробактерий разных видов на наличие фактора колонизации CFA I приведены в таблице.
С помощью CFb-фрагмента оперон CFA I выявлен у семи штаммов Е. coli и не обнаружен у других видов энтеробактерий. Результаты согласуются с данными, полученными при использовании метода Д-маннозорезистентной гемагглютинации.
Результаты исследований показывают, что данный фрагмент может быть использован для выявления энтеробактерий, обладающих фактором патогенности адгезином CFA I. ДНК зонд CFb позволяет с высокой специфичностью и чувствительностью исследовать одновременно большое количество проб на наличие ДНК оперона CFA I. Изобретение может применяться для совершенствования схемы индикации патогенных энтеробактерий.
Использование: биотехнология, генная инженерия. Сущность: получение фрагмента ДНК из природной плазмиды Escherichia coli H 104407, который используется для выявления патогенных энтеробактерий, обладающих фактором колонизации CFA I. Размер фрагмента составляет 950 п. н. причем нуклеотиды 1 484 относятся к некодирующей части оперона CFA I, а нуклеотиды 485 950 - к кодирующей области гена с faB. Данный фрагмент применяется в качестве ДНК-зонда для выявления генов оперона CFA I и для индикации штаммов энтеробактерий, обладающих фактором колонизации CFA I. 1 табл.
ФРАГМЕНТ ДНК CFb, ИСПОЛЬЗУЕМЫЙ ДЛЯ ВЫЯВЛЕНИЯ ЭНТЕРОБАКТЕРИЙ, ОБЛАДАЮЩИХ ФАКТОРОМ КОЛОНИЗАЦИИ CFA 1, выделенный из природной плазмиды Escherichia coli штамма H 10407, имеющий размер 950 п.н. и следующую последовательность нуклеотидов, указанную в описании.
| Аналогов в патентной и научно-технической литературе не обнаружено. |
Авторы
Даты
1995-12-10—Публикация
1992-12-21—Подача