Изобретение относится к медицине, генетической инженерии и биотехнологии.
Ротавирусы являются этиологическим агентом острого гастроэнтерита, поражают преимущественно детей раннего возраста и молодняк животных, вызывают в осенне- зимний период до 70% случаев острых ки-- шечных инфекций неясной этиологии. Разработка современных способов выявления ротавирусов имеет большое научно-практическое значение, так как своевременная диагностика важна для выбора правильной стратегии лечения больного и необходима для проведения
эпидемиологического изучения инфекции, вызванной ротавирусами.
Ротавирусы характеризуются широкой вариабельностью и многообразием генетических вариантов, что определило существование различных групп, субгрупп и серотипов ротавируса. Существующие в настоящее время иммуноферментные тест-системы, основанные на групповом и субгрупповом антигенах, не позволяют выявить все многообразие вариантов ротавирусов. Кроме того, иммуноферментный метод при анализе проб стула больных ро- тавирусным гастроэнтеритом дает определенный процент ложноположительных результатов. Одним из наиболее чувствительных и специфических методов индикации вирусов является метод молекулярной гибридизации.
Геном ротавирусов состоит из II сегментов двунитевой РНК. Известно, что гены, кодирующие неструктурные белки (ГНБ), могут гибридизоваться с РНК различных штаммов ротавируса.
Установлено, что степень гомологии одного и того же ГНБ у разных штаммов рота- вируса может колебаться от 74 до 88%. Разброс в чувствительности по отношению к разным штаммам ротавируса связан с ди- вергенцией нуклеотидных последовательной генов.
Кроме того, показано, что при применении в качестве зонда ДНК комплементарной РНК вирусов, циркулирующих в разных географических регионах, возможно отсутствие выраженного гибридизационного сиг- нала из-за дивергенции нуклеотидных п осл едовател ь ностей,
В связи с этим создание эффективного зонда для выявления в клиническом материале ротавирусов человека, циркулирующих на определенной территории предполагает использование РНК, доминирующих на данной территории штаммов.
Известны рекомбинантные плазмиды, содержащие фрагменты ДНК, комплементарные ГНБ ротавирусов обезьян (штамм SA11) свиней (штамм OSU) и крупного рогатого скота (штамм UK), созданные на ос- нов-е вектора pBR 322. Использование данных гибридных плазмид для выявления ротавирусов человека неэффективно, так как они несут фрагменты генетического материала штаммов ротавируса, гетероло- гических по отношению к ротавирусам человека.
Известен способ конструирования гибридных плазмид, содержащих ДНК, комплементарные сегментам генома ротавируса.
При конструировании в качестве вектора использовалась плазмида pBR 322. Клонирование проводилось в Pst сайт данной плазмиды. Известно, что при использовании такого способа конструирования 50% целевых плазмид теряют Pstl-сайт, в результате чего возникают сложности получения клонированной последовательности. Известен способ получения рекомбинант- ных плазмидных ДНК на основе вектора pUC. Однако неизвестна возможность применения такого способа при клонировании фрагментов ДНК, комплементарных генам ротавируеов, кодирующим неструктурные белки.
Известны штаммы Escherichia coli, содержащие рекомоинантные плазмиды с кДНК ГНБ ротавирусов обезьян и животных. Использование этих клеток в качестве продуцентов гибридизационного , зонда для выявления ротавирусов человека нецелесообразно в связи с тем, что содержа- щийся в них генетический материал недостаточно эффективно гибридизуется с РНК ротавирусов человека (1,2).
Цель изобретения - создание штамма Escherichia coli-nредуцента ДНК-зонда для выявления ротавирусов человека.
Поставленная цель достигается тем, что:
A.Выделяют днРНК ротавируса человека, доминирующего на территории РСФСР.
Б. Синтезируют ДНК фрагмент JRV7-II, комплементарный 7-му сегменту генома ротавируса человека, кодирующему неструктурный белок.
B,Конструируют плазмиду pRV7-ll, в которой синтезированный фрагмент кДНК встроен в Pst сайт полилинкера плазмиды pUC 9.
Г. Предлагают способ конструирования рекомбинантной плазмиды pRV7-ll, позволяющий введение ДНК, комплементарной 7-му сегменту генома ротавируса человека в Pst сайт плазмиды pUC 9.
Д. Создают штамм Escherichia coli, содержащий плазмиду pRV7-ll-пpoдyцeнт универсального зонда для выявления ротавирусов человека.
Сущность предлагаемых объектов изобретения состоит в следующем.
А, ДНК-зонд dRV7-ll для выявления ро- таеирусов человека представляет собой Pstl-Pstl фрагмент ДНК, гомологичный 7-му сегменту РНК генома ротавирусов человека. Фрагмент имеет размер 1,113 т.п.н., первичная последовательность представлена на фиг. 2. ДНК-зонд dRV7HI гибридизуется с РНК штаммов ротавируса, имеющих разные типы миграции РНК.
Синтез ДНК зонда dRV7-ll осуществляется в процессе репликации плазмиды pRV7-ll за счет участка инициации репликации плазмиды pUC 9.
Б. Плазмида pRV7-ll (фиг.1) состоит из:
- Pstl-Pstl фрагмента ДНК (dRV7-ll) размером 1,113 т.п.н. с определенной последовательностью;
-Pstl-Pstl фрагмента ДНК векторной плазмиды pUC 9 размером 2,671 т.п.н. и имеет:
уникальные сайты рестрикции для эндо- нуклеаз , Smal, Xmal. Bam HI, Sal Gl, Accl. Hincl. Hindlll;
два сайта рестрикции для эмдонуклеазы Pstl;
три сайта рестрикции для эндонуклеазы Haell;
orl репликации плазмиды pUC 9. селективный маркер Арг:
область, кодирующую а -пептид ft -ra- лактозидазы, синтез которого инактивиро- ван встройкой dRV7-ll фрагмента кДНК.
В. Сущность способа конструирования рекомбинантной плазмиды заключается в том, что к -концам смеси синтезированных фрагментов кДНК генома ротавируса человека с помощью терминальной трансфера- зы присоединяют по 20-30 остатков цитозина. Аналогично к вектору pUC 9, гид- ролизо ванному по Pstl сайту, присоединяют 20-30 остатков гуанина. Затем полученные таким образом ДНК вектора и фрагмента сплавляют. Полученной смесью ДНК трансформируют клетки Escherichia coll Z85 и выращивают при 37°С на среде, содержащей ампицилин, бром-хлор-индо- лилгалактозид и изо-пропил-тиогалактозид. Отбирают клоны, образующие колонии белого цвета, из которых выделяют плазмиду ДНК и идентифицируют целевую плазмиду по гибридизации с седьмым сегментом РНК ротавируса человека.
Г. Штамм продуцент ДНК-зонда для выявления ротавирусов человека получают трансформацией клеток E.coli Z 85 с помощью рекомбинантной плазмиды pRV7-ll.
Штамм бактерий Escherichia coll, содержащий плазмиду pRV7-ll, депонирован во Всесоюзной коллекции микроорганизмов под № В KM CR-317D, характеризуется следующими признаками.
Морфологические признаки. Клетки прямые, палочковидные (1,2-1.6 х 2.0 х х 6,0 мкм), подвижные, имеют перитрихи- альные жгутики, грамотрицательные, неспороносные.
Культуральные признаки. Клетки хорошо растут на обычно используемых питательных средах. На 1.5% питательном агаре Дифко колонии гладкие, серые, бестящие. края ровные, мутные. При выращивании в жидких средах -мясопептонном бульоне и L-бульоне образуют ровную интенсивную муть.
Физико-биохимические признаки, оптимальная температура 37°С. рН 6,8-7,5. В качестве источника углерода используют многие углеводы, органические кислоты, спирты. В качестве источника азота используют минеральные соли (в амонийной или нитратной форме), органические соединения (в виде пептона, триптона, аминокислот).
Устойчивость к антибиотикам: проявля- 4 ет устойчивость к ампицилину (100- 150мг/л).
Генетические признаки: F Alac M15. 5Присутствие в штамме Е.соИ ДНК плазмиды pRV7-ll, содержащей фрагмент dRV7- II, гомологичный 7-му сегменту РНК генома ротавируса человека, подтверждается путем проверки его устойчивости к ампицили0 ну, а также путем выделения и анализа плазмидной ДНК, а затем с помощью блот- гибридизации.
Изобретение иллюстрируется следующими примерами.
5 Пример 1. Конструирование ДНК- зонда для выявления ротавирусов человека А. Выделение очищенной РНК ротавирусов человека.
РНК ротавирусов человека выделяют из
0 инфекционного материала больного ротави- русным гастроэнтеритом (изолят N° 4097). содержащего ротавирусы с длинным типом миграции РНК. Ротавирусы с таким электрофоторетипом доминируют на терри5 тории РСФСР в течение ряда лет.
1 г инфекционного материала гомогенизируют в 3 мл буфера, содержащего 0,01 М СНзСООМа. 0,3 М NaCI, 4 м М ЭДТА. рН 5,2, 1 % ДСН, инкубируют 1 ч при 37°С, добав0 ляют равный объем прогретой до 65°С фе- нол-хлороформенной (1:1) смеси, перемешивают и инкубируют 3-5 мин при 65°С. Смесь центрифугируют при 5 тыс.об в 1 мин в течение 1U мин и отбирают супер5 натант. Экстракцию повторяют еще раз при 65°С, а затем при комнатной температуре аналогично описанному выше.
К полученному препарату добавляют 2 объема этанола, выдерживают 18-20 ч при
0 -20°С и центрифугируют при 5 тыс об/мин в течение 1 ч Осадок растворяют в 1 мл буфера, содержащего 0,01 М трис рН 8.0, 0.001М MgCla, 0,3 М NaCI, 20 мкг/мл панкреатической ДНКазы, инкубируют 30 мин при 25°С,
5 добавляют равный объем фенола (рН 8,0), интенсивно перемешивают и центрифугируют при 5 тыс.об /мин в течение 10 мин. Водную фазу отбирают, добавляют 0,1 объема 3 М ацетата натрия и два объема этано0 ла. Осадки РНК, сформированные при -20°С в течение ночи, дважды промывают 70%- ным этанолом с 0,05 М ацетатом натрия рН 5,2, растворяют в стерильной воде и переосаждают еще раз. Осадки РНК хранят при
5 -20°С.
Б Синтез двухцепочечной кДНК. Синтез кДНК осуществляют по известному методу Мак-Крас.
Препарат днДНК (5-10 мг) в буфере, содержащем ЮмМ трис-HCI. рН 8,00 1 мМ
ЭДТА (ТЕ),денатурируют при 100°С 5 мин и охлаждают при 0°С.
Реакцию полиаденилирования З кон- цов РНК проводят в объеме 200 мкл при 37°С в буфере, содержащем 50 мМ трис-НС рН 7,9,10 мМ MgCl2. 2,5 мМ MnCIa, 20 мМ NaCI, 50 мкг/мл БСА, 0,1 мМ АТФ (включая 20 мк и 1/10 объема поли-А-поли- меразы (0,5 мкг)).
Степень аденилирования определяют по известной методике, Определяют время реакции, необходимое для присоединения 15-20 остатков АМФ. Полученный препарат экстрагируют фенолом и осаждают 2,5 объемами спирта.
К препарату полиаденилированной РНК в буфере ТЕ добавляют 5 мкг олиго-оТ -ш,, денатурируют 3 мин при 100°С и охлаждают во льду. Синтез кДНК проводят в буфере, содержащем 50 мМ трис-HCI, рН 8,3, 50 мМ KCI, 10 мМ MgCl2, 10 мМ ДТТ, 4 мМ пиро- фосфата натрия, по 0,5 мМ d ATP, d CTP, dG ТР, d TIP, 10 мк Ки Р32 ATP в объеме реакционной смеси 100 мкл. Добавляют 25 ед,обратной транскриптазы из вируса мне- лобластоза птиц и инкубируют 2 ч при 42°С.
Цепи РНК удаляют щелочным гидролизом (0,25 М NaOH 20 при 70°С). Препарат нейтрализуют НС1, депротеинизируют равным объемом фенола (рН 8,0), осаждают нук- леиновую кислоту этанолом и растворяют в 50 мкл ТЕ-буфера.
Препарат очищают от невключившихся dNTP на колонке с сефадексом G 50, уравновешенной ТЕ-буфером, Отбирают фрак- ции, содержащие «ДНК. Для i получения дн кДНК полученный препарат прогревают 2 мин при 100°С, добавляют до 0,2 М и отжигают комплементарные молекулы ДНК 30 при 65°С, 607 при 50°С, ЗО5 при 40°С. Дву нитевую кДНК осаждают этанолом.
Достройку дн «ДНК до образования тупых концов проводят с помощью фрагмента Кленова постандартней методике. Затем проводят экстракцию фенолом и хроматог- рафию на колонке с сефадексом G-50. Фракции, содержащие кДНК. объединяют, кДНК осаждают этанолом.
Реакцию достройки поли-6-коннекто- ров проводят в 25 мкл инкубационной смеси следующего состава: 0,2 М какодилат Na, рН 7,9, 8 мМ MoCh, 1 мМ /3 -меркаптоэтанола, 2 мМ СТР. В реакционную смесь добавляют 20 ед. концевой нуклеотидилтрансферазы и 0,5 мкг дн кДНК. Реакцию проводят при 37°С в течение 30 мин, экстрагируют фенолом и осаждают этанолом, как указано выше.
Пример 2. Клонирование к ДНК в векторной плазмиде pUC9
А. 5 мкг векторной плазмиды pUC9 гид- ролизуют рестрикционной нуклеазой Pstl, затем депротеинизируют 2-кратной экстракцией фенолом (рН 8,0), Фенол удаляют экстракцией равным объемом хлороформа, и плазмидную ДНК осаждают спиртом.
Достройку поли-С-коннекторов проводят при 37°С 30 мин, как указано (за исключением того, что вместо d CTP берут dG TP, а вместо MgCte - Coda).
Плазмидную ДНК и дн кДНК смешивают в эквимолярных соотношениях в 20 мкл буфера, содержащего 10 мМ трис-HCI, рН 7,5, 1 мМ ЭДТА, 0,1 М NaCI.
Инкубируют 5 мин при 65°С, затем 2 ч при 42°С и охлаждают до 0°С. Полученным препаратом ДНК трансформируют компетентные клетки E.coli Z85.
Из выросших при 37°С клонов трансформантов белого цвета выделяют плазмидную ДНК щелочным методом.
Б. Рестрикционный анализ рекомби- нантной плазмиды pRV7-ll.
Выделенные плазмидные ДНК расщепляют эндонуклеазой рестрикции Pstl.
Полученные препараты анализируют в 1%-ном агарозном геле.
По данным рестрикционного анализа отбирают плазмидые ДНК, содержащие различные по размеру вставки.
Пример 3. Идентификация рекомби- нантной плазмиды pRV7-ll, содержащей универсальный зонд для выявления ротави- русов человека.
Идентификацию рекомбинантной плазмиды, содержащей вставку ДНК, комплементарную 7-му сегменту РНК генома ротавирусов. проводят методом блот-гибри- дизации.
Радиоактивные зонды для гибридизации получают по стандартной методике.
Плазмидную ДНК очищают от невключившихся дезокситрифосфатов на колонке с сефадексом G50 medium.
С целью нанесения сегментов РНК на нейлоновую мембрану проводят электрофорез РНК ротавирусов человека в ПААГ. Готовят гелевую ячейку 115x115x2, состоящую из 10% разделяющего и 3% концентрирующего гелей. Гели готовят из концентрированных растворов: 30% акри- ламид-бисакриламид(27:1), х 4-кратного буфера для разделяющего геля (1,5 М трис-HCI, рН 8,4, 0,4% ДСН), х 4-кратного буфера для концентрирующего геля (0,5 М трис-HCI, рН 6-в. 0,4% ДСН), воды, катализатора (10%-ный персульфат аммония) и инициатора полимеризации (N-N-N-N-ТЭМЭД),
Перед гибридизацией мембрану пред- гибридизуют 2-3 ч при 42°С в растворе,
содержащем 5х SSC, 50 мМ фосфата Na (рН 6,5), 500 мкг/мл денатурированной при 100°С в течение 10 мин тимусной ДНК, 0,1 % ДСН, 0,1% БСА, поливинилпиролидона и фикола. После предгибридизации в раствор обавляют меченную Р32 денатурированную ДНК рекомбинантной плазмиды и проводят гибридизацию при 55°С 24 ч, после чего мембранный блот отмывают 4 раза по 10 мин при комнатной температуре в 200 мл 2xSSC 1 % ДСН и 30 мин при 55°С в растворе 0,1% SSC - 0,1% ДСН, высушивают и радиоавтографируют при -70°С в течение 24 ч. На основании данных радиоавтографии идентифицируют целевую плазмиду pRV7-II, содержащую фрагмент ДНК. комплементарный 7-му сегменту РНК ротавируса человека. .,
Пример 4. Определение нуклеотид- ной последовательности фрагмента dRV7- II.
А. Получение производных фрагмента dRV7-ll, укороченных с Hind Ill-конца.
ДНК плазмиды pRV7-H (2 мкг) гидроли- зуют эндонуклеазой , рестрикции Hind III (5 ед.) в буфере: ГОмМ трис-HCI, рН 7.5,50 мМ NaCI. 10 мМ MgCta. 1 мМ ДТТ в объеме реакционной смеси 40 мкл в течение 2 ч при 37°С. Препарат экстрагируют равным объемом фенола, осаждают 2,5 объема этанола и растворяют полученный осадок в 10 мкл буфера ТЕ.
Полученный препарат обрабатывают нуклеазой Bal 31 (2 ед.) в 20 мкл буфера: 20 мМ трис-HCI рН 7.3, 0.6 М NaCI, 12,5 мМ MgCIa, 12.5 мМ CaCl2 при 30°С в течение 10 мин. Реакцию останавливают добавлением ЭДТА до 20 мМ, препарат экстрагируют фенолом, осаждают 2,5 объемами этанола и после промывают 70%-ным этанолом носаок растворяют в 20 мкл ТЕ. Гидролизуют НК эндонуклеазой рестрикции EcoRI 5 ед.) в 30 мкл буфера: 100 мМ трис-HCI рН 7,5, 100 мМ NaCI, 10 мМ MgCfc. 1 мМ ДТТ при 37°С 2 ч. Препарат подвергают электрофорезу в 0,9%-ном агарозном геле. Набор укороченных с Hind Hi-конца фрагментов ДНК вырезают и элюируют из геля с- по- мощью электроэлюции.
Полученные фрагменты ДНК клонируют в плазмиде pUC9 (предварительно гидроли- зованной эндонуклеазами рестрикции EcoRI и Smal) no известной методике. Клоны анализируют на наличие плазмидной ДНК с помощью электрофореза в агарозном геле и отбирают клоны, несущие плазмиды с деле- циями фрагмента dRV7-ll размером 200, 300, 400 и 500 н.п.
Б. Получение производных фрагмента dRV7-ll. укороченных с EcoRI-конца.
Аналогично получают делеции фрагмеи- v TadRV7-ll с EcoRI-конца. для чего ДНК плазмиды pRV7-ll первоначально гидролизуют эндонуклеазой рестрикции EcoRI. 5В. Определение нуклеотидной последовательности фрагмента dRV7-ll.
Плазмиду pRV7-ll, а также плазмиды с делеционными производными фрагмента dRV7-ll гидролизуют соответствующей зн- 0 донуклеазой рестрикции (Hind Шили EcoRI). Концевое мечение фосфором-32 полученных препаратов ДНК осуществляют с помощью ДНК-полимеразы (фрагмент Кленова) по известной методике. Выделение и очист- 5 ку меченого фрагмента ДНК проводят как описано выше. Нуклеотидную последовательность . меченых, фрагментов определяют по методу Максама-Гилберта. Полученная в результате полная нуклеотид- 0 ная последовательность фрагмента dRV7- 1 представлена на фиг.2.
Пример 5. Определение эффективности фрагмента dRV7-H методом дот-гибридизации.
5 Выделяют РНК ротавирусов человека, имеющих длинный (II субгруппа) и короткий (I субгруппа) типы миграции сегментов, а также РНК ротавируса SAII, как описано в примере 1. Определяют концентрацию дву- 0 нитевых РНК в полученных препаратах спектрофотометричесхим методом (7 сегмент РНК по мол.м. составляет 1/20 часть массы тотальной РНК ротавириона).
5 нг тотальной РНК каждого типа дена- 5 турируютпри 100°С в течение 5 мин в 20 мкл буфера ТЕ, быстро охлаждают во льду, наносят на нейлоновый фильтр, поедгибридизу- ют, гибридизуют с меченной ДНК-зонда и радиоавтографируют, как описано в приме- 0 ре 3. Идентифицируют зоны гибридизации для РНК различных ротавирусов.
Результаты представлены в табл. 1.
Наличие гибридизационного сигнале наблюдается во всех случаях. Для проведения 5 гибридизации также использовалась РНК в количестве от 2 до 0,1 нг.
Пример 6. Выявление ротавирусов человека в клиническом материале больных острыми кишечными инфекциями с приме- 0 нением фрагмента dRV7-ll методом дот- гибридизации.
Берут 100 мкл копроэкстракта, добавляют 0,25 объема 25% ДСН. выдерживают 3 мин при 60аС, добавляют3объема 100% B/V 5 перхлората натрия, смесь интенсивно встряхивают и центрифугируют 10 мин при 5 тыс,об/мин. Не менее 20 мкл водной фазы наносят на нейлоновый фильтр, предгибри- дизуют с Р32-меченым фрагментом dRV7-ll, как описано выше.
11
Анализируют 60 проб стула больных кишечными инфекциями, ранее обследованных на ротавирусы методами электронной микроскопии и электрофореза в ПААГ,
Результаты представлены в табл. 2.
Из табл. 2 видно, что применение метода молекулярной гибридизации с использованием в качестве зонда фрагмента dRV7-ll позволило выявить ротавирусы во всех пробах, положительных по методу электронной микроскопии, и в трех пробах, отрицательных по этому методу.
Таким образом, в результате генноин- женерных разработок создан штамм E.coli № ВКМ CR-317D, несущий рекомбинантную плазмиду - продуцент dRV7- l фрагмента ДНК-зонда для выявления ротавирусов человека с различными типами РНК методом ДНК-РНК гибридизации.
Синтезированный фрагмент dRV7-ll выявляет РНК ротавирусов различных субгрупп за счет того, что является копией гена, кодирующего неструктурный белок и консервативного у всех имеющихся штаммов ротавируса. Чувствительность фрагмента dRV7-ll составляет для РНК ротавирусов человека 0,1-0,5 нг, что выше, чем в случае фрагмента, синтезированного на матрице генома ротавируса SAM, за счет того, что
11
12
фрагмент dRV7-ll является копией гена ротавируса человека.
Использование фрагмента dRV7-ll для t выявления ротавирусов человека в клиническом материале позволило повысить процент выявленных положительных на ротавирусы проб по сравнению с методом электронной микроскопии, что может быть связано также с тем, что фрагмент dRV7-ll синтезирован на матрице генома штамма ротавируса человека, доминирующего на территории РСФСР, и имеет первичную структуру, наиболее распространенную на данной территории.
Созданная плазмида pRV7-ll позволяет нарабатывать фрагмент dRV7-ll. Уровень синтеза зонда в составе плазмиды в сконструированном штамме E.coli N ВКМ CR-317D составляет при плотности культуры 5хЮ8 клеток /мл 1,5мг/л.
л стью.
Формула изобретения 1. Рекомбинантная плазмидная ДНК pRV7ll, содержащая фрагмент dRV7-ll для выявления ротавирусов человека, содержащая: Pstl - Pstl-фрагмент ДНК dRV7-U размером 1,113 т.п.н., гомологичный 7-му сегменту РНК ротавируса человека, со следующей нуклеотидной последовательно5






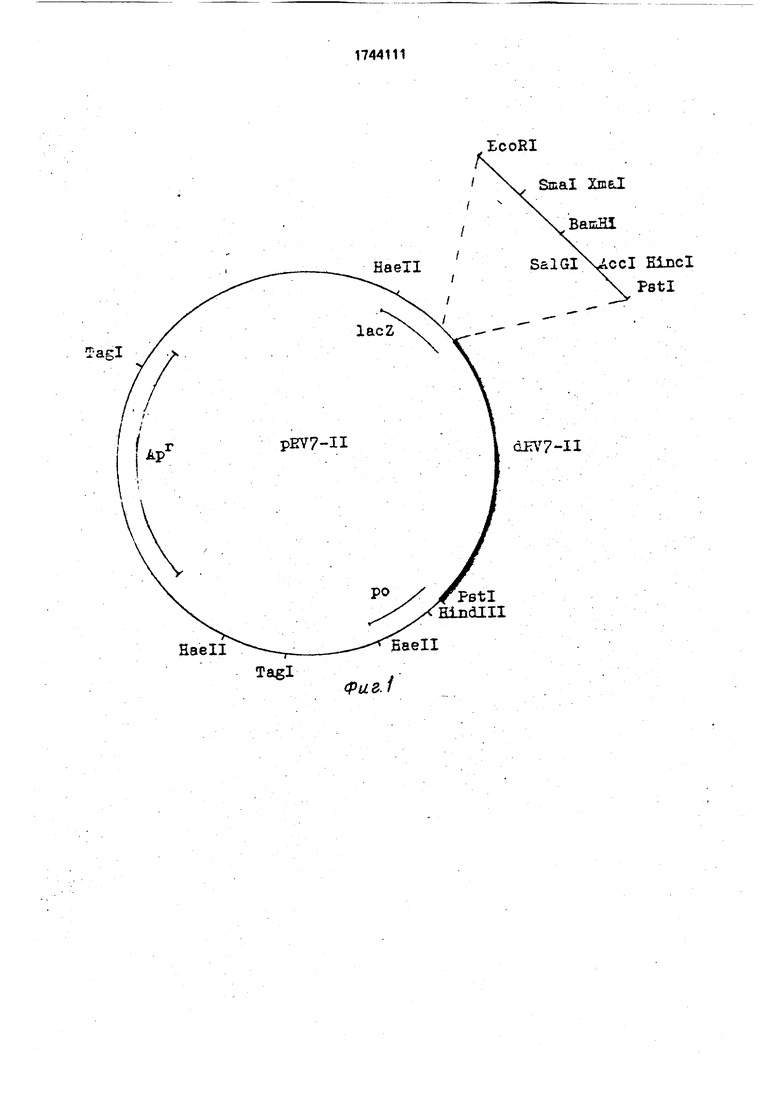

Изобретение относится к медицине, генетической инженерии и биотехнологии. Целью изобретения является создание штамма Escherichia coll - продуцента ДНК- зонда для выявления ротавирусов человека. В результате генноинженерных разработок создан штамм E.coll Nfe BKMCR-317D, содержащий плазмиду pRV7-ll - продуцент фрагмента dRV7-ll ДНК-зонда для выявления ротавирусов человека. Синтезированный фрагмент выявляет в реакции РНК-ДНК гибридизации ротавирусы человека как с длинными, так и с коротким типами миграции сегментов РНК и обладает чувствительностью 0,1-0,5 нг тотальной РНК для ротавирусов человека и 1 нг РНК гетерологичного ротавируса SAII. Использование фрагмента dRV7- l для индикации ро- тавирусов человека в клиническом материале позволяет выявить ротавирусы в большом количестве проб по сравнению с методами электронной микроскопии и электрофореза геномной РНК. 2 с.п.ф-лы, 2 ил., 2 табл. (Л
ъ - цашюотт П Т Гттт П Тт
GGCTTTTAMGCGTCTOAGTCGCGG f rTGAGCCTTGGCrGi GTAGCCATGGCTGAGCTAOO ..100
MGCTl l TGMATCCTGATSTGGAGAACGATAGCieAl AA Vl TTATUICGlVl TAAGAGTTT
.200.....
ТТС TAITG TTTATG GAATTGC GCGACC АС А АС ААТТТААААААС Са. А л ААТЛС Т AGTG А
.300 TAA i ICGAGAGGAATGAATTATGAAAGGAT MTGTTTAAlAAGGTGaCTGTCTTAATTTG
iGAAGGAGOJTAATTCAATCAAAGTCACACAATCTGAAATTGCAAAl GTTCTTTCAAGAGT.
. ..400.
AGTi1TGTGTTAGACAT l1TGGAAAj TTTAG M j.nii1GAGAAA tGjUuVA IGATCAAGACGTACT
TTTTCATTCGAAAGAAG CTCTTAAA Vi G i Gi GTTAATAGCl Al l GGTCAATCAAAAGA .500.....
AATTGAAAC TAG i GC TAG TGCCGAAGGAGGAGAAATAGTATTTCAGAATGCAGC TT2TAC
.600.
TATGTGGAAATTGACTTATTXAGATCATAAATTAAIGCCIA JTTTGGACCAGAATTTCAT
TGAATATAAAATTACATTGAA i GAAGASAAACCAATTTCAGATGTATGTGTGAAAGAGCT
.700 TGTTGCIGAATTAAGATGGCAGTACAAGAGATTTGGTGTAATAACACATGGTAAAGGTCA
Gi A MGAGTTGTTAAAl ATTCAa CAGTTGGTAACCATaCAGA JAGAGTG IJTTGOTACAa A .000.....
TAAGAATAATGGTAAyAGTGGTAATATTACTCAUT L GAATT JH TTAtiAaCAAALJGATl A i1
.900 l TGGCAAAATTGGIAGGGATrJ. GACATC rTCAATGAAACA;.GG J AATACAATTGATATATG
TMGAAACTGGTGTTTCAMAGATGAAACAAGAGAAAAAGCCATTTMAGGATTGTCAAC
.1000.
TGAGAGA.UMTGGATGAAGTATGACATGTTGGAATTT/mTTGGCTTTCGG f CAAAAAT
GATGATGACGAAGCAAGAATAGATAGCGCaJTATGTGACJGAAAAAAyVyUAALlCGCCCGCC ..1100,,.- .,
CCCGCCCCCCTGCA-- 3 . - ... .... ,
-Pstl-Pstl - фрагмент размером 2,671 т.ПсН, векторной плазмиды
- уникальные сайты рестрикции для эндрнуклеаз: EcoRl, Smal, Xmal, Bamlll, Sal CI, AccI, HincI, Hindlll; ,
-два сайта узнавания для эндонуклеазы рестрикции Pstl;
-три сайта узнавания для эндонуклеазы рестрикции Haell;
-ori репликации плазмиды рис;
-селективные маркеры Ар ,hac ;
-хозяин - Escherichia coli 85, .
.. 2. Штамм бактерий Escherichia coli ВШ Ср-317О-продуцент фрагмента dRV7-ll для
выявления ротавирусов человека.
Таблица 1
Таблица 2
Јagl
Haell
Tagl
(pue.f
bcoRI
Smal XmeJ BaizHl
SalGI AccI ElBcI PstI
dEV7-H
Petl Hindlll
Saell
5- GGGGGGTTTTT77TTTTTT
GGC7777AAAGCG7C7CAGTCGCCGT77GAGCC77GCGG7G7AGCCATGGCTGAGCTAGC
.100 TTGCTTTTGTTATCCTCATTTGGAGAACGATAGipTATAAATTTATTCCTTTTAACAGTTT
AGCAATAAAATGTATGTTGACAGCTAAAGTGGATAAAAAAGATCAAGATAAATTTTACAA . EDO.....
77CTA7TG777A7GGAATTGCGCCACCACAACAAT77AAAAAACG77ATAATAC7AG7GA
. 300 TAATTCGAGAGGAATGAATTATGAAACGATTATGTTTAATAAGGTGGCTGTCTTAATTTG
TGAAGCACTTAATTCAATCAAAGTCACACAATCTGAAATTGCAAATGTTCTTTCAAGAGT
. 400 AG77TCTGTTAGACATTTGGAAAATTTAGTATTGAGAAAAGAAAATCATCAAGACGTACT
T777CAT7CGAAAGAACTAC7CT7A/JiATCTG7GTTAATAGC7AT7GG7C/.7CAAAAGA .500.....
AAT7GAAAC7ACTGCTACTGCCGAAGGAGGAGAAATAG7ATT7CAGAATGCAGCT77TAC
. 60C 7A7G733/JiA773AC77A777A3A7CA7AAA77AA73CCTA7T77 G3ACCAGAATT7CA7
7G/ TA7/JJ 7TACAT7GAATGAAGA7AAACCA.777CAGA T37A7G7GTGAAAGAGC7 . .. 7 ОС
TGTTGC7GAATTAAGATGGCAGTACAACAGATTTGC7G7AA7AACACATGGTAAAGGTCA
CTA7AGAGTTGTTAAATA7TCA7CAGTTGCTAACCA7GCAGATAGAGTGTTTGCTACATA
.eoo.....
TAAGAA7AATGCTAAGAG7GG7AA7A77ACTGACTTCAAT7TGT7AGACCAAAGGATTAT
. 900 TTGGCAAAATTGGTACGCATTCACATCTTCAATGAAACAAGGTAATACAATTGATATATG
T/J.G JLACTGCTCTT7CAAAAGA7GAAACAAGAG/JL/ J CCCAT77AAAGGATTGTCAAC
. 1000.....
TGACAGAAAAATGGATGAAGTATCACATGTTGGAATTTAATTCGCTTTCGGTTCAAAAAT
GATGATGACGAAGCAAGAATAGATAGCGCTTATGTGACCAAAAAAAAAAAAACCCCCCCC
1100
ССССССССССТССА-З n
Фиг-Z
| Both G.W | |||
| etal - NAR | |||
| Устройство для видения на расстоянии | 1915 |
|
SU1982A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Способ изготовления пористого состава для заполнения резервуаров, предназначенных для хранения растворенных в жидкости газов | 1926 |
|
SU7075A1 |
| Dyall Smith M.L et.al - NAR | |||
| Гребенчатая передача | 1916 |
|
SU1983A1 |
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
Авторы
Даты
1992-06-30—Публикация
1989-12-26—Подача