Изобретение относится к органической и биологической химии и может найти применение при синтезе красителей и при анализе ферментов, обладающих амидазной активностью.
Известен 5-диметиламинонафталин-1-(диметилен)-сульфониламид.
Однако данное известное соединение не может быть использовано при синтезе субстратов для определения ферментов, обладающих аминопептидазной активностью, поскольку в них отсутствует незамещенная аминогруппа, которую можно превратить в карбомидную группу.
Известен способ получения 5-диметиламинонафталин-1-(диметилен) сульфониламида (I).
Однако данным известным способом нельзя получить соединения формулы I: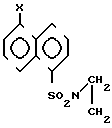 где Х является заместителем, способным к превращению в незамещенную аминогруппу, что необходимо для ее превращения в карбомидную группу, являющуюся единственным участком в молекуле субстрата, уязвимом для ферментов, обладающих аминопептидазной активностью.
где Х является заместителем, способным к превращению в незамещенную аминогруппу, что необходимо для ее превращения в карбомидную группу, являющуюся единственным участком в молекуле субстрата, уязвимом для ферментов, обладающих аминопептидазной активностью.
Проблема поиска промежуточных соединений, используемых при синтезе субстратов для этой группы ферментов актуальна, поскольку в природных материалах данные ферменты находятся в смесях и для их дифференциации необходим широкий ассортимент субстратов.
Техническим результатом, достигаемым при реализации настоящего изобретения, является получение новых соединений общей формулы I, где Х нитро-, фталимидо-, бензилоксикарбониламиногруппа и разработка нового способа их получения.
Достигается это тем, что в соединениях общей формулы I Х нитро-, фталимидо- или бензилоксикарбониламиногруппа.
Достигается это также тем, что в способе получения соединений общей формулы I, где значения Х указаны выше, а также Х диметиламиногруппа, взаимодействием соответственно 5-замещенного сульфонилхлорида с этиленимином в органическом растворителе в присутствии триэтиламина с последующим выделением целевого продукта отличительной особенностью является то, что в качестве растворителя используют низший спирт, а целевой продукт выделяют кристаллизацией из реакционной среды.
Ниже приведены примеры, иллюстрирующие изобретение.
П р и м е р 1. Синтез 5-(бензилоксикарбонил)аминонафталин-1-(диметилен)-суль- фониламида.
5,04 г (0,04 моль) 5-(карбобензокси)-аминонафталин-1-сульфонилхлорида при перемешивании на магнитной мешалке растворяют в 200 мл метанола, добавляют 3,7 мл (0,04 моль) триэтиламина и 1,72 мл (0,04 моль) азиридина (этиленимина). Через 30 мин начинается выпадение белого осадка. Перемешивание продолжают в течение 2 ч. Затем осадок отфильтровывают на вакуумном фильтре, промывают метанолом, сушат над КОН. Получают 5,01 г бесцветных кристаллов с т. пл. 107оС, выход 92,2% При использовании в качестве растворителя этанола, время реакции 3 ч, выход 91% Продукт хорошо растворим в органических растворителях (этилацетат, ацетонитрил) (см. табл.1).
П р и м е р 2. Синтез 5-фталимидонафталин-1-(диметилен)сульфониламида.
4,34 г (0,0115 моль) 5-фталимидонафталин-1-сульфонилхлорида при перемешивании на магнитной мешалке растворяют в 100 мл этанола, добавляют 1,08 мл (0,0115 моль) триэтиламина и 0,49 мл (0,0115 моль) азиридина (этиленимина). Через несколько минут начинается выпадение белого осадка. Спустя 2 ч осадок отфильтровывают на вакуумном фильтре, промывают этанолом, сушат над КОН. Получают 4,1 г бесцветных кристаллов с т.пл. 242оС, выход 93% Продукт хорошо растворим в органических растворителях (этилацетат, ацетонитрил) (см. табл. 1).
П р и м е р 3. Синтез 5-нитронафталин-1-(диметилен)сульфониламида.
5,43 г (0,02 моль) 5-нитронафталин-1-сульфонилхлорида при перемешивании на магнитной мешалке растворяют в 100 мл этанола, добавляют 1,83 мл (0,02 моль) триэтиламина и 1,04 мл (0,02 моль) азиридина (этиленимина). Через несколько минут начинается выпадение осадка. Спустя 2 ч осадок отфильтровывают на вакуумном фильтре, промывают этанолом, сушат над КОН. Получают 4,1 г бесцветных кристаллов с выходом 77% Продукт хорошо растворим в органических растворителях (этилацетат, ацетонитрил) (см. табл.1).
П р и м е р 4. Синтез 5-(бензилоксикарбонил)аминонафталин-1-(метоксиэтил)суль- фониламида.
5 г 5-(бензилоксикарбонил)аминонафталин-1-(диметилен)сульфониламида и 1 мл ацетата BF3 в 150 мл абсолютного метанола кипятят в плоскодонной колбе с обратным холодильником. Через час охлаждают до комнатной температуры, добавляют несколько капель воды до появления белой суспензии и оставляют стоять 12 ч при температуре 10оС. Выпавший осадок отфильтровывают, промывают на фильтре водой, сушат над КОН. Получают 5,01 г бесцветных кристаллов с т.пл. 144оС, выход 92,2% Продукт хорошо растворим в органических растворителях (этилацетат, ацетонитрил).
Аналогичным способом были получены соответствующие N-замещенные аминонафталиналкоксиэтилсульфониламиды при использовании соответственно этилового, n-пропилового, i-пропилового, i-бутилового спиртов (см. табл.2).
П р и м е р 5. Синтез 5-(бензилоксикарбонил)аминонафталин-1-(3,6-диоксагептил) сульфониламида.
4 г 5-(бензилоксикарбонил)аминонафталин-1-(диметилен)сульфонамида в 150 мл метилцеллозольва нагревают в плоскодонной колбе с обратным холодильником на кипящей водяной бане. 1 мл ацетата ВF3 добавляют в разогретую смесь, через 20 мин смесь охлаждают, добавляют избыток воды до расслоения смеси. Верхнюю фазу сливают, масло растворяют в горячем метаноле, добавляют 2 г активированного угля, перемешивают, уголь фильтруют, метанол частично упаривают, добавляют несколько капель воды до появления белой суспензии и оставляют стоять при 10оС. Выпавший осадок отфильтровывают, сушат над КОН. Получают 4,22 г бесцветных кристаллов с т.пл. 64оС, выход 88% Продукт хорошо растворим в органических растворителях (этилацетат, ацетонитрил).
Аналогичным способом был получен 5-(бензилоксикарбонил)аминонафталин-1-(3, 6-диоксаоктил)сульфонамид из этилцеллозольва (см. табл.2).
П р и м е р 6. Синтез 5-фталимидонафталин-1-(метоксиэтил)сульфониламида.
2,21 г 5-фталимидонафталин-1-(диметил)сульфониламида и 1 мл ацетата BF3 в 150 мл абсолютного метанола кипятят в плоскодонной колбе с обратным холодильником. Через 1,5 ч колбу охлаждают, добавляют воды до появления белой суспензии, оставляют стоять при 10оС на 12 ч. Выпавший осадок отфильтровывают, промывают на фильтре водой, сушат над КОН. Получают 2,28 г бесцветных кристаллов, выход 97,8% Продукт хорошо растворим в органических растворителях (этилацетат, ацетонитрил) (см. табл.4).
П р и м е р 7. Синтез 5-нитронафталин-1-(метоксиэтил)сульфониламида.
3,97 г 5-нитронафталин-1-(диметилен)сульфониламида и 1 мл ацетата BF3 в 150 мл абсолютного метанола кипятят в плоскодонной колбе с обратным холодильником. Через 1,5 ч колбу охлаждают, добавляют воды до появления белой суспензии, оставляют стоять при 10оС на 12 ч. Выпавший осадок отфильтровывают, промывают на фильтре водой, сушат над КОН. Получают 2,79 г бесцветных кристаллов с т. пл. 106оС, выход 62% Продукт хорошо растворим в органических растворителях (этилацетат, ацетонитрил) (см. табл.4).
П р и м е р 8. Получение бромгидрата 5-аминонафталин-1-(метоксиэтил)сульфон- иламида (снятие бензилоксикарбонильной защиты).
7,04 (0,016 М) 5-бензилоксикарбониламинонафталин-1-(метоксиэтил)сульфонил-амида перемешивают на магнитной мешалке с 17 мл (0,051 моль HBr) 3-молярного раствора HBr в уксусной кислоте. Через 2 ч выпавший осадок трижды промывают эфиром, отфильтровывают, промывают эфиром на фильтре, сушат над КОН. Получают 6,06 г продукта, выход 98,6% Продукт хорошо растворим в органических растворителях (этилацетат, ацетонитрил) (см. табл.3).
Аналогичным образом снимают защиту у всех остальных карбобензокси-АНСА.
П р и м е р 9. Снятие фталимидной группы.
3,99 (0,01 моль)-5-фталимидонафталин-1-(метоксиэтил)сульфонамида заливают 50 мл метанола, прикапывают 0,5 мл (0,01 моль) гидразингидрата и кипятят 4,5 ч. Метанол отгоняют, остаток экстрагируют 2 раза по 20 мл кипящего хлороформа, экстракт упаривают и остаток перекристаллизовывают из метанола. Получают 2,74 г (выход 98%) хроматографически и аналитически чистого продукта с т.пл. 112оС.
ПМР (ДМСО) 2,90 (СН2), 3,01 (CH3), 3,22 (СН2).
Rf 0,34 (хлороформ: этилацетат).
Данные элементного анализа: (найдено/вычислено):
C H N S
55,91 5,79 10,0 11,23
55,70 5,75 9,99 11,44
Аналогично проводили снятие фталимидной группы в других полученных соединениях.
П р и м е р 10. Восстановление NO2-группы.
12,4 г (0,04 моль) 5-нитронафталин-1-(метоксиэтил)-сульфонамида растворяют в 400 мл метанола, добавляют никель Ренея и гидрируют водородом при Р 1, 20оС. После поглощения рассчитанного количества водорода катализатор отфильтровывают, раствор упаривают досуха и получают 2,21 г (выход 81%) целевого продукта с т.пл. 112-114оС.
ПМР (ДМСО) 2,91 (СН2), 3,33 (СН3), 3,25 (СН2).
Rf 0,34 (хлороформ:этилацетат).
Данные элементного анализа (найдено/вычислено):
C H N S
55,82 5,74 10,06 11,33
55,70 5,75 9,99 11,44
Аналогично проводили восстановление нитрогруппы в других соединениях.
П р и м е р 11. Синтез 5-диметиламинонафталин-1-(диметилен)сульфониламида.
1 г (0,0037 моль) 5-диметиламинонафталин-1-сульфонилхлорида при перемешивании на магнитной мешалке растворяют в 200 мл метанола, добавляют 0,339 мл (0,0037 моль) триэтиламина и 0,192 мл (0,0037 моль) азиридина (этиленимина). Через 30 мин начинается выпадение белого осадка. Перемешивание продолжают в течение 2 ч. Затем осадок отфильтровывают на вакуумном фильтре, промывают метанолом, сушат над КОН. Получают 0,89 г желтых кристаллов, выход 91,5% Идентичен известному продукту по физико-химическим свойствам.
П р и м е р 12. Получение 5-аргиниламинонафталин-1-(метоксиэтил)-сульфонилам- ида.
Навеску сухого карбобензокси-аргинина (Z-аргинин) (40 ммоль) растворяют при осторожном нагревании в 50 мл безводного диметилформамида (ДМФА). В трехгорлой колбе с магнитной мешалкой, низкотемпературным термометром и хлоркальциевой трубкой охлаждают до -30оС 30 мл ДМФА и при перемешивании приливают в один прием 4 мл тионилхлорида. Температура быстро поднимается до -15оС. Убирают охлаждение и дают нагреться до комнатной температуры, снова охлаждают до -30оС и вливают в один прием предварительно охлажденный ранее Z-аргинин, перемешивают в течение часа при 0оС. Навеску бромгидрата 5-аминонафталин-1-(-метоксиэтил)сульфониламида (20 ммоль) растворяют в ДМФА, добавляют 120 ммоль пиридина, полученный раствор вводят в реакционную смесь при охлаждении ниже -5оС, продолжают перемешивание 2 ч при охлаждении и затем еще несколько часов при комнатной температуре. За ходом реакции наблюдают при помощи ТСХ. После исчезновения на хроматограмме пятна исходного АНСА, при перемешивании добавляют 250 мл этилацетата, а затем 300 мл гексана, оставляют раствор стоять при 4оС до тех пор, пока он не просветлеет. Раствор сливают, остаток промывают 3 раза смесью этилацетат-гексан, растворяют в 0,5 л воды и четырежды экстрагируют бутанолом (40-40-40-40 мл), водную фазу отбрасывают, бутанольный слой промывают водой 4 раза по 10 мл 5% NaHCO3, снова водой, упаривают в вакууме досуха, сушат в вакууме. К остатку добавляют 50 мл 3-молярного раствора HBr в уксусной кислоте, колбу закрывают хлоркальциевой трубкой и перемешивают, наблюдая за снятием защитной группы с помощью ТСХ. По завершении реакции в колбу при интенсивном перемешивании вливают 200 мл сухого эфира, дают осесть осадку, жидкость сливают, осадок промывают эфиром еще трижды, растворяют в 500 мл воды, экстрагируют этилацетатом, нейтрализуют NaOH до рН 8,4, затем четырежды экстpагиpуют бутанолом по 30 мл, упаривают на роторном испарителе, остаток растворяют в спирте 20 мл, добавляют по 3 г активированного угля и инфузорной земли, перемешивают, фильтруют и упаривают досуха.
Продукт получают с выходом 12-22% из расчета на вступивший в реакцию АНСА. Полученный продукт хорошо растворяется в полярных растворителях (воде, спирте) и плохо в неполярных (этилацетате, гексане) (см. табл.5).
Аналогично были получены при использовании соответствующих аминонафталин(алкоксиэтил)сульфамидов:
5-аргиниламинонафталин-1-(этокси- этил)сульфониламид,
5-аргиниламинонафталин-1-(пропиок-сиэтил)сульфониламид,
5-аргиниламинонафталин-1-(изопропи-оксиэтил)сульфониламид,
5-аргиниламинонафталин-1-(изобуто- ксиэтил)сульфониламид,
5-аргиниламинонафталин-1-(диоксагеп-тил)сульфониламид,
5-аргиниламинонафталин-1-(диокси- этил)сульфониламид (см. табл.5-6).
П р и м е р 12. Определение фермента лейцинаминопептидазы (взаимодействие хромогенных субстратов, полученных с использованием в качестве промежуточного соединения замещенного нафталин(диметилен)сульфониламида, с лейцинаминопептидазой.
Составляют эквимольную смесь семи Arg-АНСА-субстратов. В 1 мл раствора содержится по 2 о.е. ( λ -300 нм) каждого из субстратов, 0,166 мл трис-НСl 0,2 М буфера рН 7,2. В пробирку типа Eppendorf помещают 500 мкл смеси, добавляют 30 мкл раствора лейцинаминопептидазы, перемешивают, выдерживают до исчезновения голубой флюоресценции при 25оС, добавляют 500 мкл экстрагента этилацетат-гексан (в соотношении 2:1), перемешивают и разделяют фазы путем центрифугирования. Из верхней фазы отбирают 10 мкл, высушивают на воздухе. Остаток растворяют в 30 мкл ацетонитрила, отбирают аликвоту 20 мкл и детектируют продукты протеолиза с помощью ВЭЖХ. Колонка СGС Сепарон SGX С18, с детекцией по УФ-поглощению λ-254 нм (давление 83 Bar, элюент-35% ацетонитрил и 0,05 М ацетат аммония, скорость элюции 0,56 мл/мин). Все продукты протеолиза имели максимумы и минимумы поглощения, а также время удержания в колонке соответствующие данным, представленным в табл.6.
Таким образом, хромогенные продукты протеолиза, полученные при воздействии лейцинаминопептидазы на смесь субстратов, представленных новыми соединениями удается диффеpенциpовать методами ВЭЖХ, а это означает, что новые соединения могут быть использованы при синтезе субстратов для определения ферментов, обладающих аминопептидазной активностью.
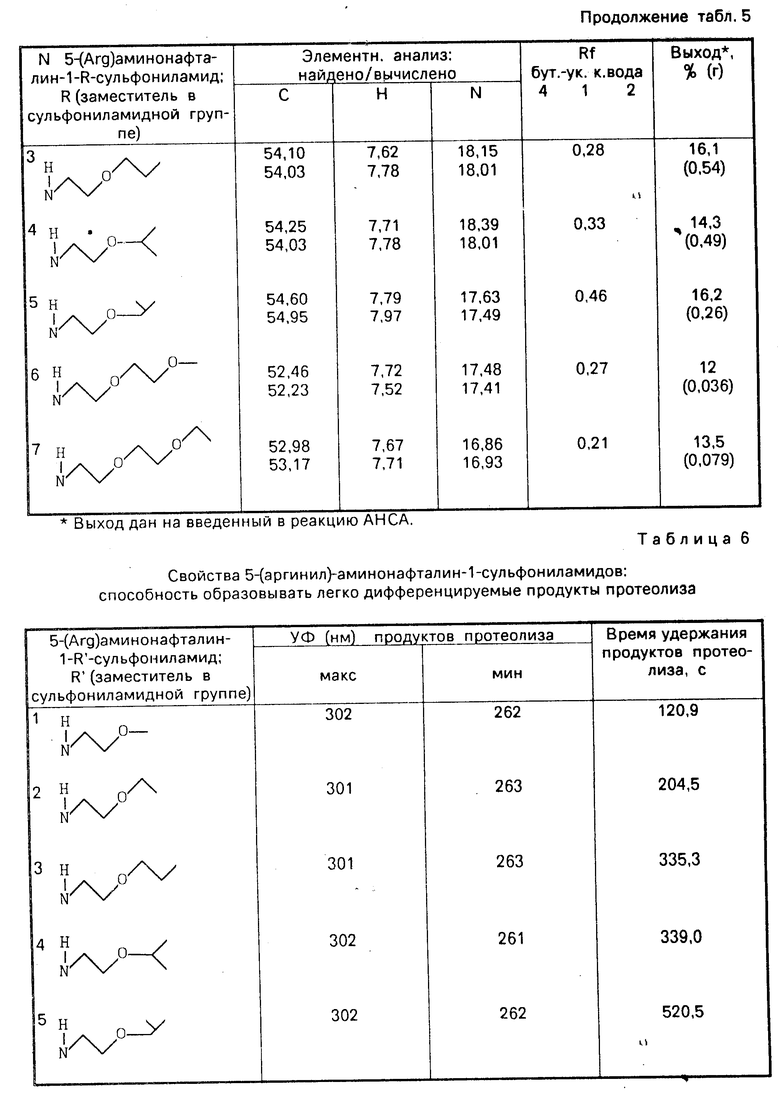
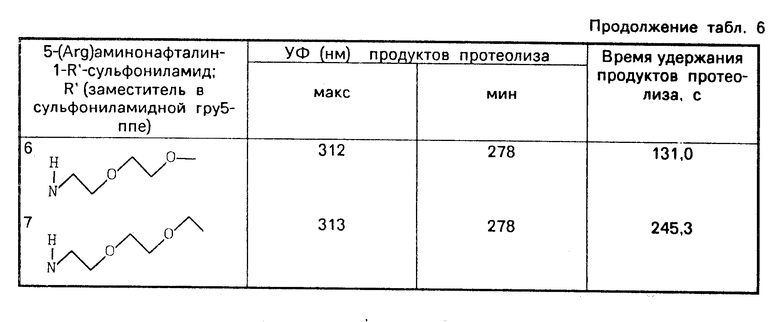
Использование: в качестве полупродукта для получения органических соединений. Сущность изобретения: продукт 5-замещенные нафталин-1-(диметилен)-сульфониламиды: X-нафталинил- SO2N-CH2-CH2 X-нитро-, фталимидо-, бензилоксикарбониламино-, диметиламиногруппы. Реагент 1: 5-замещенный сульфонилхлорид, реагент 2: этиленимин. Условия реакции: в присутствии триэтиламина в среде низшего спирта выделением целевого продукта кристаллизацией из реакционной среды. 6 табл.
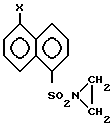
где Х нитро-, фталимидо-, бензилоксикарбониламино-.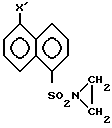
где X′ нитро-, фталимидо-, бензилоксикарбониламино-, диметиламино,
взаимодействием соответственно 5-замещенного сульфонилхлорида с этиленимином в органическом растворителе в присутствии триэтиламина и последующего выделения целевого продукта, отличающийся тем, что в качестве растворителя используют низший спирт, а целевой продукт выделяют кристаллизацией из реакционной среды.
| J.Med.Chem, 1974, 17, p.649. |
Авторы
Даты
1995-12-27—Публикация
1991-06-28—Подача