Изобретение касается способов получения оптически активных S - циангидринов реакцией альдегида с синильной кислотой, предусматривающих контактирование смеси, содержащей органический растворитель, альдегид и кислоту, с ферментом S-оксинитрилазой.
Реакция взаимодействия альдегидов с синильной кислотой в присутствии фермента оксинитрилазы и при использовании в качестве растворителя диизопропилового эфира с образованием оптически активных циангидринов известна и описана, например, в [1] Как указано в этом патенте, реакцию проводят с ферментом в иммобилизованной форме, например связанным с поверхностью стеклянных шариков, ионообменной смолы или частиц целлюлозы в виде суспензии, которая должна быть отфильтрована из раствора до выделения продукта. Этот метод эффективен при решении поставленной задачи, однако реагенты проходят через иммобилизованный фермент только один раз, при этом полный проход осуществляется за 5-6 дней. Аналогичным образом в заявке Австралии 38104/89 (Кула и др. ) рассматривается подобный процесс, в котором фермент S-оксинитрилазу получают из двухцветного сорго (Sorghum bicolor). В этом способе в одном из вариантов используются акриловые гранулы для иммобилизации фермента, которые представляют собой коммерчески доступные акриловые гранулы Eupergit® (Rohm, Дармштадт), используемые для суспендирования в реакционной среде или в колонках. В любом случае они должны использоваться в водных системах, чтобы исключить воздействие различных органических растворителей на акриловые гранулы. Более того в последнем случае с использованием связанного фермента получают выход приблизительно 85% но только при проведении реакции в течение трех дней при использовании в качестве альдегида 4 гидроксибензальдегида. См. также [3] Евр. пат. 326063, пат. США 3862030 и нем. Заявку 3823864-А-1, которые соответствуют вышеуказанным патенту США и заявке Австралии или объединяют их.
В каждом из перечисленных выше патентов есть указание на "реактор с ферментными мембранами". Однако, как указывается в соответствующей технической литературе ( см. например, работу "Engineering Aspects of Enzyme Engineering" и ссылки 16 и 17, приведенные в ней, а именно Kragl et al. Ann.N.Y. Asa. Sci. 613, p. 167-175 (1990); и Vasic Racki, et al. Appl. Microbiol. Biotechnol. 31, p. 215 222 (1989). Такие реакторы представляют собой ни что иное, как ряд контейнеров, разделенных фильтрующими мембранами, которые являются физически непроницаемыми для фермента. Следовательно, в реакторе такого типа осуществляется реакция в растворе, содержащем диспергированный фермент, с которым реагенты должны со временем вступить в контакт в результате диффузии.
Использование реакторов с полимерными мембранами для связывания ферментов в целом описано в [2] и 4169014 (оба Б.С. Голдберг). См. также работу "Новая реакторная система с иммобилизованным ферментом" (Б.С. Голдберг), представленную на 27 ежегодном симпозиуме, секция нетрадиционных реакторных систем (AICHE, East Brunswick N.J. 10 мая 1984), в которой дополнительно описаны мембранные реакторы из указанных выше двух Пат. США.
По сравнению с известными способами получения оптически активных (S)-циангидринов реакцией альдегидов с синильной кислотой в присутствии каталитического фермента S-оксинитрилазы и растворителя в способе по изобретению время реакции и работа с реагентами могут быть значительно улучшены, когда раствор альдегида и кислоты пропускают через химически активированную пористую мембрану, описанную ниже, с которой фермент S - оксинитрилаза химически связан.
Другими словами, поскольку при отсутствии стереоселективного катализатора (S)- и (R)-энантиомерные формы циангидрина будут обычно образовываться в равных количествах, то есть в соотношении 50 50, то задачей изобретения является увеличение отношения (S) изомера к (R) изомеру ("S/R") путем выбора улучшенного катализатора и условий реакции. Другая задача изобретения состоит в том, чтобы не только увеличить селективность по S изомеру, но также обеспечить высокую конверсию продукта за наиболее короткий промежуток времени. Еще одна задача изобретения состоит в том, чтобы достичь этого результата без необходимости физического отделения фермента от конечного продукта.
Поставленные задачи достигаются предлагаемым способом получения оптически активных S-циангидринов посредством того, что контактирование реакционной смеси с S-оксинитрилазой осуществляют посредством пропускания смеси через пористую мембрану, на которой иммобилизован указанный фермент, при этом упомянутый альдегид является по существу нерастворимым в воде альдегидом, органический растворитель другой, чем ди-изопропиловый эфир, а пористая мембрана включает носитель из полимерной смолы, который содержит тонкоизмельченные частицы наполнителя и сеть по существу взаимосвязанных пор, обеспечивающих проницаемость мембраны для потока жидкости, содержащей реактанты.
Неожиданно было обнаружено, что таким путем время реакции может быть уменьшено до одного дня в отличие от известных способов, в которых время реакции составляет 6 7 дней, и при этом сохраняется, а в некоторых случаях и увеличивается общий выход продукта, так же как и селективность по целевому S-изомеру.
Понятно, что с помощью изобретения общий выход может быть пропорционально увеличен, если время реакции продлить до нескольких дней аналогично известным способам, например, до 6-7 дней.
Желательно, чтобы реакция проводилась в органической системе, в которой практически нерастворимые в воде альдегид и образующийся циангидрин хорошо растворяются. Хотя возможно использование небольшого количества водного буфера, то есть до приблизительно 1% воды из расчета на общий вес системы, предпочтительно, чтобы использовалось как можно меньше воды, например приблизительно до ≅ 0.03% Следовательно, изобретение использует систему, содержащую органический растворитель ( возможно содержащую буфер), альдегид и кислотные реагенты, а также фермент, химически связанный с определенной пористой мембраной, как это более подробно описано ниже.
Реакция может быть проведена в широком интервале температур и значений pH, которые не являются критическими. Следовательно, приемлемыми могут быть температуры от приблизительно -6oC до +30oC, предпочтительно приблизительно от 6 до 25oC. Значения pH, которые хотя и не являются критическими, можно контролировать с использованием таких буферов, как ацетат натрия, цитрат натрия или фосфат натрия в интервале приблизительно 3,5 7,5.
Используются альдегиды, которые рассматриваются, например, в [1] Входящие в данное изобретение и описанные в указанном патенте США альдегиды имеют формулу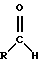
где R представляет собой насыщенный или ненасыщенный алифатический или ароматический заместитель, который может быть замещен атомом галогена, а также серу-, азот- или кислородсодержащим заместителем.
Альдегиды, используемые в способе по изобретению, должны быть практически нерастворимы в воде и предпочтительно растворяться в органических растворителях, используемых по изобретению. Таким образом, предпочтительны альдегиды, имеющие растворимость в воде менее чем приблизительно 2,0 0,01 мг/мл и наиболее предпочтительны альдегиды, имеющие растворимость менее чем 0,1 мг/мл, вплоть до приблизительно 0,01 мг/мл. Примерами таких водонерастворимых альдегидов являются альдегиды, представленные формулой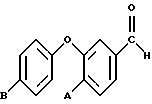
где A представляет собой атом водорода или фтора, B атом водорода, фтора, хлора или брома. Из них предпочтителен 3-феноксибензальдегид.
Желательно, чтобы молярное соотношение альдегида и синильной кислоты составляло от 1:1 до 1:100, более предпочтительно приблизительно от 1:1 до 1: 2.
Используемый органический растворитель может быть легко выбран из числа растворителей, не оказывающих отрицательного воздействия на используемые мембраны или на ход реакции. Таким образом, например, использование ди-н-бутилового эфира, с одной стороны, предпочтительно, однако ди-изо-пропиловый эфир, который используется в способе по [1] как было установлено, неожиданно превращает рассматриваемый процесс в неработоспособный.
Катализатор на основе S-оксинитрилаэы (EC 4.1.2.11) коммерчески доступен и выпускается фирмой Sigma Chemical Co. или может быть выделен из побегов сорго известными способами (см. работу Bove и др. J. Biol. Chem. 226 (1), 207, 1961). Количество используемого фермента по отношению к альдегиду должно составлять приблизительно 50 2500 единиц фермента на 1 г альдегида, более предпочтительно приблизительно 500 750 единиц на 1 г альдегида. Фермент может быть подходящим образом химически связан с пористой мембраной, описанной ниже, путем обработки мембраны, например, 5 мас. водным раствором полиэтиленимина с последующей обработкой, например, 5%-ным водным раствором глутарового альдегида и, наконец, раствором S-оксинитрилазным ферментом в подходящем буфере.
Преимуществом предлагаемого способа является то, что фермент остается связанным с мембраной в течение нескольких дней и, следовательно, не только представляется собой более стабильное и прочное образование по сравнении с известными способами, но также исключается лишняя стадия отделения и выделения фермента, который в способе по [1] и [3] используется в виде суспензии.
Пористые мембраны, используемые в способе по изобретению, в целом описаны в [2] ( см. выше ), в котором раскрыты такие иммобилизирующие фермент материалы, их природа и способ их получения, а также прикрепление ферментов на большом количестве таких материалов и их выделение. В основном эти мембраны, являющиеся тонкими или слоевыми, состоят из нерастворимого, пространственного, полимерного, смолоподобного связующего вещества, имеющего тонкопомолотые частицы наполнителя, диспергированного в вышеуказанном связующем веществе, и сеть пор, в значительной степени связанных между собой, где размер пор может изменяться в широких пределах, наиболее желательно приблизительно от 0,01 до 100 мкм, а общая пористость материала составляет от 50 до 75% причем вышеуказанные диспергированные частицы наполнителя присутствуют в количестве по меньшей мере приблизительно 25 мас.) из расчета на общий вес композиции.
Одной из таких мембран является мембрана MPSR ( FMC Corp. Филадельфия, США ), которая представляет собой микропористое полотно из поли(винилхлорида) с двуокисью кремния с пористостью 70 80% Размер пор, определенный с использованием ртутного порозиметра, составляет в основном 0,2 2,0 мкм. Эта основа в значительной степени гидрофильна, имеет отрицательный заряд, который может быть изменен на положительный, и площадь поверхности 80 м2/г. Также этот материал не сжимается при нормальных условиях и имеет низкую насыпную плотность 0,45 г/см3. Активные центры находятся на двуокиси кремния, находящейся в пределах пористой матрицы, что позволяет добавлять органические функции за счет присоединения к двуокиси кремния. Такая MPS мембрана обладает ДНК связующей способностью по меньшей мере 260 мг/см2. Более того установлено, что эта мембрана также как и другие подходящие мембраны, которые могут быть использованы в данном изобретении, несмотря на то, что обычно они используются только в водных средах, удивительно устойчивы в органических растворителях данного процесса.
Хотя полимеры, которые образуют связующее вещество, то есть матрицу мембраны, могут быть различными, желательно, чтобы они представляли собой термопластичные коммерчески доступные смолы, из которых предпочтителен поливинилхлорид (ПВХ). Однако также возможно использование таких материалов, как полиэтилен, наполненный двуокисью кремния, или сополимеры ПВХ с небольшим количеством моноэтиленовых мономеров, таких как винилацетат, винилиденхлорид, пропилен или им подобные. В других случаях матрица может быть образована из таких материалов, как политетрафторэтилен (ПТФЭ), ацетат целлюлозы или триацетат, полиамид (например, нейлон) и им подобные. Если используется ПТФЭ, то он может находиться в форме фибрильной матрицы (см. патент США 4152661 и 4373519), содержащей, например, гидрофильные, абсорбирующие частицы. Таким образом, в общем случае может быть использован термопластичный полимер, который легко пластифицируется растворителем или способен спекаться при нагревании или давлении, или который может быть легко получен исходя из предыдущей матрицы и который химически и физически стабилен в условиях изобретения.
Наполнители, предпочтительно в виде частиц, могут представлять собой как неорганические материалы, такие как упоминавшиеся выше соединения кремния или, например, соединения алюминия, такие как оксид или гидроксид алюминия, так и органические наполнители, такие как полисахариды, включая активированную целлюлозу (неактивированная целлюлоза, как было установлено, не эффективна в сочетании с ПВХ).
Получаемая мембрана может быть активирована путем обработки ее известными способами так, чтобы обеспечить химическое связывание агента между ней и ферментом, то есть между частицами наполнителя и ферментом. Такое связывание может быть осуществлено посредством хемосорбции, ковалентного связывания или за счет сшивок между промежуточным агентом и ферментом. Связующие функциональные группы, которыми могут обладать мембраны, включают любые остатки свободных аминов, а также карбоксильные, изонитрильные, альдегидные, кетонные группы, которые будут привязывать S-оксинитрилазный фермент к наполнителю мембраны. Из них предпочтителен полиэтиленимин (ПЭИ), который может быть хемоадсорбирован на наполнителе, в сочетании, например, с глутаровым альдегидом, к которому затем присоединяется фермент.
Как указано в патенте США 4102746, мембраны, используемые в изобретении, могут быть легко получены путем примешивания необходимых количеств тонкоизмельченной полимерной смолы, тонкоизмельченного неорганического наполнителя, растворителя (например, циклогексанона) и не растворителя (например, воды) в условиях низких сдвигающих усилий до образования стабильного, влажного, свободнотекучего порошка. Порошкообразная смесь может быть затем экструдирована и сформирована предпочтительно в форме в основном плоской структуры или полотна желаемых размеров, которые на следующей стадии могут быть пропущены через водяную баню для выщелачивания растворителя и затем последовательно через воздушную печь для удаления воды. В соответствии с изобретением получаемый продукт в виде микропористой, пространственно стабильной, полужесткой, нерастворимой, проницаемой для жидкостей мембраны может быть затем обработана таким образом, чтобы присоединить к ней или связать с ней ферменты.
В одном из предпочтительных вариантов выполнения исходная, не химически активированная мембрана, может быть приготовлена следующим образом: полотно пористого материала готовится путем первичного сухого смешивания 20,0 фунтов (9,07 кг) Conoco ("Коноко") 5385 поливинилхлоридная смола, имеющая размер частиц, которые будут проходить через сито с размером ячеек 180 мкм (80 меш), и 40,0 фунтов (18,14 кг) Hi SilTM 233 осажденная гидратированная двуокись кремния, в смесителе Patterson Kelley с низким сдвигающим усилием, предназначенным для перемешивания систем жидкость/твердое вещество, в течение приблизительно 3 мин. После этого, продолжая перемешивание, в течение 20 мин с помощью насоса подают 54,6 фунтов (24,8 кг) растворителя (циклогексанона). Затем в течение следующего 20 минутного периода к смеси, перемешиваемой в смесителе, добавляют 59,0 фунтов (26,8 кг) воды, получают влажный, свободно текучий порошок. Порошок затем загружают в шнековый экструдер, имеющий температуру барабана приблизительно 120oF (48,9 oC) и экструдат пропускают между роликами каландра, получая в основном плоское полотно, имеющее толщину 0,22 дюйма (56 мм). Полотно затем пропускают через экстракционную баню с водой при 170oF (76,6oC) и затем сушат в горячей воздушной печи при 225oF (107,2oC) в течение 6 мин. Получаемое пористое полотно имеет относительно широкий интервал распределения пор по размерам, начиная приблизительно от 0,01 мкм и до 100 мкм, и средний диаметр пор в интервале приблизительно от 0,15 мкм до 0,25 мкм, которые определяются с помощью ртутного интрузивного метода. Общая пористость этого материала составляет приблизительно 65% (об.), а содержание диспергированного наполнителя (например, двуокиси кремния) составляет приблизительно 56 мас. В обычных опытах, например, вода легко впитывается в материал без приложения какого-либо давления, показывая, что микропоры, по существу, связаны между собой от поверхности к поверхности.
Полученные указанным способом мембраны могут быть затем химически модифицированы с помощью связующего средства следующим образом, если желательно, чтобы S оксинитрилаза была присоединена более прочно: необработанная мембрана выдерживается при комнатной температуре в течение 1 ч в 5 мас./об.-ном водном растворе полиэтиленимина (ПЭИ) с разветвленной цепочкой. Обработанная основа промывается водой и IM раствором NaCl для того, чтобы удалить неадсорбированный ПЭИ. С использованием тринитробензолсульфокислотного теста может быть проведена оценка: на поверхности обработанной основы мембраны наблюдается появление производных тринитрофениламина, имеющих интенсивно оранжевую окраску, что указывает на присутствие существенного количества алифатических аминогрупп. Загрузка по азоту обработанной основы мембраны определяется с помощью элементного анализа например, обработанная основа содержит 1,25% азота (из расчета на сухой продукт) в сравнении с 0,02% азота в необработанной основе матрицы. Хемоадсорбирование ПЭИ на обработанной основе мембраны фактически необратима, то есть ПЭИ не может быть удален путем выдерживания в растворах с сильными ионами (например, в IM растворе NaCl или в IM растворе K2HPO4/KH2PO4) при значениях pH между 3 и 9. Только в случае сильнокислых сред (выдерживание в IM растворе HCl в течение 2 ч) будет происходить частичная десорбция до содержания азота 50% в соответствии с данными элементного анализа. Площадь поверхности обработанной основы, измеренная с помощью стандартной методики BET, составляет 55,4 м2/г против 81,1 м2/г для контроля. Основа мембраны, обработанная ПЭИ, проявляет идентичные текучие свойства, что и необработанная основа мембраны, независимо от используемого буфера или силы иона.
Фермент затем связывается с мембраной, которая была химически активирована, во первых, с помощью ПЭИ, как это описано выше, а затем с помощью связующих групп, таких как глутаровый альдегид, к которому в конце концов и присоединяется фермент. Далее реагенты контактируют с ферментом по мере того, как они протекают через поры мембраны. Поток реакционной среды желательно регулировать путем нанесения мембраны или слоев мембраны на держатель или кожух, который, удерживая края мембраны и образуя секцию реактора, делает эти края непроницаемыми для вышеуказанного потока. Если желательно, то оборудуют также входное и выходное отверстия, имеющие подход к поверхности мембраны, посредством чего направляется и принуждается движение реагентов через поры в реакторной ячейке и их контакт с ферментом. Типичными реакторами такого типа в виде кругов (дисков) являются реакторы ACTI - DISKR и ACTI-MOD(R) (FMC Corp. Филадельфия, США). Последний диск, в частности, состоит из нескольких слоев мембран для того, чтобы обеспечить полное превращение. Таким образом при чтении описания следует учитывать, что понятие "мембрана" включает один или несколько слоев мембран, при этом окончательную толщину можно легко определить с помощью рутинных экспериментов. Следовательно, в приведенных ниже примерах матрицы ACTI-DISKR содержали от одного до приблизительно 5 слоев мембран, например, в примерах 2, 3, 6 и 7 использовалась одна мембрана, в примерах 1,4 и 5 5 слоев мембран.
Продукт реакции циангидрина может быть выделен при отгонке синильной кислоты и растворителя.
Изобретение далее иллюстрируется ниже примерами. Размер ячеек, используемых в работе сит, указан по стандартам ASTM E 11 87.
Пример 1. Получение (S)-(циано)(3-феноксифенил) метанола из синильной кислоты и 3-феноксибензальдегида в ди-н- бутиловом эфире при комнатной температуре
Стадия А Иммобилизация S-оксинитрилазного фермента на пористой мембране
Матричную основу ACTI-DISKR, содержащую мембрану из поли(винилхлорида) и двуокиси кремния (полотно MPSR фирмы FMC Corp.) и предварительно обработанную полиэтиленимином, вводили в стандартный прокачиваемый насосом реактор. Реактор состоял из дозирующего насоса, способного максимально подавать 10 мл/мин, присоединенного входным отверстием с помощью прозрачной, эластичной, пластиковой трубки к входному отверстию ACTI-DISK-матричной основы, которую в свою очередь присоединяли через ее выходное отверстие к резервуару на 100 мл. Резервуар присоединяли с помощью трубок к входному отверстию насоса. Матричная основа ACTI-DISK (бионанесенные материалы, Группа Химических Продуктов ФМК Корпорейшн) содержала пластиковый кожух диаметром 63,5 мм и толщиной 6,4 мм, имеющий входное отверстие на одной из плоских сторон и выходное отверстие на противостороне. В пластмассовом кожухе содержалось 5 слоев пористой мембраны, проницаемой для жидкостей, состоящих из гидрофобной полимерной матрицы из поли(винилхлорида), тонкоизмельченного гидрофильного наполнителя из двуокиси кремния, диспергированного в слоистой матрице и сети связанных между собой микропор, пронизывающих материал.
В резервуар помещали 5 мл 5 мас./об. водного раствора глутарового альдегида для связывания N-содержащих ферментов с модифицированной ПЭИ ACTI-DISK и пропускали его со скоростью 8 мл/мин через матричную основу ACTI-DISK в течение 60 мин. Раствор заменяли на 50 мл воды и пропускали через ACTI-DISK в течение 30 мин. Затем воду из резервуара удаляли.
Разбавляли 28 мл водного раствора S-оксинитрилазного фермента, полученного из 7-ми дневных заспиртованных побегов травянистого гибрида Сорго / Судан (анализ на протеин 54 мг протеина / мл анализ на активность фермента: 10.7 ед./ мг протеина) до 100 мл 0,05 M раствором ацетатного (ацетат натрия) буфера (pH 5,4) и загружали в резервуар. Раствор пропускали через матричную основу ACTI -DISK в течение 30 мин. После этого времени направление потока через мембранную основу изменяли на противоположное для того, чтобы обеспечить полное и однородное нанесение фермента. Нанесение раствора фермента продолжали в течение еще 30 мин. Затем матричную основу ACTI -DISK промывали 50 мл воды в течение 30 мин по методике, описанной выше. Матричную основу с иммобилизованным S-оксинитрилазным ферментом вынимали из реактора и хранили в холодильнике.
Стадия В: Получение (S)-(циано) (3-феноксифенил) метанола из цианистого водорода и 3-феноксибензальдегида в ди-н- бутиловом эфире при комнатной температуре
В стандартный прокачиваемый насосом реактор вводили матричную основу ACTI-DISK со стадии 1, содержащую иммобилизованный фермент. Объем резервуара в этой системе был 250 мл или более. Из мембранной основы ACTI-DISK удаляли остаточную воду при помощи непрерывного пропускания небольшого количества ди-н-бутилового эфира через мембрану в течение 30 мин. В типичной загрузке в резервуар помещали раствор от 5,1 г (0 026 моль) до 24,8 г (0,125 моль) 3-феноксибензальдегида в 100 мл ди-н-бутилового эфира. К нему с помощью шприца добавляли 1,1 молярный эквивалент цианида водорода. Раствор перемешивали, чтобы обеспечить полное растворение цианистого водорода. Затем начинали циркуляцию раствора через матричную основу ACTI-DISK при скорости потока от 1 мл/мин до 5 мл/мин. Периодически отбирали пробы для проведения анализа, описанного ниже. После завершения реакции (обычно через 24 ч) реакционную смесь выкачивали из реактора. Затем матричную основу ACTI-DISK промывали путем прокачивания через нее 25 мл ди-н-бутилового эфира. После промывки реактор был готов для проведения следующего опыта.
Для каждой пробы, отобранной из реакционной смеси, проводили 2 анализа. Один анализ проводили для определения общей конверсии 3- феноксибензальдегида до циано-(3-феноксифенил)метанола, а второй анализ проводили для определения соотношения S- и R-изомеров в полученном продукте.
Для определения конверсии до циано-(3-феноксифенил)метанола образец реакционной смеси объемом 0,1 мл помещали в газохроматографическую автоматическую ампулу для отбора проб и разбавляли до приблизительно 1 мл метиленхлоридом. Затем добавляли N,O-бис(триметилсилил)трифторацетамид. Ампулу закрывали и встряхивали, после чего выдерживали 15 мин. Образец раствора вводили в газовый хроматограф с необходимыми параметрами.
Для определения соотношения S- и R-изомеров циано-(3-феноксифенил)метанола образец реакционной смеси помещали в ампулу на 1 драхм. Добавляли три капли хлорида кислоты Мошера хлорид S-(-)- α -метокси- a -(трифторметил)фенилуксусной кислоты) и пять капель пиридина. Полученную реакционную смесь перемешивали и выдерживали в течение 1 ч для того, чтобы закончилась реакция. Затем к реакционной смеси добавляли 1 мл воды и 1 мл этилацетата. Смесь встряхивали, слой этилацетата отделяли и помещали в газохроматографическую автоматическую ампулу для отбора проб. Образец раствора вводили в газовый хроматограф с определенными параметрами.
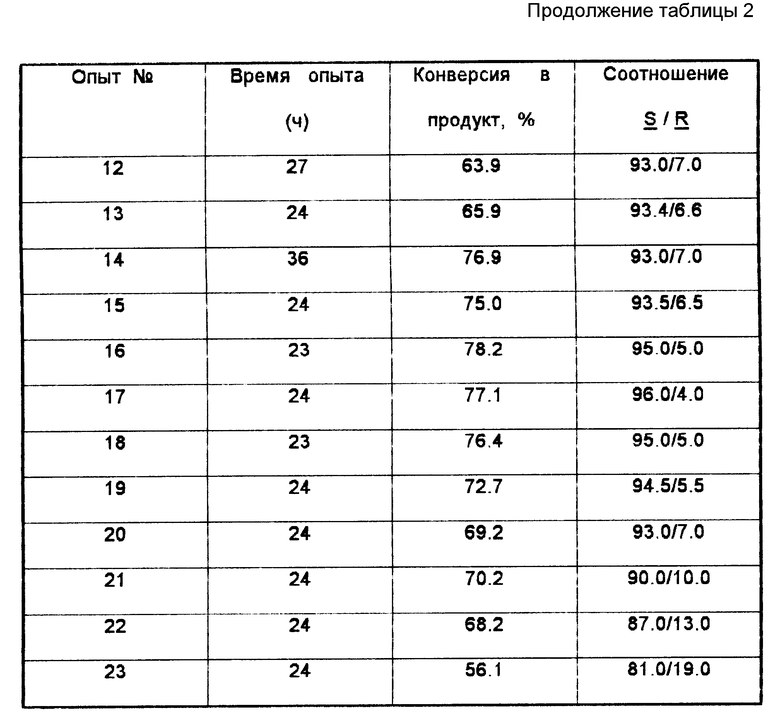
Результаты 7 опытов получения (S-циано-(3-феноксифенил)-метанола представлены в табл. 1.
Пример 2. Получение (S)-(циано)-(3-феноксифенил) метанола из цианистого водорода и 3-феноксибензальдегида в ди-н- бутиловом эфире при 6oC.
В данном примере (3)-циано-(3-феноксифенил) метанол получали в соответствии с методикой, описанной в примере 1. Прокачиваемый насосом реактор отличался тем, что матричная основа ACTI -DISK содержала только один слой проницаемой для жидкости микропористой мембраны, на которой закреплен S-оксинитрилазный фермент. Матричную основу ACTI-DISK, используемую в этом процессе, погружали в баню с постоянной температурой 6oC. Всего проведено 16 загрузок реагентов. Каждая загрузка содержала 1,0 драхм (0,005 моль) 3-феноксибензальдегида и 0,4-0,5 мл (с избытком) цианистого водорода в 25 мл ди-н-бутилового эфира. Скорость подачи поддерживали на уровне 4-5 мл/мин. Результаты 16 загрузок в процессе получения (S)- циано-(3-феноксифенил) метанола представлены в табл. 2.
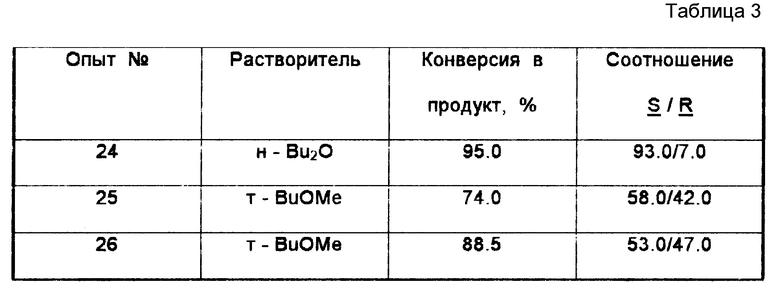
Пример 3. Получение (S)-(циано)-(3-феноксифенил) метанола из цианистого водорода и 3-феноксибензальдегида в трет-бутилметиловом эфире при комнатной температуре.
В этом примере (S)-(циано)-(3-феноксифенил) метанола получали по примеру 1. Прокачиваемый насосом реактор отличался тем, что матричная основа ACTI-DISK содержала только один слой проницаемой для жидкости микропористой мембраны, на которой закреплен фермент S-оксинитрилаэа. Всего проведено три загрузки реагентов. Каждая загрузка состояла из 1,0 драхмы (0,005 моль) 3- феноксибензальдегида и 0,5 мл цианистого водорода (последний используется в избытке для обеспечения полноты конверсии и для того, чтобы компенсировать любые потери из-за испарения). Растворителем в первой загрузке был ди-н-бутиловый эфир в количестве 50 мл, а в двух других загрузках использовалось по 50 мл трет-бутилметилового эфира. Продолжительность каждого опыта составляла 24 ч. Скорость подачи сохраняли на уровне 5 мл/мин. Результаты трех опытов по синтезу (S)-(циано)-(3-феноксифенил) ментола представлены в табл. 3.
Пример 4. Получение (S)-(циано)-(3-феноксифенил) метанола из цианида водорода и 3-феноксибензальдегида в ацетонитриле при комнатной температуре.
В этом примере (S)-(циано)-(3-фенилксифенил) метанол получали в соответствии с методикой примера 1. Проведен только один опыт. Загрузка составляла 25,0 г (0,126 моль) 3- феноксибензальдегида и 6 мл (избыток) цианистого водорода в 100 мл ацетонитрила. Реакцию проводили в течение 24 ч при скорости подачи 5 мл/мин. Конверсия в продукт составляла 88,0% а соотношение S/R-изомеров-52,0/48,0.
Пример 5. Получение (S)-(циано)-(3-феноксифенил) метанола из цианистого водорода и 3-феноксибензальдегида в тетрагидрофуране при комнатной температуре.
В данном примере (S)-(циано)-(3-феноксифенил) метанол получали по методике примера 1. Использовали загрузку, содержащую 5,0 г (0,025 моль) 3-феноксибенэальдегида и 1,5 мл (избыток) цианистого водорода в 100 мл тетрагидрофурана. Реакцию проводили 24 ч при скорости подачи 5 мл/мин. Конверсия в целевой продукт составляла 82,0% а соотношение S- и R-изомеров в продукте составляло 48,0/52,0.
Пример 6. Получение (S)-(циано)-(3-феноксифенил) метанола из цианида водорода и 3-феноксибензальдегида при комнатной температуре с использованием в качестве растворителя цианистого водорода.
В данном примере (S)-(циано)-(3-феноксифенил) метанол получали в соответствии с методикой примера 1. Прокачиваемый насосом реактор отличался тем, что матричная основа ACTI-DISK содержала только один слой проницаемой для жидкости микропористой мембраны, на которой закреплен фермент S-оксинитрилаза. Проводили одну загрузку, которая состояла из 1,0 г (0,005 моль) 3 -феноксибензальдегида в 20 мл цианистого водорода. Реакцию проводили в течение 24 ч при скорости подачи 5 мл/мин. Конверсия в продукт составляла 96,7% а соотношение S- и R-изомеров 58,1/41,9.
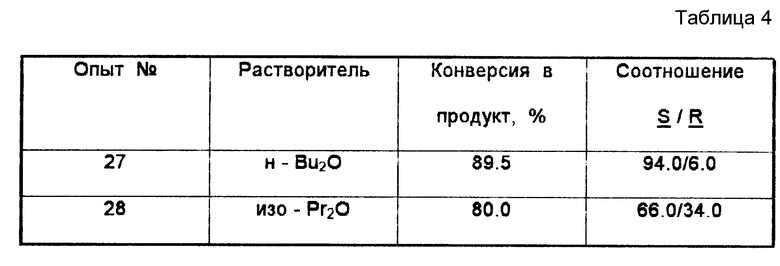
Пример 7. Получение (S)-(циано)-(3-феноксифенил) метанола из цианистого водорода и 3-феноксибензальдегида в диизопропиловом эфире при комнатной температуре.
Данный пример показывает, что диизопропиловый эфир, который используется в качестве растворителя, например в патенте 4859784 (см. выше), в рассматриваемом процессе не может быть использован.
В этом примере (S)-(циано)-(3-феноксифенил) метанол получали в соответствии с методикой примера 1. Прокачиваемый насосом реактор отличался тем, что матричная основа ACTI-DISK содержала только один слой проницаемой для жидкости микропористой мембраны, на которой иммобилизован S-оксинитрилазный фермент. Проведено две загрузки. В каждой загрузке использовалось 2,1 г (0,011 моль) 3-феноксибензальдегида и 0,6 мл (избыток) цианистого водорода. В качестве растворителя в первой загрузке использовали 50 мл ди- н-бутилового эфира, а во второй -50 мл ди-изопропилового эфира. Перед использованием ди-изопропиловый эфир очищали с помощью пропускания через колонку размерами 2,5 см x 28 см, содержащую нейтральную окись алюминия. Очищенный ди-изопропиловый эфир хранили в атмосфере азота. Между опытами реактор заполняли 75 мл очищенного ди-изопропилового эфира. В каждой загрузке время контактирования реагентов составляло 23-244. Скорость подачи равнялась 5 мл/мин. Результаты двух опытов по получению (S)-(циано)-(3 -феноксифенил) метанола представлены в табл. 4.
Использование: сельское хозяйство как промежуточный продукт в производстве инсектицидов. Сущность изобретения: способ предусматривает контактирование реакционной смеси, содержащей органический растворитель, альдегид и синильную кислоту, пропусканием через пористую мембрану, содержащую смолоподобное полимерное связующее вещество, содержащее частицы тонкоизмельченного наполнителя, диспергированные в связующем веществе, с которой фермент S-оксинитрилаза химически связан иммобилизацией посредством ковалентных или поперечных связей фермента со связывающим агентом. Мембрана химически активирована полиэтиленимином и глутаральдегидом. 9 з.п. ф-лы, 4 табл.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| US, 4859784, кл | |||
| ЭЛЕКТРОМЕХАНИЧЕСКИЙ СНЕГООЧИСТИТЕЛЬ ДЛЯ ЖЕЛЕЗНЫХ ДОРОГ | 1922 |
|
SU549A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| US, 4102746, кл | |||
| Регулятор давления для автоматических тормозов с сжатым воздухом | 1921 |
|
SU195A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| US, 5008192, кл | |||
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
Авторы
Даты
1997-10-10—Публикация
1992-11-13—Подача