Изобретение относится к медицине, точнее, к офтальмологии и может быть использовано при диагностике заболеваний и травм роговой оболочки глаза.
Известен препарат, содержащий 2% флуоресцеин-натрия и 1% метиленовую синь, применяемый для диагностики заболеваний роговицы (метод двойного окрашивания по Reis), когда лишенный эпителия участок окрашивается в синий цвет, а окаймляющая его зона в зеленый (Кацнельсон А.Б. Герпетические заболевания глаз. М. Медицина, 1969, с.41). Раствор метиленового синего окрашивает протоплазму и ядра поврежденных эпителиальных клеток, нервные стволы, волокна и их концевые колбы. Недостатком этого препарата является раздражающее действие метиленового синего на конъюнктиву глазного яблока, а также возникающее фоновое свечение. Из-за применения высоких концентраций красителей проводят вымывание излишков препарата из конъюнктивальной полости, что вызывает нежелательное окрашивание век, лица пациента и рук медперсонала.
Наиболее близким к предлагаемому препарату для диагностики заболеваний и травм роговой оболочки является 1% раствор флуоресцеина (Краснов М.Л. Шульпина Н.Б. Лекарственный справочник врача офтальмолога. МЕДГИЗ, 1958, с.102). С диагностической целью в конъюнктивальную полость закапывают 1-2 капли 1% раствора флуоресцеина, затем через 1-2 мин удаляют остатки препарата струйным промыванием физиологическим раствором, после чего проводят биомикроскопию глаза. В процессе диагностирования возникает фоновое свечение неповрежденных участков роговицы в результате использования больших концентраций флуоресцеина, что позволяет провести четкую диагностику только после вымывания излишков красителя физиологическим раствором. Другим недостатком 1% раствора флуоресцеина является его быстрая эвакуация слезой из конъюнктивальной полости ввиду низкой вязкости воды, вследствие чего происходит его исчезновение в течение 3-4 мин из поврежденных участков роговой оболочки. Метод приготовления препарата трудоемок: требует длительного времени подготовки и значительного количества импортного красителя. Готовят 2% содовый раствор, затем на 100 мл этого раствора берут 1 г флуоресцеина, раствор настаивают сутки, после чего его фильтруют.
Кроме того, при вымывании красителя физиологическим раствором из конъюнктивальной полости глаза происходит нежелательное окрашивание век, лица пациента и рук медицинского персонала.
Была поставлена задача повысить точность диагностирования заболеваний и травм роговой оболочки, сократить время проведения процедуры ее окрашивания и уменьшить расходы красителя.
Для решения поставленной задачи предложен препарат, содержащий флуоресцеин и водный раствор, отличающийся тем, что он содержит поливиниловый спирт при следующем соотношении компонентов, в мас.
Флуоресцеин 0,01-0,2%
Поливиниловый спирт 1%-2%
Дистиллированная вода остальное
Препарат в указанных концентрациях позволяет точно и детально биомикроскопировать дефекты роговой оболочки. Преимущество флуоресцеина в растворе поливинилового спирта заключается в пролонгировании действия флуоресцеина, сокращении его расхода и времени проведения процедуры ее окрашивания, так как исключают этап вымывания красителя физиологическим раствором из конъюнктивальной полости глаза, предлагая в препарате низкие концентрации флуоресцеина.
В результате экспериментальных исследований на кроликах при древовидном герпетическом кератите и непроникающей травме роговицы установлено, что применение более 0,2% раствора флуоресцеина в поливиниловом спирте дает неспецифическое фоновое окрашивание (ложно-положительный результат) при биомикроскопии глаза сразу после инстиллирования препарата в конъюнктивальную полость, а менее 0,01% дает незначительное окрашивание пораженных участков роговицы ввиду низкой концентрации флуоресцеина. При применении раствора, содержащего поливиниловый спирт менее 1% не достигается пролонгирующий эффект, так как он быстро смывается слезой, а при использовании более 2% его раствора не происходит образования стабильной прекорнеальной красящей слезной пленки роговицы ввиду высокой вязкости и низких смачивающих свойств, препарат как бы скатывается с роговой оболочки в виде шарика.
Препарат готовят следующим образом.
В 100 мл дистиллированной воды растворяют 1,0-2,0 г поливинилового спирта при постоянном помешивании для получения 1,0-2,0% раствора. В готовый водный раствор поливинилового спирта вносят 0,01-0,2 г флуоресцеина и перемешивают. Подготовленный раствор разливают во флаконы, укупоривают и подвергают стерилизации методом автоклавирования без изменения его свойств и активности.
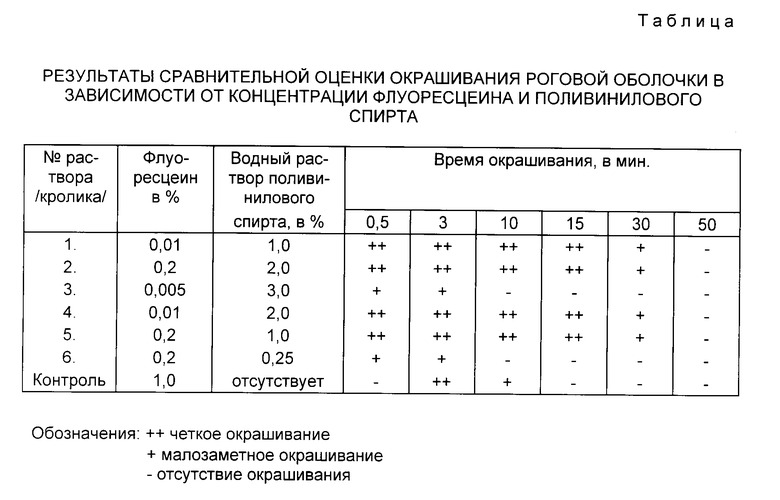
Пример 1. Для диагностики травмы роговой оболочки в опыте на кроликах, предлагаемым препаратом, были подготовлены следующие растворы: N 1 0,01% флуоресцеин в 1,0% водном растворе поливинилового спирта; N 2 0,2% флуоресцеин в 2% водном растворе поливинилового спирта; N 3 0,005% флуоресцеин в 3% водном растворе поливинилового спирта.
В качестве контроля взят 1% раствор флуоресцеина.
Для создания модели экспериментальной травмы под местной анестезией 0,25% раствором дикаина на роговицу обоих глаз 3-м кроликам (6 глаз) наносят стандартные травмы трепаном. В правый глаз кролика закапывают предлагаемые растворы: N 1 первому кролику, N 2 второму, N 3 третьему.
При осмотре щелевой лампой правого глаза первого кролика после инстилляции 1-2 капель раствора N 1 наблюдают, что краситель ровным слоем покрывает роговую оболочку, в течение 1 мин после внесения красителя окрашиваются дефекты эпителия, четкая флуоресценция которых длится до 15 мин, после чего наступает уменьшение свечения поврежденных участков эпителия роговицы, следы красителя обнаруживают до 50 мин (см. таблицу).
При биомикроскопии правого глаза второго кролика после инстиллирования 1-2 капель раствора N 2 наблюдают ровный слой красителя, покрывающий роговицу и окрашивающий дефекты эпителия в первую же минуту, четкая флуоресценция длится до 15 мин, а следы красителя обнаруживают в дефектах роговицы до 50 мин.
Как видно из таблицы, при использовании раствора N 3 у третьего кролика получают отрицательные результаты. Краситель нечетко и лишь в отдельных участках окрашивает дефекты эпителия роговицы ввиду высокой вязкости раствора и слабых смачивающих его свойств, при этом препарат как бы скатывается с роговицы.
При осмотре левого глаза каждого кролика (контроль) после инстиллирования 1% раствора флуоресцеина окрашивание наступает только после промывания излишков красителя физиологическим раствором и длится 3-4 мин, так как 1% раствор красителя быстро смывается с роговицы и эвакуируется слезой в слезно-носовой канал. Отрицательным является и то, что при диагностике указанным раствором окраске подвергаются веки и шерсть кролика, руки экспериментатора, чего не происходит при использовании предлагаемого препарата.
Пример 2. Для диагностики экспериментального древовидного кератита в опыте на кроликах предложенным препаратом готовят следующие растворы: N 4 - 0,01% флуоресцеин в 2% водном растворе поливинилового спирта; N 5 0,2% флуоресцеин в 1% водном растворе поливинилового спирта; N 6 0,2% флуоресцеин в 0,25% водном растворе поливинилового спирта.
Путем заражения вирусом простого герпеса [штамм Л2 титр 105ТЦД50 0,1 мл на роговице обоих глаз 3-х кроликов (NN 4-6)] получена экспериментальная модель герпетического древовидного кератита.
В правый глаз кролика закапывают предлагаемые растворы: N 4 четвертому кролику, N 5 пятому, N 6 шестому, а в левый глаз каждому из них 1% раствор флуоресцеина для сравнения с предлагаемыми выше растворами.
При осмотре щелевой лампой правого глаза четвертого кролика после закапывания 1-2 капель раствора N 4 сразу появляется древовидной формы окрашивание флуоресцеином пораженных участков роговицы, длящееся до 15 мин, после чего наступает уменьшение площади окрашивания и раскрашивание неповрежденных участков эпителия роговой оболочки.
После закапывания в правый глаз пятого кролика раствора N 5 биомикроскопически также наблюдают четкую флуоресценцию пораженных вирусом герпеса участков эпителия роговицы, на 15 мин уменьшение свечения и раскрашивание непораженных участков роговицы.
При использовании раствора N 6 у шестого кролика биомикроскопически наблюдают четкую флуоресценцию дефектов роговицы в течение 3-4 мин, что связано с быстрой эвакуацией данного раствора из конъюнктивальной полости из-за низкой его вязкости, связанной с недостаточной концентрацией поливинилового спирта (см. таблицу).
При осмотре левого глаза кроликов NN 4, 5 и 6 (контроль) окрашивание пораженных участков эпителия роговицы длится лишь 3-4 мин, так как 1% раствор флуоресцеина из-за низкой вязкости быстро смывается слезой, а также при промывании красителя физиологическим раствором происходит нежелательное окрашивание век и шерсти кролика, рук экспериментатора. Тогда, как при использовании предлагаемого нами препарата, этап промывания излишков красителя исключается ввиду содержания его в водном растворе поливинилового спирта в низких концентрациях.
Пример 3. Для диагностики герпетического древовидного кератита у больного М. в конъюнктивальную полость больного глаза инстиллируют 1-2 капли 0,01% флуоресцеина в 1,0% водном растворе поливинилового спирта. Биомикроскопически в течение первой минуты наблюдают четкую флуоресценцию пораженного вирусом герпеса эпителия роговой оболочки, которая длится до 15 мин, затем наступает уменьшение свечения, следы красителя обнаруживают в течение 50 мин.
Пример 4. Для диагностики травматической эрозии роговицы у больного Н. в конъюнктивальную полость больного глаза инстиллируют 1-2 капли 0,01% флуоресцеина в 1,0% водном растворе поливинилового спирта. Биомикроскопически в течение первой минуты наблюдают четкую флуоресценцию дефекта эпителия роговицы, которая длится до 15 мин, затем наступает уменьшение свечения, следы красителя обнаруживают в течение 50 мин.
Таким образом, предлагаемый препарат для диагностики заболеваний и травм роговой оболочки, содержащий флуоресцеин в водном растворе поливинилового спирта обладает значительными преимуществами в сравнении с прототипом, а именно: пролонгирует время окрашивания пораженных участков роговицы, что повышает точность диагностики, сокращает время приготовления препарата и самой процедуры ее окрашивания, при этом уменьшаются расходы импортного красителя.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРЕПАРАТ ДЛЯ ДИАГНОСТИКИ ЗАБОЛЕВАНИЙ И ТРАВМ РОГОВОЙ ОБОЛОЧКИ ГЛАЗА | 1995 |
|
RU2098089C1 |
| ПРЕПАРАТ ДЛЯ ДИАГНОСТИКИ ЗАБОЛЕВАНИЙ И ТРАВМ РОГОВОЙ ОБОЛОЧКИ ГЛАЗА | 1995 |
|
RU2142292C1 |
| ПРЕПАРАТ ДЛЯ ДИАГНОСТИКИ ТРАВМ И ЗАБОЛЕВАНИЙ РОГОВИЦЫ ГЛАЗА | 2014 |
|
RU2552318C1 |
| ПРЕПАРАТ ДЛЯ ДИАГНОСТИКИ ТРАВМ РОГОВИЦЫ ГЛАЗА | 2009 |
|
RU2404811C1 |
| СРЕДСТВО ОФТАЛЬМОЛОГИЧЕСКОЕ ДЛЯ ДИАГНОСТИКИ ТРАВМ И ЗАБОЛЕВАНИЙ РОГОВОЙ ОБОЛОЧКИ ГЛАЗА | 2016 |
|
RU2633083C1 |
| СПОСОБ ПОДБОРА КОНТАКТНЫХ ЛИНЗ | 1996 |
|
RU2134531C1 |
| СПОСОБ СОЗДАНИЯ МОДЕЛИ ХИМИЧЕСКОГО ОЖОГА РОГОВОЙ ОБОЛОЧКИ | 1995 |
|
RU2119685C1 |
| СПОСОБ ЛЕЧЕНИЯ ГЕРПЕТИЧЕСКОГО КЕРАТОКОНЪЮНКТИВИТА КРОЛИКОВ | 1992 |
|
RU2032401C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ГЕРПЕТИЧЕСКОГО КЕРАТИТА | 1996 |
|
RU2135187C1 |
| ГЛАЗНАЯ ПЛЕНКА | 1997 |
|
RU2173178C2 |
Использование: в медицине, а именно, в офтальмологии при диагностике заболеваний и травм роговой оболочки глаза. Сущность изобретения: средство содержит флуоресцеин и водный раствор поливинилового спирта, при этом компоненты взяты в следующем соотношении, мас.%: флуоресцеин 0,01-0,2, поливиниловый спирт 1-2, дистиллированная вода - остальное. 1 табл.
Средство для диагностики заболеваний и травм роговой оболочки, содержащее флуоресцеин и водный раствор вещества, отличающееся тем, что оно в качестве вещества содержит поливиниловый спирт при следующем соотношении компонентов, мас.
Флуоресцеин 0,01 0,2
Поливиниловый спирт 1,0 2,0
Дистиллированная вода Остальноей
| Краснов М.Л., Шульпина Н.Б | |||
| Лекарственный справочник врача офтальмолога.- М.: Медгиз, 1958, с | |||
| Транспортер для перевозки товарных вагонов по трамвайным путям | 1919 |
|
SU102A1 |
Авторы
Даты
1997-11-27—Публикация
1995-06-21—Подача