Изобретение относится к микробиологии, а именно к способам получения гидролизатов из отходов вакцинно-сывороточного и инкубаторного производства и использование их при изготовлении накопительных питательных сред для культивирования микроорганизмов и может быть использовано при промышленном приготовлении бактерийных вакцин.
Известен способ использования отходов биотехнологических производств как основы ферментационных сред для получения низина, заключающийся в выращивании на ферментационных средах, составленных на основе отходов биотехнологических производств молочнокислого лактококка, как продуцента антибиотика низина (Стоянова Л.П., Егоров Н.С., Баранова И.П., и др. Использование отходов биотехнологических производств как основы ферментационных сред для получения низина. В кн.: Современные достижения биотехнологии. Ставрополь, 1955, с. 77-78).
Недостатком данного способа является то, что он требует дополнительного включения в состав сред дрожжевого автолизата, кукурузных экстрактов, обрата, углеводов, свободных аминокислот для достижения стандартных параметров, что делает среду многокомпонентной.
Известен способ получения ферментативного гидролизата и питательная среда для культивирования клеток эукариотов, включающая обработку белоксодержащего сырья, разведенного водой, медицинским панкреатином или нативной поджелудочной железой свиньи, в щелочной зоне pH 7,6-7,8 в присутствии хлороформа при 37-38oC в течение 6-7 сут, прогревание при 90oC в течение 5-10 мин, последующее осаждение высокомолекулярных соединений, фильтрование целевого продукта, при этом фермент растворяют в воде в соотношении 1:25 и перед осаждением высокомолекулярных соединений проводят обработку гидролизата 20-22%-ным раствором хлористого кальция. Питательная среда для культивирования клеток эукариотов включает аминокислотную основу, комплекс витаминов, раствор Хенкса и сыворотку крови крупного рогатого скота, при этом в качестве аминокислотной основы используют ферментативный гидролизат обезжиренной, обезвоженной мозговой ткани крупного рогатого скота при следующем соотношении компонентов, об.%:
Ферментативный гидролизат обезжиренной, обезвоженной мозговой ткани крупного рогатого скота - 0,15 - 0,20
Комплекс витаминов - 0,0001 - 0,00012
Сыворотка крови крупного рогатого скота - 5 - 10
Раствор Хенкса - Остальное
(см. патент РФ N 2020153 кл. C 12 N 5/00, C 12 P 21/06).
Недостатком данного способа и питательной среды является то, что он ограничен использованием гидролизатов только из мозговой ткани крупного рогатого скота и применением на их основе питательных сред для культивирования эукариотов в виде гетероплоидных и диплоидных перевиваемых линий клеток тканей.
Наиболее близким к предлагаемому способу получения гидролизатов и принятые авторами за прототип является способ получения гидролизата белков крови ферментативного сухого (ГБК-С) для питательных сред тканевых культур клеток из отходов сывороточного производства, включающий измельчение 300 кг сгустков крови, соединение полученной массы с 480 л деминерализованной воды, нагревания ее до 80oC и выдержки в течение 30 мин, охлаждении до 50oC, установление pH 7,5±0,1 путем добавления 20%-ного раствора гидроокиси натрия, 1,5% хлороформа, добавление 200 л ферментного препарата и осуществление гидролиза в течение 48-60 ч при 40-42oC, постоянно осуществляя коррекцию pH среды в пределах указанного значения. Гидролиз завершен, если через 48-60 ч в нем отсутствует нерасщепленный белок, а накопление аминного азота достигает не менее 600 мг%. (Временное наставление по применению гидролизата, белков крови ферментативного сухого (ГБК-С) для питательных сред тканевых культур клеток, утвержденного зам.начальника Главного управления ветеринарии МСХ СССР 30.08.91.).
Недостатком данного способа и питательной среды (ПС) является то, что в качестве сырья использовались отходы только сывороточного производства в виде цельной крови и ее сгустков от крупного рогатого скота. Гидролиз сырья осуществлялся без предварительной химической обработки аммиаков, в результате чего не достигалось полного гидролиза, причем применялась только поджелудочная железа свиньи.
Наиболее близкой по ростовым свойствам питательной средой для культивирования микроорганизмов и принятая авторами за прототип является питательная среда на основе перевара Хоттингера, получаемая из ферментативных гидролизатов мяса и другого белковосодержащего сырья, имеющая следующий состав: аминокислотную основу, общий азот 1100-1200 мг%. (Виноградова И.Н. Производственные питательные среды. В кн.: Руководство по микробиологии, клинике и эпидемиологии инфекционных болезней. М.: Медгиз, 1962, с. 339-384).
Недостатком данной питательной среды является высокая стоимость. Целью изобретения является достижение полного гидролиза и снижение себестоимости продукта и питательной среды для культивирования микроорганизмов.
Поставленная цель достигается тем, что в способе получения гидролизатов включающем обработку белоксодержащего сырья ферментативным гидролизом нативной поджелудочной железой свиньи в щелочной зоне pH 7,5 в присутствии хлороформа в течение 48-60 ч при 40-42oC с добавлением 20%-ного раствора гидроокиси натрия, с последующим отделением от нерастворимых примесей, инактированием фермента, нейтрализацией до pH 7,0-7,2, сушкой целевого продукта, причем в качестве белоксодержащего сырья используют отходы вакцинно-сывороточного и инкубаторного производства в виде глобулинов, куриных эмбрионов, сгустков крови, фибрина и перед ферментативным гидролизом проводят аммиачный, причем сырье предварительно измельчают, растворяют в деминерализованной воде в соотношении для глобулинов 1:1,5, для куриных эмбрионов и фибрина 1:5, для сгустков крови 1:1,6, при этом обработку осуществляют 26%-ным водным раствором аммиака из расчета 19 мл раствора на 1 л смеси, в течение двух часов при 120oC, при этом аммиачный гидролизат охлаждают до 45oC, доводят pH до 7,0 двууглекислым натрием, причем ферментативный гидролиз проводят нативной поджелудочной железой крупного рогатого скота из расчета 200-256,4 г/л для глобулинов и сгустков крови и 83,3-166,6 г/л для куриных эмбрионов и фибрина в присутствии хлороформа при 42-43oC в течение 6-7 сут для глобулинов, 6 сут для куриных эмбрионов и фибрина и 4-5 сут для сгустков крови, при этом конечное накопление в целевом продукте азота в соотношении 500-700 мг%. Питательная среда для культивирования микроорганизмов включает аминокислотную основу, общий азот, при этом в качестве аминокислотной основы используют аммиачно-ферментативный гидролизат глобулинов, куриных эмбрионов, сгустков крови и фибрина при следующем соотношении химических соединений:
Общий азот - 1100 - 1200 мг%
Аминный азот - 200 - 220 мг%
Пептон - 1-0-2,0%
Триптофан - 80 - 200 мг%
Хлорид натрия - 0,6 - 1,2 мг%
Аммонийные соли - 0,04 - 0,1 мг%
Для реализации поставленной цели использовались белковые компоненты крови не только крупного рогатого скота, но и других видов сельскохозяйственных животных. Кроме сгустков крови подвергали ферментативному гидролизу фибрин крови, глобулины сыворотки крови, а также куриные эмбрионы, как отходы вакцинно-инкубаторного производства.
Перед ферментативным гидролизом обязательно подвергают аммиачному гидролизу. Необходимость аммиачного гидролиза заключается в том, что свободные глобулины и глобулины, содержащиеся в белках животного и растительного происхождения имеют структуры, в которых пептидные связи, как объекты воздействия протеолитических ферментов, скрыты внутри белка. Это затрудняет ферментолиз белка при воздействии на него ферментами поджелудочной железы. Поэтому глобулиновая фракция белка, не подвергалась полностью ферментному гидролизу, после отваривания материала и фильтрации, переходит в шлам. А в худшем случае она остается в гидролизате и затем при изготовлении питательной среды переходит в бульон и плохо используется микроорганизмами. В таком случае добиться прозрачности бульона, как необходимого показателя среды, не представляется возможным, даже при осаждении растворами кислот.
Для более полного высвобождения аминокислот глобулиновой фракции белка в способе предлагается предварительно воздействовать на нее 26% водным раствором аммиака, т.е. осуществить первый этап работы - аммиачный гидролиз.
По окончании аммиачного гидролиза глобулинов, куриных эмбрионов кровяных сгустков, фибрина, полученный гидролизат нейтрализовали растворами соляной или ортофосфорной кислот до значения pH 7,0. Полученный таким образом аммиачный гидролизат подвергали вторичному этапу гидролиза - воздействию ферментами поджелудочной железы. Ферментативный гидролизат осуществляли с применением поджелудочных желез крупного рогатого скота и он был более длительным, в течение 96-168 ч. Для поддержания значения pH на уровне 7,5±0,1 использовали вместо 20%-ного раствора едкого натра 26%-ный раствор двууглекислого натрия.
Сущность способа заключается в следующем. Для высвобождения аминокислот из белковосодержащих отходов вакцинно-сывороточного и инкубаторного производства - глобулинов, куриных эмбрионов, сгустков крови, фибрина, крови, подвергали их воздействию 26%-ным водным раствором аммиака, т.е. осуществляли первый этап работы, аммиачный (химический) гидролиз, гидролизуемый субстрат - куриные эмбрионы, сгустки крови и фибрин измельчали на мясорубке. Предварительно сырье разводили деминерализованной водой в соотношении: для глобулина 1:1,5, для куриных эмбрионов и фибрина 1:5, для сгустков крови 1: 1,6. К подготовленному таким образом сырью добавляли 26%-ный водный раствор аммиака из расчета 19 мл указанного раствора аммиака на 1 л смеси и воды. Гидролиз проводили в течение 2 ч при температуре 120oC и давлении в 1 атм.
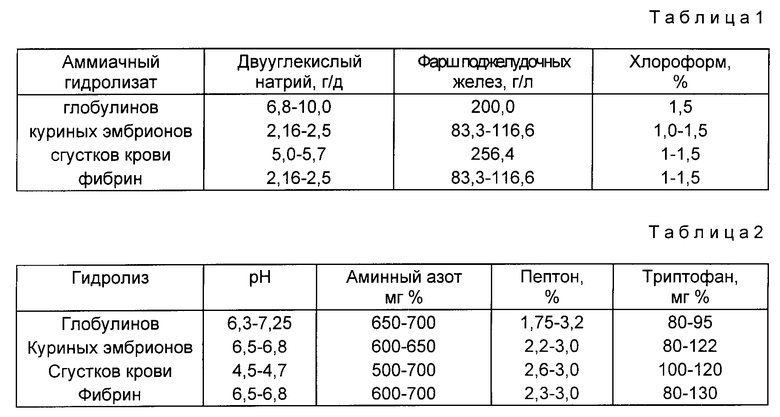
По окончании аммиачного гидролиза гидролизат охлаждали до 40oC, доводили pH гидролизуемого материала до 7,0 раствором соляной кислоты и приступали ко второму этапу работ-ферментативному гидролизу с применением ферментов поджелудочной железы крупного рогатого скота. Для этого в реактор к аммиачному гидролизату добавляли двууглекислый натрий, фарш поджелудочных желез крупного рогатого скота и хлороформ в следующих количествах (см. табл.1).
Ферментативный гидролиз осуществляли при температурах 42-43oC в течение 6-7 сут - для глобулинов, 6 сут - для куриных эмбрионов и фибрина, 4-5 сут - для сгустков крови.
В конечном гидролизате сырья получено следующее соотношение основных химических соединений (см. табл.2).
По завершению гидролиза гидролизаты глобулинов, куриных эмбрионов, сгустков крови и фибрина использовали при изготовлении питательных сред для культивирования листерий, сальмонелл, пастерелл и других микроорганизмов, используемых в биологической промышленности с целью приготовления вакцин для профилактики листериоза сельскохозяйственных животных, сальмонеллеза и других заболеваний животных и птиц.
Конкретное выполнение способа получения гидролизатов из отходов вакцинно-сывороточного и инкубаторского производства отражено следующих примерах.
Пример 1. Гидролиз глобулинов. Для более глубокого гидролиза глобулинов работы проводили в два этапа: первый - аммиачный гидролиз, второй - ферментативный гидролиз, с применением сырой или замороженной поджелудочной железа крупного рогатого скота.
Первый этап - аммиачный (химический) гидролиз глобулинов. Брали диализованный (обессоленный) глобулин, в котором не более 0,2% сернокислого аммония, 6,0-7,8% белка и pH 5,8-6,0, в количестве 200 л, добавляли в нему 300 л деминерализованной воды (соотношение глобулина и воды 1:1,5), вливали 9,5 л 26%-ного водного раствора аммиака из расчета 19 мл 26%-ного раствора аммиака на 1 л смеси глобулина и воды. Аммиачный гидролиз глобулинов проводили при температуре в гидролизуемом продукте 120oC в течение 2 ч. По окончанию аммиачного гидролиза глобулинов охлаждали реактор до температуры 45oC.
Аммиачный гидролизат обычно имеет щелочную реакцию, pH которой находится в пределах 10,5-11,5. Поэтому гидролизат нейтрализовали до значения pH 7,0 раствором соляной кислоты. Это необходимо делать для того, чтобы последующий ферментолиз глобулинов проходил успешно.
Второй этап - гидролиз нейтрализованного аммиачного гидролизата глобулинов ферментами поджелудочной железы.
К нейтрализованному аммиачному гидролизату глобулинов добавляли 3,4-5,0 кг двууглекислого натрия (17-25 г на 1 л глобулина), 100 кг фарша из очищенных поджелудочных желез крупного рогатого скота (500 г фарша поджелудочных желез на 1 л глобулина) и 1,5% хлороформа к гидролизуемой смеси 42-43oC, в течение шести-семи суток. Через двое суток после начала гидролиза отбирали пробу гидролизата и определяли в ней pH, количество аминного азота, пептона, триптофана, общего азота и хлористого натрия. При снижении pH в гидролизате ниже 7,0 добавляли двууглекислый натрия до значения pH 7,2-7,4.
По истечении времени ферментативного гидролизата глобулинов в пробах гидролизата при значении pH 6,3-7,27 получены и являются стандартными параметрами следующие соотношения химических соединений:
Аминный азот - 650 - 700 мг%
Пептоны - 1,75 - 3,2%
Триптофан - 80 - 95 мг%
Общий азот - 560 - 760 мг%
Хлорид натрия - 1,01 - 1,28%
Аммонийные соли - 0,036 - 0,1%
Гидролизат глобулинов отваривали 20-30 мин, отстаивали 30 мин и фильтровали. Гидролизат глобулинов готов для использования при изготовлении накопительных питательных сред для микроорганизмов. Гидролизат глобулинов консервируют хлороформом.
Пример 2. Гидролиз тканей куриных эмбрионов. Для более глубокого гидролизата тканей куриных эмбрионов работы проводили в два этапа: первый - аммиачный гидролиз, второй - ферментативный гидролиз, с применением сырой или замороженной поджелудочной железы крупного рогатого скота.
Первый этап - аммиачный (химический) гидролиз тканей куриных эмбрионов. 200 кг измельченных куриных эмбрионов, предварительно собранных как отходы вакцинно-инкубаторного производства, заливали 1000 л деминерализованной воды. К полученному объему в 1200 л смеси эмбрионального фарша и воды (соотношение 1:5) добавляли 19 л 26%-ного водного раствора аммиака из расчета на 1 кг куриных эмбрионов 95 мл указанного раствора аммиака, или (при расчете на воду) на 1 л воды 19 мл 26%-ного водного раствора аммиака, проводили подогревание продукта до температуры 120oC и осуществляли аммиачный гидролиз в течение 2 ч. В период проведения гидролиза периодически вели перемешивание гидролизуемой смеси.
По окончанию гидролиза охлаждали гидролизат до 45oC.
Аммиачный гидролизат тканей куриных эмбрионов обычно имеет щелочную реакцию, pH которой находится в пределах 9,0-9,7. Поэтому гидролизат тканей куриных эмбрионов нейтрализовали до значения pH 7,0 раствором соляной кислоты. Это необходимо делать для того, чтобы последующий ферментолиз эмбриональной ткани проходил успешно.
Второй этап - гидролиз нейтрализованного гидролизата эмбриональной ткани ферментами поджелудочной железы.
К нейтрализованному гидролизату эмбриональной ткани добавляли 2,6-3,0 кг двууглекислого натрия (13-15 г двууглекислого натрия на 1 кг куриных эмбрионов, или 2,16-2,5 г двууглекислого натрия на 1 л аммиачного гидролизата эмбриональной ткани), 100-200 кг фарша из очищенных поджелудочных желез крупного рогатого скота (0,5-1,0 кг фарша поджелудочных желез на 1 кг куриных эмбрионов, или 83,3-166,6 г фарша поджелудочных желез на 1 л аммиачного гидролизита эмбриональной ткани) и 1-1,5% хлороформа. Гидролиз вели при температуре в гидролизуемой смеси 42-43oC. Гидролиз осуществлялся в течение 6 сут. Через двое суток отбирали пробу гидролизата и определяли в ней pH, количество аминного азота, пептона, триптофана, общего азота и хлористого натрия. При снижении pH в гидролизате ниже 7,0, добавляли двууглекислый натрий pH 7,2-7,4.
По истечении ферментативного гидролиза эмбриональной ткани в пробах гидролизата при значении pH 6,5-6,8 получены и являются стандартными параметрами следующие соотношения химических соединений:
Амминный азот - 600 - 650 мг%
Пептон - 2,2 - 3,0%
Триптофана - 80 - 122 мг%
Общий азот - 1100 - 1200 мг%
Хлористый натрий - 1,01 - 1,03%
Аммонийные соли - 0,036 - 0,1%
Гидролизат эмбриональной ткани отваривали в течение 30-40 мин отстаивали 30 мин и фильтровали. Гидролизат эмбриональной ткани готов для использования при изготовлении накопительных сред для микроорганизмов.
Гидролизат эмбриональной ткани консервируют хлороформом.
Пример 3. Гидролиз кровяных сгустков. Для более глубокого гидролиза сгустков крови работы проводились в два этапа: первый - аммиачный гидролиз, второй - ферментативный гидролиз, с применением сырой или замороженной поджелудочной железы крупного рогатого скота.
Первый этап - аммиачный (химический) гидролиз кровяных сгустков. 300 кг измельченных сгустков крови, предварительно собранных как отходы сывороточного производства, и полученную массу заливали 480 л деминерализованной воды. К полученному объему в 780 л смеси фарша кровяных сгустков и воды (соотношение 1: 1,6) добавляли 14,8 л 26%-ного водного раствора аммиака из расчета 19 мл указанного раствора аммиака на 1 л смеси фарша из кровяных сгустков и воды, проводили подогревание продукта до 120oC и осуществляли гидролиз используемой массы в течение 2 ч. В период проведения гидролиза периодически вели перемешивание гидролизуемой смеси.
По окончанию гидролиза, гидролизат охлаждали до 45oC.
Аммиачный гидролизат сгустков крови обычно имеет щелочную реакцию, pH которой находится в пределах 10,5-11,5. Поэтому гидролизат нейтрализовали до значения pH 7,0 раствором соляной кислоты. Это необходимо делать для того, чтобы последующий ферментативный гидролиз сгустков крови проходил успешно.
Второй этап - гидролиз нейтрального аммиачного гидролизата сгустков крови ферментами поджелудочной железы.
К нейтрализованному гидролизату сгустка крови добавляли 3,9-4,5 кг двууглекислого натрия (13-15 г двууглекислого натрия на 1 кг кровяных сгустков, или 5,0-5,77 г на 1 л аммиачного гидролизата кровяных сгустков), 200 кг фарша из очищенных поджелудочных желез крупного рогатого скота (0,67 кг фарша поджелудочных желез на 1 кг кровяных сгустков или 256 4 г фарша поджелудочных желез на 1 л аммиачного гидролизата сгустков крови) и 1-1,5% хлороформа. Гидролиз вели при температуре в гидролизуемой смеси 42-43oC в течение 4-5 сут. Через двое суток после начала гидролиза отбирали пробу гидролизата и определяли в ней pH, количество аминного азота, пептона, белка, триптофана, общего азота и хлористого натрия. При снижении pH ниже 7,0 добавляли двууглекислый натрий до значения pH 7,2-7,4.
По истечении ферментативного гидролиза сгустков крови в пробах гидролизата при значении pH 4,5-4,7 получены и являются стандартными параметрами следующие соотношения химических соединений:
Амминный азот - 500 - 700 мг%
Пептона - 2,6 - 3,0%
Триптофан - 100,0 - 120,0 мг%
Общий азот - 1200 - 1400 мг%
Хлорид натрия - 1,0 - 1,2
Аммонийные соли - 0,03 - 0,1 \
Гидролизат сгустков крови отваривали в течение 30-40 мин, отстаивали 30 мин и фильтровали. Гидролизат сгустков крови готов для использования при изготовлении сред для микроорганизмов.
Гидролизат из сгустков крови консервируют хлороформом.
Пример 4. Гидролиз фибрина. Фибрин в виде плотных сгустков получают после дефирибринирования крови. Для более глубокого гидролиза фибрина работы проводились в два этапа: первый - аммиачный гидролиз второй - ферментативный гидролиз, с применением сырой или замороженной поджелудочной железы крупного рогатого скота. Оба этапа работы проводили в полном соответствии с технологией гидролиза тканей куриных эмбрионов, изложенной в примере 2, и полным соответствием всех количественных показателей.
Гидролиз фибрина осуществляли в течение 6 сут. По истечении ферментативного гидролизата фибрина пробы гидролизата исследовали. В пробах гидролизата при значении pH 6,5-6,8 должны быть следующие соотношения химических соединений:
Аминный азот - 600 - 700 мг%
Пептон - 2,3 - 3,0%
Триптофан - 80 - 120 мг%
Общий азот - 740 мг%
Остальной гидролизат фибрина отваривали в течение 30 - 40 минут, отстаивали 30 минут и фильтровали. Гидролизат фибрина готов для использования при изготовлении накопительных сред для микроорганизмов.
Гидролизат фибрина консервировали хлороформом.
Гидролизаты глобулинов, куриных эмбрионов, сгустков крови и фибрина использовали для приготовления питательных сред для производственных штаммов листерий, сальмонелл, пастерелл и некоторых других микроорганизмов, из которых готовят вакцины для профилактики листериоза сельскохозяйственных животных, сальмонеллеза и пастереллеза животных и птиц и других заболеваний.
Необходимым условием для приготовления многокомпонентных питательных сред для культивирования указанных микроорганизмов является то, что за основу берут гидролизаты отходов вакцинно-сывороточного и инкубаторного производства, приготовленные по технологиям приведенным в примерах 1-4. Соединяют их в различных соотношениях и разводят деминерализованной водой таким образом, чтобы питательные среды содержали не менее 160-180 мг% аминного азота. К таким средам добавляли предусмотренные инструкциями компоненты, необходимые для культивирования указанных микроорганизмов.
Готовые питательные среды должны быть прозрачными и иметь биохимические показатели, отраженные в примерах 5, 6, 7.
Пример 5. Готовая питательная среда для культивирования листерий штамма АУФ должна быть прозрачной, иметь pH 7,4-7,6, содержать:
Аминный азот - 200 - 220 мг%
Пептон - 1,2 - 2,0%
Триптофан - 80 - 200 мг%
Пример 6. Готовая питательная среда для культивирования сальмонелл - S. dublin N 3, S.typhimurium N 6, S.choleraesuis N 9 должна быть прозрачной, иметь pH 7,4-7,6, содержать:
Аминный азот - 200 - 220 мг%
Пептон - 0,5%
Триптофан - 70 - 80 мг%
Пример 7. Готовая питательная среда для культивирования пастерелл должна быть прозрачной, иметь pH 7,4 - 7,6, содержать:
Аминный азот - 175 - 200 мг%
пептон - 0,5%
Триптофан - 70 - 80 мг%
Приготовленные по описанию в примерах 1-4 технологиям гидролизаты могут быть использованы для приготовления питательных сред не только для культивирования листерий, сальмонелл и пастерелл, но и для культивирования других микроорганизмов.
Таким образом строгое соблюдение условий гидролиза белоксодержащих отходов вакцинно-сывороточного и инкубаторного производства и регулярный контроль физико-химических параметров гидролизата позволяют стандартный продукт, имеющий разброс количественных показателей химических соединений не более 5%.
При выращивании микроорганизмов в средах, приготовленных на основе гидролизатов, полученных по указанным в примерах 1-4 технологиям, накопление биомассы и количества живых микробных клеток было не ниже, чем в инструктивных, дорогостоящих средах.
Применение питательных сред для культивирования листерий, сальмонелл, пастерелл, приготовленных на основе гидролизатов из отходов вакцинно-сывороточного и инкубаторного производства по предлагаемому способу обеспечивает ежегодный экономический эффект не менее 1,5 миллиарда рублей (см. акт испытаний).
По сравнению с прототипом и известными техническими решениями предлагаемое изобретение имеет следующие преимущества:
при изготовлении питательных сред для микроорганизмов используются гидролизаты из более дешевого белковосодержащего сырья - отходов вакцинно-сывороточного и инкубаторного производства взамен дефицитных мясных продуктов;
для более полного высвобождения аминокислот из глобулинов сыворотки крови, куриных эмбрионов, сгустков крови, фибрина предлагается перед ферментативным гидролизом указанных отходов производства применять аммиачный (химический) гидролиз, обеспечивающий раскрытие пептидных связей белковых молекул и они становятся более доступными расщеплению всех белковых фракций при воздействии на них протеолитических ферментов поджелудочной железы;
применение гидролизатов из отходов вакцинно-сывороточного и инкубаторного производства при конструировании питательных сред для выращивания микроорганизмов (листерий, сальмонелл, пастерелл) с целью промышленного изготовления вакцин, обеспечивает ежегодный экономический эффект в сумме 1,5 млрд. рублей.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ГИДРОЛИЗАТА ИЗ ПРОДУКТОВ ПЧЕЛИНОГО ПРОИЗВОДСТВА ДЛЯ КУЛЬТИВИРОВАНИЯ СПИРОХЕТ | 2003 |
|
RU2279470C2 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ ЛЕПТОСПИР | 2000 |
|
RU2202608C2 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ГЛУБИННОГО КУЛЬТИВИРОВАНИЯ ХОЛЕРНОГО ВИБРИОНА | 2010 |
|
RU2425866C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГИДРОЛИЗАТА ИЗ ПЛОДОВ И КОЖУРЫ БАНАНОВ В КАЧЕСТВЕ СТИМУЛЯТОРА РОСТА ДЛЯ КУЛЬТИВИРОВАНИЯ ЛЕПТОСПИР | 2013 |
|
RU2534355C1 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ ЛАКТОБАКТЕРИЙ | 2009 |
|
RU2415922C1 |
| СПОСОБ И.К.ТУТОВА И В.И.СИТЬКОВА ПОЛУЧЕНИЯ СТИМУЛЯТОРА РОСТА МИКРООРГАНИЗМОВ И ЕГО ПРИМЕНЕНИЕ | 1996 |
|
RU2115720C1 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ | 2007 |
|
RU2348686C2 |
| СПОСОБ ПОЛУЧЕНИЯ ФЕРМЕНТАТИВНОГО ГИДРОЛИЗАТА И ПИТАТЕЛЬНАЯ СРЕДА "ЭПИДЕРМАТ-2" ДЛЯ КУЛЬТИВИРОВАНИЯ КЛЕТОК ЭУКАРИОТОВ | 1992 |
|
RU2068879C1 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ БИФИДОБАКТЕРИЙ И ЛАКТОБАЦИЛЛ"ЭПИДЕРМАТ" | 1992 |
|
RU2039814C1 |
| СПОСОБ ПОЛУЧЕНИЯ ОСНОВЫ ПИТАТЕЛЬНЫХ СРЕД ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ | 1994 |
|
RU2061038C1 |
использование: изобретение относится к микробиологии, а именно к способам получения гидролизатов из отходов вакцинно-сывороточного и инкубаторного производства и использованию их при изготовлении накопительных питательных сред для культивирования микроорганизмов и может быть использовано при промышленном приготовлении бактерийных вакцин. Сущность способа: для высвобождения аминокислот из белковосодержащих отходов их подвергают воздействию 26%-ным водным раствором аммиака, гидролизуемый субстрат измельчают. Предварительно сырье разводят деминерализованной водой в соотношении: для глобулина 1: 1,5, для куриных эмбрионов и фибрина - 1:5, для сгустков крови - 1: 1,6. К подготовленному таким образом сырью добавляют 26% водный раствор аммиака из расчета 19 мл на 1 л смеси и воды. Гидролиз проводят в течение двух часов при температуре 120oC. По окончании аммиачного гидролиза гидролизат охлаждают до 45oC, доводят pH гидролизуемого материала до 7,0 раствором соляной кислоты и приступали к ферментативному гидролизу с применением ферментов поджелудочной железы крупного рогатого скота. Ферментативный гидролиз осуществляют при 42 - 43oC в течение шести-семи суток - для глобулинов, шести суток - для куриных эмбрионов и фибрина, четырех - пяти суток - для сгустков крови. 2 с. и 2 з.п. ф-лы, 2 табл.
Пептон 1 2
Хлорид натрия 1,0 1,2
Аммонийные соли 0,03 0,1
а также, мг%
Общий азот 1100 1400
Аминный азот 200 220
Триптофан 80 200
2. Способ по п.1, отличающийся тем, что деминерализованную воду смешивают в соотношении 1,5 1,0 для глобулинов, 5 1 для куриных эмбрионов и фибрина, 1,0 1,6 для сгустков крови.
Пептон 1 2
Хлорид натрия 1,0 1,2
Аммонийные соли 0,03 0,1
а также, мг%
Общий азот 1100 1400
Аминный азот 200 220
Триптофан 80 200й
| Временное наставление по применению гидролизата белков крови ферментативного сухого (ГБК-С) для питательных сред тканевых культур клеток | |||
| Циркуль-угломер | 1920 |
|
SU1991A1 |
Авторы
Даты
1998-01-27—Публикация
1996-06-25—Подача