Изобретение относится к биотехнологии, в частности к питательным средам для культивирования микроорганизмов, и может быть использована при промышленном приготовлении бактерийных вакцин.
Уровень техники
Известна питательная среда для культивирования микроорганизмов, включающая аминокислотную основу, хлорид натрия, при этом в качестве аминокислотной основы используют аммиачно-ферментативный гидролизат отходов вакцинно-сывороточного производства и инкубаторного производства в виде глобулинов, или куриных эмбрионов, или сгустков крови, или фибрина, полученный путем аммиачного гидролизата измельченных смешанных с деминерализованной водой отходов и последующего гидролиза нативной поджелудочной железой крупного рогатого скота до содержания аминного азота 500-700 мг % при следующем соотношении химических соединений, мас.
а также, мг %
(см. пат. RU №2103345, кл.С 12 N 1/00, опубл. 27.01.1998 г.). Недостатком данной питательной среды является высокая стоимость.
Известна питательная среда следующего состава г/л: агар-агар - 20,0; гидролизат говяжьего мяса, содержащий аминный азот - 0,12%; натрий хлористый - 5,0; 20% гидроокись натрия - 0,002; дистиллированная вода до 1 л (Справочник по микробиологическим и вирусологическим методам исследования, Биргер М.О., 1972 г., с.53).
Недостатком данной среды является ее высокая себестоимость.
Наиболее близкой по технической сущности и достигаемому положительному эффекту и принятый авторами за прототип является питательная среда для культивирования широкого спектра микроорганизмов, включающая состав, г/л: гидролизат кильки панкреатический - 17,9; натрий хлорид - 7,7±0,3; агар микробиологический - 11,2±1,2; рН 7,3±0,2, дистиллированную воду (см. справочник помикробиологическим питательным средам, Меджидов М.М., 2003 г., с.26).
Питательная среда должна обеспечивать на всех засеянных чашках рост тест-штаммов: Shigella flexneri la 8516 и Shigella sonnei «S. Form» при посеве по 0,1 мл микробной взвеси каждого тест-штамма из разведения 10-6 через 18-20 ч инкубации при температуре (37±1)°С в виде бесцветных прозрачных круглых колоний диаметром (1,5±0,5) мм; тест-штаммов Pseudomonas aeruginosa 27/99 и Serratia marcescens-1 с образованием сине-зеленого и красного пигментов соответвенно через 18-20 ч инкубации при температуре (37±1)°С - для P. aeruginosa 27/99 и (22±2)°С для S. marcescens-1 при посеве по 0,1 мл микробной взвеси, соответствующей 10 единицам по ОСО 42-28-59-85 (Фармакопейная статья №42-3520-98, с.3).
Недостатком данной среды является ее высокая себестоимость.
Раскрытие изобретения
Задачей предлагаемого изобретения является получение качественной дешевой питательной среды для культивирования микроорганизмов.
Технический результат, который может быть получен с помощью предлагаемого изобретения, сводится к повышению качества и удешевлению получения питательной среды.
Технический результат достигается с помощью питательной среды для культивирования микроорганизмов, включающей питательную основу, натрий хлористый, агар микробиологический, дистиллированную воду, при этом среда дополнительно содержит натрий фосфорнокислый 2-замещенный и сульфит натрия, а в качестве питательной основы содержит ферментативный гидролизат лососевых рыб при следующем содержании ингредиентов, г/л:
Сущность получения питательной среды для культивирования микроорганизмов заключается в следующем.
В качестве исходного сырья используют молоки лососевых рыб ТУ 9267-037-33620410-04. Наиболее важной составной частью сырья животного происхождения, в том числе и молок, являются белки - высокомолекулярные азотистые органические вещества.
Приготовление ферментативного гидролизата из молок лососевых рыб заключается в следующем. Молоки лосевых рыб в количестве 0,5 кг режут на кусочки размером 2x3 см, заливают 1,0 л водопроводной воды, при помешивании нагревают до закипания, варят в течение 10 мин. Сваренные молоки встряхивают дуршлагом, остывшие молоки измельчают на мясорубке. Бульон остужают до 50°С, подщелачивают Na2CO3 до рН 8,2 по фенолфталеину. Фарш молок лососевых рыб помещают в трехлитровый стеклянный баллон, заливают готовым остывшим бульоном, добавляют 0,15 кг поджелудочной железы КРС.К общему объему содержимого баллона вливают 2% хлороформа, запробковывают плотно ватно-марлевым тампоном с пергаментом. Баллон помещают в термокамеру при температуре 37°С. Выдерживают в течение 5 суток, встряхивая в течение первых суток через каждые 15 минут по 5 минут, а в последующие дни - через каждые два часа по 5 минут. Затем на 6 сутки добавляют 0,1 кг пепсина, тщательно перемешивают и оставляют в термокамере на 10 дней при температуре 37°С, помешивая через каждые 2 часа. Ежедневно измеряют уровень аминного азота. Через 10 дней получается желеобразная жидкость, которая плохо фильтруется. В конце переваривания жидкость загустевает, напоминая по консистенции желе. При отсутствии такого загустевания перевар непригоден. По окончании переваривания, на 11 сутки, добавляют 400 мл 1H раствора HCL до рН 4,1 и кипятят в течение 10 мин, затем фильтруют через ткань Белтинга и 4 слоя фильтровальной бумаги. Измеряют аминный азот. Полученный гидролизат нейтрализуют 20% раствором NaOH до рН 7,0. В фильтрат добавляют 2% хлороформа, пробкуют резиновой пробкой, хранят при температуре от 2 до 8°С. Используют по мере необходимости.
Кроме того, молоки лососевых рыб исключают или сводят к минимуму наличие многих отрицательных факторов, присутствующих в мясе (антибиотики, нитриты, токсины и др.), содержат уникальный набор белков, аминокислот, витаминов, являющихся во время массового улова, зачастую, бросовым материалом. На поздних стадиях сперматогенеза у лососевых и родственных им рыб в ядрах клеток семенников появляется протамин - спермаспецифический белок низкого молекулярного веса с большим содержанием аргинина. Из спермы рыб можно выделить большое количество протаминов, таких как сальмин, клупеин, штуран (Современные исследования по биохимии рыб, Лавровская Н.Ф., 1973 г., с.6). Снижение количества белка в мышцах в нерестовый период связано с тем, что часть белков мышц участвует в формировании белковых продуктов половых органов (Современные исследования по биохимии рыб, Лавровская Н.Ф., 1973 г., с.9).
Питательную среду на основе ферментативного гидролизата готовят из молок лососевых рыб для выращивания микроорганизмов следующим образом. Ферментативный гидролизат из молок лососевых рыб разбавляют дистиллированной водой до показания аминного азота 0,14 мг % - 480 мл; натрий хлористый - 5,0; натрий фосфорнокислый 2-замещенный - 4,0; дистиллированная вода - остальное, нагревают до 60°С, затем добавляют 20% NaOH до рН 8,2 и 2% активированного угля марки «ОУ-А» к объему, кипятят в течение 10 минут. Фильтруют через фильтровальное полотно и двенадцать слоев фильтровальной бумаги, в прозрачный, охлажденный фильтрат добавляют агар микробиологический 12,0, варят 10 минут.
Измеряют рН, значение которого должно соответствовать 7,3±0,2. В качестве отклонения значение рН от заданного показателя его корректируют с помощью 20%) раствора натрия гидроокиси (если рН ниже заданного значения) или раствором соляной кислоты в разведении 1:1 (если рН выше заданного значения). Затем добавляют сульфит натрия 0,4 г/л (400 мг). Профильтрованный агар должен быть прозрачным (определение проводят визуально). Агар разливают в флаконы, стерилизуют при 0,5 атм в течение 30 минут.
Гидролизат и его качественная характеристика (аминный азот) находится в причинно-следственной связи с достигаемым техническим результатом, поэтому мы подробно описываем технологию приготовления ферментативного гидролизата молок лососевых рыб и характеризуем его качественные и количественные показатели, подтверждающие эффективность его применения для приготовления питательных сред.
Примеры конкретного получения питательной среды для культивирования микроорганизмов.
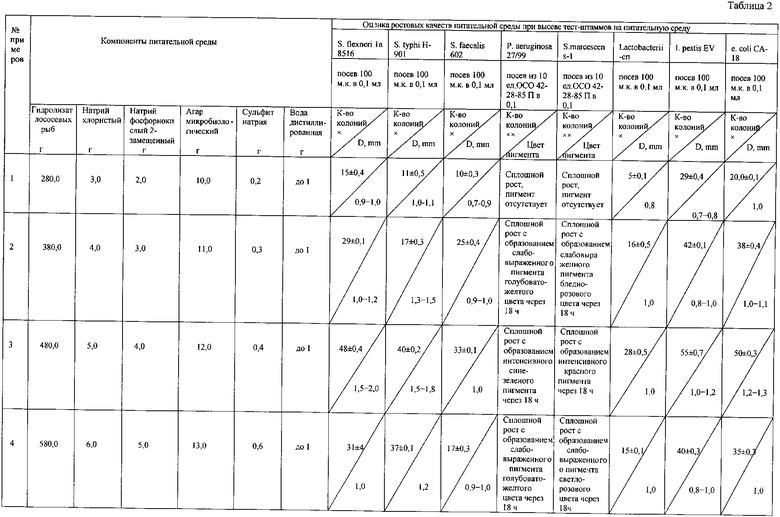
Пример 1. Питательную среду на основе ферментативного гидролизата готовят из молок лососевых рыб для выращивания микроорганизмов следующим образом. Ферментативный гидролизат молок лососевых рыб разбавляют дистиллированной водой до показания аминного азота 0,14 мг/% - 480 мл; натрий хлористый - 5,0; натрий фосфорнокислый 2-замещенный - 4,0; дистиллированная вода - остальное, нагревают до 60°С, затем добавляют 20% NaOH до рН 8,2 и 2% активированного угля марки «ОУ-А» к объему, кипятят в течение 10 минут. Фильтруют через фильтровальное полотно и двенадцать слоев фильтровальной бумаги, в прозрачный, охлажденный фильтрат добавляют агар микробиологический 12,0, варят 10 минут.
Измеряют рН, значение которого должно соответствовать 7,3±0,2. В качестве отклонения значение рН от заданного показателя его корректируют с помощью 20 раствора натрия гидроокиси (если рН ниже заданного значения) или раствором соляной кислоты в разведении 1:1 (если рН выше заданного значения). Затем добавляют сульфит натрия 0, 4 г/л (400 мг). Профильтрованный агар должен быть прозрачным (определение проводят визуально). Агар разливают в флаконы, стерилизуют при 0,5 атм в течение 30 минут.: S. flexneri la 8516; S. typhi H-901; S. faecalis-602; I. pestis Ev; P. aeruginosa 27/99; S. marcescens-1; Lactobacterium-СП; E.coli CA-18.
В качестве примера испытывают культуры тест-штаммов - выращивают на пластинках 2% агара Хоттингера рН 7,2 при температуре 37°С, а для I. pestis Ev при 28°С и для S. marcescens-1 при 22°С в течение 24-48 часов. Затем готовят микробную взвесь 1 суточную культуру тест-штаммов: S. flexneri; S. typhi H-901; S. faecalis-602; I. pestis Ev; Ps. aeruginosa 27/99; S. marcescens-1; E.coli CA-18; Lactobacterium-СП по оптическому стандарту мутности ОСО, ГИСК им. Л.А. Тарасевича, затем серийными десятикратными разведениями в физиологическом растворе в объеме 4,5 мл доводят до содержания в 1 мл 1000 м.к.; 100 м.к. Из каждого разведения взвеси культур высевают стерильной пипеткой по 0,01 мл в три чашки Петри, а для P. aeruginosa 27/99 и S. marcescens-1 из суспензии, соответствующей 10 единицам стандарта мутности ОСО 42-28-85-П, соответствующего года выпуска, стерильным шпателем распределяют взвесь по поверхности испытуемого агара. Учет результатов проводят через 24-48 часов. По поводу получения ферментативного гидролизата молок лососевых рыб с содержанием аминного азота 0,14%. Аминный азот нашего гидролизата (концентрированного) составил 252 мг%, а питательные потребности микроорганизмов, таких как S. flexneri la 8516; S. typhi H-901; S. faecalis-602; I. pestis EV; P. aeruginosa 27/99; S. marcescens-1; Lactobacterium-СП; E.coli CA-18, нуждаются в амином азоте для питательных сред 140 мг% или, если выразить в процентном содержании, то 0,14%), поэтому и разводят его дистиллированной водой, до нужной концентрации, таким образом, тест-штаммы S. flexneri la 8516; S. typhi H-901; S. faecalis-602; I. pestis Ev; P. aeruginosa 27/99; S. marcescens-1; Lactobacterium-СП; E.coli CA-18 выращивают на питательной среде, содержащей, г/л: ферментативный гидролизат молок лососевых рыб 280,0; натрий хлористый 3,0; натрий фосфорнокислый 2-замещенный 2,0; агар микробиологический 10,0; сульфит натрия 0,2; дистиллированная вода - остальное. При таком соотношении ингредиентов наблюдается сплошной рост и отсутствие пигмента для Ps. Acrusinosa 27/99; Ser. Marcescens-1, а также количество колоний, выросших на плотных пластинках агара для шести видов перечисленных тест-штаммов различных микроорганизмов, составляет при посевной дозе 100 м. к. - данные представлены в таблице 2.
Пример 2. Проводят аналогично примера 1, но тест-штаммы, указанные выше, выращивают на питательной среде, содержащей, г/л: ферментативный гидролизат молок лососевых рыб 380,0; натрий хлористый 4,0; натрий фосфорнокислый 2-замещенный 3,0; агар микробиологический 11,0; сульфит натрия 0,3; дистиллированная вода - остальное. При таком соотношении ингредиентов наблюдается сильный рост и образование пигмента бледно-выраженного для P. Aerusinosa 27/99; Ser. Marcescens-1, а также количество колоний, выросших на плотных пластинках агара для шести видов перечисленных тест-штаммов различных микроорганизмов составляет при посевной дозе 100 м. к. - данные представлены в таблице 2.
Пример 3. Проводят аналогично примера 1, но тест-штаммы, указанные выше, выращивают на питательной среде, содержащей, г/л: ферментативный гидролизат молок лососевых рыб 480,0; натрий хлористый 5,0; натрий фосфорнокислый 2-замещенный 4,0; агар микробиологический 12,0; сульфит натрия 0,4; дистиллированная вода - остальное. При таком соотношении ингредиентов наблюдается сплошной рост и интенсивное образование пигмента для Ps. Aerusinosa 27/99; Ser. Marcescens-1, а также количество колоний, выросших на плотных пластинках агара для шести видов перечисленных тест-штаммов различных микроорганизмов составляет соответственно при посевной дозе 100 м. к. - данные представлены в таблице 2.
Пример 4. Проводят аналогично примера 1, но тест-штаммы, указанные выше, выращивают на питательной среде, содержащей, г/л: ферментативный гидролизат молок лососевых рыб 580,0; натрий хлористый 6,0; натрий фосфорнокислый 2-замещенный 5,0; агар микробиологический 13,0; сульфит натрия 0,6; дистиллированная вода - остальное. При таком соотношении ингредиентов наблюдается сплошной рост и слабовыраженный пигмент для Ps. Aerusinosa 27/99; Ser. Marcescens-1, а также количество колоний, выросших на плотных пластинках агара для шести видов перечисленных тест-штаммов различных микроорганизмов составляет соответственно при посевной дозе 100 м. к. - данные представлены в таблице 2.
Таблица 1. Некоторые химические компоненты гидролизата из молок
лососевых рыб приготовленного по примеру №4
Пример 5. Проводят аналогично примера 1, но тест-штаммы, указанные выше, выращивают на питательной среде, содержащей, г/л: ферментативный гидролизат молок лососевых рыб 680,0; натрий хлористый 7,0; натрий фосфорнокислый 2-замещенный 6,0; агар микробиологический 14,0; сульфит натрия 0,7; дистиллированная вода - остальное. При таком соотношении ингредиентов наблюдается сплошной рост, пигмент отсутствует для Ps. Aerusinosa 27/99; Ser. Marcescens-1, а также количество колоний, выросших на плотных пластинках агара для шести видов перечисленных тест-штаммов различных микроорганизмов составляет соответственно при посевной дозе 100 м. к. - данные представлены в таблице 2.
Таким образом, заявляемая питательная среда, приготовленная на основе ферментативного гидролизата молок лососевых рыб вполне может заменить питательную среду на основе из говяжьего мяса и кильки панкреатической («Питательный агар для культивирования микроорганизмов сухой (СПА)» или именуется еще как панкреатический гидролизат кильки производство Россия, 367025, г. Махачкала, ул. Леваненского, д. 24, тел/факс (8722) 62-82-30).
Оценка ростовых качеств питательной среды при высеве тест-штаммов на питательную среду представлены в таблице 2.

Предлагаемое изобретение по сравнению с прототипом и другими известными техническими решениями имеет следующие преимущества:
- повышение качества питательной среды;
- удешевление получения питательной среды;
- возможность широкого использования для культивирования микроорганизмов.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ | 2009 |
|
RU2410424C1 |
| ПИТАТЕЛЬНАЯ СРЕДА ПЛОТНАЯ НА ОСНОВЕ ВТОРИЧНОГО ПРОДУКТА ГИДРОЛИЗАТА ГОВЯЖЬЕГО МЯСА ДЛЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ | 2017 |
|
RU2681499C1 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ БАКТЕРИЙ | 2008 |
|
RU2399660C2 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ВЫРАЩИВАНИЯ МИКРООРГАНИЗМОВ | 1993 |
|
RU2089609C1 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ YERSINIA PESTIS EV | 2018 |
|
RU2708029C1 |
| ПИТАТЕЛЬНАЯ СРЕДА ПЛОТНАЯ ДЛЯ КУЛЬТИВИРОВАНИЯ И СБОРА БИОМАССЫ ВАКЦИННОГО ШТАММА ЧУМНОГО МИКРОБА Y.pestis EV | 2018 |
|
RU2702174C1 |
| ПИТАТЕЛЬНАЯ СРЕДА ЖИДКАЯ С ПОВЫШЕННЫМИ НАКОПИТЕЛЬНЫМИ СВОЙСТВАМИ ДЛЯ ПОЛУЧЕНИЯ БИОМАССЫ YERSINIA PESTIS EV | 2022 |
|
RU2785826C1 |
| ПИТАТЕЛЬНАЯ СРЕДА ПЛОТНАЯ ДЛЯ КОНТРОЛЯ КОЛИЧЕСТВА ЖИВЫХ МИКРОБНЫХ КЛЕТОК ВАКЦИННОГО ШТАММА ЧУМНОГО МИКРОБА Y. PESTIS EV | 2020 |
|
RU2748492C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГИДРОЛИЗАТА ИЗ МОЛОК ЛОСОСЕВЫХ РЫБ | 2008 |
|
RU2352134C1 |
| НАКОПИТЕЛЬНАЯ ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ТРАНСПОРТИРОВКИ БИОМАТЕРИАЛА И ОБЪЕКТОВ ОКРУЖАЮЩЕЙ СРЕДЫ, КОНТАМИНИРОВАННЫХ ПОСТОРОННЕЙ МИКРОФЛОРОЙ, ПОДЛЕЖАЩИХ ИССЛЕДОВАНИЮ НА БРУЦЕЛЛЕЗ | 2020 |
|
RU2756201C1 |
Изобретение относится к биотехнологии и может быть использовано при промышленном приготовлении бактерийных вакцин. Питательная среда содержит ферментативный гидролизат молок лососевых рыб, натрий хлористый, натрий фосфорнокислый 2-замещенный, сульфит натрия, агар микробиологический и дистиллированную воду в заданном соотношении. Изобретение позволяет повысить ростовые качества питательной среды. 2 табл.
Питательная среда для культивирования микроорганизмов, включающая питательную основу, натрий хлористый, агар микробиологический, дистиллированную воду, отличающаяся тем, что она дополнительно содержит натрий фосфорнокислый 2-замещенный и сульфит натрия, а в качестве питательной основы содержит ферментативный гидролизат молок лососевых рыб при следующем содержании ингредиентов, г/л:
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ ВАКЦИННОГО ШТАММА ЧУМНОГО МИКРОБА | 2002 |
|
RU2245362C2 |
| Справочник по микробиологическим методам исследования, Под ред | |||
| Меджидова М.М | |||
| Механизм для сообщения поршню рабочего цилиндра возвратно-поступательного движения | 1918 |
|
SU1989A1 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ КЛЕТОК ЭУКАРИОТОВ И СПОСОБ ПОЛУЧЕНИЯ ОСНОВЫ ПИТАТЕЛЬНОЙ СРЕДЫ - ПРОТЕОЛИТИЧЕСКОГО ГИДРОЛИЗАТА | 1996 |
|
RU2103360C1 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ ЭШЕРИХИЙ | 1997 |
|
RU2142506C1 |
Авторы
Даты
2009-03-10—Публикация
2007-04-20—Подача