Предметом настоящего изобретения является применение кумаринов в качестве PLA2 - ингибиторов, новые производные кумарина, способ их получения и лекарственные средства, содержащие эти соединения.
Изобретение касается производных кумарина общей формулы I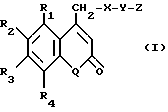
в которой R1 - водород или С1-С6-алкил,
R2 - остаток ОТ1 или
R3 - остаток ОТ2,
R4 - водород или C1-C6-алкил,
T1 и T2, которые могут быть одинаковыми или разными, и каждый означает водород, C1- C6-алкил, C1-C6--алконоил, или T1 и T2 совместно с атомами, к которым они присоединены, образуют 5-7-членное гетероциклическое кольцо, которое при желании может быть замещено оксо или тиоксо, или
Q - атом кислорода
X - атом серы или NH -группу,
Y - валентная связь, C1-C6-алкиленовый остаток, который при желании может быть замещен гидроксигруппой или аминогруппой, фениленовый остаток, который при желании может быть одно- или многократно замещен гидроксилом, галогеном, C1-C6-алкилом или карбоксилом,
Z - водород, галоген, карбоксил гидроксиметил, C1-C6-алкоксикарбонил, циано или группу NR5R6, причем R5 и R6 совместно с атомом азота, к которому они присоединены, образуют 3-7-членное гетероциклическое кольцо, которое при желании может быть замещено оксо, гидрокси или C1-C6-алкокси, их таутомеры, а также их соли с нетоксическими кислотами или основаниями.
Соединения формулы I отчасти известны. Так, например в chem Abstr. 60, 4114b описаны соединения формулы 1 с R1 = R4 = H, R2 = R3=OH, Q = O, X = Y = валентность и Z = NR5R6 в качестве средства лечения заболеваний сосудов. В chem abstr 84, 159773 указывается, что такие вещества не ингибируют каррагениновый отек.
Соединения с R1 = R4 = H, R2 и R3=OH или алкил = OH, Q = O, X -валентность, Y = алкилен и Z = водород описываются например в chem. abstr 68, 76748z в качестве ингибиторов фенилаланингидролазы, соединения с R1=R4=H, R2 и R3 совместно = метилендиокси или R2= R3=OCH3, Q = O, X=Y=валентность и Z = карбоксил или алкоксикарбонил описаны в chem abstr 100, 31674k и 112, 151027w в качестве флуоресцентных маркеров.
Синтез 4-метил-6,7-дигидроксикумарина описан в chem Ber.34, 423 (1901). Из chem. abstr 60, 4113, (1964) или 18/3v 233 известен 4-хлорметил-6,7-дигидроксикумарин.
Противовоспалительная активность или PLA2 - ингибиторная активность не упомянуты.
Соединения формулы I обладает ценными фармакологическими свойствами, в частности они могут ингибировать активность фосфолипаз. Поэтому они пригодны для лечения острых и хронических, аллергических, неаллергических и травматических и воспалительных заболеваний, как например ревматического артрита, остеоартрита, язвенного колита, острого панкреатита, контактного дерматита, воспалительных и аллергических заболеваний дыхательных путей, септического шока, аллергического шока, сывороточной болезни, аутоиммунных заболеваний, реакций "трансплантат против хозяина", заболеваний "хозяин против трансплантата", ишемических или тромботических заболеваний, например коронарного инфаркта или церебрального инфаркта.
Алкильные остатки в названных группах алкил, алкокси и алканоил могут быть прямоцепными или разветвленными. Предпочтительными остатками являются метильный, этильный, пропильный, изопропильный, н-бутильный, изобутильный, трет-бутильный, н-пентильный и 3-пентильный остатки.
Алкиленовые остатки могут быть линейными или разветвленными. Предпочтительными остатками являются метилен, 1,2 - этилен, 1,1-этилен, 1,3-пропилен, 1,2-пропилен и 2.2-пропилен.
Атомы галогена - это, в частности, фтор, хлор и бром.
Предпочтительны остатки, дающие возможность R5 и R6 совместно с атомом азота образовывать гетероциклическое кольцо, следующие: -CH2-CH2-CH2-CH2-; -CH2-CH2-CH2-CH2-CH2-; -CH2-CH2-O-CH2-CH2-; CH2-CH2- S-CH2-CH2-. Помимо соединений, указанных в примерах, предметом изобретения являются, в частности, все соединения, и имеющие любую возможную комбинацию названных в примерах заместителей.
Предметом изобретения являются также новые соединения формулы I, в которых X не является валентной связью, а также их соли с нетоксичными кислотами или основаниями.
Способ получения соединений формулы 1 характеризуется тем, что соединение общей формулы II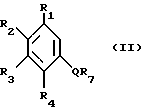
в которой R1 - R4, а также Q имеют вышеуказанное значение и R7 обозначает водород или C1 - C6 - алканоильный остаток, известным образом подвергают взаимодействие с соединением общей формулы III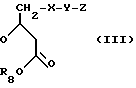
в которой X, Y, и Z имеют вышеуказанное значение и R8 обозначает C1 - C6-алкильный остаток, и циклизируют, затем при желании один или несколько остатков R1 - R4, X, Y или Z превращают соответственно в другой определяемый пунктом патентной формулы остаток, а также при желании путем нейтрализации нетоксичными кислотами или основаниями превращают в соль.
Взаимодействие соединений формулы II с соединениями формулы III целесообразно проводить в кислой среде, например в разбавленной серной кислоте, или в неводном растворителе в присутствии кислоты Льюиса, как, например, хлорида цинка или хлорида алюминия, при нагревании.
Проводимое при желании последующее превращение одного или нескольких остатков означает, например,
- отщепление алкильного или алканоильного остатка, обозначенного через T1 и/или T2, путем расщепления эфира или, соответственно, гидролиза или введения его путем алкилирования или, соответственно, этерификации,
- замену обозначенного через XYZ атома галогена путем нуклеофильного обмена с образованием O-YZ-, NH-YZ- или S-YZ -группы, C N - группы или группы N R5R6,
- омыление обозначенной через алкоксикарбонильной или цианогруппы до карбоксильной группы,
- этерификацию обозначенной через Z карбоксильной группы до алкоксикарбонильной группы,
- восстановление алкоксикарбонильной или карбоксильной группы до гидроксиметильной группы.
Соединения формул II и III известны из литературы и могут быть синтезированы тривиальным способом из известных исходных веществ.
В качестве фармакологически переносимых солей могут рассматриваться, в частности, соли щелочных металлов, щелочно-земельных металлов, и аммония, а также, при необходимости соли с нетоксическими неорганическими или органическими кислотами, как, например, соляная кислота, серная кислота, фосфорная кислота, бромистоводородная кислота, уксусная кислота, молочная кислота, лимонная кислота, яблочная кислота, бензойная кислота, салициловая кислота, малоновая кислота, малеиновая кислота, янтарная кислота или диаминокапроновая кислота.
Соли получают обычным способом, например путем нейтрализации соединений формулы I соответствующими щелочами или кислотами.
Для получения лекарственных средств соединения общей формулы I известным образом смешивают с подходящими фармацевтическими веществам - носителями, ароматическими, вкусовыми или красящими веществами и формуют, например, в виде таблеток или драже, или суспендируют или растворяют в воде или масле, как например оливковом масле, добавляя соответствующие вспомогательные вещества.
Вещества общей формулы I могут вводиться в организм в жидкой или твердой фазе орально или парентерально. В качестве инъекционной среды в основном применяют воду, содержащую обычные для инъекционных растворов стабилизатора, агенты растворения и/или буфера. Такого рода добавками являются, например, тартратный или боратный буфер, этанол, диметилсульфоксид, комплексообразователи (как например, этилендиаминтетрауксусная кислота), высокомолекулярные полимеры (как например, жидкий полиэтиленоксид) для регулирования вязкости или полиэтиленовые производные сорбитангидридов.
Твердыми носителями являются, например, крахмал, лактоза, маннит, метилцеллюлоза, тальк, высокодисперсная кремневая кислота, высокомолекулярные полимеры (как-то: полиэтиленгликоли).
Составы, пригодные для орального введения, могут при необходимости содержать вкусовые и подслащивающие вещества. Для наружного применения вещества 1 согласно изобретению могут применяться также в форме порошков и мазей. Для этого их смешивают, например, с порошкообразными, физиологическими переносимыми разбавителями или, соответственно, обычными основами для мазей. Вводимая доза зависит от возраста, здоровья и веса пациента, тяжести болезни, вида, возможно, проводимых одновременно других процедур лечения, частоты процедур лечения и вида желаемого действия. Обычно ежедневная доза активного соединения составляет от 0,1 до 50 мг/кг веса тела. Как правило, для получения желаемых результатов действенные дозы от 0,5 до 40 и предпочтительно от 1,0 до 20 мг/кг за одно или несколько применений в день.
Помимо названных в примерах веществ предпочтительны, в смысле изобретения, следующие соединения:
6,7-дигидроксикумарин-4-уксусная кислота (выход 35%, т.пл. 210 - 212oC, вода);
6,7-дигидрокси-4-(2-гидрокси-этил)кумарин;
3-(6,7-дигидроксикумарин-4-ил)пропионовая кислота;
6,7-дигидрокси-4-(2,3-дигидрокси-пропокси)метилкумарин;
3-(2-оксо-2H-пирано(3,2-g)хинолин-4-ил-метилмеркапто)- пропионовая кислота;
3-(6-гидрокси-3-оксо-3,7,8,9-тетрагидро-циклопента-(f)-(1) бензопиран-1-ил-метилмеркапто)пропионовая кислота;
3-(6-гидрокси-3-оксо-7,8,9,10-тетрагидро-3H-нафто-(2,1-b)-пиран- 1-ил-метилмеркапто)пропионовая кислота;
3-(6-гидрокси-3-оксо-3H-нафто-(2,1-b) в пиран-1-ил- метилмеркапто)пропионовая кислота;
3-(5-аллил-6-гидрокси-3-оксо-3H-нафто(2,1-b)-пиран-1-ил- метилмеркапто)пропионовая кислота;
3-(6-гидрокси-3-оксо-5-пропил-3H-нафто(2,1-b)-пиран-1-ил- метилмеркапто)пропионовая кислота;
3-(1,2-дигидро-2-оксо-хинолин-4-ил-метилмеркапто)- пропионовая кислота.
Пример 1. 4-Метил-6,7-дигидроксикумарин.
К смеси из 5,8 мл этилового эфира ацетоуксусной кислоты и 11,4 г 1,2,4-триацетоксибензола прибавляют по каплям 45 мл 75%-ной серной кислоты, нагревают 30 минут до 80oC, выливают на лед, фильтруют, промывают осадок до нейтральной реакции и сушат в вакууме. Получают 8,2 г целевого соединения (95% от теории) с т.пл. от 270 до 272oC.
Пример 2.
Способом, аналогичным описанному в примере 1, получают:
a) 4-хлорметил-6,7-дигидроксикумарин из 1,2,4-триацетоксибензола и 4-хлорацетоуксусного эфира (выход 81%, т.пл. 262oC, этанол);
b) 4-бромметил-6,7-дигидроксикумарин из 1,2,4-триацетоксибензола и 4-бромацетоуксусного эфира (выход 62%, т.пл. 246-248oC, этанол);
c) 4-(2-карбокси-фенилтио)метил-6,7-дигидроксикумарин из 1,2,4-триацетоксибензола и 4-(2-карбокси-фенилтио)ацетоуксусного эфира (выход 52%, т.пл. 275-277oC, метанол);
d) 4-бромметил-7-метоксикумарин из 3-метоксифенола и 4-бромацетоуксусного эфира (выход 47%, т.пл. 205-207oC, эфир);
e) 4-бромметил-6-метоксикумарин из 4-метоксифенола и 4-бромацетоуксусного эфира (выход 45%, т.пл. 169-171oC);
f) 4-бромметил-6-метилендиоксикумарин из 3,4-метиленодиоксифенола и 4-бромацетоуксусного эфира (выход 53%, т.пл. 240-242oC, метанол).
Пример 3. 4-N,N-Диметиламинометил-6,7-дигидроксикумарин.
К раствору 4,5 г диметиламина в 300 мл метанола прибавляют 54,7 г соединения примера 2a, перемешивают в течение ночи при комнатной температуре, фильтруют, сгущают и хроматографируют на кизельгеле (элюент этилацетат : метанол 9: 1). Выделяют 3,3 г целевого соединения (56% от теории) с точкой плавления от 212 до 215oC.
Пример 4.
Способом, аналогичным описанному в примере 3, получают (в скобках даны выход (%) и т.пл.,oC):
a) 4-пиперидинометил-6,7-дигидроксикумарин, гидрохлорид из соединения примера 2a и пиперидина (58%, 190-192oC, ацетон);
b) 4-морфолинометил-6,7-дигидроксикумарин, гидрохлорид из соединения примера 2a и морфолина (67%, выше 270oC, этанол);
c) 4-(4-метокси-пиперидино)метил-6,7-дигидроксикумани, -гидрохлорид из соединения примера 2a и метокси-пиперидина (48%, 232-234oC, этанол);
d) 4-(2-карбокси-фенилтио)метил-6,7-дигидроксикумарин из соединения примера 2a и тиосалициловой кислоты (45%, 275-277oC, этанол);
e) 4-(этоксикарбонилметилтио)метил-6,7-дигидроксикумарин из соединения примера 2a и этилового эфира меркаптоуксусной кислоты (64%, масло);
f) 4-(2-этоксикарбонил-этилтио)метил-6,7-дигидроксикумарин из соединения примера 2a и этилового эфира 3-меркапто-пропионовой кислоты (58%, масло);
g) 4-(4-метокси-пиперидино)метил-7-гидроксикумарин из соединения примера 8 и 4-метоксипиперидина (81%, 151-153oC, эфир);
h) 4-(3-карбокси-фенилтио)метил-6,7-дигидроксикумарин из соединения примера 2a и 3-меркаптобейзойной кислоты;
i) 4-(4-карбокси-фенилтио)метил-6,7-дигидроксикумарин из соединения примера 2a и 4-меркаптобейзойной кислоты;
j) 4-(2-карбокси-фенилтио)метил-6-гидроксикумарин из соединения примера 7 и тиосалициловой кислоты (52%, 262-264oC, метанол);
k) 4-(2-карбокси-фенилтио)метил-7-гидроксикумарин из соединения примера 8 и тиосалициловой кислоты (89%, 136-138oC, вода);
l) 4-(2-карбокси-фенилтио)метил-7-гидроксикумарин из соединения примера 2a и тиосалициловой кислоты (45%, 238-240oC, этилацетат);
m) 4-(2-карбокси-фенилтио)метил-6,7-метилендиоксикумарин из соединения примера 2f и тиосалициловой кислоты;
n) 4-(2-карбокси-фенокси)метил-6,7-дигидроксикумарин из соединения примера 2a и салициловой кислоты;
o) 4-(2,6-дикарбокси-фенилтио)метил-6,7-дигидроксикумарин из соединения примера 2a и 2-меркапто-изофталевой кислоты;
p) 4-аминометил-6,7-дигидроксикумарин из соединения примера 2a и аммиака;
q) 4-(2-карбокси-анилино)метил-6,7-дигидроксикумарин из соединения примера 2a и антраниловой кислоты;
r) 4-(3-карбокси-анилино)метил-6,7-дигидроксикумарин из соединения примера 2a и 3-амино-бензойной кислоты;
s) 4-(4-карбокси-анилино)метил-6,7-дигидроксикумарин из соединения примера 2a и 4-амино-бензойной кислоты;
t) 4-гидроксиметил-6,7-дигидроксикумарин из соединения примера 2a и воды (15%, 229-232oC, вода);
u) 4-цианометил-6,7-дигидроксикумарин из соединения примера 2a и цианида натрия (43%, 129-131oC, эфир);
v) 2-(6,7-дигидроксикумарин-4-ил-метилмеркапто)этанол из соединения примера 2a и 2-меркапто-этанола (58%, 208-210oC, эфир);
w) (L)-S-(6,7-дигидроксикумарин-4-ил-метил)-цистеин из соединения примера 2a и (L)-цистеина (66%, 182-184oC, вода);
x) 4-(6,7-дигидроксикумарин-4-ил-метил-меркапто)масляная кислота из соединения примера 2a и 4-меркапто-масляной кислоты (34%, 163-165oC, этилацетат);
y) 4-(2-гидрокси-этиламино)метил-6,7-дигидроксикумарин- гидрохлорид из соединения примера 2a и этаноламина (34%, 225-227oC, ацетат);
z) 4-(2-амино-этиламино)метил-6,7-дигидроксикумарин- гидрохлорид из соединения примера 2a и этилендиамина (47%, 208-210oC, вода);
aa) 4-н-бутиламинометил-6,7-дигидроксикумарингидрохлорид из соединения примера 2a и н-бутиламина (28%, 218-220oC, ацетон);
ab) 4-N,N-диэтиламинометил-6,7-дигидроксикумарин-гидрохлорид из соединения примера 2a и диэтиламина (38%, 226-228oC, ацетон);
ac) 4-(4-оксо-пиперидино)метил-6,7-дигидроксикумарин-гидрохлорид из соединения примера 2a и 8-аза-1,4-диоксаспиро(4,5)декана (55%, 233-235oC, вода);
ad) 4-(/1-гидрокси-2-гексил/амино)метил-6,7-дигидроксикумарин- гидрохлорид из соединения примера 2a и DL--2-амино-1-гексанола (17%, 200-202oC, ацетон).
Пример 5. 6,7-Дигидроксикумарин-4-ил-метилмеркаптоуксусная кислота.
Смесь из 3,1 г соединения примера 4e и 300 мл 50%-ной уксусной кислоты нагревают 24 часа с обратным холодильником. Сгущают, вносят в разбавленный раствор бикарбоната натрия, промывают этилацетатом, подкисляют водную фазу и отфильтровывают продукт. Остаются 2,1 г целевого соединения (74% от теории) с т.пл. 254-256oC.
Пример 6. Способом, аналогичным описанному в примере 5, получают:
a) 3-(6,7-Дигидроксикумарин-4-ил-метилмеркапто) пропионовая кислота из соединения примера 4 (выход 72%, т.пл. 234-236oC, вода).
Пример 7. 4-Бромметил-6-гидроксикумарин.
Смесь из 2,7 г соединения примера 2e, 100 мл дихлорметана и 5,6 мл бортрибромида перемешивают 4 часа при комнатной температуре, выливают на лед и отфильтровывают продукт. Выделяют 1,8 г целевого соединения (71% от теории) с т.пл. от 198 до 200oC.
Пример 8. Способом, аналогичным описанному в примере 7, получают 4-бромметил-7-гидроксикумарин из соединения примера 2d c 70%-ным выходом с т.пл. 182-184oC.
Пример 9. 6,7-Диацетокси-4-(4-метокси-пиперидино) метилкумарин-гидрохлорид
Смесь из 1,5 г соединения примера 4c и 15 мл уксусного ангидрида нагревают 2 часа с обратным холодильником. Сгущают, растирают с эфиром и отфильтровывают продукт. Остаются 1,4 г. целевого соединения (75% от теории) с т. пл. от 206 до 208oC.
Пример 10. 6,7-Диметокси-4-(4-метокси-пиперидино) метилкумарин
К раствору 1,5 г соединения примера 4c в 6 мл 2н-натровой щелочи прибавляют 1,1 мл диметилсульфата и перемешивают в течение ночи при комнатной температуре. Экстрагируют дихлорметаном, сушат и сгущают экстракт. Остаются 0,44 г целевого соединения (30% от теории) с т.пл. от 148 до 150oC.
Пример 11. 8-(4-Метокси-пиперидино)метил-2-тиоксо-1,3-диоксоло /4,5-g/-кумарин
К смеси из 1,5 г соединения примера 4с и 40 мл хлороформа прибавляют 5 мл пиридина и добавляют по каплям при 20oC 1,12 мл тиофосгена, растворенного в 10 мл хлороформа. Перемешивают в течение ночи при комнатной температуре, промывают раствор водой, сушат органическую фазу и очищают на кизельгеле, этилацетатом элюируют 1,5 г целевого соединения (88% от теории), которые после растирания с эфиром плавятся при 108-110oC.
Пример 12. Способом, аналогичным описанному в примере 9, получают из соединения примера 2с с 68%-ным выходом 4-(2-карбоксифенилтио)метил-6,7-диацетоксикумарин. Т.пл. 216-218oC. (Этилацетат).
Пример 13. Способом, аналогичным описанному в примере 10, получают из соединения примера 2c с 45%-ным выходом 4-(2-карбоксифенилтио)метил-6,7-диметоксикумарин.
Пример 14. Способом, аналогичным описанному в примере 10, получают из соединения примера 2c и 1,2-дихлорметана 4-(2-карбокси-фенилтио)метил-6,7-этилендиоксикумарин.
Фармакологические испытания активности кумаринов
Настоящая заявка касается лекарственных средств для лечения острых и хронических заболеваний с воспалительным, иммунологическим, аллергическим, неаллергическим или травматическим генезом.
Так как фосфолипаза A2 (PLA2) является ключевой системой при возникновении этих заболеваний, то ее торможение позволяет эффективно бороться с этими заболеваниями.
Кумарины являются, таким образом, ингибиторами PLA2, превосходящими по своему профилю действия введенные противовоспалительные вещества, как например, ингибиторы циклооксигеназы. Для сравнения профилей действия был выбран индометацин как типичный ингибитор циклооксигеназы. Уменьшение энзиматической активности, замеряемое по отщеплению жирных кислот из положения Sn-2 летицина, замерялось как показатель торможения PLA2.
Торможение активности PLA2.
В качестве типичного представителя PLA2 для исследования применяли человеческую рекомбинантную PLA2 тип II (синовиальную PLA2).
Таблица содержит данные о процентном ин-витро-торможении этого энзима соединениями согласно изобретению (примеры 4c, 5 и 4w). Торможение энзима в зависимости от дозы составляло до 100%.
В противоположность этому из таблицы видно, что индометацин хотя и тормозил энзим, однако лишь максимально на 52% при наибольшей концентрации. Тем самым подтверждается превосходство новых ингибиторов PLA2 перед ингибитором циклооксигеназы.
Незначительное торможение человеческой рекомбинантной PLA2 тип II индометацином наглядно показывают, что этот ингибитор циклооксигеназы обладает лишь слабым PLA2- ингибирующим действием. Напротив, представители кумарина из примеров 4c, 5 и 4w ингибировали PLA2 в зависимости от дозы и до 100% и тем самым превосходят известные противовоспалительные соединения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЦИКЛОГЕКСАНОЛНИТРАТЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ЛЕКАРСТВЕННОЕ СРЕДСТВО | 1991 |
|
RU2106339C1 |
| Способ получения тризамещенных аминов или их фармакологически-приемлемых солей в виде рацемата или оптически активных изомеров | 1989 |
|
SU1731044A3 |
| 4-АМИНОПИРИДИНЫ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1994 |
|
RU2126388C1 |
| ФОСФОЛИПИДНЫЕ ПРОИЗВОДНЫЕ НУКЛЕОЗИДОВ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1991 |
|
RU2104282C1 |
| Способ получения производных дифосфоновой кислоты | 1989 |
|
SU1823875A3 |
| СПОСОБ, СРЕДСТВО, ТЕСТ-СИСТЕМА ДЛЯ КОЛОРИМЕТРИЧЕСКОГО ОПРЕДЕЛЕНИЯ АНАЛИТА И НИТРОЗОАНИЛИНОВЫЕ СОЕДИНЕНИЯ | 1994 |
|
RU2114914C1 |
| Способ получения производных аминопропанола или их солей | 1976 |
|
SU791228A3 |
| Способ получения N-замещенных производных азиридин-2-карбоновой кислоты или натриевой соли кислоты | 1985 |
|
SU1431676A3 |
| Способ получения производных аминопропанола или их солей | 1977 |
|
SU1041033A3 |
| Способ получения аммонийалкиловых эфиров фосфорной кислоты (его варианты) | 1981 |
|
SU1241994A3 |

Предметом настоящего изобретения являются применение кумаринов и карбостиролов в качестве PLA2-ингибиторов, новые производные кумарина, способ их получения и лекарственные средства, содержащие эти соединения. Изобретение касается производных кумарина и карбостирила общей формулы I, в которой R1-водород или С1-С6-алкил, R2- остаток ОТ1, R3- остаток ОТ2, R4-водород или С1-С6-алкил, Т1 и Т2 одинаковые или разные и каждый - водород, С1-С6-алкил, С1-С6-алканоил, или Т1 и Т2 совместно с атомами, к которым они присоединены, образуют 5-7-членное гетероциклическое кольцо, которое при желании может быть замещено оксо- или тиоксо группой, Q - атом кислорода, Х-атом серы или NН -группа, Y- валентная группа, С1-С6-алкиленовый остаток, который при желании может быть замещен гидрокси- или аминогруппой, фениленовый остаток, который при желании может быть одно- или многократно замещен гидроксилом, галогеном, С1-С6-алкилом или карбоксилом, Z- водород, галоген, карбоксил гидроксиметил, С1-С6-алкоксикарбонил, циано- или группа NR5R6, причем R5 и R6 одинаковые или разные и каждый - водород или С1-С6-алкил, или R5 и R6 совместно с атомом азота, с которым они соединены, образуют 3-7-членное гетероциклическое кольцо, которое замещено оксо-, гидрокси- или С1-С6-алкоксигруппой, их таутомеры, а также их соли с нетоксическими кислотами или основаниями. Описывается способ их получения, а также лекарственное средство на основе соединения формулы I с PLA2-ингибирущим действием. 4 с. и 1 з.п.ф-лы, 1 табл.
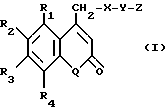
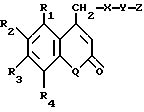
в которой R1 - водород или С1 - С6-алкил;
R2 - остаток ОТ1;
R3 - остаток ОТ2;
R4 - водород или С1 - С6-алкил;
Т1 и Т2, одинаковые или разные и каждый водород, С1 - С6-алкил, С1 - С6-алканоил или Т1 и Т2 совместно с атомами, к которым они присоединены, образуют 5-7-членное гетероциклическое кольцо, которое при желании может быть замещено оксо- или тиоксогруппой;
Q - атом кислорода;
Х - атом серы или NH-группа;
Y - валентная связь, С1 - С6-алкиленовый остаток, который при желании может быть замещен гидрокси- или аминогруппой, фениленовый остаток, который при желании может быть одно- или многократно замещен гидроксилом, галогеном, С1 - С6-алкилом или карбоксилом;
Z - водород, галоген, карбоксил, гидроксиметил, С1 - С6-алкоксикарбонил, циано или NR5R6-группа, при этом R5 и R6 совместно с атомом азота, с которым они соединены, образуют 3-7-членное гетероциклическое кольцо, которое замещено оксо-, гидрокси- или С1 - С6-алкоксигруппой,
их таутомеры, а также их соли с нетоксичными кислотами или основаниями.
| 0 |
|
SU164040A1 | |
| КОНТАКТНОЕ УСТРОЙСТВО И ЭЛЕКТРОМАГНИТНАЯ КАТУШКА | 2001 |
|
RU2276819C2 |
| УСТРОЙСТВО ПОДАЧИ ТОПЛИВА ДЛЯ ТРАНСПОРТНОГО СРЕДСТВА | 2006 |
|
RU2358144C1 |
| Галогеноалкилпроизводные 7-окси-5,6-бензо- @ -пирона в качестве флуоресцентной метки для определения третичных аминосоединений | 1983 |
|
SU1149596A1 |
| Плансуппортная расточная головка | 1977 |
|
SU614896A2 |
| 0 |
|
SU171645A1 | |
| Машковский М.Д | |||
| Лекарственные средства | |||
| - М.: Медицина, 1988, ч.1, с.315-319 | |||
| АНТИКОАГУЛЯНТНОЕ СРЕДСТВО | 0 |
|
SU175622A1 |
| Способ получения 3-тиопроизводных 4-оксикумарина | 1978 |
|
SU697515A1 |
| US 3974289 A, 10.08.76 | |||
| US 4136192 A, 23.01.79 | |||
| US 4210667 A, 01.06.80 | |||
| Способ размножения копий рисунков, текста и т.п. | 1921 |
|
SU89A1 |
Авторы
Даты
1999-07-27—Публикация
1994-07-09—Подача