(вН2) 0-е ОвН, где А - алкил или алкоксигруппа, галоген или галоидалкил, замещенная арил- или арилоксигру па; В - прямой или разветвленный насьщеннь или ненасыщенный уг леводород с 1-5 атомами угле рода; п .1-3; .-алкнльный радикал, которые снижают уровень липидов в крови. Однако известные способы не оказывают ярко выраженного тормозящего действия на агрегацию тромбоцитов. Целью изобретения является разработка способа получения производных феноксиапкилкарбоновой кислоты, снижакяцкх уровень липидов в крови и проявляюоцос ярко выраженное тормо-, зящёе действие на агрегацию тромбоцитов . Поставленная цель достигается способом получения производных феноксиалкилкарбоновой кислоты общей формулы в o-i-dooH (Нг) R4 (1 «I где R и Ry имеют указанные значения, подвергают взаимодействию с соединением общей формулы -(iH2)n-)-o-i-3 где R-, R. и п имеют указанные значения;X - галоген; J - 600021%, в среде гексаметилтриамида фосфорной кислоты при нагревании с получением эфира соответствующей кислоты, который затем гидролизуют в соединение общей формулы I и при необходимости последнее переводят в натриевую соль или обрабатывают хлористым тионилом с получением хлорангидрида соответствующей кислоты, который затем подвергают взаимодействию с аммиаком или соответствующим амином с получением амида кислоты. Превращение группы V осуществляют путем омыления зфиров карбоновых кислот (у COOCjH-) в соответствующие карбоновые кислоты минеральными кислотами или гидроокисями щелочных металлов в полярном растворителе (воде, метаноле, этаноле, диоксане или ацетоне). Омыление осуществляют предпочтительно с помощью сильного основания (гидроокиси натрия или калия) в смеси метанола и воды при ком натной температуре или при умеренно повьшенных температурах. И наоборот. 310 карбоновые кислоты можно также этерифицировать обычным способом или эфир с определенным остатком СООС Непутем переэтерификации превратить в эфир с другим остатком. Этерификацию карбоновых кислот осуществляют предпочтительно в присутствии кис лого катализатора, например хлористо го- водорода,серной кислоты, п-толуол сульфокислоты или сильно кислой ионообменной смолы. Напротив, переэтерификации требуют добавки небольшого количества оснований, например гидроокиси щелочных или щелочно-эеме ных металлов или алкоголята щелочног металла; Для этерификации карбоксиль ной группы, или для переэтерификации пригодны принципиально все спирты. Предпочтительными являются низшие одноатомные спирты, например метанол этанол или пропанол, а также многоатомные спирты, например гликоль или спирты с другими функциональными гру пами, например этаноламин или гликолевый эфир. АмиДы соединений формулы 1 получают из карбоновых кислот или их реактивных производных (галогенидов, эфиров, аэидов и ангидридов карбоновых кислот) взаимодействем с аминами В качестве аминосодержащих соединений используют аммиак, алкиламины, диалкиламины, аминоспирты (этаноламин, 2-аминопропанол), а так же аминокислоты (я-аминобензойную кислоту). Другими ценными аминокомпонентами являются алкил-, аралкили арилпиперазин. Для получения солей с фармакологи чески приемлемыми органическими или неорганическими основаниями, например гидроокисью натрия , гидроокисью калия, гидроокисью кальция, гидроокисью аммония, метилглюкамином, мор фрлином или этаноламином можно осуществлять реакцию карбоновых кислот с соответствующими основаниями. Исполь зуют также и смеси карбоновых кислот с соответствующим карбонатом щелочного металла или гйдрокарбонатом щелочного металла. Пример 1. (Н-Метил-бен золслгльфониламино)-этил}-феноксиуксусная кислота. Растворяют 9,25 г (54 ммоль) мети амида бензолсульфокислоты в 75 мл триамида гексаметилфосфорной кислоты, добавляют 1,3 г (54 ммоль) этилового эфира 4-(2-бромэтил)-феноксиуксусной 4 , 4 кислоты, в течение 24 ч перемешивают при , охлаждают и выливают в воду со льдом. С помощью разбавленной соляной кислоты доводят рП до 3, затем несколько раз экстрагируют толуолом. Раствор в толуоле промывают водой и просушивают с помощью сульфата натрия. Теперь осуществляют колоночную хроматографию с помощью силикагеля/толуола. Получают 9,2 г (45% от теории) эфира. Из этого продукта с помощью 1н. раствора едкого кали в этаноле гидролизом получают (Н-метнпбензолсульфониламино) -зтил -феноксиуксусНую кислоту-. Т, пл. 103-104 С (уксусный эфир + лигроин). Выход 91% от теории. Аналогичным образом получают из амида, бензолсульфокислоты и этилового эфира 4-(2-бромметил)феноксиуксусной кислоты этиловый эфир (бензолсульфониламино)этил J-феноксиуксусной кислоты с т. пл. 68-70 с. Пример 2. Аналогичным способом в результате взаимодействия этилбвого эфира 4-(2-бромэтил)-фенилоксиуксусной кислоты с соответствующими амидами сульфокислот в присутствии гексаметилтриамида фосфорной кислоты и толуола получают: A.Этиловый эфир 4-f2-(4-мeтoкcибeнзoлcyльфoнилaминo)-этилЗ-фeнилoкcиyкcycнoй кислоты; выход 60% от теоретически рассчитанного значения, т. пл. 81-82°С (диэтиловый эфир). Б. Этиловый эфир (4-фторбензолсульфониламино)-этил -фенилоксиуксусной кислоты; выход 80% от теоретически рассчитанного значения, т. пл. 74-76 С (метиловый спирт/вода). B.Этиловый эфир 4- 2-Сметансульфониламино)-зтил -фенш1оксиуксусной кислоты в виде вязкого маслообразного вещества; выход 65% от теоретически рассчитанного значения. HK-Maxima 3290 см, 1750 , 1608 см, а из него в результате гидролиза получают (метансульфониламино)-этил}-феннпоксиуксусную кислоту, т. пл. 142-143С; выход 77% от теоретически рассчитанного значения. Натриевая соль: т. пл. (разл.) Г. Этиловый эфир (л-толуолсульфониламино)-этил -фенилоксиуксусной кислоты, т. пл. 66-67 С (этиловый спирт); выход 74% от теоретически рассчитанного значения, а из него посредством гидролиза получают (11-толуолсульфояиламино)-этил j-фенил ксиуксусную кислоту, т. пл. 119-120 выход 93% от теоретически рассчитанного значения. Натриевая соль в виде моногидрата т. пя. 245-247 С. Д. ЭтиловьЛ эфир (1-нафталин сульфонипамино)-этилЗ-фенилоксиуксус ной кислоты, т. пл. 105-106 С (этило вый спирт); выход 65% от теоретичес ки рассчитанного значения, а из него посредством гидролиза получают (1-нафталннсульфониламино)-этил фенилоксиуксусную кислоту, т. пл. 119-120 С (этиловый эфир уксусной кислоты + лигроин); выход 92% от теоретически рассчитанного значения. Натриевая соль; т. пл. 238-239 С. Е. Этилов эфир (стиролсуль фониламиио)-этил}-фенилоксиуксусной кислоты, т, пл. 62-63°С (этиловый эфир уксусной кислоты + лигроин); выход 71% от теоретически рассчитанного значения, а из него посредством гидролиза получают (4-стиролсул фониламино)-этил7-фенилоксиуксусную кислоту, т. пл. 141-142°С (ацетон + + вода); выход 85% от теоретически рассчитанного значения. Ж. Этиловь эфир (4-хлОрстиролсульфоннламино)-этил}-фенилоксиуксусной кислоты, т. пл. 91-92с (этиловый эфир уксусной кислоты + ли гроин) ; выход 76% от теоретически рассчитанного значения, а из него посредством гидролиза получают (4-хлорстиролсульфониламино)-этил}фенилоксиуксусную кислоту, т. пл. 147-148 С (этиловый эфир уксусной кислоты лигроин); выход 69% от теоретически рассчитанного значения. 3. Этиловый эфир (4-хлорбензолсульфониламино)-этил}-фенилоксиуксусной кислоты, т. пл. 61-62 С (диэтиловый э4мр); выход 66% от теоретически рассчитанного значения, а из него в результате гидролиза получают (4-хлорбензолсульфонил амино)-этилЗ-фенилоксиуксусную к;ислоту. Т. пп. 127-128 С (ацетон + воды); выход 62% от теоретически рассчитанного значения. . И. Этиловый эфир (2-фенш1этансульфониламино)-этш1 -фенилокснуксусной кислоты, в виде вязкого маслообразного вещества (неочищенный продукт); выход 76% от теоретически рассчитанного значения, а из него в результате гидролиза получают, 4- , 2-(2-фенилэтансульфониламине)-этил3фенилоксиуксусную кислоту, т. пл. 124-125 С (этиловый спирт +10% воды); выход 74% от теоретически рассчитанного значения. К. Этиловый эфир (4-хлорфенил)-этансульфониламино -этил фенолоксиуксусной кислоты в виде вязкого маслообразного вещества (неочищенный продукт); выход 57% от теоре.тически рассчитанного значения, а из него в результате гидролиза получают 4-f2- 2-(4-хлорфенил)-этансульфониламиноЗ-этилj-фенилоксиуксусную кислоту, т. пл. 128-130°С (этиловый эфир уксусной кислоты + лигроин); выход 73% от теоретически рассчитанного значения. Л. Этиловый эфир 4-f2-(4-aцeтилбeнзoлcyльфoнилaминo)-этилЗ-фeнилoкcиyкcycнoй кислоты, т. пл. 113,5114 С (этиловый эфир уксусной кислоты + лигроин); выход 52% от теоретически рассчитанного значения, а из него в результате гидролиза получают 4-С2-(4-ацетилбензолсульфониламино)этилJ-фенилоксиуксусную кислоту, т. пл. 162°С (ацетон); выход 63% от теоретически рассчитанного значения. Для получения натриевой соли кислоту суспендируют в 150 мл метилового спирта, суспензию нагревают до и смешивают с эквимолярным количеством 1 н. раствора гидроокиси натрия. После этого реакционную смесь упаривают в вакууме, остаток растирают с ацетоном, продукт отфильтровывают и промывают ацетоном. Выход количественный. Пример 3. По примеру 1 в jpeзультате взаимодействия этилового эфира 2-(4-бромфенокси)-2-метилпропионовой кислоты с амидом 4-хлорстиролсульфокислоты получают этиловый эфир 2-{4-(4-хлорстиролсульфониламиио)-фенилоксиЗ-2-метилпропионовой кислоты т. пл. 130-131 С (этиловый эфир уксусной кислоты); выход 87% от теоретически рассчитанного значения, а из него в результате гидролиза получают 2-{|4-(4-хлорстиролсульфониламино)-фенило1сси -2-ме,тилпропионовую кислоту, т. пл. 172-173 С (этиловый эфир уксусной кислоты); выход 73% от теоретически рассчитанного значения. о Пример 4. По примеру 1 из этилового эфира 2-(4-бромэтш1)-фенило710971
си-2-метилпропиЬновой кислоты и соteeTCTByraiuero амида сульфокислоты олучают:
А. Этиловый эфир 2-{4-f2-(4-xлopтиpoлcyльфoнилaминo)-этилJ-фeнилoкcи -метилпропионовой кислоты. Бесцвет70
ное маслообразное вещество, п tj 1,5625, а из него в результате гидролиза получают 2-{4- 2-(4-хлорстиролсульфониламино)--этил -фенило- ю кси -2-метилпропионовую кислоту, т. пл. 148-149 с (бензол); выход 76% от теоретически рассчитанного значения.
Б. Этиловый эфир (2-хлор-J5 енил)-этанолсульфониламино)-эти; енилокси1-2-метилпропионовой кислоты в виде бесцветного маслообразноЛз вещества; выход 77% от теоретически рассчитанного значенияj а из него 20 в результате гидролиза получают (2-(4-хлорфенил)-этансульфониламино)-этил3-фенилокси -2-метилпропионовой кислоты, т. пл. 138-139 С (этиловый эфир уксусной кислоты + лиг- 25 роин), выход 53% от теоретически рассчитанного значения.
В. Этиловьй эфир (4-хлорбензолсульфонш1амино)-этил2-фенилокс1 2-метилпропионовой кислоты в виде Q вязкого маслообразного вещества, выход 67% от теоретически рассчитанного значения, а из него в результате гидролиза получают 2-{4- 2-(4-хлорбензолсульфониламино)-этилЗ-феннлокси|2-метилпропионову1о кислоту, выход 67% от теоретическирассчитанного значения, т. пл. (ацетон).
Г. Этиловый эфир 2-{4- 2-(бензолcyльфoншIaминo)-этилJ-фeнилoкcи|-2метилпропионовой кислоты, т., пл, 66- 67с (изопропиловый спирт + лигроин); Q выход 71% от теоретически рассчитанного значения, а из него в результате гидролиза получают 2-{4- 2-бензол-,. сульфониламино)-этш1 -фенилокси -2 метилпропионовую кислоту, т. пл. 128-129С (этиловый эфир уксусной кислоты + лигроин), выход 85% от теоретически рассчитанного значения.
Пример 5. По примеру 1 в ре- , зультате взаимодействия этилового 4-брЬмфенилоксиуксусной кисло ты с амидом бензолсульфокислоты получают этиловый эфир 4-(бензолсульфониламино)-фенш1оксиуксусной кислоты, т. пл. 127-128 С (этиловый эфир уксусной кислоты); выход 74% от теоретически рассчитанного значения, а
48
из него в результате гидролиза получают 4-(бензолсульфониламино)-фенилоксиуксусную кислоту, т. пл. 157158°С (ацетон + вода); выход 92% от теоретически рассчитанного значения.
Пример 6. По примеру 1 из этилового эфира 4-(3-бромпропил)фенилрксиуксусной кислоты и амида бензолсульфокислоты получают этиловый эфир (бензолсульфонш1амино)пропилЗ-фенилоксиуксусной кислоты, выход 70% от теоретически рассчитанного значения, т, пл. 56-57°С (диэтиловьё эфир), а из него в результате гидролиза получают (бензолсульфониламино).-пропил -фенилоксиуксусHjno кислоту, выход количественный, т. пл. 246-248 С (врда).
Пример 7. (Бензолсульфонш1амино)-этилЗ-фенилоксиацетамид.
Смесь, состоящую из 67 г (0,2 мЬль) (бензолсульфониламино)-этшт)фенилоксиуксусной кислоты, 400 мл бензола и 71,5 г г(0,6 моль) хлористого тионнла, нагревают в течение 4 ч с обратньм холодильником при температуре кипения смеси. Затем в- вакууме проводят отгонку бензола и избыточного количества хлористого тионида. Выход неочищенного продукта количественный. После перекристаллизации из хлористого метилена получают 61 г (86% от теоретически рассчитанного значения) 4-С2-(бензолсульфЬниламино)этилЗ-фенилоксиацетилхлорида с т. пл. 78,. В этом случае реакция с таким же успехом может быть осуществлена без добавлеиня бензола, т.е. с чистым хлористым тионилом.
Раствор, приготовленнь из 10,6 г (30 ммоль) (бензолсульфониламино)-этил1-фенилоксиацетилхлорида и 100 мл абсолютиого диоксана, при перемепиванни и ксмшатной температуре смешивают с 3,3 мп концентрированного раствора аммиака, смесь кратковременно нагревают при и затем охлажают. Непосредственно после этого содержимое колбы ш шивают в воду со ьдом. Осадок отфильтровывают, массу иа фильтре промывают водой и обрабатьшают раствором кислого углекислого натрия. После отделения фильтрованием и промьюки водой продукт перекрисаллизовывают из ацетоиа. Выход (бензолсульф6ииламиио)-9тил}-фенилксиацетамида, т. пл. 118-119 С, сотавляет 7,2 г (72Z от теоретически рассчитанного зиачеиня). 9 в результате взаимодействия A-f (бензолсульфониламино)-этилЗ-фенилоксиацетилхлорида с соответствующими аминами получают следующие амиды А, (Бензолсульфониламино)этил 3-фенилоксиацетанилид. К раствору, приготовленному из 7,08 г (20 ммоль) хлорангидрида кисл ты и 35 мл абсолютного бензола при перемешивании прибавляют по каплям 3,73 г (40 ммоль) анилина. Смесь кратковременно нагревают при 40 С, после чего производят отгонку бензо ла. К остатку прибавляют хлористый метилен и разбавленную соляную кислот смесь энергично встряхивают и затем производят разделение фаз. Фазу хло ристого метилена промывают 2 н. сол ной кислотой и водой, сушат и упари вают. После перекристаллизации из этилового эфира уксусной кислоты по лучают 5,58 г (68% теоретически рас считанного значения) продукта с т. пл. . Б. 2-Этоксикарбонилэтиламид 4- (бензолсульфониламино)-этил -фенилоксиуксусной кислоты. К смеси, состоящей из 4,6 г (30 ммоль) гидрохлорида этилового эфира бета-аминопропионовой кислоты 4,1 г (30 ммоль) порошкообразного углекислого калия и 100 мл абсолютного пиридина, после перемешивания в течение 20 мин при охлаждении льдом прибавляют по каплям 10,6 г (30 ммоль) хлорангидрида кислоты. Непосредственно после этого смеси дают возможность нагреваться до 20 затем ее нагревают в течение 30 мин при , охлаждают и выливают приблизительно в 500 мл воды со льдом. Посредством прибавления соляной кис лоты смесь подкисляют до рН 5,5, после чего производят экстрагирование хлористым метиленом. Фазу хлористого метилена несколько раз промывают разбавленной соляной кислото затем раствором кислого углекислор.о натрия и водойj сушат над сернокислым натрием и упаривают. В виде остатка получают 10,5 г (81% от теоре тически рассчитанного значения) мас лообразного 2-этоксикарбонилатилами да (бензолсульфонш1амино)-этил фенилоксиуксусной кислоты с показателем преломления f - 1,5490. Из этого соединения в результате гидролиза, по аналогии с описанным в примере 2,.получают 2-карбокси410этиламид 4- 2-(бензолсульфониламино)этил7-фенилоксиуксусной кислоты. Т. пл. 64-65 С (ацетон + вода); выход 86% от теоретически рассчитанного значения. В. 4-Этоксикарбониланилид (бензолсульфониламино)-этил3-фенилоксиуксусной кислоты получают по аналогии с описанным в пункте Б из хлорангидрида кислоты и гидрохлорида этилового эфира 4-аминобензойной кислоты; т. пл. 157-158°С (этиловый эфир ук- : сусной кислоты); выход 72% от теоретически рассчитанного значения, а из него посредством гидролиза получают 4-карбоксианилид (бензолсульфониламино)-этилЗ-фенилоксиуксусной кислоты. Т. пл. 185-186 0 (ацетон + + вода ; выход 65% от теоретически рассчитанного значения. Г. 4-(Этоксикарбонилметиленокси)фенилэтиламид (бензол-сульфониламино)-этилj-фенилоксиуксусной кислоты. Получают по аналогии с описанным в пункте Б из хлорангидрида кислоты и этилового эфира 4-(2-аминоэтил)фенилоксиуксусной кислоты. Т. пл. 97-98 0 (этиловый эфир уксусной кислоты); выход 68% от теоретически рассчитанного значения, а из него получают в результате гидролиза 4-(карбоксиметиленокси)-фенилэтиламид (бензолсульфониламино)этил -фенилоксиуксусной кислоты, т, пл. 148-149 0 (вода + ацетон); выход 60% от теоретически рассчита;нного значения. П р и м е р 8. 1-Окси-2-пропиламид (бензолсульфониламино)этил}-фенилоксиуксусной кислоты. К смеси, состоящей из 5,4 г (72 ммоль) 1-окси-2-аминопропана и 35 мл воды, прибавляют по каплям в течение 2 ч при раствор, приготовленный из 6,4 г (18 ммоль) (бензолсульфониламино)-этилЗфенилоксиацетилхлорида и 25 мл абсолютного бензола, причем постепенно образовывается осадок. Смесь вьщерживают в течение ночи при , проводят фильтрование, массу на фильтре промывают разбавленным раствором гидроокиси натрия, затем водой и сушат. После перекристаллизации из этилового эфира уксусной кислоты получают 5,2 г (74% от теоретически рассчитанного значения) продукта с т. пл. 90-91.С. Данные по элементному анализу ИК-спектрам и брутто-формула предста лены в таблице. Для получения лекарственных средс соединения общей формулы 1 известным способом смешивают с соответствующими фармацевтическими наполнителями, ароматическими, вкусовыми и красящими веществами и формуют, например в виде таблеток или драже, или при добавлении соответствующих вспомогательных веществ суспендируют, или растворяют в воде или масле, например в оливковом масле. Вещества общей формулы I можно принимать в жидкой или твердой форме перорально или парэнтерально. В качестве инъекционной среды применяют предпочтительно воду, которая содержит обычные для инъекционных растворов стабилизаторы, агенты растворения и/или буферы. Такими добавками являются, например тартратный или боратный буфер, этанол, диметилсульфоксид, комплексообразователи, напри мер этилендиаминтетрауксусная кислота, высокомолекулярные полимеры, например жидкий полиэтиленоксид для регулировки вязкости или производные полиэтилена сорбитангидридов. Твердыми наполнителями являются, например крахмал, лактоза, маннит, метилцеллюлоза, тальк, высокодисперс ная кремневая кислота, высокомолекулярные жирные кислоты, например стеариновая кислота, желатин, агар-агар фосфат кальция, стеарат магния, животные и растительные жиры или твердые высокомолекулярные полимеры, например полиэтиленгликоль. Пригодные для аппликации через рот препараты при желании могут содержать вкусовые и сладкие вещества. Предложенные соединения исследуют следующим образом. Венозную кровь исследуемого с нормальным обменом веществ смешивают с цитратом натрия (9:1). В резуль тате центрифугирования при нагрузке 150 г эритроциты седиментируют. Обра зовавшуюся жидкость используют в качестве богатой пластинками плазмы (БПП). Аликвотные количества БПП помещают в кювету агрегометра (универсальный агрометр фирмы Браун Мельзунген) и в кювете проводят перемешивание с помощью маленькой магнитной мешалки. Исследуемое вещество 10 412 добавляют в виде водного раствора рН приблизительно 7/. Изменение светопропускания в суспензии постоянно записывают с помощью самописца. После окончания спонтанной агрегации агрегацию вызывают прибавлением адреналина. Образовывается большой тромбоцитовый агрегат, в результате чего увеличивается светопропускание через суспензию. Вызванная адреналином агрегация проходит в две стадии, т.е. светопропускание сначала увеличивается, затем кратковременно не изменяется и еще раз увеличивается. Вещество, тормозящее агрегацию, может оказывать влияние только на вторую стадию агрегации. Для оценки результатов определяют угол второй фазы агрегации по отношению к горизонтали для агрегации, вызванной адреналином, и это принимают за 0% торможения (контрольный опыт). С такой же БПП после добавления исследуемого вещества вызывают агрегацию адреналином, после чего процесс агрегации регистрируют самописцем. Снова определяют угол второй фазы по отношению к горизонтали, причем соотношение этих обоих углов дают процент торможения второй фазы агрегации тромбоцитов. Для используемой в качестве препарата для сравнения ацетилсалициловой кислоты торможение при концентрации 10 m составляло 100%, при концентрации 5х10 1п-0%. Все вещества испытывают с агрегацией . Торможение агрегаций, Пример %
109719414 о
Остальные полученные соединения проявляю1 11ие тормозящее действие
проявляют аналогичное действие. на агрегацию тромбоцитов в кроТаким образом, предложенный способ ви.
позволяет получить новые соединения.
B2-$02lfH{CJH2ln
3
o-i-Y
Rf






| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения производных феноксиалкилкарбоновой кислоты,их солей,сложных эфиров и амидов | 1979 |
|
SU1052157A3 |
| Способ получения сульфонамидов алкилфенилкарбоновых кислот | 1981 |
|
SU1088664A3 |
| Способ получения производных 2-/4(ациламиноалкил)-фенокси/-алкилкарбоновой кислоты или их солей | 1976 |
|
SU664561A3 |
| Способ получения производных оксимов пировиноградной кислоты или ее амидов | 1981 |
|
SU1279526A3 |
| Способ получения трициклических производных -оксикарбоновых кислот | 1973 |
|
SU470956A3 |
| Способ получения оксимов пировиноградной кислоты,их солей или амидов | 1982 |
|
SU1217252A3 |
| ЦИКЛОГЕКСАНОЛНИТРАТЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ЛЕКАРСТВЕННОЕ СРЕДСТВО | 1991 |
|
RU2106339C1 |
| Способ получения производных фенилалканкарбоновых кислот,их солей, сложных эфиров или амидов | 1976 |
|
SU618038A3 |
| Способ получения производных феноксиалкилкарбоновых кислот или их солей | 1975 |
|
SU674670A3 |
| Способ получения N-замещенных производных азиридин-2-карбоновой кислоты или натриевой соли кислоты | 1985 |
|
SU1431676A3 |
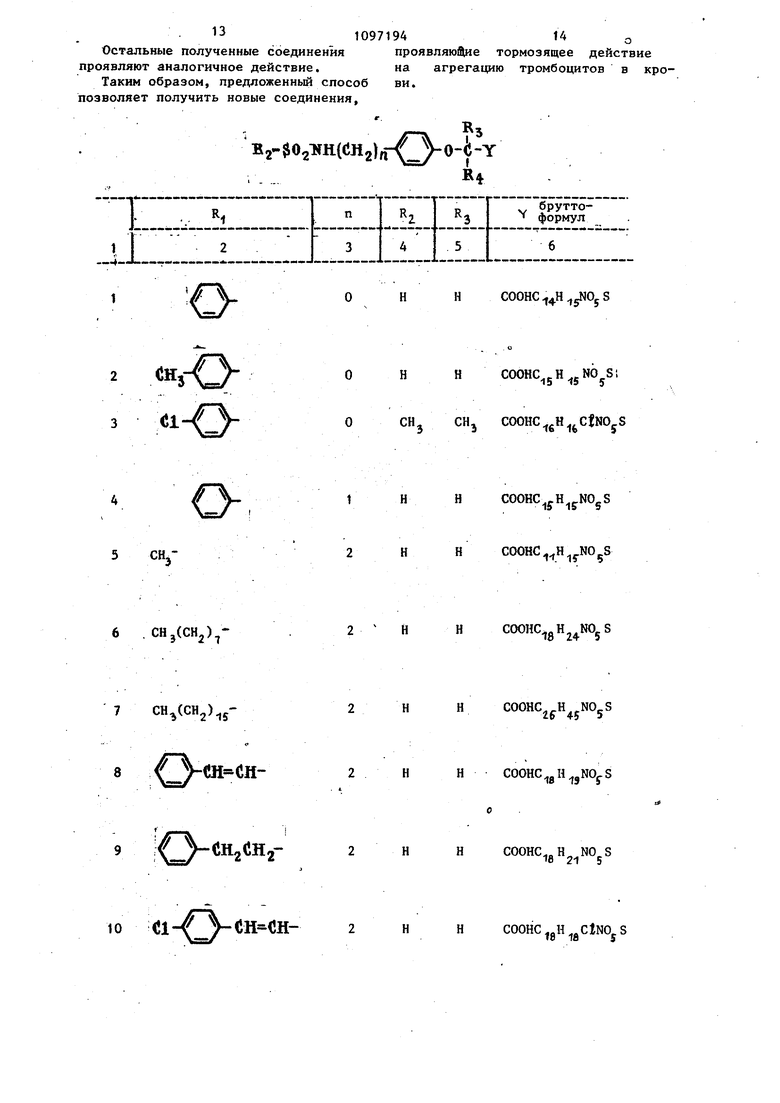
Способ получения производных феноксиалкилкарбоновой кислоты общей формулы В 2 (г п-{ о-А- соон RI R4 где R - водород или низший алкил; R2 - С -С -алкил, нафтил, незамещенный или замещенный низшим алкилом или галогеном или низшей алкоксигили ацильной группой фенил или незамещенный или замещенный галогеном фенэтил или фенэтенил; водород или низший алкил; п 5-3, а также их натриевых солей, сложных эфиров и амидов, отличающийс я тем, что сульфонамид общей формулы (fО R2S02NH где Е и Rj имеют указанные значения, подвергают взаимодействию с соединеi нием общей формулы 1Ы О) ЕЗ X(JH2) Н4 где R, 1л и п. имеют указанные значения; X - галоген; со J - COOCjHj, в среде гексаметилтриамида фосфорной кислотыпри нагревании с получением :о эфира соответствующей кислоты, который затем гидролизуют в соединение iобщей формулы I, и при необходимости последнее переводят в натриевую соль или обрабатывают хлористым тионилом с получением хлорангидрида соответствующей кислоты, который затем подвергают взаимодействию с аммиаком или соответствующим амином с получением амида кислоты. 
ониCOOHC 4 -t S оCHj CHj Н COOHC 5H,5NO,.S1 COOHC gH CfNOyS
1ННCOOHC jH NOgS 5 CHj6 , снесен,,)7 СН(СН2)52Н2 Н 2Н НCOOHC H 5. НCOOHC gH NOjS НCOOHC.H..NO-S Zo 45 9 7 JH-CH-2Н 2Н НСООНС.. Н N0 S О 21 5 НCOOHC H CtNO S То jfl5
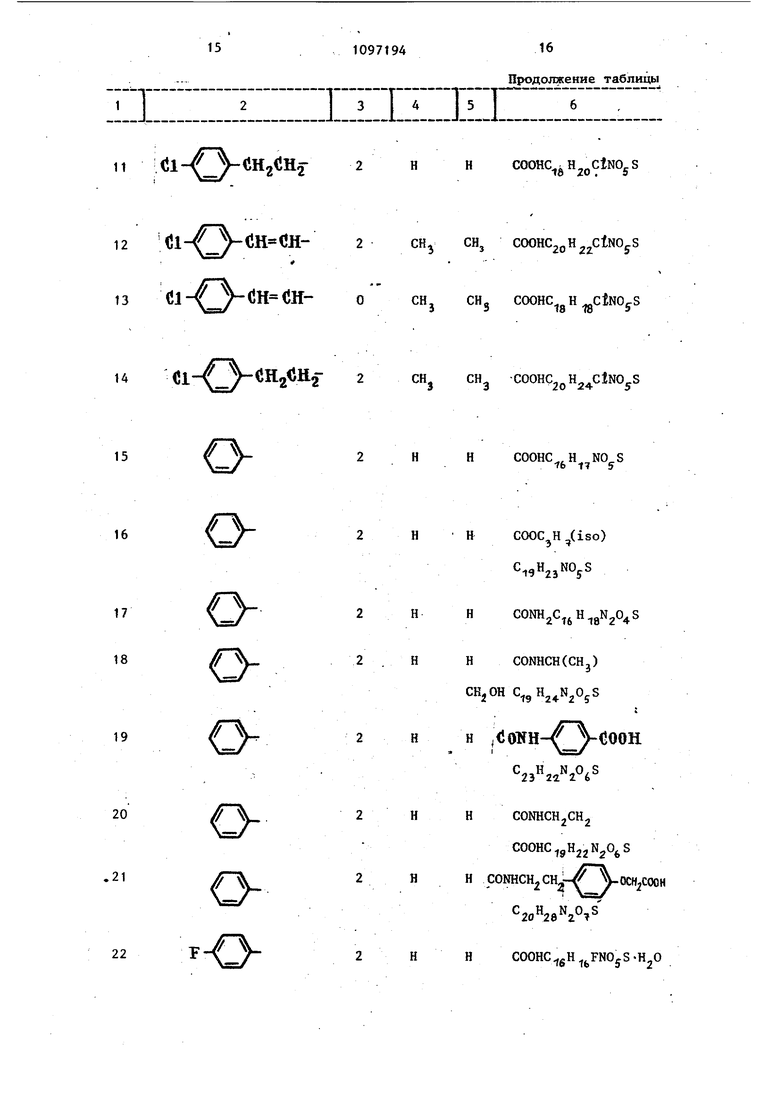
i::::::i:::::;::iz;iz::rn II ll-/ -CiHa«H5-2 11 .Cl-V y-CftgV j-2Н (JlY 5H-CH12l;l- : 7- ;n VJl-2СН y/ vV 13(Jl- /-Cll JH-0CH, 14Cl- / CH2 JH.22CHj
Продолжение таблиць 6 Э НCOOHC H pCtNOjS СН, COOHCjoH j CtNO S CH, COOHC.„H --CtNOcS Эfo lO CH COOHC pH ClNO S
15
HCOOHC.,H,
b 77 5
16
HCOOC H.j(iso)
О
17
/О
18
HCONH jC.
CONHCH(CHj)
HH
19
H .(JOITH-/ yCOOH
20
HH
CCNHCHjCHj COOHC gH jN O S
.21
HH CONHCH2CH2--/y.OCH/OOH
22
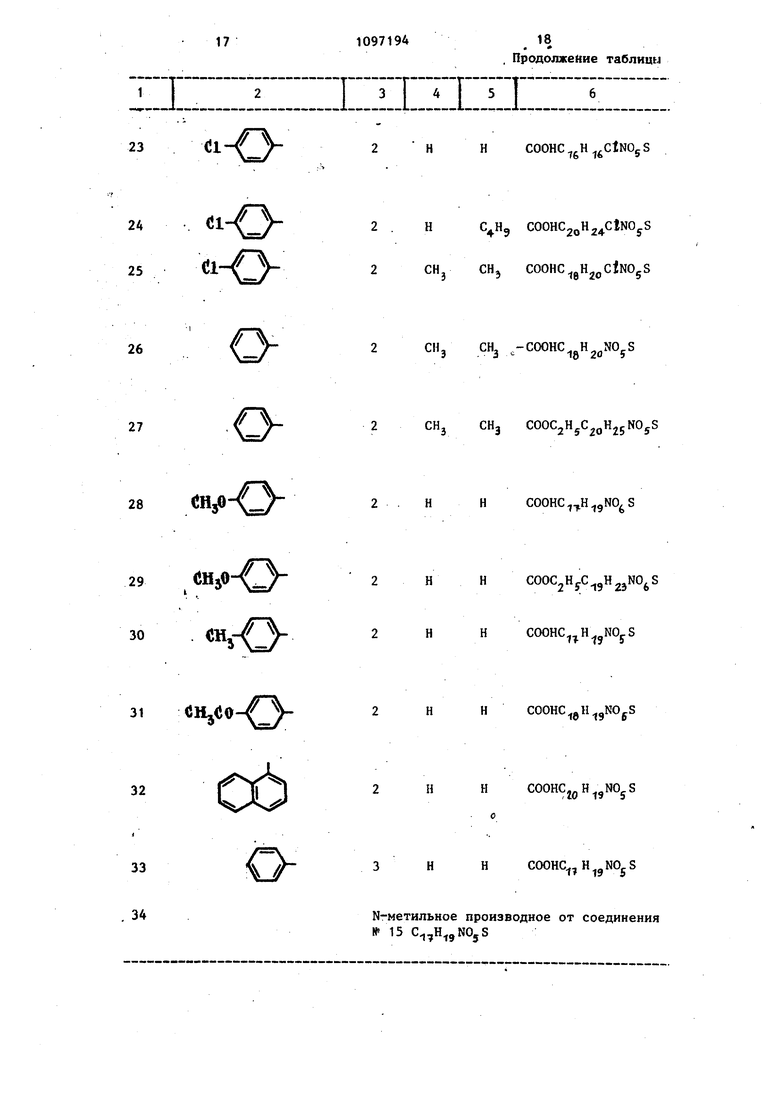
HHCOOHC gH FNOjS-H O i:n:: 23dlIZCZIII , Продолжение таблицы 3 I 4 I 5 I6 2 HHCOOHC gH CtNOjS
Cl
25
2CHj CH, COOHC gH oCjNOgS
26
2CH, СНз -COOHC gH NOyS
27
2CHj CHj COOCjHjC gHjjNOyS
28 Hjp-CJ
29
2HHCOOC HyC gH jNO S
ewj
30
CHjCo-f
31
no
32
2HHCOOHC H jNOj.S
2HHCOOHC gH gNOpS
2HHCOOHCj H jNOjS
33
3 H H COOHC,
34
N-метильное производное от соединения №15
19
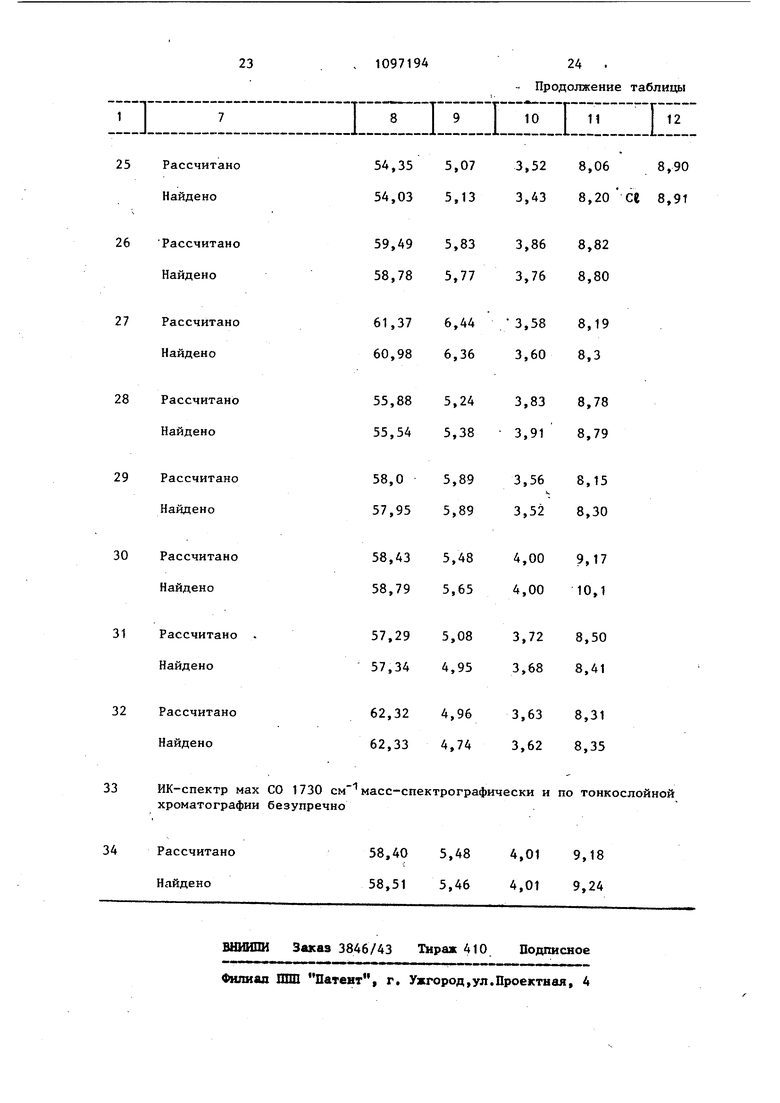
1 Рассчитано Найдено
Рассчитано Найдено
Рассчитано Найдено
Рассчитано Найдено
Рассчитано Найдено
Рассчитано Найдено
Еассчитано Найдено
Рассчитано Найдено
Рассчитано Найдено
Рассчитано Найдено
20
1097194 Продолжение таблицы
р мах.СО 1725 см масс-спектрографипо ДС безупречно
4,30
3,79 8,67
9,59
4,19 3,67 8,.1б
С1 9,50
4,70
А.35, 9,97
4,82 4,39 9,8
5,535,1211,73
5,515,07. 11,7
7,873,778,63
7,853,728,71
9,372,896,62
9,362,816,57
р мах. СО 1746сммасс-спектрограи по тонкослойной хроматографии
но
5,823,908,80
6,09, 3,878,67
4,58,3,548,10 С1 8,95
4,523,548,10 9,04
5,073,528,06 С1 8,91
4,96 3,50- 5,233,307,56 С1 8,36
5,173.317,6 8,39
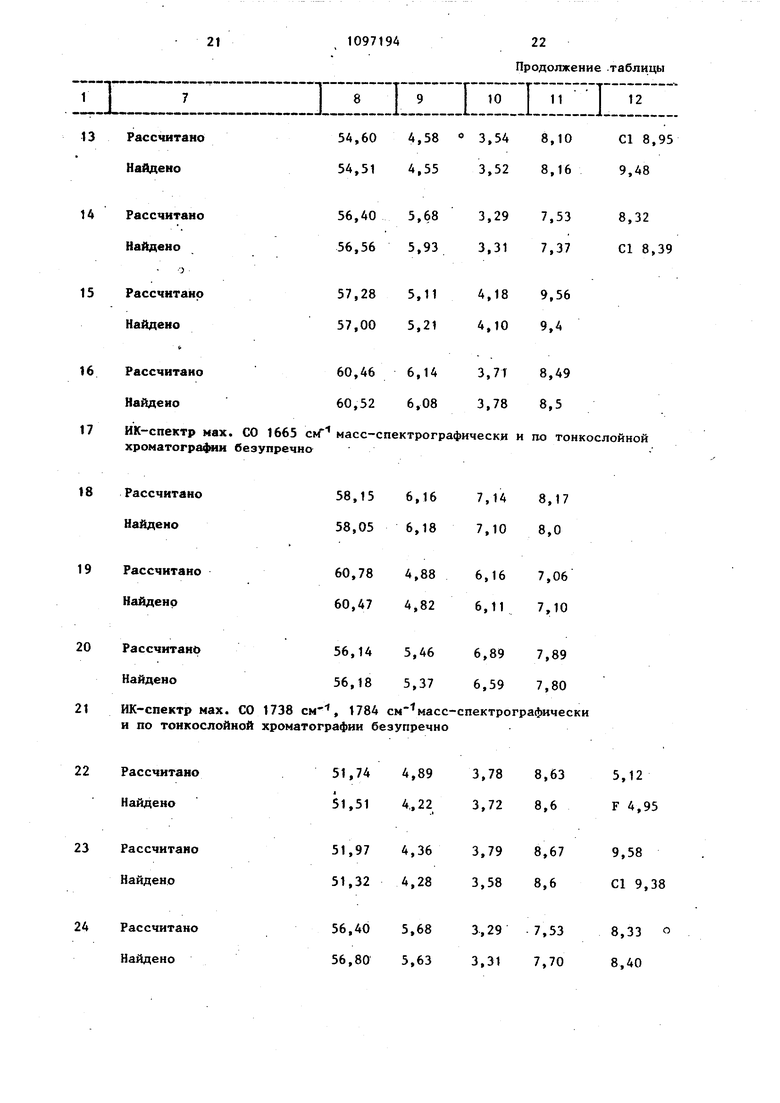
21109719422 17ИК-спектр мах. СО хроматогра и безу 18Рассчитано Найдено 19Рассчитано Найдено 20Рассчитано Найдено 21ИК-спектр мах. СО и по тонкослойной 22Рассчитано Найдено 23Рассчитано Найдено 24Рассчитано Найдено
Продолжение .таблицы 1665 ctf масс-спектрографически и по тонкослойной пречна58,15 6,167,148,17 58,05 6,187,108,0 60,78 4,886,167,06 60,47 4,826,117,10 56,14 5,466,897,89 56,18 5,376,597,80 1738 см, 1784 см масс-спектрографически хроматографии безупречно 51,74 4,893,788,63 5,12 51,51 4„223,728,6 F 4,95 51,97 4,363,798,67 9,58 51,32 4,283,588,6 С1 9,38 56,40 5,683,297,53 8,33 56,80 5,633,317,70 8,40
23
1097194 Продолжение таблицы
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| ЛОПАТОЧНЫЙ РЕАКТОР ДЛЯ ПИРОЛИЗА УГЛЕВОДОРОДОВ | 2009 |
|
RU2405622C2 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Сплав для отливки колец для сальниковых набивок | 1922 |
|
SU1975A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| СПОСОБ ПРОГНОЗА ГАЗОВОГО БАЛАНСА ОЧИСТНОГО ЗАБОЯ | 2014 |
|
RU2541342C1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Шеститрубный элемент пароперегревателя в жаровых трубках | 1918 |
|
SU1977A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Основы синтеза проме.жуточных продуктов и красителей | |||
| М., Госхимиздат, 1955, с | |||
| 532. | |||
Авторы
Даты
1984-06-07—Публикация
1981-05-29—Подача