Изобретение в общем касается области иммунологии и химии нуклеиновых кислот, а именно использования гибридизации нуклеиновых кислот в качестве средства амплифицирования обнаруживаемого сигнала при проведении иммунологического анализа.
Гибридизация нуклеиновых кислот в настоящее время широко используется при проведении генетических и биохимических исследований и клинической диагностики для обнаружения и количественной характеристики отдельных нуклеотидных последовательностей, которые присутствуют в гетерогенных смесях ДНК, РНК и (одновременно или по отдельности) в других материалах. При проведении типичного гибридизационного теста одноцепочечную нуклеиновую кислоту (либо ДНК, либо РНК), используемую в аналитическом опыте, прямо или косвенно, контактируют с известной меченой нуклеиновокислотной пробой (зондом), и двунитевые формы, содержащие метку, подвергают количественному определению. При этом используют как радиоактивные, так и нерадиактивные метки.
Обычный гибридизационный тест характеризуется недостаточной чувствительностью. Если аналит присутствует в условиях малого числа копий или в разбавленном растворе, сигнал не может быть отделен от фона. Были разработаны видоизмененные варианты основной схемы, посредством которых пытались способствовать отделению целевых гибридов от прочего материала и (одновременно или по отдельности) амплифировать аналитные последовательности, чтобы содействовать их обнаружению, однако в общем случае этим вариантам свойственны недостатки, связанные со сложностью и длительностью методик, высоким фоном, низкой чувствительностью и трудностью установления количественных характеристик. Касательно общего обсуждения этих вариантов см. WO 89/03891.
При проведении генетических и биомедицинских исследований, а также в клинической диагностике часто прибегают к иммунологическим анализам.
Это делается с целью обнаружения и количественного описания конкретных антигенных эпитопов, которые присутствуют в гетерогенных смесях образцов крови, клеточных экстрактов и других материалов. Основной иммунологический анализ сводится к проведению специфического связывания антитела - либо моноклонального, либо поликлонального - с целевым антигеном и включает использование средства обнаружения реакции.
При этом в отношении чувствительности обнаружения существенного взаимодействия антигена с антителом возникают в основном те же проблемы, что и описанные выше для гибридизации.
При проведении иммунологических анализов используют различные методики, такие как радиоиммуноанализ, иммунопероксидазный анализ и иммуноферментный твердофазный анализ. Однако радиоиммуноанализ связан с необходимостью использования опасных и экологически вредных реактивов, а способам с применением иммунопероксидазного анализа и иммуноферментного твердофазного анализа свойственны низкая величина отношения сигнала к шуму и ограниченная степень аплификации сигнала.
Главной целью изобретения является разработка уникальных полинуклеотидных молекул, (молекулярных зондов) для амплификациии сигнала, которые оказались бы полезными в гибридизационных тестах, применяемых в иммунологических анализах. Эти амплификаторные пробы (зонды) обеспечивают получение высоковоспроизводимого усиления сигнала и высоковоспроизводимого отношения сигнала к шуму, обеспечивают количественный характер, воспроизводимость и специфичность исследования в отношении аналита, присутствующего в низких концентрациях.
В патенте N 4868105, 1989 г. описывается жидкофазный гибридизационный "сэндвич"-тест, в котором аналитная нуклеиновая кислота подвергается гибридизации при сочетании с "метящей пробой" и "захватывающей пробой". Комплекс из аналита и пробы объединяется посредством гибридизации с твердофазной подложкой. Это дает возможность удалить определяемый олигонуклеотид из раствора в виде твердофазного комплекса, чем обеспечивается концентрирование аналита, облегчается его отделение от других реактивов и повышается вероятность последующего обнаружения.
В заявке по договору о патентной кооперации WO90/13667, 1990 г., заявляются линейные и разветвленные многомерные полинуклеотидные зонды, которые характеризуются наличием двух областей, и способы использования этих зондов в качестве амплификаторов сигнала в гибридизационных тестах. Первая область является комплементарной к одноцепочечной олигонуклеотидной последовательности, представляющей интерес, а вторая область состоит из большого числа одноцепочечных олигонуклеотидных субьединиц, которые являются комплементарными к одноцепочечному меченому олигонуклеотиду.
В рассматриваемой одновременно коллективной заявке по договору о патентной кооперации N PCT/US 91/00213 заявляются полинуклеотидные пробы, которые обладают тремя областями, и способы использования этих зондов в качестве амплификаторов сигнала в гибридизационных тестах. Первая область является комплементарной к одноцепочечной олигонуклеотидной последовательности, представляющей интерес, вторая область характеризуется возможностью функционирования в качестве промотора в отношении бактериальной фаг-ДНК-зависимой РНК-полимеразной ферментивной активности, а третья область характеризуется способностью выполнять роль матрицы для полимеразной активности.
Гибридные молекулы, состоящие из белка и ДНК, ранее использовались в качестве проб в нуклеиновокислотных гибридизационных тестах только в случае, когда белковая составляющая функционировала в качестве метки (Czichos, J., et al, Nucl. Acids Res. (1989) 17:1563; патент США N 4873187; патент США N 4737454).
Гибридные молекулы из белка и ДНК также использовались в качестве зондов в иммунологических анализах. В патенте США N 4692509 описана радиоактивно меченная гибридная метка, включающая белок и ковалентно связанный радиоактивный олигонуклеотид. В биологическом тесте радиоактивную олигонуклеотидную составляющую используют для индикации присутствия белковой составляющей. В Европейской патентной заявке N 154884 раскрывается гибридная молекула из белка и ДНК, в случае которой белковая составляющая специфически распознает белок-"мишень", а составляющая в виде нуклеиновой кислоты выполняет функцию метки.
Предметом изобретения является гибридная молекулярная проба из полипептида и полинуклеотида, предназначенная для использования в качестве амплификатора обнаруживаемого сигнала при проведении иммунологических анализов. Эта "мультимерная проба" включает в себя две области:
а) первая область А, которая представляет собой полипептид со способностью функционировать в качестве антитела, которое специфически связывается с известным антигеном;
б) вторая область М, включающая в себя большое число одноцепочечных олигонуклеотидных субьединиц, способных специфически связывать одноцепочечную нуклеиновокислотную последовательность, представляющую интерес; и
в) средство сопряжения первой и второй областей.
На использовании молекулярных зондов, описанных выше, основывается способ амплификации сигнала, выявляемого в процессе иммунологического анализа. Этот способ включает в себя
а) иммобилизацию на твердой подложке аналита, проводимую непосредственно или косвенно;
б) непосредственное или косвенное связывание с аналитом гибридной молекулярной пробы;
в) удаление несвязанной пробы;
г) гибридизацию одноцепочечных меченых олигонуклеотидов, содержащих нуклеотидную последовательность, которая существенно комплементарна последовательности субьединицы области М зонда с субьединичными последовательностями этой области;
д) удаление несвязанного меченого олигонуклеотида и
е) определение количества меченного олигонуклеотида, связанного с зондом.
На фиг. 1 представлено схематическое изображение зонда (многомерных амплификаторных меток), у которого область А функционирует как антитело, а область М является состоящей из большого числа олигомерных субьединиц. Обозначены как разветвленные, так и гребенкоподобные мультимеры.
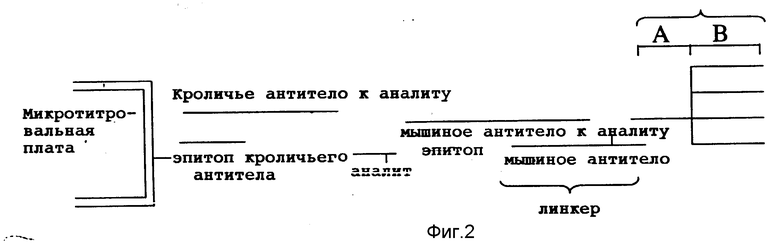
На фиг. 2 представлено схематическое изображение гибридизационной и иммунологической аналитической системы типа сэндвича. Белок аналита иммобилизирован косвенным способом. Второе антитело (мышиное антитело-аналит) объединено в комплекс с гибридной молекулой из антитела и полинуклеотида, в которой белковая составляющая функционирует в качестве антимышиного антитела, а полинуклеотидная составляющая является комплементарной к а'- нуклеотидной области амплификаторного мультимерного зонда.
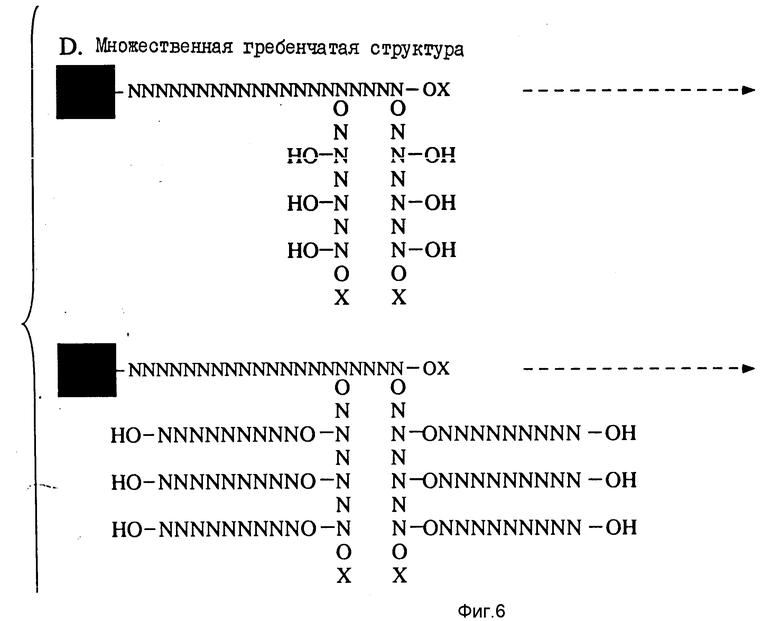
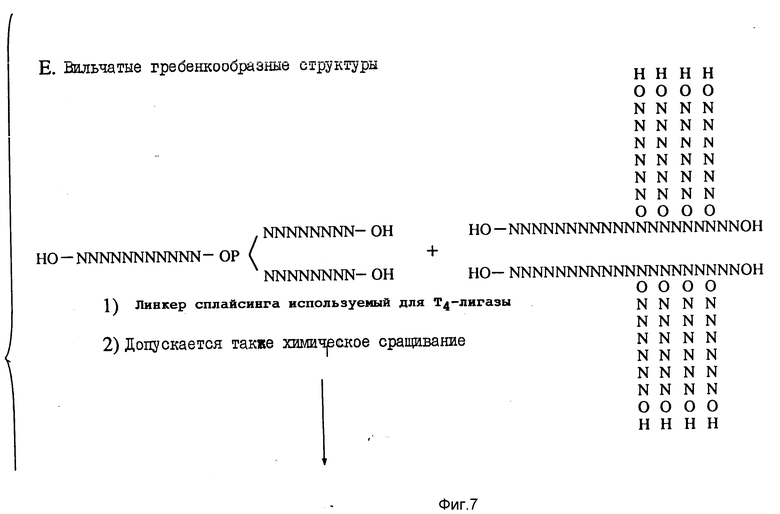
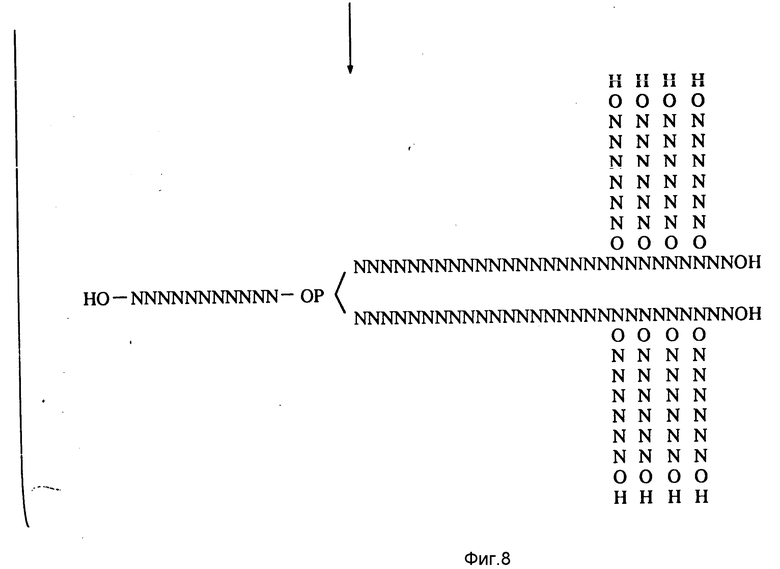
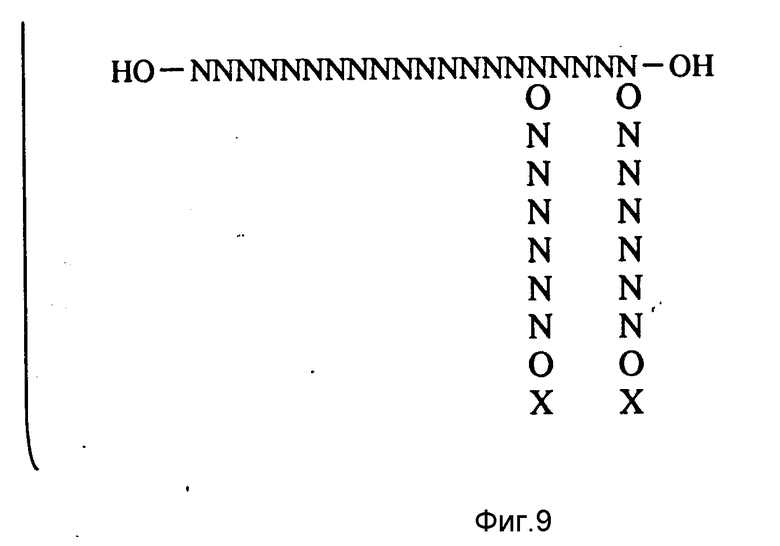
На фиг. 3 - 9 иллюстрируются методики, использованные при получении многомеров с "гребенкоподобной" и (одновременно или по отдельности) и вильчатой структурами.
Определения.
Понятие "обнаруживаемый сигнал" распространяется на переносимое указание совершения биохимического акта, такого как нуклеиновокислотная гибридизация или связывание антигена с антителом. В данной заявке описаны способы амплифицирования обнаруживаемого сигнала при проведении иммунологических анализов.
Понятие "область" распространяется на некоторую определенную область биохимической молекулы, характеризуемую ее функциональным назначением.
Понятие "эпитоп" распространяется на ту часть иммуногенной молекулы, которая специфически распознается соответствующим антителом, образует с ним комплекс в условиях протекания иммунологической реакции.
Нуклеотидно-пептидный "гибрид" включает в себя как остатки нуклеиновой кислоты, так и аминокислотные остатки, причем они находятся в отдельных функциональных областях молекулы.
Понятие "иммуноген" распространяется на вещество, которое может специфическим образом взаимодействовать с антителом.
Понятие "иммунологическая реакция" распространяется на специфическое распознавание в связывание антитела с эпитопом иммуногена. Понятие "иммунологический анализ" распространяется на способ обнаружения присутствия эпитопа посредством сочетания иммунологической реакции со средством обнаружения и количественного описания реакции.
Понятие "полидезоксирибонуклеотид" распространяется на полимерную ДНК-молекулу. Понятие "полинуклеотид" распространяется на полимерную ДНК- или РНК-молекулу.
1. Молекулярный зонд.
Реализация изобретения сводится к получению и использованию ДНК- амплификационной пробы (названной "мультимерной пробой"), содержащей две функциональные области.
Первая область описываемой пробы (область А на фиг. 1) представляет собой полипептид, который функционирует как антитело со специфичностью в отношении выбранного антигена. За функциональной областью полипептида следует область, состоящая либо из аминокислотных, либо из нуклеотидных остатков, т. е. промежуточная область, которая не оказывает существенного воздействия на активность антитела. Активность антитела может носить специфический характер в отношении эпитопа самого аналита, однако в предпочтительном варианте реализации изобретения антитело непосредственно воздействует на антигенную детерминанту конкретного иммуноглобулина, использованного в анализе, (например, антикроличий IgG или античеловеческий IgG). Согласно принятой методике, аналит сначала приводят в контакт со специфическим антителом, избыточные антитела удаляют, и затем связанное антитело обрабатывают амплификационным зондом.
Аналит желательно сначала иммобилизировать на твердой подложке, что облегчает проведение последующих операций промывки. Эта иммобилизация может быть прямой (например, биологические препараты, содержащие аналит, могут быть связаны с нитроцеллюлозным фильтром) или косвенной (например, специфическое антитело может быть иммобилизировано на твердой подложке, и аналит затем может быть связан с иммобилизированным антителом).
Вторая область (М на фиг. 1) включает несколько повторяющихся субьединиц полинуклеотидной природы.
Полинуклеотид области М может представлять собой линейный или разветвленный полимер, образованный одной и той же повторяющейся одноцепочечной олигонуклеотидной субьединицей или разными одноцепочечными олигонуклеотидными субьединицами. Эти субьединицы обладают способностью специфически гибридизоваться и являются стабильными в отношении одноцепочечного нуклеотида, представляющего интерес, которым в типичном случае является меченый олигонуклеотид или какой-то другой мультимер. Эти единицы по длине обычно содержат от 15 до 50 нуклеотидов, предпочтительно от 15 до 30, и характеризуются GC- содержанием в области от 40 до 60%. Полное число олигонуклеотидных единиц у многомера обычно находится в области от 3 до 50, чаще в области от 10 до 20. Олигонуклеотидные единицы мультимера могут быть составлены из РНК, ДНК, модифицированных нуклеотидов или представлять собой комбинации таковых.
Олигонуклеотидные субьединицы могут быть ковалентно связанными непосредственно Друг с другом через фосфодиэфирные связи или через промежуточные связующие образования, такие, как нуклеиновая кислота, аминокислота, карбогидратный или полиольный мостики, или через иные сшивающие образования, способные производить поперечное связывание нуклеиновой кислоты или модифицированных нуклеиновокислотных цепочек. Сайт (сайты), где образуется связь, может находиться на концах субьединицы (либо с нормальной ориентацией 3'-5', либо со случайной ориентацией) и (одновременно или по отдельности) на одном или нескольких внутренних нуклеотидах цепочки.
У линейных полимеров отдельные субьединицы соединяются концами. В случае одного типа разветвленного полимера три или большее число олигонуклеотидных единиц исходят из общей точки, образуя разветвленную структуру. Начальная точка может находиться на какой-то другой олигонуклеотидной субьединице или на многофункциональной молекуле, к которой могут быть ковалентно присоединены, по крайней мере, три единицы. В случае еще одного типа наблюдается олигонуклеотидный субьединичный остов с одной или несколькими "подвешенными" олигонуклеотидными субъединицами. Мультимеры этого последнего типа называют "вилкоподобными", или "гребенкоподобными". Характер "подвешенных" единиц обычно зависит от вида модифицированного нуклеотида или иной органической составляющей, имеющей надлежащие функциональные группы, к которым олигонуклеотиды могут быть коньюгированы или прикреплены иным образом (см. фиг. 1).
Мультимер может быть полностью линейным, полностью разветвленным или представлять собой комбинацию из линейных и разветвленных частей. Желательно, чтобы у мультимера было, по крайней мере, две точки ветвления, желательно, по крайней мере, 15, а еще лучше - от 15 до 50. Мультимер может содержать один или несколько участков, образованных двухцепочечными последовательностями.
Область М может быть получена клонированием (если речь идет о линейной области), ферментативным слиянием, способами химического сшивания, прямым химическим синтезом или комбинацией таковых. Эти способы синтеза являются полностью раскрытыми в коллективной Международной патентной заявке с номером публикации 89/03891, 1989 г. В случае линейных полимеров, приготовленных клонированием, нуклеиновокислотные последовательности, которые кодируют весь мультимер или участки такового, могут быть приготовлены в одноцепочечной или двухцепочечной форме путем использования обычных методик. Если дело имеют с двухцепочечной формой, то тогда мультимеры или фрагменты в конечном итоге денатурируют, получая одноцепочечные формы или их фрагменты. Мультимеры могут быть клонированы в одноцепочечной форме при использовании обычных одноцепочечных фаговых векторов, таких как М13. Фрагменты могут быть соединены ферментативно или химическим способом с образованием многомера области М. При ферментативном соединении отдельные единицы соединяют с помощью лигазы, такой как Т4; ДНК- или РНК-лигазы, что зависит от конкретной ситуации. В случае химического сшивания отдельные единицы могут быть синтезированы с использованием одной или нескольких нуклеиновых кислот, у которых образованы функциональные группы, обладающие сайтами связывания, или же такие сайты могут быть образованы после синтеза олигонуклеотида. К предпочтительному способу химического сшиваниия относится способ с введением в нуклеотид N4 - модифицированных цитозиновых оснований, как это описано в коллективной Европейской патентной заявке N 225807.
В случае прямого химического синтеза олигонуклеотиды, содержащие дериваты нуклеиновых кислот или эквивалентные им многофункциональные молекулы, у которых функциональные группы являются блокированными, готовят, используя обычные способы синтеза олигонуклеотидов. Функциональные группы подвергают разблокировке, и олигонуклеотидные единицы синтезируют на разблокированном сайте (сайтах).
Базовая структура молекул, используемых для образования точек ветвления у мультимеров, представляется следующим образом: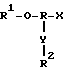
где R - органическая составляющая молекулы (желательно, чтобы это была нуклеиновая кислота), R1 - гидроксильная защитная группа, которая может быть удалена в условиях, при которых не происходит удаления синтетической нуклеиновой кислоты из твердой фазы и не происходит удаления экзоциклических азотных или фосфатных защитных групп, X - фосфорсодержащая группа, которая способствует протеканию синтеза нуклеиновой кислоты, причем такая, как защищенная фосфорамидатная, фосфатная или фосфатная группа, Y - радикал нуклеофильной природы, такой как аминогруппа, гидроксильная группа, сульфгидрильная группа или защищенная фосфатная группа, и R2 - группа R1 или блокирующая, или защитная группа, которая может быть удалена и замещена водородом без воздействия на группу R1. У молекул, используемых для инициирования "вилкоподобного" ветвления, группы R1 и R2 являются одинаковыми, тогда как у молекул, используемых для инициирования "гребенкоподобного" ветвления, группа R2 является блокирующей группой, которая сохраняет устойчивость в присутствии реактива, деблокирующего группу R1. На фиг. 3 - 9 схематически проиллюстрированы методики, используемые для синтеза мультимеров, обладающих "гребенкоподобными" явлениями, "вилкоподобными" ветвлениями или комбинациями таковых.
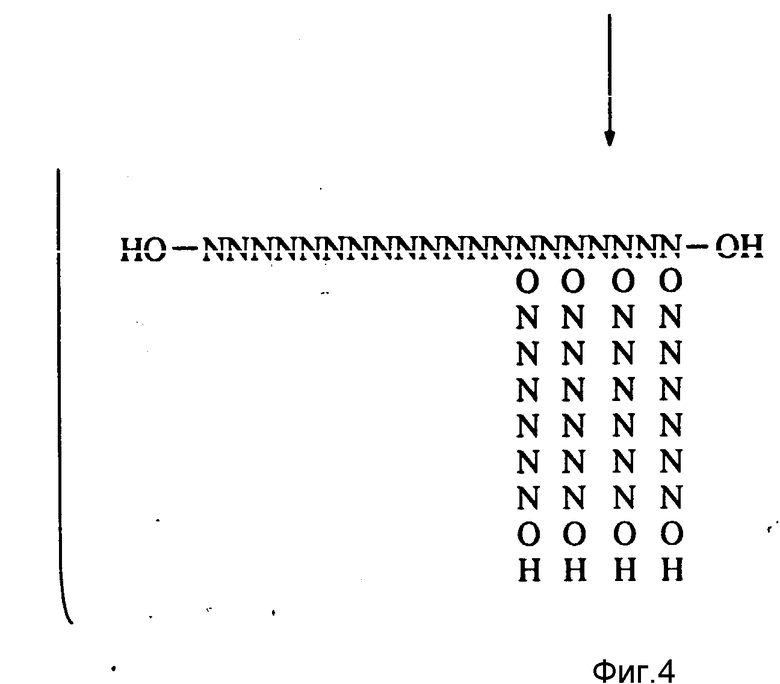
Часть А (фиг. 3) иллюстрирует обычную схему синтеза олигонуклеотидов, используемую для получения линейных олигонуклеотидов, типа применяемой в автоматизированном фосфорамидатном способе (Warner et al., DNA, (1984) 3:401). Темный квадрат обозначает твердую подложку, N обозначает нуклеотид и образование p-N-OR1 (где группа R1 является эквивалентной группе R1, приведенной ниже) представляет собой обычное нуклеотидное производное, обладающее надлежащими защитными группами.
Часть В (фиг. 3 - 4) иллюстрирует методику получения гребенкоподобного мультимера. Соединение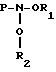
представляет модифицированное основание с приведенной ниже формулой (II). Олигомерную единицу требуемого размера и чередования в последовательности синтезируют и оставляют на подложке. Затем в цепь, пользуясь упомянутой автоматизированной методикой, вводят одно или несколько N4 - модифицированных цитозиновых оснований. Желательно, чтобы модифицированное основание обладало формулой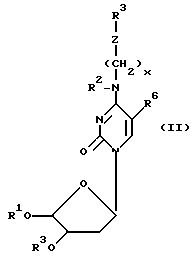
где Z - нуклеофильная группа, такая как -O-, -NH-, -S-, PO4 = и  , R1 - блокирующая или защитная группа, такая как диметокситритильная или пиксильная группа, которая обычно является стабильной в отношении оснований и чувствительной к воздействию кислоты, R2 - водород или метильная группа, R3 - блокирующая или защитная группа, которая может быть удалена и замещена водородом без воздействия на R1 и которая является такой, как группы
, R1 - блокирующая или защитная группа, такая как диметокситритильная или пиксильная группа, которая обычно является стабильной в отношении оснований и чувствительной к воздействию кислоты, R2 - водород или метильная группа, R3 - блокирующая или защитная группа, которая может быть удалена и замещена водородом без воздействия на R1 и которая является такой, как группы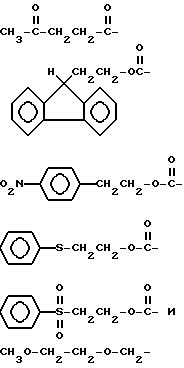
R5 - фосфорамидат или иное фосфорное производное, обеспечивающее введение нуклеотидов в 5'- положение олигонуклеотидной цепи при проведении химического синтеза (например, фосфодиэфир, фосфотриэфир и т. д.), R6 - метильная группа, водород, иод бром или фтор, а X - целое число, заключенное в области от 1 до 8 включительно. При введении более одного модифицированного основания желательно, чтобы они были разделены в цепи промежуточными основаниями, лучше всего димером -TT-. В каркас могут быть введены дополнительные олигонуклеотидные единицы с последующим добавлением модифицированных оснований и т. д.
Нуклеофильную группу N4 затем деблокируют (удаляют группу R3), и по автоматизированной методике из этого образования получают дополнительные олигонуклеотидные единицы. Остаточные R1-группы, находящиеся на концах цепи, удаляют, и с подложки снимают разветвленный "гребенкоподобный" мультимер.
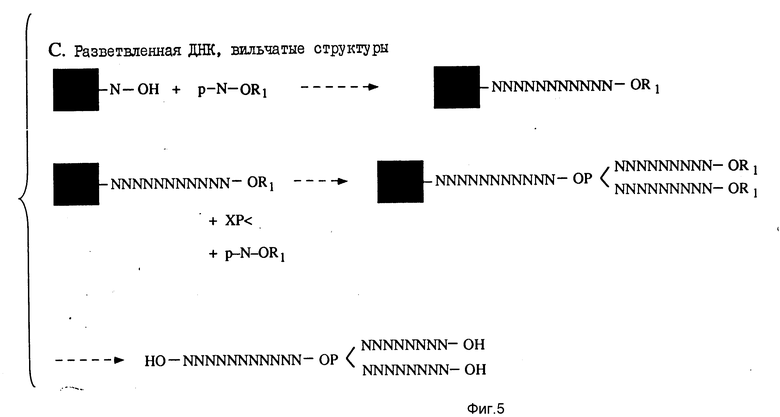
Часть C (фиг. 5) иллюстрирует общую методику получения "вилкоподобного" полимера. И в этом случае обычными способами синтезируют олигомерную единицу требуемых размеров и последовательности, и ее оставляют на подложке. В цепь, пользуясь автоматизированной методикой, затем вводят блокированную бифункциональную фосфорсодержащую группу (представленную как XP в части C), такую как блокированная фосфорамидатная группа. Предпочтительными бифункциональными фосфорсодержащими группами являются блокированные фосфорамидаты с формулой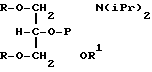
где R - упомянутая гидроксильная защитная группа, iPr - изопропильная группа и R1 - метильная или бета-цианоэтильная группа. Лучше всего, если R представляет собой диметокситритильную группу и R1 - бета-цианоэтильную группу.
Или же может быть использовано N4- модифицированное цитозиновое основание, у которого R1 и R2 являются одинаковыми (например, ими может быть диметокситритильная группа).
Затем удаляют две защитные группы, и из них по автоматизированной методике генерируют дополнительные олигонуклеотидные единицы. Удаляют остаточные R1 - группы, и от подложки отделяют вильчатый полимер.
Части D и E (фиг. 6 - 9) иллюстрируют методики, в случае которых два или несколько вильчатых мультимеров, "гребенкоподобных" мультимеров или комбинации таковых соединяют ферментативно или химически. В общем случае вильчатые и (одновременно или по отдельности) "гребенкоподобные" полимеры готовят, как это описано выше, и удаляют с подложки. Их затем соединяют в растворе по методикам с ферментативным или химическим связыванием, как это описано выше.
Часть F иллюстрирует методику синтеза множественного "гребенкоподобного" мультимера. Эта методика является разновидностью методики, проиллюстрированной в части В, она предполагает введение модифицированных оснований в зависимые стороны цепей и генерирование вторичных олигонуклеотидных боковых цепей на их основе.
У мультимеров в предварительно заданные сайты могут быть введены подходящие отщепляемые соединительные молекулы, что делают с целью проведения анализа структуры или с целью использования в качестве средства высвобождения предварительно заданных участков (таких как та часть мультимера, которая присоединена к меченому опигонуклеотиду). После синтеза полимера и его очистки эти связки могут быть удалены специфическим образом без дополнительного разрушения нуклеотидной структуры полимера. Было установлено, что предпочтительный тип соединительной молекулы должен содержать 1,2 - диольную группу (которая может быть избирательно отщеплена воздействием периодатов), а также защищенную гидроксильную и образованную у фосфорамидата гидроксильную группу, чем обеспечивается возможность введения связки в какой-либо ДНК-фрагмент при использовании стандартных методик фосфорамидатной химии. Предпочтительным вариантом такой связки является соединение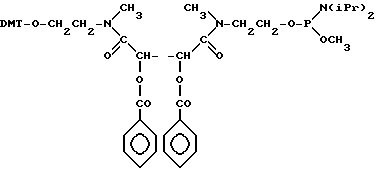
где DMT - диметокситритильная группа и iPr - изопропильная группа, как это было указано выше. После введения в ДНК-фрагмент и полного деблокирования фрагмента, содержащего связку, структура имеет следующий вид: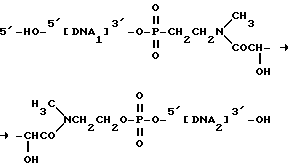
где ДНК1 и ДНК2 являются ДНК-субфрагментами, которые могут быть одинаковыми или разными. При взаимодействии этого фрагмента с периодатом натрия происходит отщепление фрагмента с образованием следующих субфрагментов: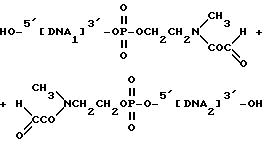
Или же 1,2-диольная группа может быть замещена соединительными группами, которые содержат связь, чувствительную к воздействию гидраксиламина, сульфоновую связь, чувствительную к воздействию основания, или дисульфидную связь, чувствительную к воздействию тиола. Такие соединительные группы могут быть выделены из сшивающих веществ, обычно используемых при коньюгировании белков с другими образованиями. Аналогичным образом, могут быть использованы защитные группы, отличные от диметокситритильной группы.
Область А у мультимерных зондов может быть коньюгирована с областью М через промежуточные связывающие образования, такие как нуклеиновая кислота, аминокислота, карбогидратные или полиольные мостики или через другие сшивающие образования. Область М может быть синтезирована совместно с 5'- нуклеиновокислотным остатком, который может быть изменен с образованием функциональной группы, содержащей связующий сайт для области А. Остаток может быть изменен и после синтеза олигонуклеотида с образованием такого сайта. Предпочтительный способ химического сшивания сводится к введению N4- модифицированного цитозинового основания на 5'-конце полинуклеотида, как это описано в коллективной Европейской патентной заявочной публикации N 0225807.
2. Иммунологический анализ.
Аналитом может быть какой-нибудь известный иммуноген, представляющий интерес. Аналит может присутствовать в низкой концентрации в приготовленном образце или находиться в виде небольшого числа частиц в гетерогенной смеси биологического материала. Аналит может присутствовать в самых разных источниках, например, в биологических средах и тканях, у персонала пищевой индустрии, в материалах окружающей среды и т. д., а также может быть синтезирован in vitro.
На первом этапе готовят образец, содержащий аналит, для чего используют какой-либо из многих методов, известных специалистам, работающим в этой области техники.
Амплификаторные молекулярные зонды могут быть применены для обнаружения аналита при любом числе иммунологических аналитических методик, реализуемых либо в растворе, либо в условиях иммобилизации на твердой фазе. Если иммунологический анализ проводят в растворе, то, тогда образец, содержащий аналит, либо непосредственно связывают с зондом, либо делают это косвенно через одно или несколько антител, специфических для данного аналита.
При проведении иммунологического анализа с использованием твердой фазы аналит (которым может быть либо антиген, либо антитело) либо иммобилизируют непосредственно на твердой фазе, либо связывают с первым антителом, которое сначала было связано с твердой фазой, либо проводят анализ способом сэндвича (фиг. 2), при котором второе антитело распознает аналит и, в свою очередь, распознается антителом, связанным с твердой фазой.
Если аналит должен быть непосредственно связан с твердой фазой, то тогда образец, содержащий аналит, приводят в контакт с нитроцеллюлозным фильтром или с аналогичным материалом, позволяющим осуществить неизберательное связывание белка. Если аналит должен быть косвенно и избирательно связан с твердой фазой, то тогда первое антитело, направленное на эпитоп аналита или на второе антитело, коньюгируют с твердой фазой и затем используют для связывания аналита или второго антитела, связанного с аналитом.
В предпочтительном варианте реализации изобретения аналит косвенно иммобилизируют на твердой фазе, например, на пластине из поливинилхлорида с 96-углублениями. В случае теста типа сэндвича, в углубление вводят 50 мкл первого антитела (антикроличьего при концентрации 20 мкг/мл в 0,2 М растворе NaCO3). Это углубление накрывают, и его содержимое инкубируют в течение 2 ч при комнатной температуре во влажной атмосфере. Раствор затем отсасывают из углубления. Углубление дважды промывают блокирующим буферным раствором, содержащим 3% бычий сывороточный альбумин, находящийся в фосфатно-солевом буферном растворе, содержащем 0,02% азида натрия. Содержимое углубления затем инкубируют совместно с блокирующим буферным раствором в течение 20 мин при комнатной температуре в увлажненной атмосфере и затем еще два раза промывают блокирующим буферным раствором.
В углубление добавляют 50 мкл второго антитела (аналит в виде кроличьего антитела, также находящийся при концентрации 20 мкг/мл), и методику, описанную выше, повторяют. Затем аналит подвергают серии разбавлений в блокирующем буферном растворе. В углубление вводят 50 мкл раствора от каждого разбавления. Пластину накрывают и инкубируют в течение 2 ч при комнатной температуре в увлажненной атмосфере. После этой инкубации углубления четыре раза промывают блокирующим буферным раствором. Затем аналогичным образом добавляют третье антитело (аналит в виде мышиного антитела), после чего добавляют гибридный амплификаторный зонд. Поскольку случайные тканевые препараты могут содержать анти-ДНК-антитела, блокирующий буферный раствор, использованный для промывок после добавления метки, также содержит 20 мкг/мл ДНК лососевой семенной жидкости.
Стадия гибридизации следует за этапом комплексообразования аналита и антител.
Обычно гибридизацию проводят в водной среде, в частности в буферной водной среде, которая содержит различные добавки. В эти добавки могут входить полинуклеотиды, которые должны быть подвергнуты гибридизации, соли (например, цитрат натрия при концентрациях от 0,017 до 0,17 М и одновременно или по отдельности хлорид натрия с концентрацией от 0,17 до 1,7 М), неионные детергенты, такие как NP-40 или тритон X-100 (при концентрации от 0,1 до 1,0%), которые не оказывают воздействия на комплекс из антигена и антитела. Смесь инкубируют в течение 15-75 мин при температуре от 35 до 55oC.
Если условия, примененные при гибридизации меченного олигонуклеотида с мультимерными субьединицами, вызывают нестабильность комплексов из антигена и антитела, то тогда стадии гибридизации может предшествовать обработка комплекса белковым сшивателем, таким как глутаровый альдегид, или может быть использован другой способ стабилизации комплекса. Стабилизировав белковый комплекс, можно изменять условия нуклеиновокислотной гибридизации, что позволяет вводить додецилсульфат натрия (до 1%), неводные растворители, такие как диметилформамид, диметилсульфоксид и формамид, и повышать температуру до 70oC.
Важно отрегулировать условия гибридизации таким образом, чтобы сохранялась стабильность комплексов из антигена и антитела. Например, гибридизация комплементарных последовательностей более короткой протяженности может быть осуществлена при пониженных температурах. В предпочтительном варианте реализации изобретения комплементарные одноцепочечные области содержат от 12 до 20 оснований. В предпочтительном варианте температура гибридизации находится в области от 35 до 45oC. Кроме того, поскольку единственными одноцепочечными олигонуклеотидами, присутствующими на этой стадии, являются комплементарные цепочки, может оказаться терпимой более высокая жесткость и, следовательно, могут оказаться терпимыми пониженные концентрации солей (0,3 М по натрию).
Результирующий твердофазный меченый нуклеиновокислотный комплекс затем отделяют от избытка меченого олигонуклеотида, что достигается промывкой с удалением несвязанного меченого олигонуклеотида, и считывают результат.
3. Замечания общего характера.
Твердая фаза, которую используют при проведении анализа, может находиться в виде раздробленных частиц или представлять собой твердую поверхность стенки любого из самых разных контейнеров, например, ими могут быть пробирки центрифуги, колонки, стенки микротитровальной пластины, фильтры и т. д. Желательно, чтобы размер у используемых частиц находился в области от 0,4 до 200 мкм и, более желательно, в области примерно от 0,8 до 4,0 мкм. Частицы могут быть изготовлены из какого-либо приемлемого материала, такого как латекс или стекло. Первое антитело, обладающее специфическими свойствами в отношении аналита или в отношении второго антитела, которое обладает специфическими свойствами в отношении аналита, может быть устойчиво прикреплено к твердой поверхности через функциональные группы известными способами.
Метящая метка должна включать одну или несколько молекул, которые непосредственно или косвенно пригодны для получения выявляемого сигнала. Метки могут быть присоединены к индивидуальным членам внутри последовательности или могут находиться в виде концевого ее участка, обладающего множеством меток. В литературе сообщаются различные способы получения меченых последовательностей. См. , например, Urdea et al. Nucl. Acids Res. (1988) 16:4937; Leary et al., Proc. Natl. Acad. Sci USA (1983) 80:4045; Penz and Kurz, Nucl. Acids Res. (1984) 12:3435; Richardson and Gumport, Nucl. Acids. Res. (1983) 11: 6167; Smith et al., Nucl. Acids Res. (1985) 13:2399; Mein-koth and Wahl, Anal. Biochem. (1984) 138:267. Метки могут быть связаны с комплементарной последовательностью либо ковалентно, либо нековалентно. К меткам, которые могут быть применены, относятся радионуклиды, флюоресцирующие образования, хемилюминесцирующие образования, красители, ферменты, ферментные субстраты, ферментные кофакторы, ферментные ингибиторы, ферментные субьединицы, металлические ионы и т. п. К распространенным неизотопным меткам относятся флуоресцеин, родамин, техасский красный, фикоэритрин, умбеллиферон, лиминол, НАДФ, галактозидаза, пероксидаза хрена обыкновенного и т. д. Касательно сопоставления изотопных и неизотопных способов мечения см. работу Урдеа (Urdea) и др.
В зависимости от природы метки могут быть применены разные способы обнаружения ее присутствия. В случае флуоресцирующих веществ для этой цели может быть использовано большое число различных доступных флуориметров. В случае ферментов может образовываться либо флюорисцирующий, либо окрашенный продукт, который может быть определен флуориметрически, спектрофотометрически или визуально. Применительно к данным тестам могут быть применены различные метки, нашедшие применение в иммунологических анализах, и разные способы, пригодные для проведения иммунологических анализов.
Методика, используемая на отдельных этапах проведения анализа, будет различной, изменяясь в зависимости от природы твердой фазы.
Примеры. Следующие примеры представлены с целью иллюстрации, но не ограничения рамок настоящего изобретения. Другие варианты без выхода за рамки изобретения могут предложить сами специалисты, работающие в этой области техники.
Пример 1. Иммунологический анализ на наличие антигена вируса гепатита C в человеческой сыворотке.
Этот анализ проводится с целью прямого тестирования наличия антигена C-100 вируса гепатита C. Общий ход этого иммунологического анализа описан выше. Микротитровальные пластины готовят с использованием коэлино-антимышиного антитела в качестве первого антитела. Это антитело подвергают иммобилизации в углублениях микротитровальной пластины на 96 углублений. Вторым антителом является мышиное моноклональное антитело, обладающее специфическими свойствами в отношении эпитопа C-100 вируса гепатита C. В блокирующем буферном растворе при двукратном разбавлении сыворотки, взятой у отдельных лиц, подвергаемых проверке на вирус гепатита C, готовят препараты, и их инкубируют в углублениях микротитратора наряду с надлежащими контрольными препаратами. Третьим антителом является комбинация поликлональных кроликовых антител, который распознают каждый из антигенов вируса гепатита C. Конечным антителом является полипептидная составляющая области А в составе зонда, которая функционирует как козлино-антимышиное антитело и завершает построение "сэндвича" при проведении иммунологического анализа.
После связывания одного из описанных выше зондов добавляют раствор, содержащий 50 фмоль меченной олигонуклеотидной последовательности, которая обладает существенно гомологическим характером в отношении многомерной субьединицы области М. Меченый ферментом зонд добавляют в 40 мкл раствора, содержащего 4 х SSC и 100 мкг/мл поли-А, и выдерживают в течение 15 мин при 55oC. И, наконец, комплекс дважды промывают раствором, содержащим 0,1 х SSC и 0,1% додецилсульфата натрия, а затем дважды промывают раствором, содержащим 0,1 х SSC.
С целью обнаружения метки проводят диоксэтановую реакцию (Schapp et al. (1987) Tet lett 28:1159-1162 и патент США N. 4857652), используя реактивы, полученные у фирмы "Лумиген инк". Методика обнаружения такова. На стадии введения метки 20 мкл НМ- буферного раствора, содержащего метку, добавляют в каждое углубление, и углубления инкубируют при 55oC в течение 15 мин. Надосадочную жидкость удаляют, а углубления дважды промывают 380 мкл раствора, содержащего 0,1 х SSC и 0,1% додецил-сульфата натрия. Углубления затем дважды промывают 380 мкл раствора, содержащего 0,1 х SSC, что делают с целью удаления всяких следов додецилсульфата натрия. В каждое углубление добавляют 20 мкл раствора, содержащего З.З•10-4М диоксэтана в цетилтриметиламмониевобромидном буферном растворе. По пластине с углублениями слегка постукивают, чтобы реактив попал на дно, и ее осторожно крутят, чтобы реактив равномерно распределился по дну. Углубления накрывают уплотнителем в виде пластины микротитрометра и инкубируют в печи при 37oC в течение одного часа. Люминометром находят затем показания для углублений, и их количественно характеризуют относительно стандартной кривой, полученной при хорошо известных количествах антигена.
Пример 2. Иммунологический анализ на присутствие антитела к вирусу гепатита C в человеческой сыворотке.
Пластины микротитрометра сначала покрывают антигеном C-100 HCV, выделенным из вируса гепатита C. Непосредственно перед добавлением готовят раствор, содержащий покрывающую буферную смесь (50 мМ бората натрия, pH 9,0), в количестве 21 мл на пластину, бычий сывороточный альбумин (25 мкг/мл) и антиген C-100 HCV (2,50 мкг/мл). После перемешивания в течение 5 мин раствор, взятый в количестве 0,2 мл на углубление, добавляют на пластины, которые затем покрывают и инкубируют в течение 2 ч при 37oC, после чего раствор удаляют отсасыванием. Углубления один раз промывают 0,4 мл промывочного буферного раствора, содержащего 100 мМ фосфата натрия при pH 7,4, 140 мМ хлорида натрия, 0,1% казеина, 1% (вес к обьему) тритона X-100, 0,01% (вес к обьему) гибитана. После удаления промывочного раствора в каждое углубление добавляют 200 мкл раствора Посткоута (Postcoat), содержащего 10 мМ фосфата натрия при pH 7,2, 150 мМ хлорида натрия, 0,1% (вес к объему) казеина, 3% сахарозы и 2 мМ фтористого фенилметилсульфонала, пластины неплотно накрывают, чтобы воспрепятствовать испарению, и оставляют стоять в течение 30 мин при комнатной температуре. Из углублений затем отсасывают раствор и подвергают их сухой лиофилизации на протяжении ночи, делая это без нагревания.
С целью проведения иммунологического анализа 20 мкл образцов сыворотки двойного разбавления и контрольных образцов добавляют в углубления, содержащие 200 мкл разбавителя образца, содержащего 100 мМ фосфата натрия при pH 7,4, 500 мМ хлорида натрия, 1 мМ этилендиаминтетрауксусной кислоты, 0,1% (вес к объему) казеина, 0,01% (вес к объему) гибитана, 1% (вес к объему) тритона X-100, 100 мкг/мл дрожжевого экстракта. Пластины герметизируют и инкубируют при 37oC в течение 2 ч, после чего раствор удаляют отсасыванием, и углубления три раза промывают 400 мкл промывочного буферного раствора (фосфатно- солевой буферный раствор, содержащий 0,05% твина 20).
После добавления образцов сыворотки углубления обрабатывают, как и в примере 1, за исключением того, что при этом кроличью античеловеческую сыворотку заменяют третьим антителом (антианалитное антитело).
Другие варианты и применения различных амплификаторных молекулярных зондов, описанных в настоящей заявке, применительно к способам проведения иммунологического анализа, должны быть очевидными для специалистов, работающих в этой области техники, и можно думать, что они находятся в рамках данного изобретения.
1. Характеристики последовательности
A. Длина: 32 пары оснований
B. Тип: нуклеиновая кислота
C. Строение: одноцепочечная.
D. Топология: линейная
XI. Описание последовательности SEQ ID NO:4 CTGGCTTATC GAAATTAATA CGACTCACTA TA
2. Информация о последовательности N 5 (SEQ ID NO:5)
1. Характеристика последовательности
A. Длина: 32 пары оснований
B. Тип: нуклеиновая кислота
C. Строение: одноцепочечная
D. Топология: линейная
XI. Описание последовательности SEQ ID NO:5 TATAGTGAGT CGTATTAATT TCGATAAGCC AG
2. Информация о последовательности N 6 (SEQ ID NO:6)
1. Характеристики последовательности
A. Длина: 43 пары оснований
B. Тип: нуклеиновая кислота
C. Строение: одноцепочечная
D. Топология: линейная
XI. Описание последовательности SEQ ID NO:6 GGGAGATGTG GTTGTCGTAC TTAGCGAAAT ACTGTCCGAG TCG
2. Информация о последовательности N 7 (SEQ ID NO:7)
1. Характеристики последовательности
2. Информация о последовательности N 1 (SEQ ID NO:1)
1. Характеристики последовательности
A. Длина: 7 пар оснований
B. Тип: нуклеиновая кислота
C. Строение: одноцепочечная
D. Топология: линейная
XI. Описание последовательности SEQ ID NO:1 AAAAAAA
2. Информация о последовательности N 2 (SEQ ID NO:2)
1. Характеристики последовательности
A. Длина: 17 пар оснований
B. Тип: нуклеиновая кислота
C. Строение: одноцепочечная
D. Топология: линейная
XI. Описание последовательности SEQ ID NO:2 TAATACGACT CACTATA
2.Информация о последовательности N 3 (SEQ ID NO:3)
1. Характеристики последовательности
A. Длина: 17 пар оснований
B. Тип: нуклеиновая кислота
C. Строение: одноцепочечная
D. Топология: линейная
XI. Описание последовательности SEQ ID NO:3 TATAGTGAGT CGTATTA
2. Информация о последовательности N 4 (SEQ ID NO:4)
A. Длина: 43 пары оснований
B. Тип: нуклеиновая кислота
C. Строение: одноцепочечная
D. Топология: линейная
XI. Описание последовательности SEQ ID NO:7 CGACTCGGAC AGTATTTCGC TAAGTACGAC AACCACATCT CCC
2. Информация о последовательности N 8 (SEQ ID NO:8)
1. Характеристики последовательности
A. Длина: 10 пар оснований
B. Тип: нуклеиновая кислота
C. Строение: одноцепочечная
D. Топология: линейная
XI. Описание последовательности SEQ ID NO:8 AAAAAAAAAAA
2. Информация о последовательности N 9 (SEQ ID NO:9)
1. Характеристики последовательности
A. Длина: 41 пара оснований
B. Тип: нуклеиновая кислота
C. Строение: одноцепочечная
D. Топология: линейная
XI. Описание последовательности SEQ ID NO:9 TTTTTTTTTC TGGCTTATCG AAATTAATAC GACTCACTAT A
2. Информация о последовательности N 10 (SEQ ID NO:10)
1. Характеристики последовательности
A. Длина: 41 пара оснований
B. Тип: нуклеиновая кислота
C. Строение: одноцепочечная
D. Топология: линейная
XI. Описание последовательности SEQ ID NO: 10 TATAGTGAGT CGTATTAATT TCGATAAGCC AGAAAAAAAA A
2. Информация о последовательности Т 11 (SEQ ID NO:11)
1. Характеристики последовательности
A. Длина: 43 пары оснований
B. Тип : нуклеиновая кислота
C. Строение: одноцепочечная
D. Топология: линейная
XI. Описание последовательности SEQ ID NO: 11 GGGAGATGTG GTTGTCGTAC TTAGCGAAAT ACTGTCCGAG TCG
2. Информация о последовательности N 12 (SEQ ID NO:12)
1. Характеристики последовательности
A. Длина: 43 пары оснований
B. Тип, нуклеиновая кислота
C. Строение: одноцепочечная
D. Топология: линейная
XI. Описание последовательности SEQ ID NO: 12 CCCTCTACAC CAACAGCATG AATCGCTTTA TGACAGGCTC AGCо

Изобретение касается использования нуклеиновокислотной гибридизации в качестве средства амплифицирования обнаруживаемого сигнала при проведении иммунологического анализа. Молекулярный зонд, используемый для амплификации сигнала, содержит две области. Первая область А включает полипептид, способный функционировать в качестве антитела. Последнее специфически связывается с известным аналитом. Вторая область М включает множество одноцепочечных олигонуклеотидных субъединиц. Последние обладают способностью специфически связываться с заданной последовательностью нуклеиновой кислоты. Область М включает от 15 до 50 оснований и содержит гуанинцитозиновые пары (GС) от 40 до 60%. Олигонуклеотидные субъединицы соединены в линейную или разветвленную структуру. Области А и М соединены через многофункциональный фрагмент. 6 з. п. ф-лы, 9 ил.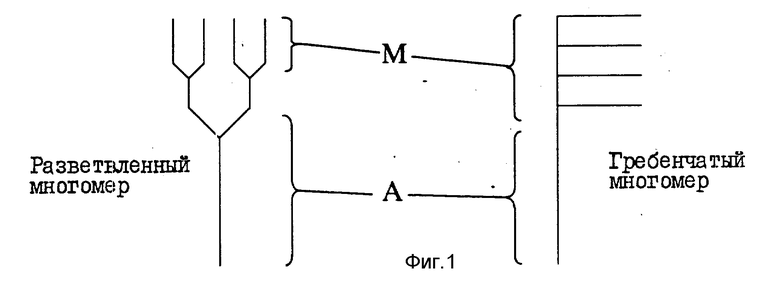
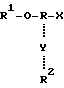
где R - органическая составляющая, преимущественно нуклеиновая кислота;
R1 - гидроксильная защитная группа, которая может быть удалена в условиях, при которых не происходит удаление синтетической нуклеиновой кислоты из твердой фазы и не происходит удаление экзоциклических азотной или фосфатной защитных групп;
Х - фосфорсодержащая, которая способствует протеканию синтеза нуклеиновой кислоты;
Y - радикал, образованный из нуклеофильной группы;
R2 - группа R1, или блокирующая, или защитная группа, которая может быть удалена и замещена водородом без воздействия на группу R1.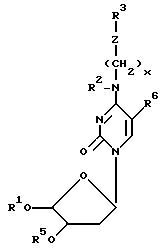
где Z - нуклеофильная группа;
R1 - защитная группа, которая в общем случае является устойчивой в отношении воздействия щелочей и чувствительной к воздействию кислот;
R2 - водород или метильная группа;
R3 - защитная группа, которая может быть удалена и замещена водородом без воздействия на группу R1;
R5 - фосфорное производное, которое обеспечивает добавление нуклеотидов по 5'-положению олигонуклеотидной цепи при проведении химического синтеза;
R6 - метильная группа, водород, йод, бром или фтор,
Х - целое число, находящееся в области от 1 до 8 включительно.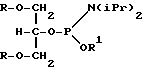
где R - гидроксильная защитная группа;
iPr - изопропильная группа,
R1 - метильная или бета-цианоэтильная группа.
| WO, заявка, 90/013667, C 12 Q 1/68, 1990. |
Авторы
Даты
1998-03-27—Публикация
1991-05-06—Подача