Изобретение относится к биотехнологии и касается получения микробиологическим методом авермектина - антибиотика сельскохозяйственного назначения.
Авермектин, обладающий противопаразитарной активностью, был открыт и запатентован как таковой в 1978 г и был первоначально назван "веществом С-076".
Один из способов его получения заключается в том, что после выращивания культуры продуцента вида Streptomyces avermetilis культуральную жидкость подкисляют до значения pH 1,5 - 6,0, экстрагируют несмешивающимся с водой растворителем при нагревании, декантируют экстракт, удаляют экстрагент и получают целевой продукт [1].
В результате получают суммарный препарат авермектина, поскольку продуценты синтезируют группу антибиотиков авермектинового ряда, которые несколько отличаются по химической структуре.
Наиболее близким к предложенному по технической сущности является способ получения авермектина, позволяющий выделить отдельные компоненты авермектинового комплекса.
Этот способ-прототип состоит в том, что культуру-продуцент вида Sterptomyces avermitilis выращивают в питательной среде, содержащей источники углерода, азота и минеральные соли, отделяют мицелий, экстрагируют его смешивающимся с водой растворителем, экстракт концентрируют, подкисляют до значения pH примерно 4 и экстрагируют органическим растворителем, не смешивающимся с водой, с последующим разделением при необходимости компонентов авермектинового комплекса хроматографическим методом [2].
Описанный способ позволяет получать кроме суммарного препарат более простые смеси компонентов или индивидуальные авермектины путем одной или нескольких процедур хроматографической очистки.
Однако, как было установлено, полученные известными способами авермектины содержат значительные количества примесей в частности липидов и/или жирных кислот, которые в данных условиях хроматографической очистки отделить не удается.
Цель изобретения - получить авермектины с пониженным содержанием балластных веществ и тем самым повысить удельную активность авермектинов.
Поставленная цель была достигнута в результате того, что повторную экстракцию исходного первичного экстракта осуществляют в щелочных условиях.
Было показано, что в процессе повторной экстракции несмешивающимся с водой органическим растворителем исходного первичного экстракта в щелочной среде удается избавиться от значительного количества балластных веществ, которые не удаляются на дальнейших этапах хроматографической очистки.
Сущность предложенного способа состоит в следующем.
Культуру-продуцент вида Streptomyces avermitilis выращивают в оптимальных для роста условия на питательной среде, содержащей источники углерода, азота и минеральные соли.
Традиционными методами отделяют мицелий, экстрагируют его смешивающимся с водой органическим растворителем, например, ацетоном и экстракт предпочтительно упаривают полностью или частично. Концентрат подщелачивают до значения pH 8,0 - 12,0 и экстрагируют органическим растворителем, не смешивающимся с водой, например, этилацетатом.
Вторичный экстракт может быть непосредственно подвергнут хроматографии, но можно его упарить и остаток растворить в свежей порции того же или другого растворителя или в смеси растворителей.
Могут быть использованы любые известные системы растворителей для разделения авермектинов хроматографическими методами, например система хлороформ : метанол (80 - 100) : 1.
Приемлемо использование различных вариантов хроматографического разделений, в частности классической изократической хроматографии.
В качестве носителя могут быть использованы традиционные материалы, например силикагель.
Существенное преимущество предложенного способа перед известными состоит в том, что полученные на стадии экстракционной очисти препараты авермектинов имеют в 6 - 10 раз более высокую удельную активность по сравнению с авермектинами, получаемыми известным способом. Для получения авермектинов с такой активностью по известному способу приходится осуществлять несколько этапов хроматографической очистки. В зависимости от использованных методов хроматографического разделения, авермектины, полученные известным способом, имеют удельную активность 150 - 500 мкг/мг после двух- или трехкратной хроматографии, в то время как средняя удельная активность авермектинов, выделенных предложенным способом, предусматривающим лишь однократную хроматографическую обработку экстракта, составляет величину не менее 900 мкг/мг.
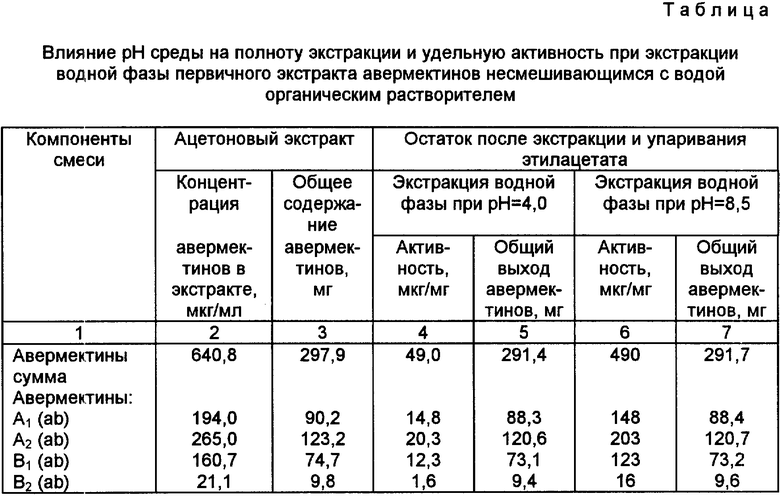
То, что проведение этапа повторной экстракции авермектинов в условиях щелочной среды является ключевым моментом предложенного способа вытекает из данных таблицы.
Как видно из представленных в таблице данных (см. графы 5 и 7), полнота экстракции авермектинов в кислой и щелочной среде практически одинакова, однако препарат авермектина, полученный в щелочных условиях имеет на порядок большую удельную активность (сравни графы 4 и 6), что свидетельствует о значительно меньшем количестве балластных веществ в полученных предлагаемым способом препаратах авермектина. При этом процентное соотношение авермектинов в первичном экстракте и конечном препарате не меняется.
Предложенный способ в равной мере может быть использован для получения суммарного препарата авермектина, определенных фракций авермектинов или индивидуальных авермектинов.
Пример 1. Культуру Streptomyces avermitilis шт. 1051-3 выращивают в колбах объемом 750 мл, заполненных 100 мл питательной среды, содержащей, мас. %: глюкоза 4,5; лактоза 2,0; соевая мука 2,0; натрий хлористый 0,1; дрожжевой экстракт 0,25, при 28 ± 1oC в течение 168 ч. Общий объем полученной культуральной жидкости составил 2350 мл. После фильтрации на воронке Бюхнера было получено 529 г влажной биомассы. К полученной пасте приливают 500 мл ацетона. Общий объем экстракционной системы оказался приблизительно равным 1 л. Первичную экстракцию проводят при периодическом взбалтывании системы в течение 1 ч, а затем биомассу отделяют фильтрованием. Всего было получено 620 мл ацетонового экстракта, который содержит 583,3 мг смеси авермектинов. Ацетон отгоняют на роторном испарителе под вакуумом при температуре не выше 50oC и получают 300 мл мутного раствора, к которому добавляют 100 мл этилацетата и около 10 мл 8 %-ного раствора гидроксида натрия; в результате pH системы оказался равным 9,2. Повторную экстракцию проводят при периодическом перемешивании системы в течение 10 - 15 мин. Этилацетатный слой отделяют, а водную фазу дважды экстрагируют порциями этилацетата по 50 мл. Этилацетатные растворы объединяют, сушат над безводным сульфатом натрия и фильтруют. После упаривания экстракта было получено 1,54 г масла, содержащего 554,2 мг (36 мас. %) смеси авермектинов, которое было растворено в 4 мл смеси хлороформ : метанол (80 : 1). Раствор был нанесен на хроматографическую колонну длиной 25 см и диаметром 2,5 см, заполненную силикагелем марки L 40/100, которая предварительно была промыта 450 мл хлороформа и 100 мл упомянутой системы. Элюцию целевого продукта проводят системой хлороформ : метанол (80 : 1), причем общий объем элюента составил 560 мл, а скорость его пропускания равнялась 2 мл/мин. Элюат после колонки собирают в пробирки с помощью коллектора фракций, в каждой пробирке по 8 мл. По данным ТСХ авермектины содержатся в пробирках с 10 по 54, т.е. в объеме 360 мл. Элюаты, содержащие авермектины, объединяют, упаривают в вакууме, оставшееся масло растворяют в 3 мл ацетона, добавляют 14 мл гексана и упаривают в вакууме до сухого остатка. Получают 492 мг аморфного порошка белого цвета. Выход авермектинов составил 84,4 % от содержания в культуральной жидкости. Суммарная активность препарата равнялась 952 мкг/мг. В качестве балластных веществ препарат содержит до 2 % олигомицинов A и B.
Пример 2. 340 мл культуральной жидкости, полученной в условиях примера 1, фильтруют на воронке Бюхнера, получают 120 г влажной пасты. К полученной пасте добавляют 120 мл ацетона и выдерживают 1 ч при периодическом взбалтывании, затем отфильтровывают. Получают 150 мл водно-ацетонового экстракта авермектинов, который упаривают в вакууме в роторном испарителе при температуре не выше 60oC. Получают мутный раствор объемом 90 мл с величиной pH 6,0. К полученному раствору приливают 100 мл этилацетата, интенсивно встряхивают и образовавшуюся стойкую суспензию разрушают путем добавления 3н. раствора щелочи. Смесь расслаивается при величине pH 9,5. Этилацетатный слой отделяют, а водную фазу дважды экстрагируют 50 мл этилацетата. Этилацетатные растворы объединяют, сушат над безводным сульфатом натрия, осушитель отделяют фильтрованием, этилацетат отгоняют в вакууме при температуре не выше 45oC до получения вязкого остатка. Получают 345 мг вязкого масла, в котором содержится 138 мг (40%) смеси авермектинов, в том числе, %: A1 7,2; A2 8,9; B1 1,6; и B2 12,3. Полученное масло растворяют в 10 мл системы растворителей хлороформ-метанол (80 : 1) и с помощью насоса наносят на колонку с силикагелем (25 • 150 мм), предварительно прокачав через нее 450 мл хлороформа и приблизительно 100 мл системы. Вещества с колонки элюируют системой хлороформ-метанол (80 : 1) со скоростью 1,8 мл/мин. Фракции отбирают через 5 мин с помощью коллектора фракций (объем 9 мл). Процесс разделения контролируют методом ТСХ на пластинках фирмы Мерк с люминофором F254 в системе растворителей хлороформ : метанол (19 : 0,5), нанося по 4 мкл элюата. Близкие по компонентному составу фракции объединяют. Из пробирок 10 - 18 после упаривания элюата и переосаждения осадка из смеси растворителей ацетон : гексан (3 : 14) получают 50 мг смеси авермектинов A1 и A2 с соотношением 1 : 1,2, из пробирок 19 - 21 выделяют 6 мг смеси авермектинов A1, A2 и B1 с примерно равным соотношением компонентов между собой, из пробирок 22 - 31 получают 62 мг смеси авермектинов B1 и B2 с соотношением компонентов между собой 1 : 1, из пробирок 32 - 43 - 16 мг авермектина B2. Суммарный выход авермектинов составил 97 % от взятого для хроматографического разделения количества (138 мг). Таким образом, было получено 50 мг суммарного препарата авермектинов A с удельной активностью 950 мкг/мг и 62 мг суммарного препарата авермектинов B с удельной активностью 970 мкг/мг.
Пример 3. Водно-ацетоновый экстракт авермектинов объемом 480 мл, полученный из 1390 мл культуральной жидкости (384 г биомассы) упаривают на роторном испарителе под вакуумом при температуре не выше 50oC в 2,4 раза. К полученному мутному раствору объемом 200 мл добавляют 100 мл этилацетата и добавлением 10 мл 10 %-ного раствора гидроксида натрия доводят pH до значения 9 - 10. Раствор встряхивают, этилацетатный слой отделяют, а водную фазу дважды экстрагируют 50 мл этилацетата. Этилацетатные растворы объединяют, сушат над безводным сульфатом натрия и отфильтровывают. После отгонки этилацетата получают 1,5 г масла, в котором содержится 450 мг (30 %) авермектинов, в том числе, %: A1 3,3; A2 7,0; B1 15,7 и B2 4,0.
Полученную смесь авермектинов растворяют 4 мл системы хлороформ-метанол (100 : 1) и с помощью насоса наносят на колонку 25 • 250 мм, заполненную суспензией силикагеля в абс. EtOH, через которую предварительно прокачивают 290 мл системы хлороформ : метанол (100 : 1). Вещества с колонки элюируют со скоростью 1,8 мл/мин, отбирают в пробирки через 5 мин (объем 9 мл). Процесс разделения контролируют методом ТСХ, как это представлено в примере 2. Пробирки с одинаковым компонентным составом объединяют по фракциям. Растворители после объединения фракций полностью удаляют в вакууме, остаток переосаждают из смеси ацетон-гексан. Фракция 1 (пробирки 7 - 9) общей массой 2,1 мг содержит, %: A1 46,9 и A2 9,6. Фракция 2 (пробирки 10 -12) массой 49,2 мг содержит, %: A1 44 и A2 52. Фракция 3 (пробирки 13 - 19) массой 65,6 мг представляет собой 100 % смесь авермектинов A1 и A2 с соотношением между собой 1 : 2, соответственно. Фракция 4 (пробирки 20 - 21) массой 16,1 мг на 98 % состоит из A2, а в качестве примеси содержит около 2 % A1. Промежуточная фракция 5 (пробирки 22 - 23) массой 15,1 мг представляет собой смесь авермектинов, состоящую, %: A1 1,8; A2 36,7 и (B1 + B2) 61,5. Фракция 6 (пробирки 24 - 40) массой 206 мг состоит на 98 % из авермектинов B1 и B2 и, наконец, фракция 7 (пробирки 41 - 64) массой 25,5 мг представляет собой чистый авермектин B2. Таким образом, было получено 16,1 мг индивидуального авермектина A2 с удельной активностью 980 мкг/мг и 25,5 мг индивидуального авермектина B2 с удельной активностью 975 мкг/мг.
В доступной научно-технической и в патентной литературе не было обнаружено сведений о проведении экстракции авермектинов в щелочной среде. Производные авермектина, например, 22-гидрокси-авермектины также рекомендовано экстрагировать в кислой среде [3] . Более того, имеются указания, что при значениях pH выше 7,0 имеет место разложение авермектина и по этой причине рекомендуется остатки после экстракции авермектинов обрабатывать щелочью, чтобы инактивировать не извлеченные авермектины и улучшить условия труда, поскольку авермектины являются токсичными продуктами [1].
Как оказалось в результате исследований, в условиях многокомпонентной эктсракционной системы на этапе повторной экстракции авермектинов инактивации последнего в щелочной среде не происходит, что подтверждается данными приведенной таблицы сравнения.
Изложенное дает основание полагать, что достигнутый полезный результат не вытекал из известного уровня знаний, а заявленное техническое решение соответствует требованиям, предъявляемым к изобретению.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ АВЕРМЕКТИНА И ШТАММЫ STREPTOMYCES AVERMITILIS - ПРОДУЦЕНТЫ АВЕРМЕКТИНА | 1988 |
|
RU2096462C1 |
| СПОСОБ ПОЛУЧЕНИЯ КРИСТАЛЛИЧЕСКОГО ТИЛОЗИНА | 1997 |
|
RU2114173C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ МИКРОКОЛИЧЕСТВ АВЕРМЕКТИНОВ В ПРОДУКТАХ ЖИВОТНОГО И РАСТИТЕЛЬНОГО ПРОИСХОЖДЕНИЯ | 2001 |
|
RU2207547C1 |
| ШТАММ АКТИНОМИЦЕТА STREPTOMYCES AVERMITILIS ССМ 4697 - ПРОДУЦЕНТ АВЕРМЕКТИНОВ | 1998 |
|
RU2156301C2 |
| Штамм @ @ 12/3а-продуцент аклациномицинов @ и @ | 1982 |
|
SU1069433A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ 2,4-ДИХЛОРФЕНОКСИУКСУСНОЙ КИСЛОТЫ В БИОЛОГИЧЕСКОМ МАТЕРИАЛЕ | 2011 |
|
RU2453848C1 |
| Способ получения фракции иридоидов,обладающей способностью повышать физическую работоспособность | 1981 |
|
SU1028335A1 |
| Способ получения (+) салютаридина | 1974 |
|
SU507204A3 |
| СПОСОБ ПОЛУЧЕНИЯ ОМОМИЦИНА | 1987 |
|
SU1450373A1 |
| Способ получения 6-замещенных 8-метоксиметил-или 8-метилмеркаптометилэрголинов или их солей | 1979 |
|
SU912045A3 |
Использование: биотехнология, микробиология. Сущность изобретения: при получении авермектина осуществляют выращивание культуры - продуцента, экстракцию целевого продукта смешивающимся с водой органическим растворителем, повторную экстракцию полученного первичного экстракта проводят органическим растворителем, несмешивающимся с водой в щелочных условиях, а хроматографическую очистку осуществляют в изократическом режиме при использовании системы хлороформ-метанол (80 - 100) : 1. 1 з.п. ф-лы. 1 табл.
| US, патент 4412991, кл | |||
| Устройство для сортировки каменного угля | 1921 |
|
SU61A1 |
Авторы
Даты
1998-04-20—Публикация
1994-07-05—Подача