Изобретение относится к области медицины, а именно экспериментальной и практической токсикологии, и может быть использовано для определения степени алкилирования белков, в частности гемоглобина, акрилонитрилом в организме экспериментальных животных и людей, подвергшихся воздействию этого ксенобиотика.
Количественная оценка аддуктов алкилирующих ксенобиотиков обычно производится с применением газовой хроматографии и масс-спектрометрии.
До сих пор при подготовке проб к анализу предварительно производился гидролиз алкилированных белков с использованием сильных минеральных кислот либо щелочей, затем следовала стадия изоляции молекул ксенобиотика, ковалентно связанных с аминокислотами (чаще цистеином). После чего изолированные соединения подвергались дериватизации для придания им формы летучих эфиров. Потом производилось собственно изменение с применением газовой хроматографии и масс-спектрометрии по стандартной методике (Fennel T.R., Mac NeeCa J.P., Tunner M.J. Toxicologist, 1989, voc. 9, p. 509).
Недостатками этого способа являются:
Невысокая эффективность метода (часть анализируемых компонентов теряется в стадии дериватизации, так как отсутствует прямой перенос их в хроматографическую колонку).
Длительность периода подготовки образцов к изменению (18 ч).
Необходимость в специальном оборудовании в период подготовки образцов.
Наиболее близким техническим решением, избранным в качестве прототипа, является применяемый в настоящее время способ определения акрилонитрила в его аддуктах с белками, использующий газовую хроматографию (Fennel T.R., MacNeeCa J.P., Tunner M.J., Toxicologist, 1989, Voc. 9, p. 509).
Способ осуществляется следующим образом.
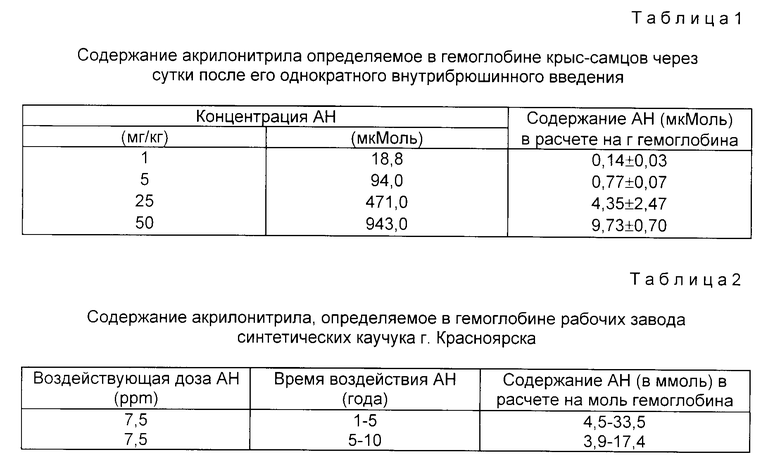
Экспериментальным животным (крысам) за 24 ч до начала определения вводится водный раствор акрилонитрила в дозе 25 мг/кг внутрибрюшинно. Животным контрольной группы вводится изотонический раствор натрия хлорида в том же объеме. Пробы крови забираются путем сердечной пункции. Глобин выделяется по методу Остермана-Голкара (см. в конце текста). Около 5 мг глобина от каждого животного растворяется в 6 М соляной кислоты до концентрации 10 мг/мл. Образцы гидролизуются в течение 18 ч при температуре 110oC в условиях вакуума. Гидролизаты выпариваются, а затем растворяются в 1 мл воды и вводятся в колонки Dowex 50 для выделения анализируемого компонента, в данном случае -S-(2-карбоксиэтил)цистеина. Дериватизация производится по общепринятой методике.
Дальнейшее измерение проводится с использованием газовой хроматографии по стандартной методике.
Однако данный метод имеет следующие недостатки:
1. Невысокая эффективность метода (часть анализируемых компонентов теряется в стадии дериватизации, так как отсутствует прямой перенос их в хроматографическую колонку).
2. Длительность периода подготовки образцов к измерению (18 ч).
3. Необходима специальная сепарационная техника для получения S-(2-карбоксиэтил)цистеина.
4. Этот метод не может быть применен при совместном воздействии акрилонитрила, акриламида и метакрилата, так как в результате гидролиза соединений, алкилированных ими, освобождается одно и то же вещество S-(2-карбоксиэтил)цистеин.
Технические и аналитические сложности препятствуют внедрению данного метода в практическую токсикологию и здравоохранение. Целью предложенного изобретения является упрощение способа. Поставленная цель достигается тем, что количественное определение акрилонитрила в его аддуктах с белками производится следующим образом: а) окисление атома серы в алкилированном цистеине до сульфоксидной формы с помощью перекиси водорода, б) освобождение акрилонитрила из сульфоксидной формы при высокой температуре (250±5oC) в инъекционной камере газового хроматографа, в) количественное определение акрилонитрила с использованием газовой хроматографии.
Сопоставительный анализ заявляемого решения с прототипом показывает, что в заявляемом способе, в отличие от известного, производится окисление атома серы в алкилированном цистеине до сульфоксидной формы с помощью перекиси водорода, что позволяет в дальнейшем отделить исходную молекулу акрилонитрила. Таким образом, заявляемый способ соответствует критериям изобретения "новизна" и "изобретательский уровень".
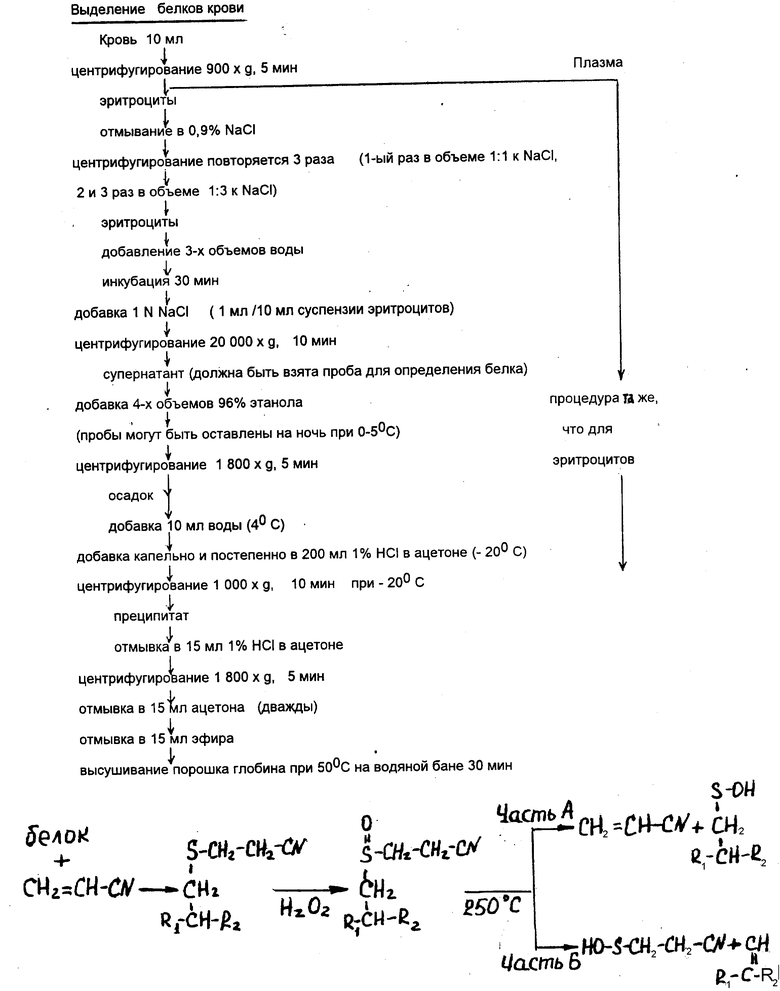
Предлагаемый способ определения акрилонитрила в его аддуктах с белками осуществляют следующим образом: в качестве экспериментальных животных использовались крысы-самцы линии Вистар с массой 470 - 530 г. Животные имели свободный доступ к воде и пище в течение всего эксперимента. Водные растворы акрилонитрила вводились внутрибрюшинно в объеме 1 мл/кг массы тела в диапазоне доз от 1 до 50 мг/кг акрилонитрила однократно. Контрольные животные получали внутрибрюшинно изотонический раствор натрия хлорида (1 мл/кг). Количество животных каждой группы равнялось 5. Под нембуталовым наркозом пробы крови были взяты путем сердечной пункции через 24 ч после инъекции акрилонитрила. Кроме того, были взяты образцы человеческой крови (10 мл) путем пунктирования вены при текущем медицинском осмотре у рабочих Красноярского завода синтетического каучука (6 мужчин и 6 женщин в возрасте 20 - 45 лет), имеющих по роду деятельности, контакт с акрилонитрилом на протяжении от 1 до 10 лет. Контрольные образцы крови были получены от 30 человек, не имеющих контакта с акрилонитрилом. Очищение глобина производилось по методу Остермана-Голкара (Osterman - GolKar S., Ehrenberg L., Segerback D., Mutal. Res., 1976, vol. 34, p. 1-10). Затем производили окисление атома серы в алкилированном глобине до образования сульфоксидной формы.
Инкубационная смесь, общим объемом 0,5 мл, включала 0,25 мл воды с растворенным в ней глобином (10 мг) и 0,25 мг 3%-ной перекиси водорода (для окисления глобина). Эта смесь инкубировалась при 30oC в течение 30 мин при постоянном встряхивании. Реакция останавливалась после разрушения перекиси водорода путем добавления каталазы (484 ЕД). Во избежание интенсивного вспенивания добавлялось 5 мкл октанола. Потом по 2 мкл полученных образцов вводились сплитметодом в инъекционную камеру газового хроматографа, где при температуре 250oC происходило освобождение исходного акрилонитрила из соединения с окисленными продуктами и следовал прямой перенос в колонку акрилонитрила в состоянии газовой фазы.
Примерная схема способа показана на чертеже, где часть А - освобождение акрилонитрила из связи с окисленным производным в свободном виде (86% от расчетного); часть Б - частичное освобождение акрилонитрила в виде HO-S-CH2-CH2-CN 3-S-гидроксимеркаптопропанонитрила.
Аналитические доказательства, базирующиеся на газовой хроматографии и масс-спектрометрии, подтверждают идентичность хроматографического пика вещества, присоединенного к белку - акрилонитрилу, определяющуюся одинаковыми времяудержанием и выходом из колонки, а также ионным спектром, совпадающим со спектром акрилонитрила. У животных контрольной группы и лиц, не подвергавшихся воздействию акрилонитрила в рабочих условиях, аддуктов акрилонитрила с гемоглобином обнаружено не было.
В эксперименте исследовались пробы крови, взятые у 25 экспериментальных животных и у 42 человек.
Использование предлагаемого способа определения акрилонитрила в его аддуктах с белками обеспечивает по сравнению с прототипом следующие преимущества:
1. Этот способ более чувствительный, чем прототип. Так, при уровне доз акрилонитрила 25 - 28 мг/кг, количество акрилонитрила, связанного с гемоглобином и измеренного как S-(2-карбоксиэтил)цистеин, составляет примерно 27% от соответствующей величины, определенной по предлагаемому нами способу (2).
2. Исключается принципиальная потеря анализируемых компонентов в стадии дериватизации, так как имеется прямой перенос акрилонитрила из окисленных аддуктов в хроматографическую колонку.
3. Период подготовки образцов значительно сокращается (30 мин вместо 18 ч).
4. Отсутствует необходимость в специальной сепарационной технике для получения S-(2-карбоксиэтил)цистеина.
5. Способ сравнительно недорогой, так как основной реагент - перекись водорода, является обычным коммерческим продуктом.
6. Появляется возможность дифференцированного определения акрилонитрила и других акриловых соединений в аддуктах с белками.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ АКРИЛАМИДА В ЕГО АДДУКТАХ С БЕЛКАМИ | 1994 |
|
RU2105305C1 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ АКРИЛОНИТРИЛА В КРОВИ МЕТОДОМ ГАЗОХРОМАТОГРАФИЧЕСКОГО АНАЛИЗА | 2011 |
|
RU2452961C1 |
| СПОСОБ ИНТЕГРАЛЬНОЙ ОЦЕНКИ СИЛЫ БЕЛОК-ЛИПИДНОГО ВЗАИМОДЕЙСТВИЯ В МЕМБРАНЕ ЭРИТРОЦИТА | 2001 |
|
RU2187112C1 |
| СПОСОБ ЛЕЧЕНИЯ СЕРОРЕЗИСТЕНТНОСТИ ПРИ СИФИЛИСЕ | 2001 |
|
RU2201752C1 |
| СПОСОБ ЛЕЧЕНИЯ ПСОРИАЗА | 2001 |
|
RU2214252C2 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ РАННИХ И ПОЗДНИХ ФОРМ НЕЙРОСИФИЛИСА | 1998 |
|
RU2141660C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ДЕФОРМИРУЕМОСТИ ЭРИТРОЦИТОВ | 2001 |
|
RU2204137C2 |
| СПОСОБ ВОССТАНОВЛЕНИЯ ФУНКЦИОНАЛЬНОГО ПОЧЕЧНОГО РЕЗЕРВА | 1993 |
|
RU2084248C1 |
| СПОСОБ ОЦЕНКИ ТЯЖЕСТИ ЭНДОТОКСИКОЗА У ОЖОГОВЫХ БОЛЬНЫХ | 1999 |
|
RU2169369C2 |
| СПОСОБ ЛЕЧЕНИЯ УРЕМИЧЕСКОГО СИНДРОМА | 2001 |
|
RU2201755C2 |
Изобретение относится к медицине, а именно к экспериментальной и практической токсикологии. Способ включает взятие крови, очищение глобина по Остерману-Голкару, подготовку образцов к количественному определению, количественное определение акрилонитрила с использованием газовой хроматографии и масс-спектрометрии. Новым в способе является то, что подготовку образцов к количественному определению осуществляют путем окисления атома серы в алкилированных белках до сульфоксидной формы с помощью перекиси водорода с последующим освобождением акрилонитрила из сульфоксидной формы при температуре 250 ± 5oC в инъекционной камере газового хроматографа. 2 ил., 2 табл.
Способ определения акрилонитрила в его аддуктах с белками крови, включающий взятие крови, выделение и очищение глобина по Остерману - Голкару, подготовку образцов к количественному определению, количественное определение акрилонитрила с использованием газовой хроматографии и масс-спектрометрии, отличающийся тем, что подготовку образцов к количественному определению осуществляют путем окисления атома серы в алкилированных белках до сульфоксидной формы перекисью водорода с последующим освобождением акрилонитрила из сульфоксидной формы при (250 ± 50)oС в инъекционной камере газового хроматографа.
| Calleman C.J | |||
| и др | |||
| J.Environ | |||
| Pathol | |||
| Toxicol | |||
| Чугунный экономайзер с вертикально-расположенными трубами с поперечными ребрами | 1911 |
|
SU1978A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Способ уравновешивания движущихся масс поршневых машин | 1925 |
|
SU427A1 |
| Fennel T.R и др | |||
| Toxicologist | |||
| Механизм для сообщения поршню рабочего цилиндра возвратно-поступательного движения | 1918 |
|
SU1989A1 |
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| Инерционно-аккумуляторное приспособление для автоматического открывания и закрывания поршневого затвора | 1912 |
|
SU509A1 |
| Ostevman - Golkar S | |||
| et al Mutal | |||
| Res | |||
| Планшайба для точной расточки лекал и выработок | 1922 |
|
SU1976A1 |
| Нивелир для отсчетов без перемещения наблюдателя при нивелировании из средины | 1921 |
|
SU34A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
1998-05-10—Публикация
1992-11-04—Подача