Изобретение относится к области фармацевтической технологии и касается получения лиофилизированной лекарственной формы нового противоопухолевого препарата нитруллина, производного нитрозоалкилмочевин, относящегося к классу алкилирующих соединений.
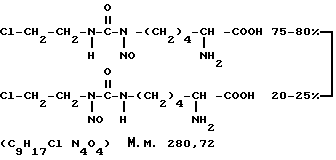
Нитруллин-димер Nω -(2-хлорэтил)- Nω,ε -нитрозо-L-гомоцитруллина стандартного состава.
 .
.
В качестве прототипа нами выбран способ получения Nω (2-хлорэтил)- Nε -нитрозо-L-гомоцитруллина, согласно которому с целью повышения растворимости, его обрабатывают охлажденным до 0 - 15oС 2 - 10%-ным водным раствором декстрана или поливинилпирролидона, предварительно подкисленных до величины pH 3,5 - 5,5, при соотношении Nω (2-хлорэтил)- Nε -нитрозо-L-гомоцитруллин: раствор декстрана или поливинилпирролидона 1:10-50, далее стерильно фильтруют и лиофилизируют (SU N 1410314, 03.07.85).
Недостатками способа является следующее.
Недостаточная растворимость и малая скорость растворения, как Nω -(2-хлорэтил)- Nε -нитрозо-L-гомоцитруллина, так и Nω -(2-хлорэтил) Nω,ε -нитрозо-L-гомоцитруллина в воде, приводящие к затруднениям в технологии и ее неэкономичности.
Недостаточная растворимость субстанции в воде приводит:
к увеличению объемов лиофилизируемых концентратов на единицу дозы препарата в 2 раза, что влечет за собой увеличение обычного времени лиофилизации в 3 - 4 раза (т.е. вместо 18 - 24 ч до 48 - 72 ч), а это приводит к удорожанию производство не менее чем в 3 раза;
к необходимости использования для ускорения процесса лиофилизации флаконов большей вместимости (50 - 100 мл вместо 20 мл), что из-за уменьшения загрузки сублимационных камер лиофилизационных установок (в 3 - 4 раза) и ограниченности производственных мощностей снижает как минимум в 3 раза эффективность производства.
Малая скорость растворения Nω (2-хлорэтил)- Nε -нитрозо-L-гомоцитруллина и особенно Nω -(2-хлорэтил)- Nω,ε -нитрозо-L-гомоцитруллина при приготовлении 2% растворов, удлиняет процесс растворения до 1,2 ч, что, безусловно, приводит к большей дезактивации неустойчивого вещества, чем при более быстром его растворении.
Кроме того, для приготовления 2% растворов Nω -(2-хлорэтил)- Nε -нитрозо-L-гомоцитруллина или Nω -(2-хлорэтил)- Nω,ε -нитрозо-L-гомоцитруллина необходимо брать такое избыточное количество субстанции, которое эквивалентно приготовлению почти 3 % растворов этого вещества (т.е. в 1,4 - 1,5 раза больше расчетного, чем это требуется при обычной технологии).
Содержащиеся же в лекарственных формах (для внутривенных инъекций прототипа) лимонная или соляная кислота могут усиливать геморрагический синдром у больных с тромбицитопенией - наиболее распространенном побочном эффекте при химиотерапии алкилирующими соединениями.
Перечисленные выше недостатки прототипа не только свидетельствуют о невысокой технологичности способа получения препарата прототипа, его неэкономичности, но и о неучете биофармацевтического аспекта при создании лекарственной формы.
В связи с вышеизложенным для обеспечения высокотехнологичного способа получения, повышения экономичности производства, а также с целью создания рациональной лекарственной формы противоопухолевого препарата, нами предложен способ получения Nω (2-хлорэтил)- Nε -нитрозо-L-гомоцитруллина или Nω -(2-хлорэтил)- Nω,ε -нитрозо-L-гомоцитруллина для инъекций путем растворения субстанции, стерильной фильтрации и лиофилизации, отличающийся тем, что с целью повышения растворимости, улучшения технологии, субстанцию Nω -(2-хлорэтил)- Nε -нитрозо-L-гомоцитруллина или Nω -(2-хлорэтил)- Nω,ε -нитрозо-L-гомоцитуллина растворяют в соотношении 1:25 в охлажденном до 2 - 5oC растворителе, состоящем из 15,0 - 25,0 г мочевины и вспомогательных ингредиентов 4,0 - 6,0 г поливинилпирролидона М.м. 12000 - 35000 или декстрана М.м. 40000 - 60000, 0,8 - 0,9 г кислоты глютаминовой, 5,0 - 6,0 г маннита и 88 - 92 г воды для инъекций.
Лиофилизированный препарат, полученный указанным способом, практически мгновенно растворяется при добавлении воды и используется для внутривенных инъекций.
Вспомогательные вещества: мочевина, поливинилпирролидон или декстран, маннит, кислота глютаминовая, используемые при приготовлении препарата для инъекций, должны соответствовать требованиям Государственной фармакопеи, фармакологическим статьям и соответствующим ГОСТам на препараты, предназначенные для медицинского использования.
Примеры способов получения Nω -(2-хлорэтил)- Nε -нитрозо- L-гомоцитруллина или Nω -(2-хлорэтил)- Nω,ε -нитрозо-L-гомоцитруллина для инъекций.
Пример 1. 4,0 г субстанции Nω -(2-хлорэтил)- Nε -нитрозо-L-гомоцитруллина или Nω -(2-хлорэтил)- Nω,ε -нитрозо-L- гомоцитруллина растворяют в растворителе в соотношении 1:25, приготовленном из: 20,0 - 22,0 г мочевины 4,0 г поливинилпирролидона М.м. 12000 - 35000, 0,8 - 0,9 г кислоты глютаминовой и 90 - 92 г воды для инъекций; раствор подвергают стерильной фильтрации, дозированию по 2,5 мл во флаконы вместимостью 20 мл и лиофилизации.
Пример 2. 4,0 г субстанции Nω -(2-хлорэтил)- Nε -нитрозо- L-гомоцитруллина или Nω -(2-хлорэтил)- Nω,ε -нитрозо-L- гомоцитруллина растворяют в растворителе в соотношении 1:25, приготовленном из: 20,0 - 22,0 г мочевины, 4,0 г декстрана М.м. 40000 - 60000, 0,8 - 0,9 г кислоты глютаминовой и 90 - 92 г воды для инъекций; раствор подвергают стерильной фильтрации, дозированию по 2,5 мл во флаконы вместимостью 20 мл и лиофилизации.
Пример 3. 3,5 г субстанции Nω -(2-хлорэтил)- Nω,ε -нитрозо-L- гомоцитруллина растворяют в растворителе в соотношении 1:25, приготовленном из: 15,0 - 17,0 г мочевины, 6,0 г маннита, 4,0 г декстрана М.м. 40000 - 60000, 0,8 г кислоты глютаминовой и 88 - 90 г воды для инъекций: раствор подвергают стерильной фильтрации, дозированию по 2,5 мл во флаконы вместимостью 20 мл и лиофилизации.
Пример 4. 3,5 г субстанции Nω -(2-хлорэтил)- Nω,ε -нитрозо-L- гомоцитруллина растворяют в растворителе в соотношении 1:25, приготовленном из: 15,0 - 17,0 г мочевины, 5,0 г маннита, 4,0 г поливинилпирролидона М.м. 12000 - 35000, 0,8 г кислоты глютаминовой и 88 - 90 г воды для инъекций; раствор подвергают очистке от механических включений, стерильной фильтрации, дозированию по 2,5 мл во флаконы вместимостью 20 мл и лиофилизации.
Пример 5. 4,5 г субстанции Nω -(2-хлорэтил)- Nω,ε -нитрозо- L-гомоцитруллина растворяют в растворителе в соотношении 1:25, приготовленном из: 23,0 - 24,0 г мочевины, 4,0 - 6,0 г декстрана М.м. 40000 - 60000, 0,8 г кислоты глютаминовой и 89-90 г воды для инъекций; раствор подвергают стерильной фильтрации, дозированию по 2,2-2,5 мл во флаконы вместимостью 20 мл и лиофилизации.
Пример 6. 4,5 г субстанции Nω -(2-хлорэтил)- Nε -нитрозо-L- гомоцитруллина или Nω -(2-хлорэтил)- Nω,ε -нитрозо-L-гомоцитруллина растворяют в растворителе в соотношении 1:25, приготовленном из: 24,0 - 25,0 г мочевины, 4,0 - 6,0 г поливинилпирролидона М.м. 12000 - 35000, 0,8 г кислоты глютаминовой и 89 - 90 г воды для инъекций: раствор подвергают стерильной фильтрации, дозированию по 2,2 - 2,5 мл во флаконы вместимостью 20 мл и лиофилизации.
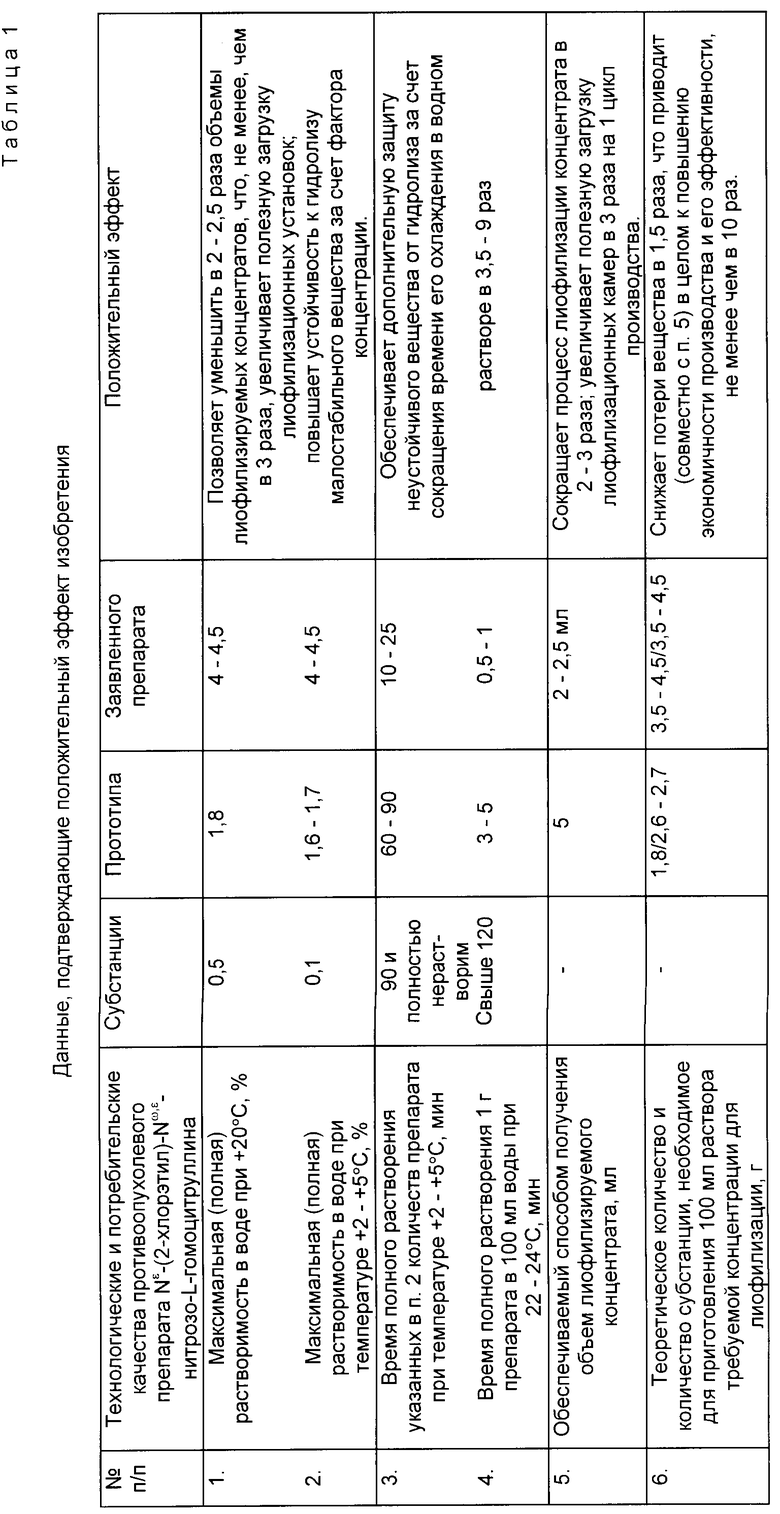
Предлагаемый способ получения Nω -(2-хлорэтил)- Nω,ε -нитрозо- L-гомоцитруллина [субстанция 1] или Nω -(2-хлорэтил)- Nε -нитрозо- L-гомоцитруллина [субстанция 2] для инъекций позволит решить множество задач, сказавшихся отрицательным образом на технологичности и экономичности производства по способу-прототипу (табл. 1).
Предлагаемый способ обеспечивает повышение растворимости субстанции 1 и 2 как минимум в 2 - 2,5 раза по сравнению с прототипом (а по сравнению с обычным способом в 4 - 8 раз), что позволяет готовить более концентрированные растворы (4 - 4,5% концентрации), а это в свою очередь позволяет:
снизить в 2 - 2,5 раза объемы лиофилизируемых концентратов и сократить время лиофилизации в 2 - 3 раза по сравнению с прототипом, т.е. привести к обычной затрате времени на этот процесс, что не менее чем в 3 раза удешевит производство;
использовать флаконы вместимостью 20 мл (вместо 50 - 100 мл), что дополнительно только за счет большей загрузки лиофилизационной камеры повысит эффективность производства не менее чем в 3 раза.
Кроме того, сокращение времени растворимости препарата в 5 - 6 раз по сравнению с прототипом снижает возможность дезактивации препарата в водных растворах.
Для приготовления 4 - 4,5%-ных растворов препарата по предлагаемому способу не следует брать избыточное количество субстанции. Субстанция берется в количестве, соответствующем содержанию в ней основного вещества.
Все это в общей сложности должно на порядок повысить экономичность производства и его эффективность.
Наконец, из состава ингредиентов, использующихся для приготовления лекарственной формы препарата, исключены лимонная и соляная кислота, которые отрицательным образом влияют на свертывающую систему крови при геморрагическом синдроме - обычном побочном эффекте от алкилирующих препаратов.
Для определения возможного влияния технологического процесса получения лекарственной формы из Nω -(2-хлорэтил)- Nω,ε -нитрозо- L-гомоцитруллина [субстанции 1] составов, описанных в примерах 1 и 2, на соотношение изомеров исходной субстанции, был проведен анализ ее изомерного состава в готовой лекарственной форме с использованием метода жидкостной хроматографии высокого разрешения.
Анализ показал, что предлагаемый способ получения препарата не меняет соотношение изомеров в димере [субстанция 1] и соответствует соотношению мономеров в исходной субстанции (фиг. 1).
Предлагаемый способ обеспечивает получение стабильной лекарственной формы.
Изучение стабильности 4 и 0,5%-ного водного раствора Nω -(2- хлорэтил)- Nω,ε -нитрозо-L-гомоцитруллина для внутривенных инъекций, приготовленного по предлагаемому нами способу, показало, что препарат в виде 4%-ного раствора стабилен при температуре 5 - 10oC в течение 5 ч с момента его приготовления, что гарантирует достаточный запас времени для производства лиофилизированной лекарственной формы; в 0,5%-ном растворе, предназначенном для внутривенного введения, содержание препарата практически не уменьшается в течение 1 - 3 ч экспозиции при указанной температуре (табл. 2), что создает большое удобство пользования препаратом в клинических условиях.
Определены сроки годности нескольких серий готовых лиофилизированных лекарственных форм, полученных по предлагаемому нами способу.
Результаты спектрофотометрического метода определения содержания основного вещества в лекарственной форме представлены в табл. 3.
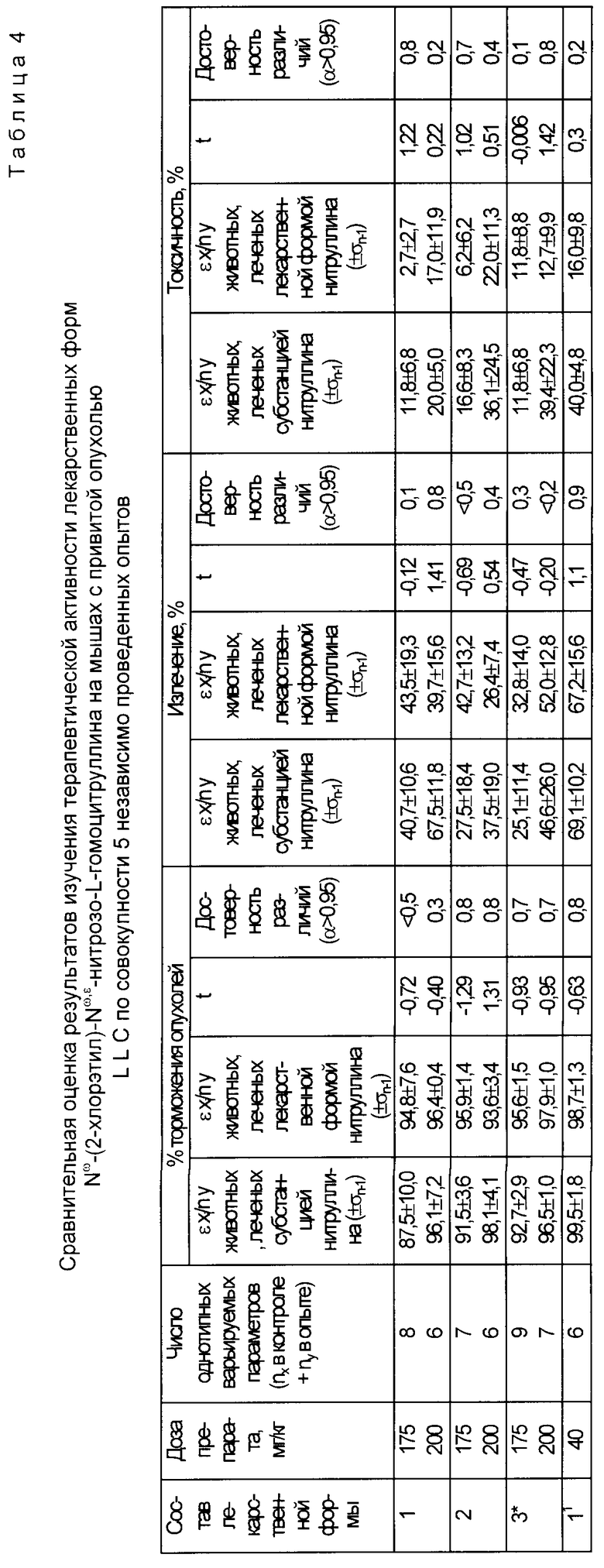
Биологические исследования, проведенные с лекарственными формами Nω -(2-хлорэтил)- Nω,ε -нитрозо-L-гомоцитруллина и Nω -(2-хлорэтил)- Nε -нитрозо-L-гомоцитруллина, приготовленных по предложенному нами способу (табл. 4), подтвердили, как терапевтическую их равноэффективность с исходной субстанцией и с прототипом (состав 3*), так и показали высокую эффективность субстанции 2 в чистом виде и в лекарственной форме.
Пояснения к табл. 4. Составы, обозначенные NN 1 и 2 соответствуют примеру 1 и 2 предлагаемого нами способа получения с использованием субстанции 1 ( Nω -(2-хлорэтил)- Nω,ε -нитрозо-L- гомоцитруллина);
состав, обозначенный как 11, соответствует примеру 1 предлагаемого нами изобретения с использованием субстанции 2 ( Nω -(2-хлорэтил)- Nε нитрозо-L-гомоцитруллина);
состав, обозначенный 3*, приготовлен по способу-прототипу с использованием субстанции 1 и вспомогательных ингредиентов: декстрана М.м. 60000 и лимонной кислоты.
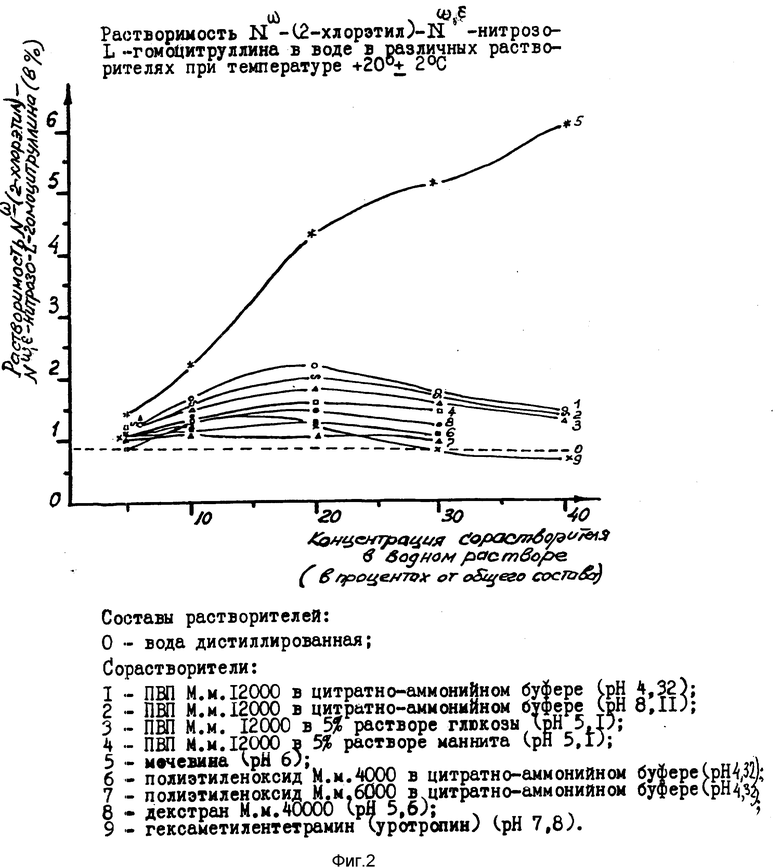
Исследование растворимости субстанции 1 ( Nω -(2-хлорэтил)- Nω,ε -нитрозо-L-гомоцитруллина) и субстанции 2 ( Nω -(2-хлорэтил)- Nε - нитрозо-L-гомоцитруллина) в растворителях с различным составом вспомогательных ингредиентов показало, что ни один из ингредиентов, использованных в прототипе и в наших экспериментах в качестве солюбилизатора, ни в отдельности, ни в смеси с другими веществами, не способен повысить растворимость субстанции 1 и 2 свыше 2% (фиг. 2).
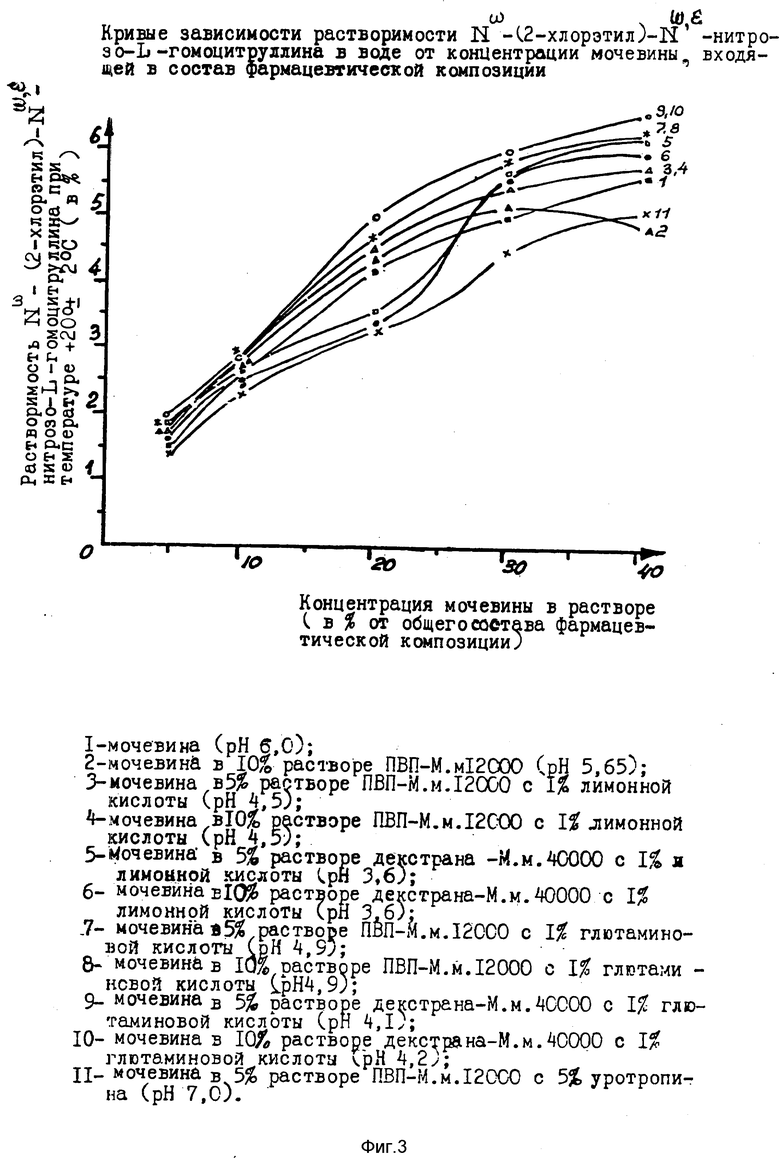
Только использование мочевины как в отдельности, так и в смеси с другими ингредиентами дает в 2 - 2,5 раза большей солюбилизурующий эффект.
На фоне сильного солюбилизирующего эффекта мочевины действия остальных ингредиентов являются лишь дополнительными и корректирующими по отношению к основному веществу, что наглядно показано графически на фиг. 3.
| название | год | авторы | номер документа |
|---|---|---|---|
| N-НИТРОЗО-N-[(2-ХЛОРЭТИЛ)КАРБАМОИЛ]-L-ОРНИТИН | 2012 |
|
RU2503657C1 |
| ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО | 1988 |
|
SU1834006A1 |
| СПОСОБ ПОЛУЧЕНИЯ ИНДИВИДУАЛЬНЫХ N-НИТРОЗО- N-[(2-ХЛОРЭТИЛ)КАРБАМОИЛ]-L-ЛИЗИНА И N-[(2-ХЛОРЭТИЛ)-N-НИТРОЗОКАРБАМОИЛ]-L-ЛИЗИНА | 2008 |
|
RU2408576C2 |
| ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО | 1996 |
|
RU2093158C1 |
| СПОСОБ ПОЛУЧЕНИЯ N-НИТРОЗО-N-[(2-ХЛОРЭТИЛ)КАРБАМОИЛ]-L-ОРНИТИНА | 2015 |
|
RU2601753C1 |
| ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО | 1998 |
|
RU2128042C1 |
| 3-OR-ДИ-(2-ХЛОРЭТИЛ)АМИНОСОДЕРЖАЩИЕ αАЦИЛ(ГИДР)ОКСИСТЕРОИДЫ, ОБЛАДАЮЩИЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 1998 |
|
RU2139292C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПЛЕКСА 1-(2'-ГИДРОКСИЭТИЛ)-2-МЕТИЛ-5-НИТРОИМИДАЗОЛА С ПОЛИВИНИЛПИРРОЛИДОНОМ | 2001 |
|
RU2205841C2 |
| КОМПЛЕКС 1-(2-ГИДРОКСИЭТИЛ)-2-МЕТИЛ-5-НИТРОИМИДАЗОЛА С ПОЛИВИНИЛПИРРОЛИДОНОМ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ АНТИМИКРОБНЫМ ДЕЙСТВИЕМ | 1998 |
|
RU2157384C2 |
| ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО | 2014 |
|
RU2569729C1 |
Изобретение относится к фармацевтической технологии и касается получения лиофилизированной лекарственной формы нового противоопухолевого препарата нитруллина, производного нитрозоалкилмочевин, относящегося к классу алкилирующих соединений. Изобретение заключается в том, что субстанцию Nω(2-хлорэтил)-Nε-нитрозо-L-гомоцитруллина или Nω(2-хлорэтил)-Nω,ε-нитрозо-L-гомоцитруллина растворяют в соотношении 1 : 25 в охлажденном до 2 - 5oC растворителе, состоящем из 15 - 25 г мочевины и вспомогательных ингредиентов 4 - 6 г поливинилпиролидона М.м. 12000 - 35000 или декстрана М.м. 40000 - 60000, 0,8 - 0,9 г кислоты глютаминовой, 5 - 6 маннита и 88 - 92 г воды для инъекций. Изобретение устраняет побочный эффект при химиотерапии. 3 ил., 4 табл.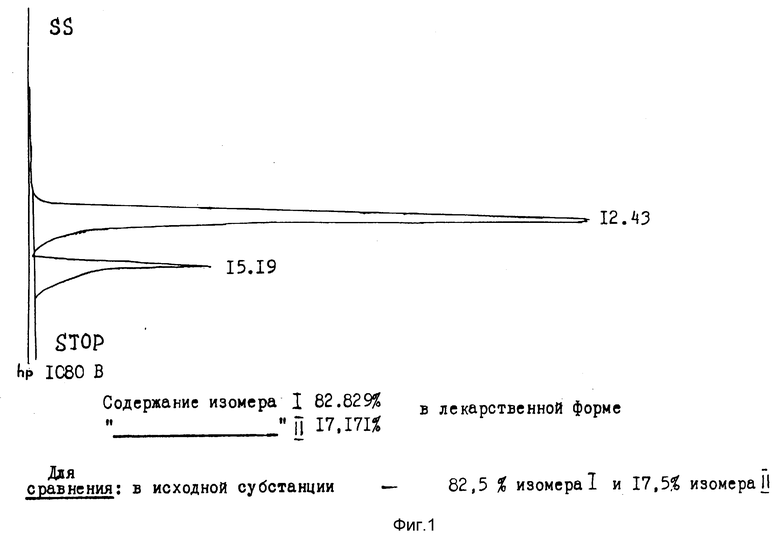
Способ получения Nω-(2-хлорэтил)-Nε-нитрозо -l-гомоцитруллина или -Nω- (2-хлорэтил)Nω,ε-нитрозо-l-гомоцитруллина для инъекций путем растворения субстанции, стерильной фильтрации и лиофилизации, отличающийся тем, что субстанцию Nω-(2-хлорэтил)Nε- нитрозо-l-гомоцитруллина или Nω-(2-хлорэтил)-Nω,ε-нитрозо-l-гомоцитруллина растворяют в соотношении 1 : 25 в охлажденном до 2 - 5oC растворителе, состоящем из 15 - 25 г мочевины и вспомогательных ингредиентов - 4 - 6 г поливинилпирролидона мол. м. 12000 - 35000 или декстрана мол. м. 40000 - 60000, 0,8 - 0,9 г кислоты глютаминовой, 5 - 6 г маннита и 88 - 92 г воды для инъекций.
| Химико-фармацевтический | |||
| - М.: Медицина, 1984, т.18, N 3, с | |||
| Прибор для исправления снимков рельефа местности | 1921 |
|
SU301A1 |
| Способ получения раствора окситетрациклина для инъекций | 1980 |
|
SU1186074A3 |
| US), 15.10.85, A 61 K 9/08 | |||
| Способ получения цисплатины | 1983 |
|
SU1424722A3 |
| RU 94020614 А (ОНЦ РАМН), 27.08.96, A 61 K 9/08 | |||
| US 3950538 А (Chemical Company Midland, Miok), 13.04.76, A 61 31/17 | |||
| US 3968249 А (ER Sguibb Sons Inc.), 06.06.76, A 61 K 31/17 | |||
| US 4148921 А (Tetsuo Soam Tokyo, Japan), 10.04.79, A 61 K 31/17. | |||
Авторы
Даты
1998-05-27—Публикация
1995-06-28—Подача