Настоящее изобретение относится к новым производным метилпиперазиназепина и к их нетоксичным солям, а также к способу получения этих соединений и их применению в терапии.
Новые метилпиперазиназепины изобретения соответствуют общей формуле (I):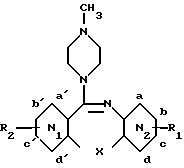 ,
,
в которой
X является атомом кислорода, серы или селена, или группой HN или NR3, где R3 является группой 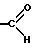 ,
, 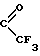 ,
,
или алкилом с 1-4 атомами углерода, разветвленным или нет;
R1 является атомом водорода, атомом галоида или алкилом с 1-4 атомами углерода, разветвленным или нет;
R2 является атомом водорода, атомом галоида или алкилом с 1-4 атомами углерода, разветвленным или нет; и
N1 является бензольным ядром и N2 является пиридиновым ядром или наоборот при условии, если R1 и R2 являются водородом и X является серой, кислородом или группой NH, а N1 является пиридиновым циклом, а N2-бензольным ядром, причем пиридиновый азот не может находиться в положении d', и N1 и N2, кроме того, могут быть оба бензольным ядром, если X является атомом селена.
Некоторые представители производных метилпиперазиназепина этого типа описаны в литературе. В этом отношении можно, в частности, упомянуть статьи Дюпона с сотр., Acta cryst., с. 43, 716-718, 1987, где описаны кислородсодержащие производные, Хоффманна с сотр. патент США N 4163785 (1979), где описаны серосодержащие производные и Чакрабарти с сотр. Journal of Medicinal Chemistry, т. 32, N 10, 2375-2381, 1989, описывающие азотсодержащие производные. Однако, в отличие от производных настоящего изобретения, ни одно из производных метилпиперазиназепина этого типа, описанных до настоящего времени в литературе, не обладало интересной фармакологической активностью.
Как уже говорилось ранее, производные метилпиперазиназепина настоящего изобретения соответствуют общей формуле (I). В приведенной выше общей формуле под алкилом с 1-4 атомами углерода, разветвленным или нет, понимают метил, этил, н-пропил, изопропил, н-бутил, изобутил и трет. бутил. Термин "галоид" охватывает хлор, фтор, иод и бром.
Предпочтительными классами соединений формулы (I) являются, например, те, в которых R1 является атомом водорода, атомом хлора, атомом фтора и метилом, и те, в которых R2 является атомом водорода или атомом хлора. Особенно предпочтительным классом этих соединений являются те, у которых R1 является водородом, хлором, фтором или метилом и одновременно R2 является водородом или хлором.
Производными формулы (I), которые могут находиться в форме нетоксичных солей, являются, в частности, соли неорганических кислот, такие как хлоргидраты, бромгидраты, фосфаты, сульфаты, или органических кислот, такие как ацетаты, цитраты, малеаты, фумараты и метансульфонаты.
Примерами производных согласно изобретению являются: 11-/4-метилпиперазин-1-ил/-5H-пиридо/4,3-b-/бензо-1,5-диазепин, 6-/4-метилпиперазин-1-ил/пиридо/2,3-b-/бензо-1,4-тиазепин, фумарат 8-хлор-6-/4-метилпиперазин-1-ил/пиридо/2,3-b-/бензо-1,4-тиазепина,
малеат 5-/4-метилпиперазин-1-ил/пиридо/2,3-b/бензо-1,5- оксазепина, фумарат 8-хлор-5-/4-метилпиперазин-1-ил/пиридо/2,3-b/ бензо-1,5-оксазепина,
фумарат 5-/4-метилпиперазин-1-ил/-8-метилпиридо/2,3-b/бензо-1,5- оксазепина,
фумарат 6-/4-метилпиперазин-1-ил/пиридо/2,3-b/бензо-1,4-оксазепина,
фумарат 8-хлор-6-/4-метилпиперазин-1-ил/пиридо/2,3-b/бензо-1,4-оксазепина,
6-/4-метилпиперазин-1-ил-11H-пиридо/2,3-b/бензо-1,4- диазепин,
8-хлор-6-(4-метилпиперазин-1-ил)-11H-пиридо/2,3-b/бензо-1,4- диазепин,
6-/4-метилпиперазин-1-ил/-8-метил-11H-пиридо/2,3-b/бензо-1,4- диазепин,
9-хлор-6-/4-метилпиперазин-1-ил/-11H-пиридо/2,3-b/бензо-1,4- диазепин,
8-фтор-6-/4-метилпиперазин-1-ил/-11H-пиридо/2,3-b/бензо-1,4- диазепин,
5-формил-11-/4-метилпиперазин-1-ил/-5H-пиридо/4,3-b/бензо-1,5- диазепин,
11-формил-5-/4-метилпиперазин-1-ил/-11H-пиридо/2,3-b/бензо-1,5- диазепин,
11-трифторметилкарбонил-5-/4-метилпиперазин-1-ил/-11H-пиридо- /2,3-b/бензо-1,5-диазепин,
11-формил-6-/4-метилпиперазин-1-ил/-11H-пиридо-/2,3-b/бензо-1,4- диазепин,
10-/4-метилпиперазин-1-ил/пиридо/4,3-b/бензо-1,4-тиазепин,
5-/4-метилпиперазин-1-ил/дибензо(b,f)-1,4-селеназепин,
6-/4-метилпиперазин-1-ил/дипиридо/2,3-b;3',2'-f(1,4-тиазепин),
6-/4-метилпиперазин-1-ил/-11-метил-11H-пиридо/2,3-b/бензо-1,4-диазепин.
Новые соединения согласно изобретению могут быть получены в соответствии с общим способом, являющимся объектом настоящего изобретения, из известного или легко синтезированного азепинона формулы (II) ,
,
в которой
X, R1 и R2 имеют указанные ранее значения, а N1 и N2 каждый является бензольным или пиридиновым ядром.
В этом отношении ниже приведены некоторые азепиноны, уже описанные в литературе:
5,11-дигидро-6H-пиридо/2,3-b/бензо/1,4-диазепин-6-он,
6,11-дигидро-5H-пиридо/2,3-b/бензо-1,5-диазепин-5-он,
5,10-дигидро-1H-пиридо/4,3-b/бензо-1,5-диазепин-11-он,
5,11-дигидро-11-метил-6H-пиридо/2,3-b/бензо-1,4-диазепин-6-он,
5H,6H-пиридо/2,3-b/бензо-1,5-оксазепин-5-он,
5H,6H-пиридо/2,3-b/бензо-1,4-оксазепин-6-он,
5,11-дигидро-8-метил-6H-пиридо/2,3-b/бензо-1,4-диазепин-6-он,
9-хлор-5,11-дигидро-6H-пиридо/2,3-b/бензо-1,4-диазепин-6-он, 10H,11H-дибензо/b,f/1,4-селеназепин-11-он.
Последний азепинон, а именно 10H, 11H-дибензо/b,f/1,4-селеназепин-11-он также может быть получен из 2,2'-дибромбензанилида. Для этого в колбу загружают, например, 150 мл диметилформамида, 0,015 моль селена, 0,050 моль натрия. Смесь нагревают до 100oC при перемешивании в течение 4 ч. Когда все растворится, прибавляют 0,025 моль 2,2'-дибромбензанилида и оставляют при перемешивании в течение 20 ч при 100-110oC.
Раствор выливают в смесь соляной кислоты и льда. Отфильтровывают осадок. Полученный продукт обрабатывают кипящим спиртом и фильтруют. Производное перекристаллизовывают из смеси диметилформамида и воды. Точка плавления 275oC.
Ниже приводятся синтезы некоторых оригинальных азепинонов, еще не описанных в литературе.
Приготовление 1.
8-хлор-5H, 6H-пиридо/2,3-b/бензо-1,5-оксазепин-5-он (формула II: X = O, R1 = Cl в положении b, R2 = H, N1 = пиридин с N в положении d', N2 = бензол).
Раствор 0,1 моль хлорангидрида 2-хлорпиридин-3-карбоновой кислоты выливают понемногу в раствор 0,2 моль 2-амино-4-хлорфенола в 150 мл тетрагидрофурана. Оставляют при перемешивании и кипячении с обратным холодильником на 1 ч. Разбавляют 1 л воды. Собирают образовавшийся осадок, промывают и сушат. Сырой продукт используют как таковой для дальнейшей работы. Оксазепин получают обработкой амида теоретическим количеством этилата натрия в абсолютном спирте. При выпаривании растворителя выделяется натриевая соль. При кипячении последней с обратным холодильником в течение 3-4 ч в диметилформамиде получают желаемую циклизацию. Концентрируют смесь отгонкой ДМФ в вакууме и оставляют кристаллизоваться при 0oC. Выделенный продукт промывают холодным метанолом и кристаллизуют из смеси ДМФ/метанол. Точка плавления 300oC.
Приготовление 2.
5H, 6H-метилпиридо/2,3-b/бензо-1,5-оксазепин-5-он (формула II: X = O, R1 = CH3 в положении b, R2 = H, N1 = пиридин с N в положении d', N2 = бензол).
Это вещество получают по методике приготовления I, но используя в качестве исходных веществ 2-хлорпиридин-3-карбоновую кислоту и 2-амино-4-метилфенол. Точка плавления 203oC.
Приготовление 3.
8-хлор-5H, 6H-пиридо/2,3-b/бензо-1,4-оксазепин-6-он (формула II: X = O, R1 = H, R2 = Cl в положении b', N1 = бензол, N2 = пиридин с N в положении d).
Готовят сложный фенольный эфир 5-хлорсалициловой кислоты, нагревая при кипячении с обратным холодильником 0,1 моль фенола и 0,1 моль 5-хлорсалициловой кислоты в присутствии избытка OPCl3 в течение 2 ч. Реактив отгоняют в вакууме. Полученную пастообразную массу постепенно обрабатывают водой. Образовавшийся осадок отфильтровывают и промывают водой. Точка плавления 89oC.
Нагревая в расплаве до прекращения реакции 0,05 моль полученного выше сложного эфира с 0,1 моль 3-амино-2-хлорпиридина, получают целевое соединение. Массу поглощают 30 мл этанола и тщательно растирают до получения фильтрующегося осадка. После отделения продукт промывают этанолом и перекристаллизовывают из диоксана или из смеси ДМФ/метанол. Точка плавления 280oC.
Приготовление 4.
5H,6H-пиридо/2,3-b/бензо-1,4-тиазепин-6-он (формула II: X = S, R1 = R2 = H, N1 = бензол, N2 = пиридин с N в положении d).
Способ 1.
a) Получение 2-/фенилтио/пиридин-3-карбоновой кислоты.
Диспергируют 0,2 моль тиофенола и 0,2 моль гидрида натрия (50%-ного) в 50 мл пропиленгликоля. К этой смеси прибавляют 0,1 моль 2-хлорпиридинкарбоновой кислоты и нагревают до кипения. По окончании реакции выпаривают растворитель. Остаток поглощают водой и устанавливают pH 7. Экстрагируют избыток тиофенола хлороформом. Водную фазу очищают активированным углем и подкисляют. Продукт осаждается в виде белого порошка. Точка плавления 164oC.
b) Полученное выше соединение превращают в азид при взаимодействии полученного выше хлорангидрида кислоты. Хлорангидрид кислоты выливают в избыток охлажденного раствора азида натрия. По окончании прибавления продолжают перемешивание в течение 1/4 ч и разбавляют водой. Продукт выделяют и используют после сушки как таковой в последующей реакции. Циклизацию соединения проводят по следующей методике. Прибавляют понемногу 1 г сырого азида к раствору AlCl3 в орто-дихлорбензоле при 120oC и при перемешивании. Выдерживают температуру в течение 0,5 ч. Затем смесь поглощают хлороформом и экстрагируют 0,1H соляной кислотой. Кислую фазу повторно экстрагируют несколько раз хлороформом. Объединяют хлороформные фазы, сушат и концентрируют в вакууме. Остаток обрабатывают ацетоном и оставляют на 2 ч на холоде. Осадок собирают фильтрованием. Точка плавления 206-208oC.
Способ 2.
Нагревают в расплаве 0,01 моль 3-амино-2-хлорпиридина до прекращения реакции с 0,01 моль 2-тиосалициловой кислоты. После охлаждения осадок поглощают 30 мл этанола. Кипятят несколько минут, потом дают остыть. Отфильтровывают осадок, промывают этанолом и сушат. Точка плавления 205-208oC.
Приготовление 5.
5H,6H-пиридо/4,3-b/бензо-1,4-тиазепин-6-он (формула II: X = S, R1 = R2 = H, N1 = бензол, N2 = пиридин с N в положении b).
Нагревают при кипячении с обратным холодильником в течение нескольких часов 0,01 моль тиосалициловой кислоты и 0,01 моль 3-амино-4-хлорпиридина в присутствии орто-дихлорбензола. По окончании реакции удаляют растворитель. Остаток поглощают небольшим количеством воды и устанавливают pH 5-6. Соединение экстрагируют хлороформом. Выпаривают хлороформные экстракты. Остаток поглощают бикарбонатной водой и перемешивают 0,5 ч. Отфильтровывают суспензию соединения и промывают водой. Точка плавления 244oC.
Приготовление 6.
8-хлор-5H,6H-пиридо/2,3-b/бензо-1,4-тиазепин-6-он (формула II: X = S, R1 = H, R2 = Cl в положении b', N1 = бензол, N2 = пиридин с азотом в положении d).
Соединение получают по методике, описанной в приготовлении 4, способ 1. Точка плавления 314oC.
Приготовление 7.
5H, 6H-дигидро/2,3-b: 3',2'-f/1,4-тиазепин-5-он (формула II: X = S, R1 = R2 = H, N1 = N2 = пиридин с N в положении d и d'/.
Получают хлорангидрид кислоты из 1,575 г 2-хлорпиридин-3-карбоновой кислоты при взаимодействии с тионилхлоридом. После выпаривания избытка реагента остаток обрабатывают 200 мл диоксана и понемногу выливают в раствор 3,12 г 3-амино-2-меркаптопиридина в 50 мл диоксана при хорошем перемешивании. Продолжают перемешивание 1/4 ч, потом разбавляют в 5 раз водой. Все переходит в раствор и среда является слабокислой, в некоторых случаях удаляют осадок. Устанавливают pH 7 бикарбонатом и дают кристаллизоваться. Полученный продукт сушат в сушильном шкафу и перекристаллизовывают из толуола при необходимости. Точка плавления 183oC.
Прибавляют 0,01 моль амидного производного к суспензии 0,012 моль трет. бутилата натрия в 50 мл ДМФ. Кипятят с обратным холодильником в течение 10-20 ч, выпаривают ДМФ в вакууме и поглощают остаток 50 мл воды. Отфильтровывают осадок, промывают водой и сушат. После сушки его обрабатывают эфиром и тщательно растирают. После фильтрации и сушки продукт при необходимости может быть перекристаллизован из ДМФ. Точка плавления 305oC.
Приготовление 8.
8-хлор-5H, 6H-пиридо/2,3-b/бензо-1,4-тиазепин-6-он (формула II: X = NH, R1 = Cl в положении b', R2 = H, N1 = бензол, N2 = пиридин с N в положении d).
1) Обрабатывают 0,01 моль 5-хлор-2-нитробензойной кислоты 20 мл OCl2 и несколькими каплями ДМФ при кипячении с обратным холодильником в течение 1 ч. Отгоняют избыток OCl2, остаток поглощают 20 мл диоксана. Этот раствор понемногу прибавляют к раствору 0,015 моль 3-амино-2-хлорпиридина в 20 мл диоксана. После часа перемешивания смесь разбавляют пятикратным объемом воды. Отфильтровывают осадок, промывают холодной водой. При необходимости продукт перекристаллизовывают из изопропанола. Точка плавления 190oC.
2) Растворяют 0,01 моль нитропроизводного в 25 мл концентрированной HCl. К этому раствору прибавляют понемногу 11 г SrCl2 • 2H2O, растворенного в 20 мл концентрированной HCl. Затем раствор выдерживают в течение часа на водяной бане. После охлаждения осадок отфильтровывают, поглощают 10%-ным NaOH и экстрагируют хлороформом. Хлороформную фазу сушат и концентрируют до малого объема в присутствии петролейного эфира 100-140. Кристаллический продукт фильтруют и промывают петролейным эфиром 40-60. Точка плавления 173oC.
3) Растворяют 0,01 моль аминопроизводного, полученного в 2), в 18 мл монометилового эфира диэтиленгликоля. Прибавляют 0,2 мл 5%-ной HCl. Смесь нагревают до 130oC при перемешивании. После 2-3 ч нагревания получают суспензию. По окончании реакции смесь охлаждают и фильтруют. Выделенный продукт промывают холодным метанолом и перекристаллизовывают из диоксана при необходимости. Точка плавления 296oC.
Приготовление 9.
5,11-дигидро-8-фтор-6H-пиридо/2,3-b/бензо-1,4-диазепин-6-он (формула II: X = NH, R1 = F в положении d', R2 = H, N1 = бензол, N2 = пиридин с N в положении d).
Это соединение получают по способу приготовления 8, но исходя из 5-фтор-2-нитробензойной кислоты и 3-амино-2-хлорпиридина. Точка плавления 270oC.
Общий способ получения метилпиперазиноазепинонов формулы (I) изобретения из азепинонов формулы (II) может быть осуществлен в соответствии с тремя вариантами реализации, схемы которых даны и прокомментированы ниже.
Схема A.
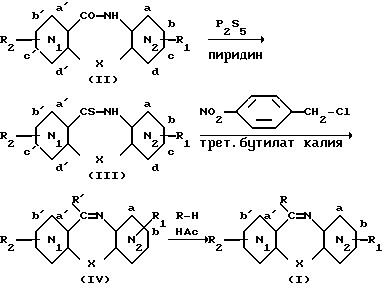
R' = пара-нитробензил; R = N-метилпиперазинил.
Из азепинона (II) синтезируют соответствующий тион (III) при действии P2S5 в пиридине. Выделяют сырой продукт, используют его как таковой и прибавляют трет. бутилат калия и пара-нитробензилхлорид для получения тиоэфира (IV). Соединение формулы (I) получают при взаимодействии тиоэфира в присутствии N-метилпиперазина и ледяной уксусной кислоты (см. Ханзиккер с сотр. , Helv. Chim. Acta, 50, 1588, 1967).
Схема B.
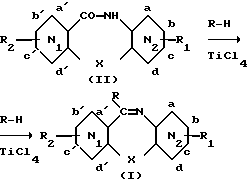 .
.
R = N-метилпиперазинил.
Смешивают азепинон (II) с N-метилпиперазином в присутствии раствора TiCl4 в анизоле. Эта смесь позволяет получить при перемешивании и нагревании соединение (I) изобретения (см. Чакрабарти с сотр., J. Med. Chem. 23, 876, 1980 и Пресс Дж. с сотр., J. Med. Chem. 22, 725, 1979).
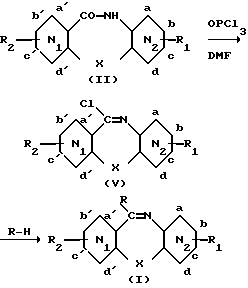 .
.
R = N-метилпиперазинил.
Азепинон (II) обрабатывают OPCl3 и ДМФ, чтобы получить соответствующий иминохлорид (V), который без выделения вводят в реакцию, и последующую конденсацию с N-метилпиперазином в толуоле, чтобы получить соединение (I) (см. Ханзиккер с сотр., Helv. Chim. Acta 49(5), 1933, 1966).
Можно также синтезировать соединения изобретения без использования азепинона (II) как исходного или промежуточного продукта, как будет показано далее в рамках синтеза метилпиперазиноазепина примера 21, из продукта реакции орто-галоиднитропиридина формулы (V)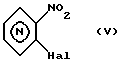 ,
,
в которой
Hal является атомом галоида, таким как Cl, F, I или Br, и бензолкарбоновой кислоты формулы (VI):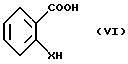 ,
,
в которой
X имеет указанные ранее значения.
Соли метилпиперазиназепинов формулы (I) могут быть получены по хорошо известным на практике способам. Обычно эти соли могут быть получены при взаимодействии эквимолекулярного количества метилпиперазиназепина с кислотой в адекватном растворителе, как, например, в спирте, затем, при необходимости осаждения соли, добавляют другой растворитель, смешивающийся с первым и в котором соль нерастворима, например простой эфир, или нейтрализуют эфирный раствор кислоты или основания основанием или кислотой. Использованные кислоты являются или органическими кислотами или неорганическими кислотами. В качестве неорганических кислот используют предпочтительно соляную кислоту, бромистоводородную кислоту, серную кислоту, фосфорную кислоту, хлорную кислоту и т.п. Органические кислоты являются или карбоновыми кислотами или сульфоновыми кислотами, например уксусной, лимонной, малеиновой, фумаровой, пропионовой, гликолевой, молочной, аскорбиновой, янтарной, винной, фенилуксусной, бензойной, п-аминобензойной, антраниловой, п-оксибензойной, салициловой, метансульфоновой, этансульфоновой, глюкуроновой и т.п.
Ниже приводятся детальные примеры получения некоторых производных метилпиперазиноазепинов согласно изобретению.
Пример 1.
11-/4-метилпиперазин-1-ил)-5H-пиридо/4,3-b/бензо-1,5-диазепин (формула I: X = NH, R1 = R2 = H, N1 = пиридин с N в положении b', N2 = бензол).
Способ A.
1) Обрабатывают 0,01 моль 5,10-дигидро-11H-пиридо/4,3-b/бензо-1,5-диазепин-11-она избытком P2S5 в пиридине при кипячении с обратным холодильником. После нескольких часов нагревания удаляют избыток реагентов и растворителя. Остаток осторожно обрабатывают льдом. Выделяют образовавшийся осадок и используют как таковой для дальнейшей работы.
2) Прибавляют 5,2 г тиолактама к суспензии трет.-бутилата калия в 80 мл диоксана (приготовленной следующим образом: 1,64 г калия растворяют в 40 мл трет.-бутанола, после окончания выделения газов удаляют растворитель и остаток поглощают 80 мл диоксана). Смесь 1 ч кипятят с обратным холодильником. Затем прибавляют 4,1 г пара-нитробензилхлорида. Кипятят с обратным холодильником 4 ч. Удаляют растворитель. Остаток поглощают хлороформом и промывают щелочью. Хлороформную фазу сушат и выпаривают досуха. Остаток перекристаллизовывают из смеси петролейный эфир/ацетон. Точка плавления 127oC.
3) Кипятят с обратным холодильником 4,3 г тиоэфира, полученного в 2), в течение 24 ч в присутствии 10 мл N-метилпиперазина и 0,1 мл ледяной уксусной кислоты. После выпаривания досуха остаток поглощают разбавленной уксусной кислотой. При необходимости фильтруют осадок. Фильтрат обесцвечивают обработкой активированным углем. Осаждают основание добавлением концентрированного гидрата окиси аммония, фильтруют, промывают водой и сушат. Продукт может быть перекристаллизован из смеси дихлорметан/гексан. Точка плавления 216oC.
Способ B.
Перемешивают 0,01 моль 5,10-дигидро-11H-пиридо/4,3-b/бензо-1,5-диазепин-11-она в 10 мл N-метилпиперазина. При перемешивании осторожно добавляют к суспензии диазепинона раствор 1,2 мл TiCl4 в 5 мл анизола. Реакционную смесь выдерживают при перемешивании при 120oC в течение 2-3 ч. Смесь охлаждают и поглощают ледяной водой. pH раствора должно быть щелочным. Тогда продукт экстрагируют дихлорметаном. После выпаривания растворителя очищают остаток на колонке с кизельгуром (элюент: ацетон/петролейный эфир 40-60: 9(1)). После удаления элюента перекристаллизовывают продукт из гексана. Точка плавления 216oC.
Пример 2.
6-/4-метилпиперазин-1-ил/пиридо/2,3-b/бензо-1,4-тиазепин (формула I: X = S, R1 = R2 = H, N1 = бензол, N2 = пиридин с N в положении d).
Обрабатывают 3 г 5H,6H-пиридо/2,3-b/бензо-1,4-тиазепин-6-она избытком оксихлорида фосфора и 5 каплями N,N-диметиланилина при кипячении с обратным холодильником в течение 20 ч. Раствор обрабатывают безводным толуолом и выпаривают досуха. Остаток поглощают 50 мл безводного толуола и прибавляют избыток N-метилпиперазина. Затем эту смесь кипятят с обратным холодильником в течение 2-4 ч. Сразу по окончании реакции удаляют растворитель. Окрашенную массу обрабатывают хлороформом и промывают два раза водой. Хлороформную фазу обесцвечивают углем и сушат. После концентрирования до мелкого объема смесь пропускают через колонку с оксидом кремния (Woelm act III).
Элюируют ацетоном. Сразу после отделения различные фазы, содержащие целевой продукт, выпаривают досуха. Остаток перекристаллизовывают из петролейного эфира 100-140. Точка плавления 134oC.
Пример 3.
Фумарат 8-хлор-6-/(4-метилпиперазин-1-ил)пиридо/2,3-b/бензо-1,4- тиазепин (формула I: X = S, R1 = H, R2 = Cl в b', N1 = бензол, N2 = пиридин с N в положении d').
Исходя из 5H,6H-пиридо/2,3-b/бензо-1,4-оксазепин-6-она, получают метилпиперазиназепиновое основание, указанное в названии, согласно способу примера 2. После выпаривания хлороформных фракций растворяют остаток в минимальном количестве кипящего спирта. Прибавляют эквимолекулярное количество фумаровой кислоты, предварительно растворенной в горячем спирте. Раствор охлаждают. Если продукт не кристаллизуется при стоянии, прибавляют эфир для кристаллизации. После отстоя получают белый порошок, который отделяют и промывают эфиром. Точка плавления 198oC.
Пример 4.
Малеат 5-/4-метилпиперазин-1-ил/пиридо/2,3-b/бензо-1,5-оксазепин (формула I: X = 0, R1 = R2 = H, N1 = пиридин с N в положении d', N2 = бензол).
Продукт получают из 5H,6H-пиридо/2,3-b/бензо-1,5-оксазепина-5-она и по методике примера 2. Хлороформные фракции затем выпаривают досуха. Остаток поглощают метилэтилкетоном. Прибавляют эквимолекулярное количество малеиновой кислоты, растворенной в метилэтилкетоне, затем безводной простой эфир. Продукт кристаллизуется. Его выделяют и промывают эфиром. Точка плавления 206oC.
Пример 5.
Фумарат 7-хлор-5-/4-метилпиперазин-1-ил/пиридо/2,3-b/бензо-1,5- оксазепин (формула I: X = 0, R1 = Cl в положении b, R2 = H, N1 = пиридин с N в положении d', N = бензол).
Из оксазепина, описанного в приготовлении 1, используя методику примера 2, выделяют соединение в виде фумарата так же, как и в примере 3. Точка плавления 260oC.
Пример 6.
Фумарат 5-/4-метилпиперазин-1-ил/-8-метилпиридо/2,3-b/бензо-1,5- оксазепин (формула I: X = 0, R1 = CH3 в b1, R2 = H, N1 = пиридин с N в положении d', N2 = бензол).
Из оксазепина, описанного в приготовлении 2, используя методику примера 2, выделяют соединение в виде фумарата так же, как в примере 3. Точка плавления 235oC.
Пример 7.
Фумарат 6-/4-метилпиперазин-1-ил/пиридо/2,3-b/бензо-1,4- оксазепин (формула I: X = O, R1 = R2 = H, N1 = бензол, N2 = пиридин с N в положении d).
Исходя из 5H, 6H-пиридо/2,3-бензо/-1,4-оксазепин-6-она и используя методику примера 2, выделяют соединение в виде фумарата. Точка плавления 183oC.
Пример 8.
Фумарат 8-хлор-6-/4-метилпиперазин-1-ил/пиридо/2,3-b/бензо- 1,4-оксазепина (формула I: X = O, R1 = H, R2 = Cl в положении b', N1 = бензол, N2 = пиридин с N в положении d).
Исходя из 8-хлор-5H,6H-пиридо/2,3-b/бензо-1,4-оксазепин-6-она приготовления 3, получают соединение по способу примера 2. Соединение выделяют в виде фумарата так же, как в примере 3. Точка плавления 250oC.
Пример 9.
6-/4-метилпиперазин-1-ил/-11H-пиридо/2,3-b/бензо-1,4-диазепин (формула I: X = NH, R1 = R2 = H, N1 = бензол, N2 = пиридин с N в положении d).
Исходя из 5,11-дигидро-6H-пиридо/2,3-b/бензо-1,4-диазепин-6- она, проводят конденсацию согласно способу B примера 1. Точка плавления 142oC.
Пример 10.
8-хлор-6-/4-метилпиперазин-1-ил/-11H-пиридо/2,3-b/бензо-1,4- диазепин (формула I: X = NH, R1 = Cl в b', R2 = H, N1 = бензол, N2 = пиридин с N в d).
Исходя из тиазепинона приготовления 8, получают целевой продукт согласно условиям работы, описанным в примере 1, способ B. Точка плавления 180oC.
Пример 11.
6-/4-метилпиперазин-1-ил/-8-метил-11H-пиридо(2,3-b)бензо-1,4- диазепин (формула I: X = NH, R1 = CH3 в b', R2 = H, N1 = бензол, N2 = пиридин с N в d/.
Исходя из 5,11-дигидро-8-метил-6H-пиридо/2,3-b/бензо-1,4- тиазепин-6-она, получают соединение, указанное в заглавии, согласно методике примера 1, способ B. Точка плавления 157oC.
Пример 12.
9-хлор-6-/4-метилпиперазин-1-ил/-11H-пиридо/2,3-b/бензо-1,4- диазепин (формула I: X = NH, R1 = Cl в c', R2 = H, N1 = бензол, N2 = пиридин с N в d/.
Исходя из 9-хлор-5,11-дигидро-6H-пиридо(2,3-b)бензо-1,4- диазепин-6-она, получают продукт, указанный в названии, по методике примера 1, способ B. Точка плавления 186oC.
Пример 13.
8-фтор-6-/4-метилпиперазин-1-ил/-11H-пиридо/2,3-b/бензо- 1,4-диазепин (формула I : X = NH, R1 = F в b', R2 = H, N1 = бензол, N2 = пиридин с N в d/.
Исходя из диазепинона приготовления 9, получают соединение, указанное в заглавии, по методике примера 1, способ B. Точка плавления 188oC.
Пример 14.
5-формил-11/4-метилпиперазин-1-ил/-5H-пиридо/4,3-b/бензо- 1,5-диазепин (формула I : X = 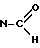 , R1 = R2 = H, N1 = пиридин с N в b', N2 = бензол).
, R1 = R2 = H, N1 = пиридин с N в b', N2 = бензол).
Исходят из соединения примера 1. Охлаждают 15 мл уксусного ангидрида и прибавляют туда понемногу при перемешивании 7 мл 99%-ной муравьиной кислоты. Смесь нагревают в течение 15 мин при 50oC, потом охлаждают на ледяной бане. Прибавляют 0,02 моль соединения примера 1, оставляют при перемешивании на ночь. Смесь обрабатывают льдом, подщелачивают и экстрагируют дихлорметаном. Сушат и концентрируют в вакууме, перекристаллизовывают из гексана. Точка плавления 196oC.
Пример 15.
11-формил-5-/4-метилпиперазин-1-ил/-11H-пиридо/2,3-b/бензо- 1,5-диазепин (формула I : X = 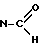 , R1 = R2 = H, N1 = пиридин с N в d', N2 = бензол).
, R1 = R2 = H, N1 = пиридин с N в d', N2 = бензол).
Исходя из соединения, описанного в статье Чекрабарти с сотр. j. Med. Chem., 32, N 10, 2375-2381, 1989, проводят формилирование по методике примера 14. Точка плавления 194oC.
Пример 16.
11-трифторметилкарбонил-5-/4-метилпиперазин-1-ил/-11H- пиридо-/2,3-b/бензо-1,5-диазепин (формула I: X = N-CO-CF3, R1 = R2 = H, N1 = пиридин с N в d', N2 = бензол).
Исходят из соединения, описанного в статье, указанной в примере 15. Перемешивают 0,02 моль соединения с 15 мл ангидрида трифторуксусной кислоты и несколькими каплями N,N-диметиланилина при хорошем охлаждении, потом кипятят с обратным холодильником в течение 5 мин и оставляют при перемешивании на ночь. Выливают на лед, подщелачивают, экстрагируют хлороформом. Очищают на колонке с оксидом кремния и концентрируют. Перекристаллизовывают из гексана. Точка плавления 183oC.
Пример 17.
11-формил-6-/4-метилпиперазин-1-ил/-11H-пиридо-/2,3-b/бензо-1,4- диазепин (формула I: X = 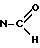 , R1 = R2 = H, N1=бензол, N2 = пиридин с N в d).
, R1 = R2 = H, N1=бензол, N2 = пиридин с N в d).
Исходят из соединения примера 9 и проводят формилирование по методике примера 14. Точка плавления 202oC.
Пример 18.
10-/4-метилпиперазин-1-ил/пиридо/4,3-b/бензо-1,4-тиазепин (формула I: X = S, R1 = R2 = H, N1 = бензол, N2 = пиридин с N в b).
Исходят из тиазепинона приготовления 5, получают соединение, указанное в названии, используя способ примера 2. Точка плавления 143-144oC.
Пример 19.
5-/4-метилпиперазин-1-ил/дибензо(b, f)1,4-селеназепин (формула I: X = Se, R1 = R2 = H, N1 = N2 = бензол).
Исходят из 10H, 11H-дибензо/b, f/1,4-селеназепин-11-она и получают соединение, указанное в заглавии, используя способ примера 2. Точка плавления 107oC.
Пример 20.
6-/4-метилпиперазин-1-ил/пиридо/2,3-b/3',2'-f/1,4-тиазепин (формула I: X = S1, R1 = R2 = H, N1 = N2 = пиридин с N в d и d'/.
Продукт получают из соединения приготовления 7, используя способ примера 2. Точка плавления 170oC.
Пример 21.
6-/4-метилпиперазин-1-ил/-11-метил-11H-пиридо/2,3-b/бензо-1,4- диазепин (формула I: X = N-CH3, R1 = R2 = H, N1 = бензол, N2 = пиридин с N в положении d).
Кипятят с обратным холодильником в течение 24 ч 0,02 моль 2-хлор-3-нитропиридина, 0,01 моль N-метилантраниловой кислоты, 5 г безводного K2CO3 и 50 мл сухого изопропанола. После выпаривания растворителя остаток поглощают водой и доводят до кипения в присутствии активированного угля. После охлаждения раствор подкисляют до pH 3. Продукт осаждается в виде желтого порошка, его отфильтровывают, промывают водой и сушат.
Точка плавления 174oC.
Суспендируют в безводном эфире 0,005 моль полученной кислоты. Соединение этерифицируют диазометаном, который получают из 4 г нитрозометилмочевины при разложении его едким натром в присутствии эфира. Эфирный раствор диазометана понемногу приливают к эфирному раствору нитрокислоты. Сразу по окончании реакции выпаривают растворитель. Остаток поглощают раствором и экстрагируют два раза CHCl3. Хлороформный раствор сушат и концентрируют в присутствии петролейного эфира 100-140. Затем отфильтровывают кристаллический продукт и промывают петролейным эфиром 40-60. Точка плавления 71oC.
Каталитически восстанавливают 0,01 моль производного нитроэфира (растворенного в 150 мл этанола) на 1 г 10%-ного палладия на угле Pd/C) в гидрогенизаторе низкого давления. Через 2 ч реакция заканчивается и растворитель выпаривают. Остаток (аминоэфир) поглощают 50 мл анизола и переносят в колбу. Прибавляют 20 мл N-метилпиперазина. Смесь нагревают при перемешивании до 120oC. Осторожно приливают к смеси раствор 5 мл TiCl4 в 10 мл анизола. Реакционную смесь 12 ч кипятят с обратным холодильником. Затем смесь охлаждают и обрабатывают 10 мл изопропанола, 10 мл концентрированного гидрата окиси аммония и 2 г оксида кремния. Смесь фильтруют и собранный осадок промывают тщательно хлороформом. Фильтрат промывают один раз водой, потом экстрагируют 2н HCl. Этот раствор обесцвечивают активированным углем и подщелачивают гидратом окиси аммония. Образовавшийся осадок экстрагируют хлороформом. Хлороформные фракции объединяют и концентрируют до малого объема. Полученный остаток очищают на колонке с кизельгуром, элюируя смесью 9/1 ацетона и петролейного эфира 40-60. Сразу после выделения перекристаллизовывают продукт из смеси дихлорметана и гексана. Точка плавления 146oC.
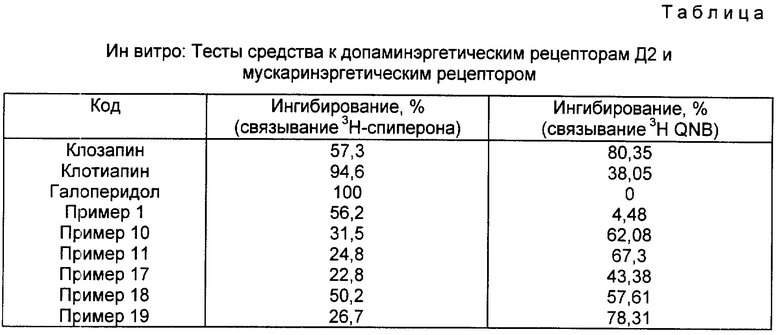
Соединения изобретения были изучены в соответствующих фармакологических тестах, чтобы показать активность на уровне центральной или периферической нервной системы. Были получены следующие результаты на веществах примеров 1, 10, 11, 17, 18 и 19, они подтверждают антидепрессивную, антипсихотическую, анксиолитическую, нейролептическую или седативную активность соединений изобретения (см. табл. 1).
Допаминэргетические рецепторы Д2.
Характеристика опытами по замещению (3H) спиперона.
Приготовление мембран.
Изымают мозг у самцов крыс Вистар (200-250 г). Полосатое тело быстро иссекают и гомогенизируют в 20 мл ледяного буфера (50 нМ Трис) HCl, pH 7, 4, 25oC), используя тефлоновый гомогенизатор. Гомогенат центрифугируют при 4oC и 10000 g в течение 10 мин, донную часть два раза промывают ледяным буфером и повторно центрифугируют. Конечную донную часть суспендируют в ледяном буфере (50 нМ/HCl, pH 7,4), содержащем 5 нМ MgSO4, 0,5 нМ ЕДТА. После повторной гомогенизации суспензию устанавливают на 1 мг белка/мл. Определяют количество белка по методу Лоури с сотр. /J. Biol. Chem. 193, 265-275 (1951)), используя в качестве стандарта бычий сывороточный альбумин.
Опыт по связыванию.
Используют метод, разработанный Текоттом с сотр. (Biol. Psychiatry 21, 1114-1122 (1986)). Оценивают связывание (3H)-спироперона по следующей смеси: 200 мкл мембранного препарата (0,1-0,2 мг белка), 100 мкл (10-6M) испытуемого вещества и 600 млк буфера для конечного объема 1 мл. Контрольные трубки, взятые для контроля неспецифического связывания, содержат также 1 мкМ (+)-бутакламола. Содержимое (в трех повторах) затем инкубируют с 0,5 нМ (3H) спироперона при 25oC в течение 60 мин. Манипуляцию прекращают, быстро фильтруя в вакууме суспензию через фильтр из стекловолокна (CF/C). Фильтр три раза промывают 5 мл ледяного буфера. Измеряют радиоактивность на спектрометре с жидкой сцинцилляцией (ZKB Rack Beta 1219). Результаты приведены как разница в процентах между контролем ( IμM ) + (бутакламола) и испытуемым веществом.
Характеристика мускариновых рецепторов
Связи рецепторов
Способ основан на методике, описанной Ямамура и Снайдерон (Proc. Natl. Sci. USA, 71, 1725 (1974)). После быстрого изъятия мозг крысы СГУ (130-180 г) рассекают для удаления мозжечка. Другие ткани гомогенизируют с Поттером в растворе 0,32 М сахарозы, 50 мМ буфера Трис(HCl), pH 7,5. Концентрацию белка определяют по методике Петерсона (Anal. Biochem. 83, 346 (1977)).
Опыт по связыванию проводили три раза при 25oC. Среда инкубации (1 мл) состоит из 60 мМ NaCl, буфера Трис(HCl), pH 7,5 и 1,5 нМ (3H) QNB (Нью Инглэнд Ньюклеар, опред. активность: 1,18 TBq (моль). Реакционную смесь выдерживают с гомогенатом в течение 60 мин, гомогент содержит 250-400 мкг белка. Неспецифическое связывание осуществляется 10-5 М атропина. Прекращение манипуляции осуществляют быстрой фильтрацией через стеклянный фильтр Ватмана CF/C. Свободный лиганд также удаляют. Каждый образец промывают 2 x 10 мл холодного буфера. Фильтры сушат, переводят в толуольный раствор для сцинцилляции и помещают в счетчик с компьютером Паккард Трикарб жидкий сцинцилляционный счетчик на день. Связь с рецептором прямо пропорциональна концентрации белка до 700 мкг белка/мл.
Ин виво: тест на антагонизм к апоморфину.
При 20 мг/кг большинство соединений снижает подвижность у животных и обладает седативным действием. В большинстве случаев соединения обладают активностью, интенсивность которой находится между активностью клозапина (20 мг/кг) (+) и активностью галоперидола (0,63 мг/кг (+++++). Следующие результаты приводятся в качестве примера.
Пример 1 - ++
Пример 5 - +
Пример 7 - +
Пример 8 - +++
Пример 10 - +++
Пример 11 - +++
Пример 12 - +
Пример 13 - +
Пример 19 - ++
Тест на каталепсию.
(См. , например, Грей У.Д., Остерберг А.Ч., Раух Ч.Е. Arch. Int. Pharmacodyn. 134, 198, 1961, и Костолл В., Оллей Дж., Е, Neuropharmacology 10, 297, 1971).
Этот тест показывает уровень экстрапирамидальных эффектов, которые имеются у многих нейролептиков (побочный нежелательный эффект). Соединения изобретения провоцируют очень низкую каталепсию и, следовательно, кажутся лишенными этого побочного нежелательного действия. Однако некоторые продукты обладают слабой каталепсией:
- примеры 1 и 3: каталепсия при дозах выше 40 мг/кг;
- пример 4; слабый каталептический эффект, начиная с 20 мк/кг;
- клозапин: незначительный каталептический эффект, начиная с 20 мг/кг.
Объектом настоящего изобретения являются также фармацевтические композиции, которые содержат в качестве активного составляющего одно или несколько соединений формулы (I), одних или с другими активными веществами подобного или другого действия, и смеси с фармацевтически приемлемыми экципиентами.
Эти фармацевтические композиции могут быть твердыми, например таблетки с покрытием и без него, покрытие может быть в один или несколько слоев, облатки, капсулы, диспергируемые или растворимые порошки, суппозитории, или жидкими, например растворы, суспензии, эмульсии, сиропы, препараты для парентерального введения, например, в виде аэрозоля.
Твердые композиции для орального применения могут быть приготовлены при смешивании одного или нескольких веществ согласно изобретению, например, с молочным сахаром, сахарным порошком, крахмалом, тальком, с продуктами, предназначенными для замедления или пролонгирования эффекта, например, ацетофталатом целлюлозы, стеаратами глицерина, ионообменными смолами.
Суппозитории могут быть приготовлены при введении одного или нескольких веществ согласно изобретению в масло какао, например, или в любое другое подходящее вещество, например, моно-, ди- и триглицериды насыщенных жирных кислот.
Жидкие композиции могут быть приготовлены, например, при растворении, суспендировании или переведении в эмульсию в момент приготовления или непосредственно перед введением одного или нескольких веществ согласно изобретению и, кроме того, любого другого продукта, присутствие которого является желательным или необходимым, например консервантов, таких как метил-п-оксибензоаты и пропил-н-оксибензоаты, загустители и эмульгаторы, например производные целлюлозы и сложные эфиры полиоксиэтиленсорбитан, пищевые и ароматизирующие добавки, например сахар, сахарин, сорбит, природные или синтетические эссенции, изотонизаторы, например хлористый натрий, или буферы, например фосфаты натрия, в дистиллированной воде, в других приемлемых гидроксилсодержащих жидкостях, таких как этанол, глицерин, некоторые гликоли, в смесях этих растворителей или в фармацевтически приемлемых маслах.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТРИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ, СПОСОБ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ИНГИБИРОВАНИЯ ВАЗОПРЕССИНА | 1994 |
|
RU2149160C1 |
| НЕСТЕРОИДНЫЕ МОДУЛЯТОРЫ РЕЦЕПТОРА ПРОГЕСТЕРОНА | 2003 |
|
RU2309155C2 |
| ПРОИЗВОДНЫЕ ДИАЗЕПИНОНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1992 |
|
RU2081870C1 |
| БИЦИКЛИЧЕСКИЕ ЛАКТАМЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2716136C2 |
| КОНДЕНСИРОВАННОЕ ПРОИЗВОДНОЕ ТИОФЕНА, ПРОИЗВОДНОЕ БЕНЗОТИОФЕНА, ПРОИЗВОДНОЕ ТИЕНОБЕНЗОКСАЗЕПИНОНА, ФАРМАЦЕВТИЧЕСКОЕ СРЕДСТВО И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1998 |
|
RU2197491C2 |
| ПРОИЗВОДНЫЕ ТРИАЗОЛО[1,4]ДИАЗЕПИНА И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 1989 |
|
RU2117670C1 |
| ПРОИЗВОДНЫЕ БЕНЗОТРИАЗОЛА | 2020 |
|
RU2840112C2 |
| АМИНОЗАМЕЩЕННЫЕ АНАЛОГИ ДИАРИЛ [a,d] ЦИКЛОГЕПТЕНА В КАЧЕСТВЕ МУСКАРИНОВЫХ АГОНИСТОВ И СПОСОБЫ ЛЕЧЕНИЯ ПСИХОНЕВРОЛОГИЧЕСКИХ РАССТРОЙСТВ | 2004 |
|
RU2394030C2 |
| ПРОИЗВОДНЫЕ БЕНЗОТИОФЕНА, БЕНЗОФУРАНА, ИНДОЛТИАЗЕПИНОНА, ОКСАЗЕПИНОНА И ДИАЗЕПИНОНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ ИНГИБИРУЮЩЕЙ КЛЕТОЧНУЮ АДГЕЗИЮ ИЛИ ВИЧ-АКТИВНОСТЬЮ, СПОСОБ ТОРМОЖЕНИЯ АДГЕЗИИ ЛЕЙКОЦИТОВ К ЭНДОТЕЛИАЛЬНЫМ КЛЕТКАМ ПРИ ЛЕЧЕНИИ ВЫЗВАННЫХ ЕЮ БОЛЕЗНЕЙ, СПОСОБ ЛЕЧЕНИЯ МЛЕКОПИТАЮЩИХ, ЗАРАЖЕННЫХ ВИЧ | 1995 |
|
RU2144033C1 |
| ЗАМЕЩЕННЫЕ ТЕТРАЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ОКСАЗЕПИНА И ТИАЗЕПИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ АНТИПСИХОТИЧЕСКОЙ АКТИВНОСТЬЮ, И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1995 |
|
RU2161159C2 |
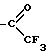
Использование: в химии гетероциклических соединений, проявляющих активность в отношении центральной нервной системы. Сущность изобретения: производные метилпиперазиназепина формулы I, приведенный в описании, где X - O, S, Se, NH или NR3, где R3-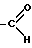 ,
,  или C1-C4 -алкил; R1, R2 - H, галоид или C1-C4-алкил, N1 является бензольным ядром и N2 является пиридиновым циклом, или наоборот, в которых атом азота пиридинового цикла находится в положении b, b', d или d', при условии, если R1 и R2 являются H, а X - S, O или NH, то N1 является пиридиновым циклом, а N2 - бензольным ядром, причем пиридиновый азот не может находиться в положении d'; или N1 и N2 оба -бензольные ядра, если X - Se; или N1 и N2 оба - пиридиновые циклы с атомом азота в d и d' положении, когда X - S, а R1 и R2 - H, или их соли. 4 з.п. ф-лы, 1 табл.
или C1-C4 -алкил; R1, R2 - H, галоид или C1-C4-алкил, N1 является бензольным ядром и N2 является пиридиновым циклом, или наоборот, в которых атом азота пиридинового цикла находится в положении b, b', d или d', при условии, если R1 и R2 являются H, а X - S, O или NH, то N1 является пиридиновым циклом, а N2 - бензольным ядром, причем пиридиновый азот не может находиться в положении d'; или N1 и N2 оба -бензольные ядра, если X - Se; или N1 и N2 оба - пиридиновые циклы с атомом азота в d и d' положении, когда X - S, а R1 и R2 - H, или их соли. 4 з.п. ф-лы, 1 табл.
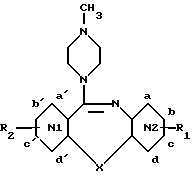
где X - кислород, сера, селен или группа NH или NR3, где R3 - группа
или алкила с 1 - 4 атомами углерода, разветвленный или неразветвленный;
R1 - водород, галоид или алкил с 1 - 4 атомами углерода, разветвленный или неразветвленный;
R2 - водород, галоид или алкил с 1 - 4 атомами углерода, разветвленный или неразветвленный;
N1 - бензольное ядро;
N2 - пиридиновый цикл или наоборот, в которых атом азота пиридинового цикла находится в положении b, b', d или d', при условии, если R1 и R2 - водород и X - сера, кислород или группа NH, то N1 - пиридиновый цикл, а N2 - бензольное ядро, причем пиридиновый азот не может находиться в положении d'; или N1 и N2 оба являются бензольными ядрами, если X - селен; или N1 и N2 оба - пиридиновые циклы с атомом азота в d и d' положении, когда X - сера, а R1 и R2 - водород,
или фармацевтически приемлемые соли этих производных.
| EP, патент, 413300, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| EP, патент, 0003016 | |||
| кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1998-05-27—Публикация
1991-10-10—Подача