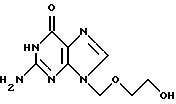
Изобретение относится к новому, улучшенному способу получения 9-(2-гидрокси)-этоксиметилгуанина, формулы (I)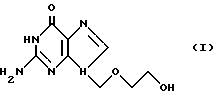
Получение соединения (I), хорошо известного как "ацикловир" и широко используемого в терапии в качестве противовирусного агента, раскрытого, например, в бельгийском патенте 833006, проводят исходя из гуанина, который сначала подвергают триметилсилилированию в три положения 2-амино, 6 и 9. Полученный силилированный промежуточный продукт обрабатывают затем 2-бензоилоксиэтоксиметилхлоридом с образованием (после снятия защиты в N2 и N6 положения) 9-(2-гидрокси)-этоксиметилгуанина, из которого регенерируют ацикловир за счет аммонолиза в метаноле. Способ включает использование очень большого избытка силилирующего агента с совершенно очевидной проблемой, касающейся цены и отходов, однако это приводит к продукту, в котором присутствует заметное количество примеси 7-замещенного изомера в количествах, не приемлемых с точки зрения фармацевтического использования.
Английский патент 1567671 раскрывает другой способ, в котором защиту аминогруппы в 2-положении проводят за счет ацилирования; в качестве ацилирующих групп в патенте используют ацетил, пропионил, бутирил и бензоил, хотя описан только случай, где представлен один N2, 9-диацетилгуанин, который взаимодействует с 2-окса-1,4-диацетоксибутаном с образованием N2-ацетил-9-(2-ацетокси)этоксиметилгуанина, который гидролизуют с выходом конечного ацикловира, с выходами, которые могут быть удовлетворительными, если только не образуется заметных количеств (вплоть до 13%) 7-изомера, который кроме образования, наносящего вред желаемому продукту, включает дальнейшее удорожание за счет стадий очистки.
Патент США 4146671 обеспечивает способ получения производных гуанина, включающий ацикловир, за счет реакции диацилирования гуанина диэфиром 2-оксо- или 2-тиабутандиола и последующего гидролиза.
Европейский патент 0532878 описывает получение ацикловира исходя из гуанозина и диэфира 2-окса-бутандиола и уксусного ангидрида с последующим гидролизом. Желаемый продукт получают вместе с 7-изомером, который должен быть превращен в желаемый 9-изомер.
Неожиданно было обнаружено, что ацикловир может быть получен с высокими выходами, по существу предотвращающими образование нежелательного 7-изомера, проведением алкилирования пуринового кольца в 9-положении 2-окса-1,4-диацетоксибутаном в N2-формилгуанин. Последнее соединение описано в литературе (Shapiro, Biochemstry, 8, 231 - 245 (1969)). Согласно этому автору N2-формилгуанин может быть получен за счет обработки глиоксаль-гуанинового аддукта периодатом натрия и/или периодной кислотой; действительно, способ является воспроизводимым с высокими выходами, хотя N2-формилгуанин может быть получен согласно способу изобретения также и с помощью других способов, таких как:
- окислением глиоксаль-гуанинового аддукта с помощью перуксусной кислоты или перекиси водорода или тетраацетата свинца;
- прямым формилированием гуанина муравьиной кислотой в присутствии или в отсутствии растворителя, такого как диметилформамид или диметилсульфоксид, необязательно в присутствии дициклогексилкарбодиимида;
- прямым формилированием гуанина формилуксусным ангидридом необязательно в растворителях, таких как диметилформамид, диметилсульфоксид, гексаметилфосфортриамид или муравьиная кислота.
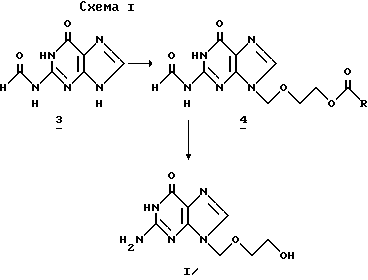
Способ согласно изобретению (схема 1) представляет способ получения 9-(2-гидрокси)этоксиметилгуанина формулы I: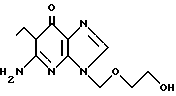
алкилированием N2-защищенного гуанина 2-окса-1,4-диацетоксибутаном и гидролизом образующегося N2-защищенного 9-(2-ацетокси)этоксиметилгуанина в присутствии кислого катализатора, заключающийся в том, что в качестве N2-защищенного гуанина используют N2-формилгуанин общей формулы II: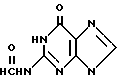
с получением N2-формил-9-(2-ацетокси)этоксиметилгуанина общей формулы III: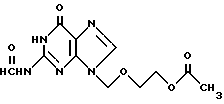
который гидролизуют.
Какую бы ни выбирали процедуру для получения N2-формилгуанина, понимают, что последующая реакция указанного соединения с 2-окса-1,4-диацетоксибутаном приводит к N2-формил-9-(2-ацетокси)этоксиметилгуанину с выходами выше 90% (и что более существенно, с образованием только следов 7-изомеров), который, наконец, диацилируют либо в одну стадию водным раствором щелочи, либо сначала деформилируют в кислой среде и, наконец, диацетилируют за счет щелочного гидролиза. Схема 2 суммирует способ получения согласно изобретению.
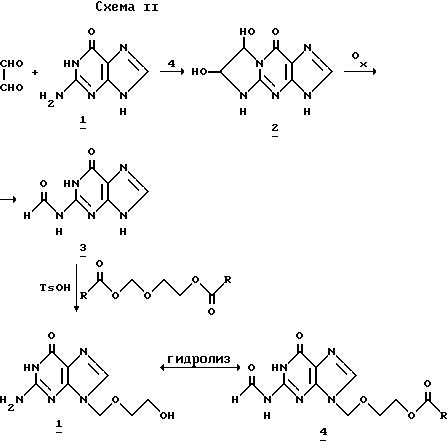
В указанной схеме R представляет водород, C1-C4 алкил или фенил. Диольный продукт (2) может быть регенерирован с высокими выходами суспендированием гуанина (1) в H2O добавлением водного раствора глиоксаля и нагреванием смеси до 80oC в течение 4 ч (Shapiro, loc. cit.; Ahapiro and J. Hachmann Biochemystry, 5, 2799 (1966)). Диол (2) может быть затем окислен до формил производного с хорошими выходами с помощью стехиометрического количества Na1О4 в воде при сохранении pH 1,8 - 2,2.
N2-формилгуанин (3) (который, как уже установлено может быть получен прямым формилированием гуанина) может быть затем подвергнут реакции алкилирования с получением N-9-алкилированного соединения (4) с высокими выходами без образования N-7 алкилированного продукта в заметном количестве; наконец, ацикловир (1) может быть получен из и соединения (4) за счет гидролиза водным раствором aOH с превосходными выходами.
В целом поэтому вышеописанный синтез позволяет получать желаемый продукт (1) с удовлетворительными выходами, выше, тем те, которые получали при синтезе через ацетилгуанин, и больше всего без образования заметных количеств 7-алкилированного продукта.
Было обнаружено, что элюирование основного водного раствора ацикловира через сильную анионообменную смолу позволяет получать желаемый продукт, по существу свободный от гуанина.
В соответствии с настоящим изобретением стадия очистки включает:
a) растворение ацикловира в водном основном растворе и разбавление полученного таким образом раствора водой;
b) загрузку указанного водного раствора по существу (a) в колонку с сильной анионообменной смолой с отношением смола:ацикловир вес./вес. от 2 до 1,5;
c) элюирование указанного разбавленного раствора при скорости потока от 200 до 300 мл/ч;
d) элюирование ацикловира элюэнтом, состоящим из смеси, образованной низшим спиртом/водным основным: раствором в отношении объем/объем от 0,8 до 1,2, и смеси элюэнт/ацикловир с отношением объем/вес от 15:1 до 20:1 л/кг при том же потоке (c) с получением элюата;
e) выделение ацикловира из указанного элюата по пункту (d).
Анионообменные смолы представляют смолы основного типа, которые состоят из полимеров, обладающих некоторой степенью сшивки и несущих четвертичные аммониевые группы. Смолы, использованные согласно настоящему изобретению, представляют сильно основные смолы.
Примеры сильно основных смол представляют декстраны, агарозу, целлюлозу, дивинилбензол, соответственно функциолизированные четвертичными аммониевыми группами.
Эти смолы являются обычно коммерчески доступными с торговыми марками AmberliteR, DowexR, SephacelR, SephadexR и т.д.
AmberliteR 1RA-400, ReliteR 3A, 1MAC HP-441 являются предпочтительными.
Хроматографию проводят на смоле в ее основной форме.
Элюирование проводят при комнатной температуре.
Водный основной раствор (a) состоит из гидроокиси щелочного металла, такого как раствор гидроокиси лития, натрия, калия. Концентрация основания находится в области от 5 до 15%. 10%-ный раствор гидроокиси натрия является предпочтительным.
Отношение вес/вес смола: ацикловир, равное 1,75, является предпочтительным.
Низшие спирты (d) представляют метиловый спирт, этиловый спирт, пропиловый спирт. Водный основной раствор (d) по существу состоит из гидроокиси щелочного металла в концентрации от 0,8 до 1,2 М. Отношение 1:1 объем/объем метиловый спирт/1М раствор гидроокиси является предпочтительным.
Отношение объем/вес элюат/ацикловир, равное 17,5, является предпочтительным.
Выделение продукта из элюата, как в (e), проводят согласно обычной процедуре. Предпочтительно ацикловир осаждают путем подкисления элюата соответствующей кислотой.
Полученный таким образом продукт содержал меньше чем 0,1% гуанина.
В соответствии со стадией очистки согласно изобретению полученный таким образом ацикловир являлся в 3 - 4 раза чище, чем наилучший коммерчески доступный продукт.
Приведенная выше чистая форма ацикловира и является целью настоящего изобретения.
Стадия очистки согласно изобретению является применимой к другому хорошо известному способу получения ацикловира. Например, вышеупомянутые способы BE 833006 и GB 1567671 приводят к конечному продукту, содержащему от 1 до 3% гуанина, которое является неприемлемым, так как предписываемый U.S. Pharmacopoia максимальный верхний предел составляет 0,7%.
Поэтому очистка ацикловира, как описано выше, составляет также цель настоящего изобретения.
Cледующие примеры иллюстрируют далее способ изобретения.
Пример 1.
a) "Глиоксальгуанин" (2).
100 г (0,662 моль) гуанина, 800 мл H2O и 150 мл 40%-ного водного раствора глиоксаля вес/вес. (1,32 моль) смешивают при комнатной температуре в 2-л круглодонной склянке, оборудованной холодильником, термометром и магнитной мешалкой, и смесь нагревают до 80oC в течение 4 ч, после чего содержимое склянки постепенно охлаждают до 5oC, фильтруют и промывают водой. После сушки в вакууме до постоянного веса, получают 136 г продукта (98%-ный выход), показывающего более 98%-ную чистоту по данным анализа, полученным с помощью ГПТХ.
b) N2-формилгуанин (3).
Суспензию 100 г (0,478 моль) глиоксальгуанина в 800 мл воды доводят до pH 1,8 - 2,26 мл H3PO4, добавляют 107,4 г (0,502 моль) NalO4 при механическом перемешивании и поддерживании температуры при 30oC с помощью водяной бани, контролируя непрерывно pH, которая не должна по существу меняться от 1,8 - 2,2. Реакцию постепенно доводят до постоянной гексотермичности до окончания, которое происходит через 2 ч после добавления окислителя. После указанного времени реакционную смесь охлаждают до 5oC, фильтруют, промывают водой и сушат. Получают 82 г формилгуанина (3) (96%-ный выход), показывающего более 98%-ную чистоту по данным анализа ГПТХ.
c) N2-формил-9-(ацетокси)этоксиметилгуанин (4) с R=CH3.
100 г (0,559 моль) формилгуанина (3), 300 г (1,705 моль) 2-окса-1,4-диацетокси-бутана и 2 г (0,0105 моль) п-толуолсульфоновой кислоты помещают в 500-мл круглодонную склянку в масляной бане, оборудованную термометром и устройством для перегонки. В системе создают давление (30 - 40 мм Hg), и реакционную массу нагревают до достижения внутренней температуры 118 - 122oC в течение 1 ч. Температуру 118 - 122oC поддерживают в течение 8 ч, отгоняя образующуюся уксусную кислоту. Смесь охлаждают до 50 - 60oC и разбавляют 150 мл ацетона (или н-бутилового спирта, или этилацетата), охлаждают до 0 - 5oC, фильтруют и сушат в вакууме при 60 - 70oC, с получением 148,3 г (4) с R=CH3 (90%-ный выход). Данные элементного анализа и спектральные данные согласуются с предполагаемой структурой.
d) Ацикловир (1).
65 г (0,220 моль) (4) (R=CH3) диспергируют в 650 мл мл 5%-ного раствора NaOH, проверяя полноту растворения твердого вещества. После 12 ч перемешивания смесь нейтрализуют до pH 5 - 6 водным раствором HCl. Суспензию охлаждают до 20 - 25oC, сырой остаток отфильтровывают и промывают 400 мл деионизированной воды. После сушки в вакууме при 60 - 70oC получают 46,1 г ацикловир (1) с выходом 93%.
Пример 2.
a) 9-(2-ацетокси)этоксиметил-гуанин (6).
300 мл 95% EtOH 29,5 г (0,1 моль) промежуточного соединения (4) и 40,4 г (0,4 моль) Et3N помещают в 500-мл круглодонную склянку, оборудованную термометром, мешалкой и шариковым холодильником. Реакционную массу кипятят с обратным холодильником в течение 5 ч. Доводят pH до 5 - 6 водным раствором HCl, смесь охлаждают до 15 - 20oC, сырой остаток отфильтровывают и промывают 200 мл деионизированной воды. После сушки в вакууме при 60 - 70oC получают 22,8 г (6) (выход 85%).
b) Ацикловир (1).
26,7 г (0,1 моль) (6) обрабатывают 5%-ным раствором NaOH, как описано в примере 1 (d). Ацикловир получают с существенным количественным выходом.
Пример 3.
Следуя процедуре примера 1, используют вместо 2-окса-1,4-диацетоксибутана соответствующее количество 2-окса-1,4-диформилокси-бутана или 2-окса-1,4-дибензоилокси-бутана для алкилирования N2-формилгуанина. Получают соответствующие промежуточные соединения (4) с R=H и соответственно с R= фенил, по существу с такими же выходами, как те, которые в примере 1 (c), из которых легко получают промежуточные соединения ацикловира согласно процедуре, описанной в примере 1 (d).
Пример 4.
87,5 г (125 мл, кажущийся d-0,7) сильно основной смолы (AVBERLITE 1RA-400) суспендируют в деионизированной воде и загружают в хроматографическую колонку (диаметром 4 см, высотой 40 см). После обычных регенерационных обработок (последовательное элюирование 2M NaOH, 2M HCl, 2M NaOH и деионизированной водой до нейтральной реакции) раствор, полученный растворением 50 г ацикловира в 100 мл 10%-ного раствора NaOH, разбавленного вплоть до 200 мл водой, загружали в колонку. Затем раствор элюировали со скоростью 250 мл/ч (4,2 мл/мин). После элюирования вышеуказанного раствора колонку элюировали с той же скоростью потока 900 мл 1:1 об/об смесью MeOH/1 M NaOH. Полученный таким образом элюат доводили до pH 5 - 6 водным раствором HCl. Осаждающееся твердое вещество промывали водой и сушили. Получали 45 г ацикловира (90%-ный выход), свободного от гуанина.
Изобретение относится к улучшенному способу получения ацикловира алкилированием N-формилгуанина 2-окса-1,4-диацилоксибутаном и гидролизом образующегося промежуточного соединения в присутствии кислого катализатора. Ацикловир-9-(2-гидрокси)этоксиметилгуанин - известное противовирусное соединение. Предлагаемый способ позволяет получить ацикловир с высокими выходами, практически без образования нежелательного 7-изомеpa. 6 з.п.ф-лы.
алкилированием N2-защищенного гуанина 2-окса-1,4-диацетоксибутаном и гидролизом образующегося N2-защищенного 9-(2-ацетокси)этоксиметилгуанина в присутствии кислого катализатора, отличающийся тем, что в качестве N2-защищенного гуанина используют N2-формилгуанин общей формулы II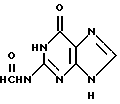
с получением N2-формил-9-(2-ацетокси)этоксиметилгуанина общей формулы III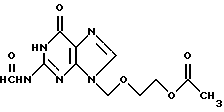
который гидролизуют.
а) растворение 9-(2-гидрокси)этоксиметилгуанина в водном растворе и разбавление полученного таким образом раствора водой;
b) загрузку указанного водного раствора (а) в колонку с сильной анионообменной смолой с массовым отношением смола: 9-(2-гидрокси)этоксиметилгуанин от 2 до 1,5;
с) элюирование указанного разбавленного раствора со скоростью от 200 до 300 мл/ч;
d) элюирование 9-(2-гидрокси)этоксиметилгуанина элюэнтом, состоящим из смеси низший спирт/водный основной раствор основания в отношении объем/объем от 0,8 до 1,2, и элюэнт/9-(2-гидрокси)этоксиметилгуанин в соотношении объем/вес от 15 : 1 до 20 : 1 л/кг в основном практически со скоростью потока при получении элюата на стадии с);
е) выделение 9-(2-гидрокси)этоксиметилгуанина из указанного элюата стадии (d).
Приоритет по пунктам:
10.09.93 - по пп.1 - 4;
03.11.93 - по пп.5 - 7.
| Способ получения 9-(2-оксиэтоксиметил)гуанина | 1988 |
|
SU1705296A1 |
| DE 3544461 A1, 03.07.86 | |||
| US 4146715 A, 27.03.79 | |||
| US 4609661 A, 02.09.86 | |||
| Устройство телемеханики для сосредоточенных объектов | 1975 |
|
SU532878A1 |
| Способ зевообразования на ткацком станке | 1988 |
|
SU1567671A1 |
| Biochemystry, 1969, т.8, 231 - 245 Chemical Abstracts т.107, N 13, 115906 и (1987) | |||
| Там же т | |||
| Шкив для канатной передачи | 1920 |
|
SU109A1 |
Авторы
Даты
1999-01-27—Публикация
1994-02-03—Подача