Изобретение относится к новой форме безводной соли метансульфоновой кислоты и 7-([1α,5α,6α]-6-амино-3-азабицикло[3.1.0] гекс-3-ил)-6-фтор-1-(2,4-дифторфенил)- 1,4-дигидро- 4-оксо-1,8-нафтиридин-3-карбоновой кислоты, к способу использования указанного соединения при лечении бактериальной инфекции у млекопитающих, особенно людей, и к фармацевтическим композициям, полезным для него.
В патенте США N 5229396, который приводится здесь для сведения, раскрывается 7-([1α,5α,6α]-6-амино-3-азабицикло-[3.1.0]гекс-3-ил)-6-фтор-1-(2,4-дифторфенил)- 1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновая кислота, соль метансульфоновой кислоты формулы (т.е. соль указанной 3-карбоновой кислоты и метансульфоновой кислоты)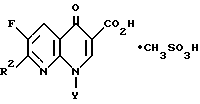
в которой Y представляет о,п-дифторфенил и R2 представляет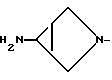
имеющая противобактериальную активность
Сущность изобретения.
Данное изобретение относится к новой кристаллической форме безводной 7-([1α,5α,6α]-6-амино-3-азабицикло[3.1.0] гекс-3-ил)-6-фтор-1-(2,4-дифторфенил)- 1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновой кислоты, соли метансульфоновой кислоты, которая обладает ценными и неочевидными свойствами. Поскольку ангидрат является практически гидрофобно стабильным, проблемы изготовления готовых препаративных форм активного ингредиента во время операций таблетирования или капсулирования облегчаются.
Подробное описание изобретения.
7-([1α,5α,6α]-6-амино-3-азабицикло[3.1.0] гекс-3-ил)-6-фтор-1-(2,4- дифторфенил)-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновая кислота, соль метансульфоновой кислоты, раскрытая в Пат. США N 5229396 и характеризуемая основными пиками в рентгенограмме порошковой дифракции (табл.1), является по существу гигроскопичной и может поглощать воду из атмосферы, образуя моногидрат. Моногидрат характеризуется основными пиками в рентгенограмме порошковой дифракции (табл.2).
Новая кристаллическая форма.
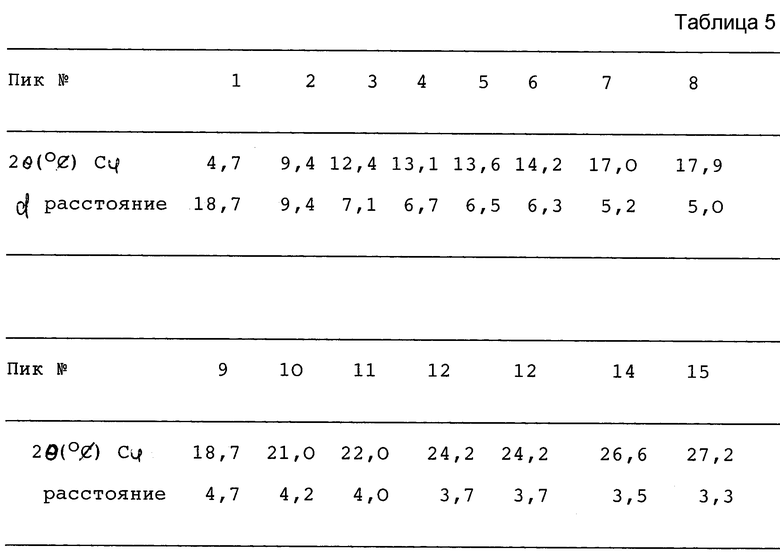
7-([1α,5α,6α]-6-амино-3-азабицикло[3.1.0] гекс-3-ил-6-фтор-1-(2,4- дифторфенил)-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновой кислоты, соли метансульфоновой кислоты (называемая здесь "ангидрат") гидрофобно стабильна и характеризуется основными пиками в следующей рентгенограмме порошковой дифракции (табл.3).
Ангидрат можно получить путем нагревания
7-([1α,5α,6α]-6-амино-3-азабицикло[3.1.0] гекс-3-ил)-6-фтор-1-(2,4-дифторфенил)- 1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновой кислоты, соли метансульфоновой кислоты или ее производного моногидрата в органическом растворителе или смеси его с апротонным сорастворителем, таком как изопропанол, диметилсульфоксид, н-пропанол, тетрагидрофуран или н-бутанол, предпочтительно н-бутанол или тетрагидрофуран/н-бутанол, до температуры дефлегмации или до температуры примерно между 70oC и 90oC, предпочтительно около 85oC. В зависимости от температуры реакции и других условий, время реакции обычно варьирует примерно от 1 до 20 часов, предпочтительно примерно от 2 до 16 часов.
Образующуюся суспензию кристаллов охлаждают до температуры примерно между 20oC и 30oC, предпочтительно около 25oC, в течение периода времени примерно между 2 и 24 часами, предпочтительно примерно от 2 до 12 часов. Кристаллический продукт затем отфильтровывают от маточного раствора и сушат под вакуумом до тех пор, пока растворитель не будет удален.
Ангидрат можно назначать для приема в качестве противобактериального средства, как описано в вышеупомянутом Пат. США N 5229396. Субъекту он может назначаться один, но обычно ангидрат вводят в смеси с фармацевтическим носителем, выбранным с учетом предлагаемого способа введения и общепринятой фармацевтической практики. Например, он может назначаться для приема орально или в форме таблеток, содержащих такие наполнители, как крахмал или лактоза, или в капсулах, либо один, либо в смеси с наполнителями, или в форме эликсиров или суспензий, содержащих ароматизирующее средство или красители. В случае животных, его преимущественно включают в корм животного.
Изобретение также представляет фармацевтические композиции, включающие противобактериально эффективное количество ангидрата вместо с фармацевтически приемлемым разбавителем или носителем.
Ангидрат можно вводить людям для лечения бактериальных заболеваний либо оральным, либо парентеральным путями, и он может назначаться орально при уровнях доз примерно от 0,1 до 500 мг/кг/день, предпочтительно 0,5-50 мг/кг/день, вводимых в виде однократной дозы или вплоть до 3-х раздельных доз. При внутримышечном или внутривенном введении доза составляет около 0,1-200 мг/кг/день, преимущественно 0,5-50 мг/кг/день. При внутримышечном введении доза может быть однократной или вплоть до 3-х дробных доз, внутривенное введение может представлять собой продолжительное капельное внутривенное вливание. Специалистам в данной области известно, что возможны вариации в зависимости от веса и состояния субъекта, подлежащего лечению и выбранного конкретного способа введения.
Противобактериальная активность ангидрита демонстрируется испытанием по Steer's репликаторной методике, которое является стандартным in vitro методом испытания на противобактериальную активность, описанным B.Steers et al., Antibiotics and Chemotherapy, 9,307 (1959).
Гидратационные свойства определялись гравитаметрически в некотором диапазоне относительных влажностей, с использованием системы VT1 микробаланса для использования сорбции влаги (Model MB 3000 W).
Приготовление A.
7-([1α,5α,6α]-6-амино-3-азабицикло[3.1.0] гекс-3-ил)-6-фтор-1-(2,4-дифторфенил)- 1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновая кислота, соль метаносульфоновой кислоты
Этиловый эфир 7-([1α,5α,6α]-6-трет-бутилоксикарбониламино-3-азабицикло- [3.1.0] гекс-3-ил)-6-фтор-1-(2,4-дифторфенил)-1,4-дигидро-4-оксо-1,8- нафтиридин-3-карбоновой кислоты (25 г) и метансульфоновую кислоту (11 г) добавляли к смеси воды (250 мл) и тетрагидрофурана (250 мл). Полученную суспензию нагревают до температуры дефлегмации (около 66oC) и выдерживают при этой температуре в течение 20 часов, по истечении которых получается прозрачный раствор. Раствор охлаждают до 35-40oC и концентрируют при пониженном давлении до приблизительно половины его первоначального объема. Полученную суспензию кристаллов медленно охлаждают до комнатной температуре (около 20oC) и затем еще перемешивают при 10oC в течение 2 часов. Кристаллический продукт 7-([1α,5α,6α]-6-амино-3-азабицикло[3.1.0] -гекс-3-ил)-6-фтор-1-(2,4-дифторфенил)-1,4- дигидро-4-оксо-1,8-нафтиридин-3-карбоновая кислота, соль метаносульфоновой кислоты, отделяется фильтрацией и промывается смесью тетрагидрофурана (12,5 мл) и воды (12,5 мл). Кристаллы сушат под вакуумом при 30-35oC до тех пор, пока остаточное содержание воды в кристаллах не будет ниже 0,2%. Выход 21,2 г, 90%. Кристаллы 7-([1α,5α,6α]-6-амино-3-азабицикло[3.1.0] гекс-3-ил)-6-фтор-1-(2,4-дифторфенил)-1,4- дигидро-4-оксо-1,8-нафтиридин-3-карбоновой кислоты, соли метансульфоновой кислоты характеризуются основными пиками в рентгенограмме порошковой дифракции (табл.4).
Кристаллы 7-([1α,5α,6α]-6-амино-3-азабицикло[3.1.0]гекс-3-ил)-6-фторо-1-(2,4-дифторфенил)-1,4- дигидро-4-оксо-1,8-нафтиридин-3-карбоновой кислоты, соли метансульфоновой кислоты, могут поглощать воду из атмосферы и образовывать моногидрат. Моногидрат характеризуется основными пиками в рентгенограмме порошковой дифракции.
Пример 1.
7-([1α,5α,6α]-6-амино-3-азабицикло[3.1.0] гекс-3-ил)-6-фтор-1-(2,4-дифторфенил)-1,4- дигидро-4-оксо-1,8-нафтиридин-3-карбоновая кислота, соль метансульфоновой кислоты, безводная
7-([1α,5α,6α]-6-амино-3-азабицикло[3.1.0] гекс-3-ил)-6-фтор-1- (2,4-дифторфенил)-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновую кислоту, соль метансульфоновой кислоты или ее моногидрат (20 г) перемешивают с изопропанолом (220 мл). Суспензию кристаллов кипятят с обратным холодильником в течение 16 часов или до тех пор, пока исследование под микроскопом не покажет, что кристаллическая форма изменилась на гексагональную форму. Суспензию кристаллов охлаждают до 20-25oC и перемешивают при этой температуре в течение около 1 часа. Кристаллический продукт отфильтровывают изопропанолом (около 50 мл) и сушат в вакууме при 40oC до тех пор, пока весь растворитель не будет удален. Выход 98%.
Продукт представляет собой новую полиморфную форму 7-([1α,5α,6α]-6-амино-3-азабицикло[3.1.0] гекс-3-ил)-6-фтор-1-(2,4- дифторфенил)-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновой кислоты, соли метансульфоновой кислоты, безводную, характеризуемую основными пиками в следующей рентгенограмме порошковой дифракции.
Пример 2.
7-([1α,5α,6α]-6-амино-3-азабицикло[3.1.0] гекс-3-ил)-6-фтор-1-(2,4- дифторфенил)-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновая кислота, соль метансульфоновой кислоты, безводная
7-([1α,5α,6α]-6-амино-3-азабицикло[3.1.0] гекс-3-ил)-6-фтор-1-(2,4- дифторфенил)-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновую кислоту, соль метансульфоновой кислоты или ее моногидрат (7 г) растворяют в диметилсульфоксиде, (DMCO, 21 мл) при нагревании до 80-85oC до полного растворения, к раствору по каплям добавляют изопропанол (150 мл), чтобы вызвать кристаллизацию. Суспензию кристаллов выдерживают при температуре дефлегмации около 85oC в течение 2-16 часов или до тех пор, пока исследование под микроскопом не покажет, что кристаллическая форма изменилась на гексагональную форму. Полученную суспензию кристаллов охлаждают до 20-25oC. Кристаллический продукт отфильтровывают от маточного раствора, промывают изопропанолом (около 50 мл) и сушат под вакуумом при 50oC до полного удаления всех растворителей. Выход 77%.
Продукт является тем же самым, что в примере 1.
Пример 3.
7-([1α,5α,6α]-6-амино-3-азабицикло[3.1.0] гекс-3-ил)-6-фтор-1- (2,4-дифторфенил)-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновая кислота, соль метансульфоновой кислоты, безводная
7-([1α,5α,6α]-6-амино-3-азабицикло[3.1.0] гекс-3-ил)-6-фтор-1- (2,4-дифторфенил)-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновую кислоту, соль метансульфоновой кислоты или ее моногидрат (55,6 г) растворяют в диметилсульфоксиде, (DMCO, 159 мл) при нагревании до 80-85oC до тех пор, пока не образуется раствор. Раствор охлаждают до 20-25oC и перемешивают в течение 2 часов до образования суспензии кристаллов. К раствору при около 25oC добавляют по каплям дихлорметан (1200 мл), чтобы вызвать полную кристаллизацию. Суспензию кристаллов выдерживают при комнатной температуре на протяжении ночи или до тех пор, пока исследование под микроскопом не покажет, что кристаллическая форма изменилась на гексагональную форму. Кристаллический продукт отфильтровывают от маточного раствора, промывают дихлорметаном (3 • 119 мл) и сушат под вакуумом при 50oC до удаления всего растворителя. Выход 91%.
Продукт является тем же самым, что в примере 1.
Пример 4.
7-([1α,5α,6α]-6-амино-3-азабицикло[3.1.0] гекс-3-ил)-6-фтор-1- (2,4-дифторфенил)-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновая кислота, соль метансульфоновой кислоты, безводная
7-([1α,5α,6α]-6-амино-3-азабицикло[3.1.0] гекс-3-ил)-6-фтор-1- (2,4-дифторфенил)-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновую кислоту, соль метансульфоновой кислоты или ее моногидрат (1 г) перемешивают с н-пропанолом (44 мл). Суспензию кристаллов кипятят с обратным холодильником в течение 3 часов или до тех пор, пока исследование под микроскопом не покажет, что кристаллическая форма изменилась на гексагональную форму. Суспензию кристаллов охлаждают при 20-25oC и перемешивают на протяжении ночи. Кристаллический продукт отфильтровывают от маточного раствора, промывают н-пропанолом (около 10 мл) и сушат под вакуумом при 50-55oC до удаления всего растворителя. Выход 68%.
Продукт является тем же самым, что в примере 1.
Пример 5.
7-([1α,5α,6α]-6-амино-3-азабицикло[3.1.0] гекс-3-ил)-6-фтор-1- (2,4-дифторфенил)-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновая кислота, соль метансульфоновой кислоты, безводная
7-([1α,5α,6α]-6-амино-3-азабицикло[3.1.0] гекс-3-ил)-6-фтор-1- (2,4-дифторфенил)-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновую кислоту, соль метансульфоновой кислоты или ее моногидрат (70 г) перемешивают со смесью тетрагидрофурана (175 мл) и н-бутанола (525 мл). Суспензию кристаллов нагревают в течение 16 часов или до тех пор, пока исследование под микроскопом, не покажет, что кристаллическая форма изменилась на гексагональную форму. Суспензию кристаллов охлаждают до 20-25oC на протяжении ночи. Кристаллический продукт отфильтровывают от маточного раствора, промывают смесью тетрагидрофурана (25 мл) и н-бутанола (75 мл) и сушат в вакууме при 80oC до удаления растворителя. Выход 95%.
Продукт является тем же самым, что в примере 1.
Пример 6.
7-([1α,5α,6α]-6-амино-3-азабицикло[3.1.0]гекс-3-ил)-6-фтор-1- (2,4-дифторфенил)-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновая кислота, соль метансульфоновой кислоты, безводная
7-([1α,5α,6α]-6-амино-3-азабицикло[3.1.0]гекс-3-ил)-6-фтор-1- (2,4-дифторфенил)-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновую кислоту, соль метансульфоновой кислоты или ее моногидрат (5 г) перемешивают с н-бутанолом, содержащим вплоть до 1% воды (220 мл). Суспензию кристаллов нагревают до температуры дефлегмации в течение 5 часов или до тех пор, пока исследование под микроскопом не покажет, что кристаллическая форма изменилась на гексагональную форму. Суспензию кристаллов охлаждают до 20-25oC и перемешивают на протяжении ночи. Кристаллический продукт отфильтровывают от маточного раствора, промывают н-бутанолом (около 20 мл) и сушат под вакуумом при 50-55oC до удаления всего растворителя. Выход 92%.
Продукт является таким же, как в примере 1.
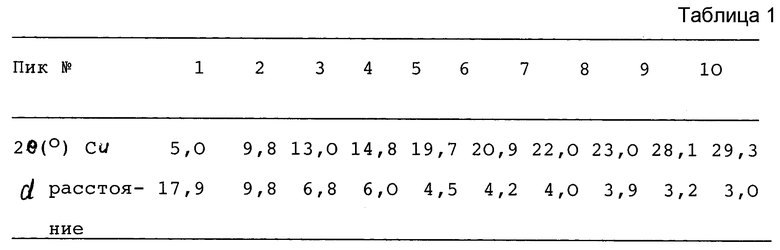
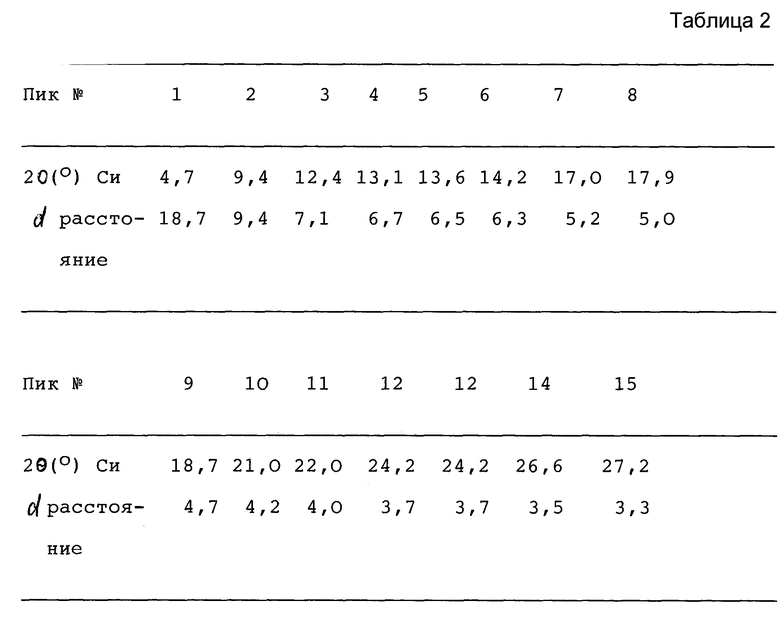


Соль 7-([1α,5α,6α]-6-амино-3-азабицикло[3.1.0] гекс-3-ил)-6-фтор-1-(2,4-дифторфенил)-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновой и метансульфоновой кислот имеет благоприятную для готовой формы препарата стабильность в качестве противобактериального средства. Способ ее получения заключается в том, что указанную соль или ее моногидрат с отличными от целевого продукта основными пиками в рентгенограмме порошковой дифракции кипятят или нагревают до температуры 80 - 85oС в присутствии спирта или его смеси с апротонным сорастворителем. 2 с.п. ф-лы, 5 табл.

2. Способ получения соединения по п. 1, отличающийся тем, что соль 7-([1α,5α,6α]-6-амино-3-азабицикло[3.1.0] гек-3-ил)-6-фтор-1-(2,4-дифторфенил)-1,4-дигидро-4-оксо-1,8-нафтиридин-3-карбоновой и метансульфоновой кислот или ее моногидрат кипятят или нагревают до температуры 80 - 85oC в присутствии спирта или его смеси с апротонным сорастворителем.
| US 5229396 [Katherine E.Bniqhty | |||
| Graton, Conn] 1993 | |||
| Способ получения 1-этилимидазолов | 1973 |
|
SU501671A3 |
Авторы
Даты
1999-01-27—Публикация
1996-06-05—Подача