Изобретение относится к новому способу получения S-(+)-2,2-диметилциклопропанкарбоксамида с помощью новых, пригодных для данного способа микроорганизмов. Эти микроорганизмы трансформированы новым геном, кодирующим стереоспецифическую гидролазу, благодаря чему они способны биотрансформировать R-(-)-изомер рацемического R,S-(±)-2,2-диметилциклопропанкарбоксамида в соответствующую кислоту, с получением оптически активного S-(+)-2,2-диметилциклопропанкарбоксамида.
2,2-Диметилциклопропанкарбоксамид далее обозначен как 2,2-ДМЦПКА, а 2,2-диметилциклопропанкарбоновая кислота - как 2,2-ДМЦПКК.
Оптически чистый S-(+)-2,2-ДМЦПКА является исходным продуктом для получения ингибитора дегидропептидазы циластатина, который используется в терапии вместе с антибиотиками из ряда пенемов и карбапенемов, для предотвращения дезактивации антибиотиков в почках под действием ренальной дегидропептидазы (см. ЕР 048301).
Примерами микроорганизмов, экспрессирующих стереоспецифическую гидролазу для R-(-)-2,2-ДМЦПКА, могут служить микроорганизмы видов Comamonas acidovorans А:18 (ДСМ N 6351), Bacterium sp. VIII:II (ДСМ N 6316), Pseudomonas sp. NSAK: 42 (ДСМ N 6433), Comamonas acidovorans TG 308 (ДСМ N 6552), а также их потомки и мутанты. Эти микроорганизмы подробно описаны в Европейской патентной заявке 92103780.0.
Задачей настоящего изобретения является разработка методов рекомбинантной ДНК для создания новых штаммов микроорганизмов-продуцентов, у которых каталитическая и экспрессирующая способность гена гидролазы по сравнению с известным способом значительно выше.
Согласно изобретению указанная задача была решена с помощью нового фрагмента, кодирующего ген гидролазы, новых гибридных плазмид, содержащих эту ДНК, новых микроорганизмов, трансформированных этой гибридной плазмидой, и с помощью нового способа получения S-(+)-2,2-ДМЦПКА.
Фиг. 1 показывает рестриктную карту гена, в которой ДНК, кодирующая стереоспецифическую гидролазу, полученная из микроорганизмов типа Comamonas, характеризуется сайтом рестрикции EcoR1 около -0,45 kb, сайтом рестрикции EcoRV около -0,44 kb, сайтом рестрикции PvuII около 0 kb, сайтом рестрикции KspI около 0,5 kb, сайтом рестрикции SmaI около 0,55 kb, сайтом рестрикции PstI около 0,65 kb, сайтом рестрикции SmaI около 0,73 kb, сайтом рестрикции StuI около 1,24 kb, сайтом рестрикции SmaI около 1,25 kb, сайтом рестрикции PstI около 1,8 kb и сайтом рестрикции BamHI около 1,85 kb.
Фиг.2 - физическая карта гибридной плазмиды pCAR6.
Фиг. 3 показывает последовательность аминокислот и нуклеотидную последовательность гена, кодирующего стереоспецифическую гидролазу.
Предлагаемый согласно изобретению способ получения S-(+)-2,2-диметилциклопропанкарбоксамида заключается в том, что в среду, содержащую рацемический R, S-(±)-2,2-диметилциклопропанкарбоксамид при рН 6-11 и температуре 15-55oC добавляют микроорганизм, трансформированный рекомбинантной плазмидной ДНК, содержащей фрагмент ДНК, кодирующий R-(-)-2,2-диметилциклопропанкарбоксамидгидролазу Comamonas, с рестриктной картой, характеризующейся следующими сайтами рестрикции: EcoRI около -0,45 kb, EcoRV около -0,44 kb, PvuII около 0 kb, KspI около 0,5 kb, SmaI около 0,55 kb, PstI около 0,65 kb, SmaI около 0,73 kb, StuI около 1,24 kb, SmaI около 1,25 kb, PstI около 1,8 kb и BamHI около 1,85 kb, или экспрессируемую указанным микроорганизмом иммобилизованную гидролазу с получением смеси S-(+)-2,2-диметилциклопропанкарбоксамида и R-(-)-2,2-диметилциклопропанкарбоновой кислоты, из которой выделяют конечный продукт.
В качестве рекомбинантной плазмидной ДНК обычно используют плазмидную ДНК, содержащую фрагмент ДНК, характеризующийся нуклеотидной последовательностью, представленной на фиг.3 и кодирующий гидролазу с аминокислотной последовательностью, представленной на фиг.3, или плазмидную ДНК, содержащую фрагмент ДНК, который гибридизуется с нуклеотидной последовательностью, представленной на фиг.3.
В качестве микроорганизма обычно используют штамм микроорганизма, выбранный из группы, включающей роды Escherichia, Pseudomonas, Comamonas, Acinetobacter, Rhizobium и Agrobacterium.
Предпочтительно в качестве микроорганизма используют штамм, выбранный из бактерий Escherichia coli, в частности, используют штамм бактерий Escherichia coli XL I-Blue (ДСМ N 6551), трансформированный рекомбинантной плазмидной ДНК pCAR6, или штамм бактерий Escherichia coli DH 5 (ДСМ N 7053), трансформированный рекомбинантной плазмидной ДНК pCAR6.
Согласно настоящему изобретению предлагается также фрагмент ДНК, кодирующий R-(-)-2,2-диметилциклопропанкарбоксамидгидролазу Comamonas и представляющий собой либо нуклеотидную последовательность размером около 2,3 kb, характеризующуюся следующей рестриктной картой: EcoRI около -0,45 kb, EcoRV около -0,44 kb, PvuII около 0 kb, KspI около 0,5 kb, SmaI около 0,55 kb, PstI около 0,65 kb, SmaI около 0,73 kb, StuI около 1,24 kb, SmaI около 1,25 kb, PstI около 1,8 kb и BamHI около 1,85 kb, либо ее частью от сайта PvuII 0 kb до сайта BamHI 1,86 kb.
Указанный фрагмент ДНК обычно имеет нуклеотидную последовательность, представленную на фиг. 3, и кодирует гидролазу с аминокислотной последовательностью, представленной на фиг.3, или имеет нуклеотидную последовательность, гибридизующуюся с нуклеотидной последовательностью, представленной на фиг.3.
Фрагмент ДНК может быть включен в плазмиду pCAR6, депонированную в штамме бактерий Escherichia coli XL I-Blue (DSM N 6551) или в плазмиду pCAR6, депонированную в штамме бактерий Escherichia coli DH5 (DSM N 7053).
Настоящее изобретение относится также к рекомбинантной плазмидной ДНК pCAR5, обеспечивающей экспрессию R-(-)-2,2-диметилциклопропанкарбоксамидгидроксилазы, содержащей:
- Eco RI- Bam HI- фрагмент ДНК гена rad штамма Comamonas acidovorans А: 18 размером 2,3 kb;
- ДНК вектора pBLUESCRIPT-KS+;
- сайты рестрикции фрагмента ДНК: EcoRI около -0,45 kb, EcoRV около -0,44 kb, PvuII около 0 kb, KspI около 0,5 kb, SmaI около 0,55 kb, PstI около 0,65 kb, SmaI около 0,73 kb, StuI около 1,24 kb, SmaI около 1,25 kb, PstI около 1,8 kb и BamHI около 1,85 kb, а также к рекомбинантной плазмидной ДНК pCAR6, обеспечивающей экспрессию R-(-)-2,2-диметилциклопропанкарбоксамидгидроксилазы, содержащей:
- PvuII- BamHI- фрагмент ДНК гена rad штамма Comamonas acidovorans А:18 размером 1,85 kb;
- ДНК вектора pBLUESCRIPT-KS+;
- сайты рестрикции фрагмента ДНК: PvuII около 0 kb, KspI около 0,5 kb, SmaI около 0,55 kb, PstI около 0,65 kb, SmaI около 0,73 kb, StuI около 1,24 kb, SmaI около 1,25 kb, PstI около 1,8 kb и BamHI около 1,85 kb.
Объектом настоящего изобретения также являются:
штамм бактерий Escherichia coli DSM N 7053, содержащий рекомбинантную плазмидную ДНК pCAR6, и штамм бактерий Escherichia coli DSM N 6551, содержащий рекомбинантную плазмидную ДНК pCAR6, обеспечивающие экспрессию R-(-)-2,2-диметилциклопропанкарбоксамидгидроксилазы.
Таким образом, в предлагаемом согласно изобретению способе рацемический R,S-(±)-2,2-ДМЦПКА R-(-)-2,2-ДМЦПКА с помощью микроорганизмов, трансформированных геном, кодирующим стереоспецифическую гидролазу, биотрансформируют в R-(-)-2,2-ДМЦПКК, и в результате получают оптически активный S-(+)-2,2-ДМЦПКА, который затем выделяют.
Получение биотрансформированных микроорганизмов
Получение предлагаемых микроорганизмов, экспрессирующих стереоспецифическую гидролазу, осуществляют следующим образом:
а) выделяют ДНК, кодирующую гидролазу,
б) эту специфическую последовательность ДНК вносят в вектор экспрессии, в результате чего получают гибридную плазмиду, которую иногда целесообразно подвергать определенным модификациям, позволяющим повысить эффективность экспрессии,
в) полученной гибридной плазмидой трансформируют пригодный для проведения предлагаемого способа микроорганизм (штамм-хозяин), после чего трансформированный микроорганизм представляет собой штамм-продуцент для заявленного способа биотрансформации.
а) Выделение гена (ДНК) стереоспецифической гидролазы
В качестве источника ДНК гидролазы, называемой в последующем ДНК гидролазы (rad) или геном гидролазы (rad), можно использовать, например, хромосомную ДНК микроорганизмов Comamonas acidovorans А:18 (DSM N 6315) или Comamonas acidovorans TG 308 (DSM N 6552), которые уже описаны в Европейской патентной заявке 92103780.0. Предпочтительным источником является Comamonas acidovorans А: 18. ДНК гидролазы можно выделить из линейной геномной библиотеки микроорганизма Comamonas acidovorans А:18 в микроорганизме Escherichia coli (E. coli) XL1-Blue® c помощью стандартного вектора для геномной библиотеки BLUESCRIPT® (BLUESCRIPT-KS+ или BLUESCRIPT-SK+) (фирма Stratagene Co., поставщик - Genofit SA, г. Женева).
Для этого выделяют сначала, например, хромосомную ДНК микроорганизма Comamonas acidovorans А:18 по методике R.H.Chesney и др. (см. J. Моl. Biol. 130, (1979), стр. 161-173). С помощью обычных, применяемых в молекулярной биологии методов эту ДНК можно разрезать рестриктазой EcoRI и встроить в разрезанный аналогичным образом вектор экспрессии ДНК pBLUESCRIPT-KS+R. Потом лигированную ДНК (смесь гибридных плазмид) трансформируют в компетентные микроорганизмы штамма E. coli XL1-BlueR по методу S. Fiedler и R.Wirth (Analyt. Biochem. 170 (1988), стр.38-44).
"Скрининг" геномной библиотеки также осуществляют аналогично известным методам. В этом случае целесообразно проверить культивируемость клонов, содержащих плазмиды, помещая их в пригодную среду, содержащую R,S-(±)-2,2-ДМЦПКА в качестве единственного источника азота, обычный источник углерода, подходящий индуктор и подходящий антибиотик. С помощью этого "скрининга" отбирают те клоны, которые в составе своей ДНК содержат активный ген гидролазы (rad) и, следовательно, оказываются способными использовать в качестве единственного источника азота предпочтительно R-(-)-2,2-ДМЦПКА. Эти клоны гибридных плазмид будут способны гидролизовать R-(-)-2,2-ДМЦПКА до соответствующей кислоты.
Целесообразно выявить локализацию гена гидролазы (rad) в гибридной плазмиде pCAR1 (выбранной среди клонов гибридных плазмид), состоящей из вектора-экспрессии pBLUESCRIPT-KS+R и встроенного EcoRI-фрагмента ДНК длиной около 23 kb. Собственно локализацию гена гидролазы (rad) целесообразно выявить известным методом Саузерн-блоттинга ("Southern-blotting") (см. Current Protocols in Molecular Biology, изд-во John Wiley & Sons, г.Нью-Йорк, раздел 2.9). Для этого целесообразно сначала разрезать гибридную плазмиду pCAR1 рестриктазами BamHI, PstI, PvuII и EcoRI. Получаемые в результате фрагменты ДНК целесообразно гибридизировать с радиоактивно мечеными олигомерами ДНК, соответствующими N-концевой последовательности белка гидролазы. Таким образом на гибридной плазмиде pCAR1 удалось обнаружить участок ДНК EcoRI-BamHI длиной 2,3 kb или участок ДНК PvuII-BamHI длиной 1,85 kb.
Необходимые для гибридизации олигомеры ДНК можно получить известными специалисту в данной области методами, например, путем хроматографического обогащения стереоспецифической гидролазы, определения N-концевых аминокислот, синтеза соответствующей последовательности ДНК с последующим радиоактивным ее мечением.
Установленный таким образом фрагмент ДНК, который кодирует стереоспецифическую гидролазу (rad) и рестриктная карта которого приведена на фиг.1, также входит в объем настоящего изобретения. Его можно выделить из гибридной плазмиды pCAR1 известными специалисту методами с помощью рестриктаз BamHI и EcoRI или BamHI и PvuII, после чего по проведении ряда шагов, например, после секвенирования ДНК, можно вывести всю аминокислотную последовательность. Таким образом получают пригодные для проведения способа трансформированные микроорганизмы.
Предлагаемый согласно изобретению фрагмент ДНК, кодирующий полипептид с активностью стереоспецифической гидролазы, аминокислотная последовательность которого изображена на фиг.3, фрагмент ДНК, гибридизирующийся с изображенным на фиг. 3 фрагментом ДНК и кодирующий этот полипептид, также может быть пригоден для осуществления заявленного изобретения.
б) Лигирование гена, кодирующего стереоспецифическую гидролазу (rad) в вектор-экспрессию гена
Полученную таким образом последовательность гена можно лигировать и получить гибридную плазмиду с помощью обычных молекулярно-биологических способов посредством обработанного аналогичными рестриктазами вектора-экспрессии.
Векторы-экспрессии обычно содержат пригодный, чаще всего регулируемый промотор (последовательность, контролирующая экспрессию). За этим промотором функционально по ходу транскрипции находятся одно или несколько сайтов рестрикции. В эти места затем обычно встраивают фрагмент гена, в экспрессии которого заинтересованы.
Для предлагаемого способа можно использовать либо векторы-экспрессии с широким кругом хозяев ("broad host range"), либо торговый вектор-экспрессии, например, вектор p-BLUESCRIPT-KS+R. Предпочтительно применяют вектор-экспрессии pBLUESCRIPT-KS+R с промотором РLac (лактозный промотор).
Вектор-экспрессии pBLUESCRIPT-KS+R целесообразно разрезать рестриктазами EcoRI и BamHI или PvuII и BamHI, а образующиеся рестрикционные концы лигируют с выделением фрагментом ДНК (EcoRI-BamHI или PvuII-BamHI), кодирующим стереоспецифическую гидролазу, например, с помощью Т4-ДНК-лигазы.
в) Гибридные плазмиды
Изобретение относится также к полученным выше гибридным плазмидам, содержащим последовательность гена стереоспецифической гидролазы (rad).
В основном можно применять все гибридные плазмиды, способные экспрессировать гидролазу в выбираемом микроорганизме (штамме-продуценте). Пригодные гибридные плазмиды содержат происходящие от вектора-экспрессии интактный репликон и селектируемый маркерный ген, обеспечивающий селекцию и идентификацию трансформированных гибридной плазмидой микроорганизмов на основе фенотипического признака. Подходящий маркерный ген придает микроорганизму, например, устойчивость к антибиотикам.
Для достижения эффективной экспрессии в гибридной плазмиде целесообразно обеспечить операбельное расположение гена гидролазы (rad) относительно промотора.
Примерами гибридных плазмид, пригодных для экспрессии гена гидролазы в штамме E. coli, являются плазмиды pCAR5 и pCAR6 с маркерным с геном bla (придающим устойчивость к ампициллину; АрR) и промотором РLac. Целесообразная плазмида pCAR5 состоит из фрагмента ДНК EcoRI-BamHI длиной 2,3 kb (см. рестриктную карту на фиг.3) и вектора-экспрессии pBLUESCRIPT-KS+. Гибридная плазмида pCAR6 состоит из фрагмента ДНК PvuII-BamHI длиной 1,85 kb (см. рестриктную карту на фиг.1) и вектора-экспрессии pBLUESCRIPT-KS+.
Целесообразно использовать гибридную плазмиду pCAR6 с промотором РLac, причем экспрессия гена гидролазы (rad) в зависимости от штамма-хозяина индуцируется изопропилтиогалактозидом (ИПТГ).
Гибридная плазмида pCAR6 депонирована в Немецкой коллекции микроорганизмов и клеточных культур (Deutsche Sammlung fur Mikroorganismen und Zellkulturen GmbH, Mascheroderweg lb, D-3300 Braunschweig) как 6.06.1991 г. под номером ДСМ 6551 в Е.соli XL1-BlueR, так и 21.04.1992 г. под номером ДСМ 7053 в E.coli DH5.
На фиг.2 приведена физическая карта гибридной плазмиды PCAR6.
г) Штаммы-хозяева
Полученными таким образом гибридными плазмидами целесообразно трансформировать штаммы-хозяева.
В случае гибридных плазмид с широким кругом хозяев целесообразно использовать штаммы-хозяева, обладающие высокой совместимостью с субстратом и исходными продуктами, например, микроорганизмы родов Pseudomonas, Comamonas, Acinetobacter, Rhizobium, Agrobacterium и Escherichia. В случае гибридных плазмид с узким кругом хозяев, таких как гибридная плазмида pCAR6, применяют, как правило, специфические штаммы-хозяева, в которых они реплицируются.
Таким образом, в качестве штаммов-хозяев для гибридной плазмиды pCAR6 предпочтительно применяются микроорганизмы рода Escherichia, в частности, микроорганизмы виды Е.соli, которые приведены в таблице 1.
д) Трансформация
Трансформацию штаммов-хозяев с помощью предлагаемых гибридных плазмид осуществляют известными способами. Выделение трансформированных штаммов-хозяев предпочтительно осуществляют на селективной питательной среде, к которой добавляют антибиотик, относительно которого содержащийся в гибридной плазмиде маркерный ген придает устойчивость. Так, в случае предпочтительного использования гибридной плазмиды pCAR6, содержащей ген bla, в питательную среду добавляют ампициллин.
е) Штамм-продуцент
В качестве штаммов-продуцентов согласно предлагаемому способу можно использовать все штаммы-хозяева, трансформированные гибридной плазмидой, содержащей ген стереоспецифической гидролазы. Однако предпочтительными штаммами-продуцентами являются микроорганизмы вида E.coli, приведенные в таблице 1, трансформированные с помощью гибридной плазмиды pCAR6, а также их потомки и мутанты.
Как уже упоминалось, микроорганизмы Е.соli XL-1Blue (ДСМ N 6551) и Е.соli DH5 (ДСМ N 7053) депонированы.
Если в качестве штамма-хозяина применяют, например, штамм Е.соli МС4100 по таблице 1 (описанный в Mol. Gen. Genet. 192, 1983, стр.293-294), то экспрессия гена стереоспецифической гидролазы (rad) под контролем промотора РLac происходит конститутивно из-за делеции в lac-опероне (оперон лактозы) (делеция /argF - lac/ U169). Из-за этого не образуется штамм с геном lac-репрессора - lacI (дефектный по гену репрессора микроорганизм). Если в качестве штаммов-хозяев используют, например, указанный в таблице 1 штамм Е.соli К12 (ДСМ N 498) или Е.соli HB101 (H.W.Boyer и D.Roulland-Dussoix, J. Mol. Biol. 41, 1969, стр.459-472), то экспрессия гена гидролазы (rad) индуцируется ИПТГ из-за присутствия гена репрессора lacI (не дефектный по гену репрессора микроорганизм).
ж) Биотрансформация
Согласно изобретению для биотрансформации можно использовать все микроорганизмы (штаммы-продуценты), которые трансформированы геном, кодирующим стереоспецифическую гидролазу, которая обеспечивает стереоспецифический гидролиз до кислоты R-(-)-2,2-ДМЦПКА.
Биотрансформацию целесообразно осуществлять микроорганизмами, трансформированными геном гидролазы (rad), рестриктная карта которого изображена на фиг. 1. Пригодными являются и микроорганизмы, трансформированные фрагментом ДНК, кодирующим полипептид с активностью стереоспецифической гидролазы, аминокислотная последовательность которого изображена на фиг.3. Также пригодными являются микроорганизмы, трансформированные фрагментом ДНК, гибридизирующимся с фрагментом ДНК, изображенным на фиг.3, и кодирующим полипептид с активностью стереоспецифической гидролазы.
Особенно пригодными для проведения предлагаемого способа являются, как описано выше, микроорганизмы вида Е.соli (см. таблица 1), трансформированные гибридными плазмидами pCAR5 или pCAR6, особенно те, которые трансформированы гибридной плазмидой pCAR6.
Пригодными оказываются также выделенные из клеток этих микроорганизмов энзимы (стереоспецифические гидролазы). Подобные энзимы можно получать путем известного специалисту методу разрушения клеток микроорганизма. Для этой цели можно применять, например, ультразвуковой, "French-Press"- или лизоцимный метод. Для осуществления способа эти выделенные из клеток энзимы затем можно иммобилизовать на соответствующем носителе обычными в данной области методами.
Предпочтительно способ осуществляется с находящимися в состоянии покоя (в lag-фазе) клетками микроорганизмов, которые предварительно индуцируются в соответствии с системой экспрессии. То есть, если используются не дефектные по гену репрессора микроорганизмы, например, E.coli XL1-Blue или E.coli DH5, трансформированные гибридной плазмидой pCAR6, то индукция осуществляется ИПТГ. Если в способе используются, например, дефектные по гену репрессора микроорганизмы вида E.coli, например, E.coli МС4100, то экспрессия гена гидролазы (rad) происходит перманентно (конститутивно).
Согласно особо предпочтительному варианту выполнения изобретения у микроорганизмов для повышения активности специфической гидролазы используют спирты С1-4. Примерами последних могут служить метанол, этанол, пропанол, изопропанол, бутанол, но предпочтение отдается метанолу и этанолу.
В качестве среды для способа можно использовать обычные в данной области среды, такие как низкомолярные фосфатные буферы, среда с минеральными солями, описанные по автору Kulla и др. (Arch. Microbiol. 135, 1983, стр.1-7) или же буфер HEPES (N-2-оксиэтилпиперазин-2'-этансульфокислота). Предпочтительно способ осуществляется в низкомолярном фосфатном буфере.
Целесообразно, чтобы среда для биотрансформации содержала рацемический R, S-(±)-2,2-ДМЦПКА в количестве от 0,2 до 5 вес.%, в частности, от 0,2 до 2 вес.%.
Целесообразно осуществлять биотрансформацию при значении pH в интервале от 6 до 11, в частности, в интервале от 6,5 до 10.
Целесообразно осуществлять биотрансформацию при температуре от 15 до 55oC, в частности, от 20 до 40oC.
По истечении обычно 1-30 часов, в частности, 5-25 часов, R-(-)-2,2-ДМЦПКА полностью превращается в соответствующую кислоту, причем получают оптически чистый S-(+)-2,2-ДМЦПКА, который можно выделить, например, путем экстракции, электродиализа или лиофилизации.
Пример 1
1.1. Приготовление хромосомной ДНК штамма Comamonas acidovorans А:18
Хромосомную ДНК свежей, выращенной в течение ночи культуры Comamonas acidovorans А: 18 (100 мл среды Nutrient Yeast Broth, 30oC) выделяли по модифицированному методу автора R. H. Chesney с соавт. (J. Мо1. Biol. 130 /1979/, 161-173):
Отделенные центрифугированием (15 мин, 6500 X g, 4oC) клетки помещали в буфере Трис-HCl (2,25 мл, 0,05 моля/л), pH 8,0, с 10% (вес./об.) раствором сахарозы. После добавления 375 мкл раствора лизоцима (10 мг/мл 0,25 моля/л буфера Трис-HCl, pH 8,0) и 900 мкл 0,1 моля/л EDTA, pH 8,0, взвесь в течение 10 минут охлаждали льдом. Затем добавляли 450 мкл 5% (вес./об.) SDS и 50 мкл рибонуклеазы (10 мг/мл Н2О) и выдерживали смесь при 37oC в течение 30 мин. После добавления на кончике шпателя протеиназы К и 400 мкл проназы (20 мл/мл Н2О) продолжали выдерживать смесь еще в течение 2 часов. После смешения с 4,3 г CsCl полученную смесь центрифугировали (30 мин, 40000 Х g, 20oC), добавляли 250 мкл бромистого этидия (10 мг/мл) и центрифугировали в ультрацентрифуге (с пробирками типа VTi 65.2) (свыше 8 ч, 246000 X g, 20oC). Под действием длинноволнового УФ-излучения отсасывали из пробирок полосу ДНК. После добавления 4-кратного объема буфера ТЕ (10 ммоля/л Трис-HCl, рН 8,0, 1 ммоль/л EDTA) бромистый этидий трижды экстрагировали н-бутанолом, насыщенным водой. Затем ДНК осаждали изопропанолом, смешивали с буфером ТЕ и выдерживали 15 минут при 65oC. Полученный препарат можно хранить при 4oC.
1.2. Рестрикция и лигирование хромосомной ДНК
5 мкг ДНК штамма Comamonas acidovorans А:18 (ДСМ N 6315) и 4,5 мкг ДНК вектора (pBLUESCRIPT-KS+R) разрезали каждую 20 единицами рестриктазы EcoRI в рестрикционном буфере с общим объемом 100 мкл (6,5 час при 37oC). Обе ДНК осаждали этанолом и высушивали в центробежном концентраторе типа Speed VacR. Осадки помещали в буфер лигирования (20 ммолей/л Трис-буфера, 10 ммолей/л ДТТ (дитиотреитола), 10 ммолей/л MgCl2, 0,6 моля/л АТФ (аденозинтрифосфата), рН 7,2) и объединяли их в этом буфере (объем лигирования 100 мкл). После добавления 1 единицы Т4-ДНК-лигазы смесь выдерживали в течение ночи при 13oC.
ДНК смеси лигирования осаждали изопропанолом и затем помещали в 30 мкл воды для трансформации.
1.3. Трансформация E.coli XL1-Blue2 и селекция
Компетентные клетки E.coli XL1-BlueR трансформировали путем электропорации смесью лигирования по методу, описанному авторами S.Fiedler и R.Wirth (Analyt. Biochem. 170 /1988/, стр.38-44).
Для доказательства наличия плазмиды осуществляли селекцию на питательном агаре с ампициллином (100 мкг/мл), а для доказательства наличия "вставки" в агар добавляли 0,5 ммоля/л ИПТГ (изопропил-β-D-тиогалактозида) и 30 мкг/мл х-галя (5-бром-е-хлор-3-индолил-β-D-галактопиранозида) при температуре 37oC.
При значении 1,7 • 108 cfu/мл (колонеобразующие единицы/мм) почти все клоны содержали "вставку" EcoRi.
Пример 2
2. Поиск гена R -специфической амидазы в библиотеке генов Comamonas acidovorans А:18
Культивировали клоны с гибридными плазмидами со "вставкой" EcoRI на минимальном питательном агаре по H. Kulla с соавт. (Arch. Microbiol. 135 /1983/, 1-7), содержащем 0,2% (об./об.) глицерина в качестве источника углерода, 0,15% (вес./об.) R,S-(±)-2,2-ДМЦПКА в качестве единственного источника азота и 0,5 ммоля/л ИПТГ в качестве индуктора промотора lac, а также 5 мкг/мл ампициллина для стабилизации плазмид. Оказалось, что только клоны, содержащие в плазмиде интактный гидролазный ген rad на "вставке" ДНК, были способны использовать R-(-)-2,2-ДМЦПКА в качестве источника азота, превращать его в желаемую R-кислоту и расти на этой минимальной питательной среде. Все без исключения отобранные таким образом клоны содержали гибридную плазмиду, происходящую из вектора pBLUESCRIPT-KS+R и содержащую "вставку" EcoRI длиной около 23 kb.
Выделяли плазмиду pCAR1 и составляли подробную ее характеристику.
Пример 3
3.1. Выделение R-специфической гидролазы из Comamonas acidovorans А:18 и анализ аминокислот N-концевой аминокислотной последовательности
а) Приготовление бесклеточного экстракта
16 л взвеси клеток Comamonas acidovorans А:18 (ДСМ N 6315), имеющей гидролазную активность при 37oC, 0,6 г R-(-)-2,2-ДМЦПКК /л/ч/ оптическая плотность при 650 нм (ОП650) = 1, у которых заранее индуцировали R,S-(±)-ДМЦПКА, концентрировали до 700 мл (ОП650 = 33,5). Затем клетки несколько раз центрифугировали, потом их повторно взвешивали в буфере ХЕПЕС, после чего их смешивали с 40 мл этого буфера, причем общий объем взвеси составлял 95 мл (ОП650 = 210). Гидролазную активность определяли при 30oC. Она составляла 0,34 г продукта/л/ч/ОП650 = 1. Затем клетки 2 раза разрушали под действием пресса типа French-press под давлением 1200 бар. Для получения бесклеточного экстракта взвесь 20 минут центрифугировали при 20000 Х g. В результате получали 50 мл экстракта, содержащего 39,3 мг/мл белка, измеренного по методу Бредфорда, и имеющего гидролазную активность при 30oC в 12,5 г R-(-)-2,2-ДМЦПКК/л/ч/мг белка.
б) Хроматография экстракта
Полученный сырой экстракт (50 мл) вводили в заполненную Q-сефарозой (фирмы Pharmacia) колонку, уравновешенную буфером ХЕПЕС (0,1 мол/л, рН 7,5). Колонку еще 2 раза промывали этим буфером, а затем элюировали белок градиентом буфера ХЕПЕС (0,1-1 мол/л). Буфером ХЕПЕС (1 моль/л) элюировали всего 140 мл белкового раствора с гидролазной активностью, который концентрировали путем ультрафильтрации (через мембрану Amicon-Membran YM10). Количество белка в этом растворе, содержащем фермент, равнялось 131 мг/мл, а гидролазная активность составляла 1 мкмоль/мин/нг белка.
Затем вводили 2 мл этого белкового раствора в заполненную суперозой-12 (фирмы Pharmacia) колонку, уравновешенную буфером ХЕПЕС (0,1 мол/л, рН 7,5). С помощью этого буфера элюировали всего 36 мл белкового раствора. Его тоже концентрировали ультрафильтрацией (через мембрану Amicon-Membran YM10). Количество белка равнялось 20,1 мг/мл, а гидролазная активность составляла 1,2 мкмоля/мин/нг белка.
Полученный таким образом белковый раствор вводили в заполненную анионитом Li Chirospher 2000 ТМАЕ (этилтриметиламмониевая соль) (фирмы Merck), уравновешенную буфером ХЕПЕС (0,1 мол/л, рН 7,5). После промывания колонки этим же буфером элюировали белковый раствор с градиентом NaCl (0-1 моль/л) в указанном буфере. Концентрация белка равнялась 15 мг/мл, а гидролазная активность составляла 1,2 мкмоля/мин/нг белка.
в) Идентификация гидролазы с помощью 1- и 2-мерного электрофореза
Содержащийся в сыром клеточном экстракте белок гидролазы идентифицировали с помощью электрофорезного прибора типа SDS-PAGE. Для этого сравнивали неиндуцированный клеточный экстракт на SDS-PAGE с индуцированным (индукция осуществлена с помощью R,S-(±)-2,2-ДМЦПКА).
В индуцированном клеточном экстракте определяли полосу белка с молекулярным весом около 46000. Полученные хроматографическим путем белковые фракции с гидролазной активностью также анализировали с помощью SDS-PAGE. Белок с молекулярным весом около 46000 концентрировали путем хроматографии, причем после третьего прохода через колонку степень обогащения составляла около 80%. Затем эту пробу со степенью чистоты 80% анализировали методом двухмерного элекрофореза (2-D-SDS-PAGE). Этим методом удалось доказать наличие белкового "пятна" с молекулярным весом около 46000, который соответствовал весу гидролазы.
г) Определение секвенирования белка
Полученное в результате электрофореза (2-D SDS-PAGE) белковое "пятно" наносили на мембрану из поливинилидендифторида (ПВДФ) и вырезали его из мембраны. Затем определяли последовательность аминокислот этого белка непосредственно по методу Hochstrasser и др. (см. Applied and Theoretical Electrophoresis 1, стр.73-76, 1988 "HDL particle-associated proteins in plasma and cerebrospinal fluid").
По этому методу определяли 21 аминокислоту (АК) N-концевой аминокислотной последовательности.
Пример 4
4. Локализация гена гидролазы (rad) на клонированном фрагменте EcoRI
4.1. Составление общей рестриктной карты pCAR1
Рестрикционным анализом, осуществленным по обычному методу (Current Protocols Molecular Biology, изд-во John Wiley and Sons, г.Нью-Йорк, 1987 г., раздел 2) составляли общую рестриктную карту pCAR1, показывающую расположение сайтов рестрикции EcoRV, PvuII, KaspI, SmaI, PstI, StuI, BamHI.
4.2. Конструирование смешанных ДНК-олигомеров на основе N-концевой пептидной последовательности гидролазы
На основе генетического кода конструировали два смешанных ДНК-олигомера N-концевой пептидной последовательности гидролазы микроорганизма Comamonas acidovorans А-18 и синтезировали их.
ДНК-олигомер (смесь)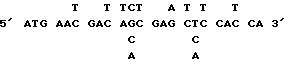
As Met Asn Asp Ser Glu Leu His As
ДНК-олигомер "Антисмысловая" (смесь)
AS Ile Glu Arg Gly Val Glu AS
4.3. Гибридизация по методу "Саузерн-блоттинга" рестрикционных фрагментов плазмиды pCAR1
Разделенные электрофорезом на агарозном геле (0,6%) фрагменты ДНК, полученные в результате фрагментирования разными рестриктазами (BamHI, PstI, EcoRI) плазмиды pCAR1, известным методом "Саузерн-блоттинга" переносили на нитроцеллюлозу (см. Current Protocols in Molecular Biology, изд-во John Wiley and Sons, г.Нью-Йорк, 1987 г., раздел 2.9 и сл.).
Концы ДНК-олигомеров метили с помощью [32Р] -гамма-АТР:
400 нг ДНК-олигомеров, 22μCi32P-γ-ATP, 11 ед. бесфосфатной полинуклеотидкиназы, в общем объеме 25 мкл полинуклеотидкиназного буфера (0,05 моля/л Трис-HCl, рН 7,5, 0,01 моля/л MgCl2, 5 ммолей/л дитиотреитола) инкубировали 30 минут при 37oC. Затем осуществляли очистку гель-фильтрацией с использованием сефадекса G-25 (фирмы Pharmacia) и гибридизацию с "Саузерн-блотами" известным приемом (см. указанную выше литературу).
В результате гибридизации с нуклеотидными олигомерами, соответствующими N-концевой белковой последовательности, удалось выявить на гибридной плазмиде pCAR1 EcoRI-BamHI ДНК-фрагмент длиной 2,3 kb или PvuII -BamHI ДНК-фрагмент длиной 1,85 kb.
4.4. Субклонирование гена гидролазы (rad)
EcoRI-BamHI ДНК-фрагмент длиной 2,3 kb или же PvuII-BamHI ДНК-фрагмент длиной 1,85 kb, кодирующий R-специфическую гидролазу из микроорганизма Comamonas acidovorans А: 18, вставляли в переваренную аналогичным образом векторную ДНК pBLUESCRIPT-KS+R или pBLUESCRI-РТ SK+R.
После индукции IPTG лишь одна ориентация "вставки" относительно промотора РLac в клонах проявляла нужную гидролазную активность.
Вектор pBLUESCRIPT-KS+R с EcoRI-BamHI ДНК-фрагментом длиной 2,3 kb называли гибридной плазмидой pCAR5. Вектор pBLUESCRIPT-KS+R с PvuII-BamHI ДНК-фрагментом длиной 1,85 kb называли гибридной плазмидой pCAR6.
Пример 5
5. Определение активности R-(-)-2.2-ДМЦПКА-гидролазы
В целях определения активности гидролазы определяли оптическую плотность взвеси микроорганизмов 0,5 при 650 нм. Средой служил фосфатный буфер (10 ммолей/л), рН 7,0, с 0,2 вес.% R,S-(±)-2,2-ДМЦПКА. Эту взвесь при встряхивании инкубировали в течение 4 часов при 30oC. Измеряли выделенный гидролазой NH4 + или R-(-)-2,2-ДМЦПКК и определяли активность в граммах R-(-)-2,2-ДМЦПКА, превращенного на л/ч/оптическую плотность при 650 нм при условии, что 1 ммоль образованного NH4 + = 1 ммолю превращенного R-(-)-2,2-ДМЦПКА.
Пример 6
Получение S-(+)-2,2-ДМЦПКА
Микроорганизм E. coli К12 с гибридной плазмидой pCAR6 в среде с минеральными солями, содержащей 0,2% (об/об) глицерина и 0,15 вес. % R, C-(±)-2,2-ДМЦПКА проявлял специфическую гидролазную активность в 1,2 г R-(-)-2,2-ДМЦПКК/л/ч/ОП650 после индукции ИПТГ. Превращение R-(-)-2,2-ДМЦПКА в R-(-)-кислоту было подтверждено выделением NH4 + и данными ГХ-анализа. Конечный продукт - S-(+)-2,2-ДМЦПКА в рацемической смеси не изменялся.
Аналогично E.coli К12 культивировали микроорганизмы, указанные в таблице 1. Результаты превращения приведены в таблице 1.
Пример 7
Тест на активность с помощью спиртов С1-4
Тест на активность проводили сначала с микроорганизмом Comamonas acidovorans А:18 при 37oC с 0,5% R,S-2,2-ДМЦПКА в 10 ммолях буфера фосфата калия при рН 7,0. Контрольные опыты проводили без растворителя, испытательные - с 5-15 об. % растворителя. Специфическую активность вычисляли аналогично методу, описанному в примере 5. Данные приведены в таблице А
В случае биотрансформации в ферментере емкостью 20 л с 2-3% R,S-2,2-ДМЦПКА (37oC, 10 ммолей, буфер - фосфат калия, рН 7,0) добавка 5-7,5 об.% метанола или этанола давала сокращение времени превращения и повышение выхода S-(+)-2,2-ДМЦПКА (повышение избирательности). Такой же эффект наблюдали у штамма E. coli XL1-Blue, содержащего ген гидролазы. Результаты опытов приведены в таблице 2.
Пример 8
Иммобилизация стереоспецифической гидролазы E.coli XL-Blu/pCAR6
Бесклеточный экстракт (288 мл) E.coli XL1-Blu/pCAR6, содержащий 28 мг белка/мл с гидролазной активностью при 37oC в 0,29 мкмоля R-(-)-2,2-ДМЦПКА/мин•мг белка подвергали предварительной очистке путем колоночной хроматографии с Q-сефарозой (фирмы Pharmacia). Для этих целей гидролазный белок с градиентом NaCl (0-1 моль/л) элюировали в буфере Трис-НСl (0,1 м, рН 7,50). Белок с гидролазной активностью, который элюировали в интервале 40-80% градиента NaCl, концентрировали ультрафильтрацией (через мембрану Amicon Membran YM10) и обессоливали гельфильтрацией (PD-10, сефадекс G-25 М, фирмы Pharmacia LKB). Конечный объем составлял 47 мл в буфере - фосфате калия (0,1 м, рН 7,0), содержащий 67 мг белка/мл с гидролазной активностью при 37oC 0,69 мкмоля R-(-)-2,2-ДМЦПКА/мин•мг белка. Затем фиксировали эту предварительно очищенную стереоспецифическую гидролазу на носителе Eupergit С (фирмы Pharma GmbH, Weiterstadt, ФРГ). Для этих целей оксирановые группы нерастворимого носителя ковалентно связывали со свободными аминогруппами гидролазного белка. Реакцию иммобилизации осуществляли в течение 90 часов при комнатной температуре в буфере - фосфате калия (1 м, рН 8,5). Получали 10,2 мг иммобилизованного белка/г влажного Eupergit С, с гидролазной активностью при 37oC 1,5 мкмоля R-(-)-2,2-ДМЦПКА/мин/г влажного Eupergit С. Стабильность иммобилизованной гидролазы при 37oC в буфере - фосфате калия (10 ммолей, pH 8,50), содержащем 0,5 вес.% R,S-(±)-2,2-ДМЦПКА, указана в таблице 3.
Пример 9
В соответствии с примером 1.3 плазмидами pCAR5 и pCAR6 трансформировали микроорганизмы: Comamonas, Acinetobacter, Pseudomonas, Rhizobium и Agrobacterium.
Пример 10
Тест на активность стереоспецифической гидролазы при определенной pH и температуре. Данные приведены в таблице Б.




Изобретение относится к генно-инженерному способу получения S-(+)2,2-диметилциклопропанкарбоксамида (S-(+)-2,2-ДМЦПКА). Последний является исходным продуктом для получения ингибитора дегидропептидазы циластатина, используемого в терапии для предотвращения дезактивации антибиотиков в почках под действием ренальной дегидропептидазы. В среду, содержащую рацемический R1S -(±)-2,2-ДМЦПКА, при рН 6-11 и температуре 15-55oС добавляется микроорганизм, трансформированный рекомбинантной плазмидной ДНК, содержащей фрагмент ДНК, кодирующий R-(-)-2,2-диметилциклопропанкарбоксамидгидролазу Comamonas, или экспрессируемую указанным микроорганизмом иммобилизованную гидролазу. Получают смесь S-(+)-2,2-ДМЦПКА и R-(-)-2,2-диметилциклопропанкарбоновой кислоты, из которой выделяют конечный продукт. Способ осуществлен с помощью нового фрагмента ДНК, кодирующего ген гидролазы Comamonas, новых гибридных рекомбинантных плазмид, содержащих эту ДНК, новых микроорганизмов -штаммов Escherichia coli DSM N 7053 и E.coli DSM N 6551, трансформированных этой рекомбинантной плазмидной ДНК pCAR6. Созданы новые штаммы микроорганизмов - продуцентов, у которых каталитическая и экспрессирующая способность гена гидролазы по сравнению с известным способом значительно выше. 6 с. и 10 з.п.ф-лы, 3 ил., 3 табл.
pBLUESCRIPT-KS+; сайты рестрикции фрагмента ДНК: Eco RI около 0,45 kb, Eco RV около 0,44 kb, Pvu II около 0 kb, Ksp I около 0,5 kb, Sma I около 0,55 kb, Pst I около 0,65 kb, Sma I около 0,73 kb, Stu I около 1,24 kb, Sma I около 1,25 kb, Pst I около 1,8 kb и Bam HI около 1,85 kb.
| УСТРОЙСТВО для УМНОЖЕНИЯ ЧАСТОТЫ | 0 |
|
SU264457A1 |
Авторы
Даты
1999-02-20—Публикация
1992-07-24—Подача