Аналогичным образом получают:
(±)-8-фтор-6,11-дигидро-5H-[1,2,4] -триазол[5,1-b] [3] бензазепин-11-ол; т.пл. 179,8oC (промежуточное соединение 7), и
(±)-9-хлор-6,11-дигидро-5H-[1,2,4] -триазол[5,1-b] [3] бензазепин-11-ол; т.пл. 138,8oC (промежуточное соединение 8).
в) Смесь промежуточного соединения (6) (0,0235 моля) и диоксида марганца (50 г) в N,N-диметилформамиде (30 мл) выдерживают при 40oC в течение 2 часов и затем перемешивают при комнатной температуре в течение ночи. Смесь фильтруют на целите и промывают метанолом. Фильтрат упаривают досуха. Остаток (10,58 г) очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH, 98/2) (35-70 мкм). Чистые фракции собирают и упаривают. Остаток (8,95 г) кристаллизуют из 2,2'-оксибиспропана, получают 7,16 г (77%) 5,6-дигидро-11H-1,2,4- триазоло-[5,1-b] [3] бензазепин-11-она (промежуточное соединение 9).
Аналогичным образом получают:
8-фтор-5,6-дигидро-11H-[1,2,4] триазол[5,1-b] [3] бензазепин-11-он; (промежуточное соединение 10); и
9-хлор-5,6-дигидро-11H-[1,2,4]триазол[5,1-b] [3] бензазепин-11-он; т.пл. 160,6oC (промежуточное соединение 11).
Пример 2
а) Смесь 1H-4,5-дигидро-бензазепин-2-амина (0,068 моля) и гидразида муравьиной кислоты (12,25 г) в метаноле (980 мл) перемешивают и нагревают с обратным холодильником в течение 72 часов. Смесь упаривают в вакууме. Остаток помещают в 5%-ный карбонат калия (150 мл) и экстрагируют метиленхлоридом. Органический слой промывают водой, сушат (MgSO4), фильтруют и упаривают. Остаток (9,9 г) очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH, 95/5). Чистые фракции собирают и упаривают, получают 8,8 г (70%) продукта. Образец (1,9 г) перекристаллизовывают из 2,2'-оксибиспропана, получают 1,6 г 6,11-дигидро-5H-1,2,4-триазол[3,4-b] [3]бензазепина; т.пл. 191,4oC (промежуточное соединение 12).
Аналогичным образом получают:
6,11-дигидро-3-фенил-5H-1,2,4-триазол[3,4-b] [3]бензазепин (промежуточное соединение 13);
6,11-дигидро-3-метил-5H-1,2,4-триазол[3,4-b] [3]бензазепин (промежуточное соединение 14); и
6,11-дигидро-3-(4-пиридинил)-5H-1,2,4-триазол[3,4-b] [3]бензазепин т.пл. 214,4oC (промежуточное соединение 15).
б) Смесь промежуточного соединения (12) (0,035 моля) и диоксида марганца (64,4 г) в N, N -диметилформамиде (220 мл) энергично перемешивают в течение 24 часов при 40oC. Горячую смесь фильтруют на целите, промывают горячим N, N-диметилформамидом и упаривают в вакууме при 80oC. Остаток растворяют в 2,2'-оксибиспропане и фильтруют. Осадок промывают 2,2'-оксибиспропаном и сушат, получают 5,8 г (83%) продукта. Образец (2,1 г) перекристаллизовывают из метанола, получают 0,92 г 5,6-дигидро-11H-1,2,4-триазол[3,4-b] [3]бензазепин-11-она; т.пл. 187,2oC (промежуточное соединение 16).
Аналогичным образом получают:
11H-1,2,4-триазол[3,4-b] [3] бензазепин-11-он (промежуточное соединение 17);
5,6-дигидро-3-фенил-11H-1,2,4-триазол[3,4-b] [3]бензазепин-11-он; т.пл. 188,3oC (промежуточное соединение 18);
5,6-дигидро-3-метил-11H-1,2,4-триазол[3,4-b] [3] бензазепин-11-он (промежуточное соединение 19); и
5,6-дигидро-3-(4-пиридинил)-11H-1,2,4-триазол[3,4-b] [3]бензазепин-11-он (промежуточное соединение 20).
Пример 3
Магниевые стружки (1,91 г) и 1,2-дибромэтан (3 капли) перемешивают в тетрагидрофуране (несколько мл). Добавляют 4-хлор-1-метилпиперидин (несколько мл) и после начала реакции добавляют по каплям 4-хлор-1-метилпиперидин (9,52 г) в тетрагидрофуране (40 мл) и смесь доводят до кипения. Смесь кипятят в течение 2 часов, затем добавляют промежуточное соединение (9) (0,036 моля) в тетрагидрофуране (90 мл) при 60oC и смесь кипятят в течение 3 часов. Смесь охлаждают, выливают в смесь хлорид аммония/лед и экстрагируют. Водный слой экстрагируют дихлорметаном и метанолом. Органический слой сушат (MgSO4), фильтруют и упаривают. Остаток (16,5 г) очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 99/5/0,05) (15 мкм). Чистые фракции собирают и упаривают, получают 4,14 г (39%) (±)-6,11-дигидро-11-(1-метил-4-пиперидинил)-5H-1,2,4-триазол[5,1-b] [3] бензазепин-11-ола (промежуточное соединение 21).
Аналогичным образом получают:
(±)-8-фтор-6,11-дигидро-11-(1-метил-4-пиперидинил)- 5H-1,2,4-триазол-[5,1-b] [3]бензазепин-11-ол (промежуточное соединение 22);
(±)-11-(1-метил-4-пиперидинил)-11H-1,2,4-триазол-[3,4-b] [3] бензазепин-11-ол (промежуточное соединение 23);
(±)-6,11-дигидро-11-(1-метил-4-пиперидинил)-5H-1,2,4- триазол-[3,4-b] [3]бензазепин-11-ол (промежуточное соединение 24);
(±)-6,11-дигидро-11-(1-метил-4-пиперидинил)-3-фенил-5H- 1,2,4-триазол-[3,4-b] [3]бензазепин-11-ол (промежуточное соединение 25);
(±)-6,11-дигидро-3-метил-11-(1-метил-4-пиперидинил)- 5H-1,2,4-триазол-[3,4-b] [3]бензазепин-11-ол (промежуточное соединение 26);
(±)-6,11-дигидро-11-(1-метил-4-пиперидинил)-3-(4-пиридинил) -5H-1,2,4-триазол-[3,4-b] [3]бензазепин-11-ол (промежуточное соединение 27);
(±)-9-хлор-6,11-дигидро-11-(1-метил-4-пиперидинил) -5H-[1,2,4] триазол[5,1-b] [3]бензазепин-11-ол (промежуточное соединение 28).
Пример 4
Смесь промежуточного соединения (5) (0,098 моля) и хлористого алюминия (65,35 г) в 1,2-дихлорэтане (400 мл) перемешивают при комнатной температуре в течение ночи. Смесь выливают в ледяную воду и подщелачивают аммиаком. Неорганическую часть фильтруют на целите и экстрагируют метиленхлоридом. Органический слой сушат (MgSO4), фильтруют и упаривают. Остаток (25 г) очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/ CH3OH/NH4OH 96/4/0,2) (15-40 мкм). Фракцию (1) собирают и упаривают. Остаток кристаллизуют из 2,2'-оксибиспропана, получают 1,33 г (4%) (±)-6,11-дигидро-7-метил-11-(1-метил-4- -пиперидинил)-5H-[1,2,4] -триазол-[5,1-b] [3]бензазепин-11-ола; т.пл. 190,8oC (промежуточное соединение 29).
Б. Приготовление конечных соединений
Пример 5
Смесь промежуточного соединения (4) (0,127 моля) и метансульфокислоты (220 мл) перемешивают и нагревают с обратным холодильником в течение ночи. Смесь охлаждают, выливают в лед, подщелачивают аммиаком и экстрагируют метиленхлоридом. Органический слой сушат (MgSO4), фильтруют и упаривают. Остаток (44,8 г) очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH от 90/10/0,5 до 80/20/0,5) (14-40 мкм). Чистые фракции собирают и упаривают. Фракцию (1) (8,8 г) перекристаллизовывают из смеси 2-бутанон/2,2'-оксибиспропан, получают 3,8 г (20%) 6,11-дигидро-8-метокси-11-(1-метил-4-пиперидинилиден)-5H-[1,2,4]- триазол[5,1-b] [3]бензазепина; т. пл. 165,5oC (соединение 1). Фракцию (2) (6 г) перекристаллизовывают из смеси метанол/2,2'-оксибиспропан, получают 5,1 г (16%) 6,11-дигидро-11-(1-метил-4-пиперидинилиден)-5H-[1,2,4] триазол-[5,1-b] - [3]бензазепин-8-ола; т.пл. 285,3oC (соединение 2).
Пример 6
Смесь промежуточного соединения (5) (0,098 моля) и хлористого алюминия (65,35 г) в 1,2-дихлорэтане (400 мл) перемешивают при комнатной температуре в течение ночи. Смесь выливают в ледяную воду и подщелачивают аммиаком. Неорганическую часть фильтруют на целите и экстрагируют метиленхлоридом. Органический слой сушат (MgSO4), фильтруют и упаривают. Остаток (25 г) очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 96/4/0,2) (15-40 мкм). Фракцию (1) собирают и упаривают. Остаток кристаллизуют из 2,2'-оксибиспропана, получают 1,33 г (4%) (±)-6,11-дигидро-7-метил-11-(1-метил-4-пиперидинил)- 5H-[1,2,4] -триазол-[5,1-b] [3]бензазепин-11-ола. Фракцию (2) собирают и упаривают. Остаток (14,2 г) перекристаллизовывают из 2,2'-оксибиспропана. получают 6,66 г (49%) 6,11-дигидро-7-метил-11-(1-метил-4-пиперидинилиден)-5H-[1,2,4] - триазол-[5,1-b] [3]бензазепина; т.пл. 150,2oC (соединение 3).
Пример 7
Смесь промежуточного соединения (28) (0,006 моля) с фосфорилхлоридом (80 мл) перемешивают при кипячении в течение 24 часов. Смесь упаривают, остаток помещают в ледяную воду с этилацетатом, подщелачивают гидроксидом натрия и экстрагируют этилацетатом. Органический слой промывают водой, сушат (MgSO4), фильтруют и упаривают досуха. Остаток очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH, 99/5/0,5). Чистые фракции собирают и упаривают, получают 1,5 г (80%). Продукт кристаллизуют из 2,2'-оксибиспропана, получают 1,04 г (55%) (±)-9-хлор-6,11-дигидро-11-(1-метил-4-пиперидинилиден)- 5H-[1,2,4] -триазол[5,1-b] [3] бензазепина; т. пл. 176,2oC (соединение 4).
Пример 8
а) Смесь промежуточного соединения (21) (0,0139 моля) с серной кислотой (40 мл) нагревают при 80oC в течение 1 часа. Смесь охлаждают, выливают в ледяную воду, подщелачивают аммиаком и экстрагируют метиленхлоридом. Органический слой сушат (MgSO4), фильтруют и упаривают. Остаток (2,28 г) очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH, от 95/5/0,1 до 90/10/0,1) (15 мкм). Чистые фракции собирают и упаривают. Остаток (1,93 г) кристаллизуют из 2,2'-оксибиспропана, получают 1,36 г (49%) 6,11-дигидро-11-(1-метил-4-пиперидинилиден)-5H-[1,2,4] - триазол-[5,1-b] [3] бензазепина; т.пл. 126,8oC (соединение 5).
Аналогичным образом получают:
8-фтор-6,11-дигидро-11-(1-метил-4-пиперидинилиден)-5H- [1,2,4] -триазол-[5,1-b] [3]бензазепин; т.пл. 146,2oC (соединение 6);
11-(1-метил-4-пиперидинилиден)-11H-1,2,4-триазол[3,4-b] [3] бензазепин; т.пл. 252,2oC (соединение 7);
6,11-дигидро-11-(1-метил-4-пиперидинилиден)-3-фенил-5H -1,2,4-триазол-[3,4-b] [3]бензазепин; т.пл. 221,2oC (соединение 9);
6,11-дигидро-3-метил-11-(1-метил-4-пиперидинилиден)- 5H-1,2,4-триазол-[3,4-b] [3]бензазепин; т.пл. 226,7oC (соединение 10); и
6,11-дигидро-11-(1-метил-4-пиперидинилиден)-3-(4-пиридинил)-5H- 1,2,4-триазол-[3,4-b] [3]бензазепин; т.пл. 239,6oC (соединение 11).
Пример 9
а) Этилхлорформиат (34,1 мл) добавляют по каплям при 80oС к раствору соединения (5) (0,0446 моля) в N,N-диэтилэтанамине (12,4 мл) и толуоле (800 мл) и смесь перемешивают и кипятят в течение 2 часов. Смесь охлаждают, выливают в воду, декантируют и экстрагируют этилацетатом. Органический слой промывают водой, сушат (MgSO4) фильтруют и упаривают. Остаток используют без дальнейшей очистки, получают 19,3 г (100%) продукта. Образец (2 г) очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 96/4/0,1) (15 мкм). Чистые фракции собирают и упаривают. Остаток кристаллизуют из смеси 2-пропанол/2,2'-оксибиспропан, получают 1 г этил-4-(5,6-дигидро-11H-[1,2,4] триазол-[5,1-b] [3] бензазепин-11-илиден)-1-пиперидинкарбоксилат; т.пл. 105,9oC (соединение 12).
Аналогичным образом получают:
этил-4-(8-фтор-5,6-дигидро-11H-[1,2,4] триазол-[5,1-b] -[3]бензазепин -11-илиден)-1-пиперидинкарбоксилат; т.пл. 118,2oC (соединение 13);
этил-4- (5,6-дигидро-7-метил-11H-[1,2,4]триазол-[5,1-b] [3]бензазепин-11-илиден)-1-пиперидинкарбоксилат; т.пл. 163,0oC (соединение 14); и
этил-4-(9-хлор-5,6-дигидро-11H-[1,2,4] триазол-[5,1-b] [3]бензазепин-11H-илиден)-1-пиперидинкарбоксилат (соединение 15).
б) Смесь соединения (12) (0,051 моля) с 48%-ным водным раствором бромистоводородной кислоты (315 мл) перемешивают и нагревают до 100oC в течение 6 часов. Смесь охлаждают, выливают в лед, подщелачивают аммиаком и экстрагируют дихлорметаном. Органический слой сушат (MgSO4), фильтруют и упаривают. Остаток (10,2 г) очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH, 93/7/0,2) (15-40 мкм). Чистые фракции собирают и упаривают, получают 9,2 г (68%) продукта. Образец (2 г) кристаллизуют из смеси 2-бутанон/2,2'-оксибиспропан, получают 1,88 г 6,11-дигидро-11-(4-пиперидинилиден)-5H-[1,2,4] триазол-[5,1-b] бензазепина, полугидрат; т.пл. 116,2oC (соединение 16).
Аналогичным образом получают:
8-фтор-6,11-дигидро-11-(4-пиперидинилиден)-5H-[1,2,4] - триазол-[5,1-b] [3]бензазепин, полугидрат; т.пл. 125,3oC (соединение 17);
9-хлор-6,11-дигидро-11-(4-пиперидинилиден)-5H-[1,2,4] - триазол-[5,1-b] [3]бензазепин оксалат (1:1); т.пл. 217,5oC (соединение 18); и
6,11-дигидро-7-метил-11-(4-пиперидинилиден-5H- [1,2,4] триазол-[5,1-b] [3]бензазепин, полугидрат; т.пл. 144,0oC (соединение 19).
Пример 10
Смесь соединения (16) (0,00751 моля), 1-(2-бромэтил)- 4-метоксибензола (0,0113 моля), иодида калия (0,125 г) и карбоната калия (2,1 г) в 4-метил-2-пентаноне (50 мл) перемешивают при температуре кипения в течение ночи. Смесь охлаждают и упаривают. Остаток растворяют в метиленхлориде. Органический слой промывают водой, сушат (MgSO4), фильтруют и упаривают. Остаток (4,5 г) очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH, от 99,5/1,5/0,2 до 98/2/0,2) (15 мкм). Чистые фракции собирают и упаривают. Остаток (2,5 г) перекристаллизовывают из смеси 2-пропанон/2,2'-оксибиспропан, получают 1,94 г (88%) 6,11-дигидро-11- [1-[2-(4-метоксифенил)этил)-4-пиперидинилиден] - 5H-[1,2,4] -триазол[5,1-b] [3] бензазепина; т.пл. 129,3oC (соединение 20).
По аналогичной методике получают:
8-фтор-6,11-дигидро-11-[1-[2-(4-метоксифенил)этил] -4- пиперидинилиден] -5H-[1,2,4]триазол-[5,1-b] [3]бензазепин; т.пл. 128,2oC (соединение 21);
6-[2-[4-(8-фтор-5,6-дигидро-11H-[1,2,4] -триазол-[5,1-b] [3]бензазепин-11-илиден)-1-пиперидинил]этил]-7-метил-5H-триазол- [3,2-a]пиримидин-5-он; т. пл. 196,2oC (соединение 22);
8-фтор-6,11-дигидро-11-[1-[2-(2-пиридинил)этил] -4-пиперидинилиден] -5Н-[1,2,4] -триазол[5,1-b] [3] бензазепина оксалат (1:2), полугидрат; т.пл. 161,7oC (соединение 23);
6-[2-[4-(8-фтор-5,6-дигидро-11H-[1,2,4] -триазол[5,1-b] [3]бензазепин-11-илиден)-1-пиперидинил] этил] -2,3- дигидро-7-метил-5H-триазол[3,2-a]пиримидин-5-он, моногидрат; т.пл. 129,7oC (соединение 24);
3-[2-[4-(8-фтор-5,6-дигидро-11H-[1,2,4] -триазол-[5,1-b] [3] бензазепин-11-илиден)-1-пиперидинил] этил]-2-метил-4H-пиридо [1,2-a]пиримидин-4-он; т.пл. 176,4oC (соединение 25);
1-[3-[4-(8-фтор-5,6-дигидро-11H-[1,2,4] -триазол- [5,1-b] [3]бензазепин-11-илиден)-1-пиперидинил]пропил] -1,3-дигидро-2H-бензимидазол-2-он, полугидрат; т.пл. 131,8oC (соединение 26);
1-этил-4-[2-[4-(8-фтор-5,6-дигидро-11H-[1,2,4]-триазол- [5,1-b] [3] бензазепин-11-илиден)-1-пиперидинил]этил]-1,4- дигидро-5H-тетразол-5-он, оксалат (2:5); т.пл. 190,0oC (соединение 27);
11-[1-[3-(4-фторфенокси)пропил] -4-пиперидинилиден] - 6,11-дигидро-6H [1,2,4]-триазол[5,1-b][3]бензазепин, оксалат (1:1); т.пл. 185,5oC (соединение 28);
(E)-8-фтор-6,11-дигидро-11-[1-(3-фенил-2-пропенил)-4- пиридинилиден] -5H-[1,2,4] -триазол[5,1-b] [3] бензазепина оксалат, (1: 1); т.пл. 212,9oC (соединение 29);
3-[2-[4-(5,6-дигидро-11H-[1,2,4] триазол [5,1-b] [3] бензазепин-11-илиден)-1-пиперидинил] этил] -2-оксазолидинона оксалат (1:1), полугидрат; т.пл. 160,2oC (соединение 30);
11-[1-(2-этоксиэтил)-4-пиперидинилиден]-6,11-дигидро-5H- [1,2,4]триазол[5,1-b] [3]бензазепин; т. пл. 99,0oC (соединение 31); и
4-(5,6-дигидро-11H-[1,2,4] триазол[5,1-b] [3] бензазепин-11-илиден)-1-пиперидинацетонитрил; т. пл, 161>5oC (соединение 32).
Пример 11
Трибромид бора (28 мл) добавляют по каплям при 0oC к раствору соединения (21) (0,00471 моля) в метиленхлориде (50 мл) и полученную смесь перемешивают при комнатной температуре в течение 24 ч. Смесь выливают в лед, подщелачивают с помощью карбоната калия и экстрагируют метиленхлоридом. Органический слой сушат (MgSO4), фильтруют и упаривают. Полученный остаток (1,8 г) очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH, 96/4/0,5) (15-40 мкм). Чистые фракции собирают и упаривают. Остаток (0,61 г) превращают в соль щавелевой кислоты (1:1) в 2-пропаноле. Получают 0,57 г (32%) 4-[2-[4-[8-фтор-5,6-дигидро-11H-[1,2,4]триазол[5,1-b] [3]бензазепин-11-илиден)-1-пиперидинил] этил] фенола оксалат (1: 1), полугидрат; т.пл. 181,2oC (соединение 33).
Пример 12
Смесь соединения (32) (0,0245 моля) в метаноле, насыщенном аммиаком (200 мл), гидрируют в течение 12 ч в аппарате Парра (комнатная температура, давление 2,96 атм (3 бара)) в присутствии никеля Ренея (7,5 г) в качестве катализатора. После поглощения водорода (2 экв.) колбу продувают азотом, катализатор отфильтровывают и упаривают фильтрат. Получают 7,3 г (96%) 4-(5,6-дигидро-11H-[1,2,4] триазол[5,1-b] [3]-бензазепин-11-илиден)-1-пиперидинэтанамина (используется на следующей стадии без дополнительной очистки) (соединение 34). Продукт очищают колоночной хроматографией на силикагеле (элюент CH2Cl2/CH3OH/NH4OH 90/10/1) (15-40 мкм). Чистые фракции собирают и упаривают. Остаток (2,7 г) превращают в соль (E)-2-бутендикислоты (1:2) и перекристаллизовывают из метанола (абс.). Получают 1,53 г 4-(5,6-дигидро-11H- -[1,2,4] триазол[5,1-b] [3] бензазепин-11-илиден)-1-пиперидинэтанамина бутендиоат (1:2), гидрат (2:5); т.пл. 184,3oC (соединение 35).
Пример 13.
Раствор 1,1'-карбонил-бис-1H-имидазола (0,028 моля) в тетрагидрофуране добавляют по каплям при комнатной температуре к раствору соединения (34) (0,00937 моля) в тетрагидрофуране и смесь перемешивают при комнатной температуре в течение 1 ч. Затем по каплям добавляют раствор метанамина (40%) (1,5 г) и полученную смесь перемешивают при комнатной температуре в течение 12 ч. Смесь упаривают и остаток экстрагируют метиленхлоридом. Органический слой промывают насыщенным водным раствором хлористого натрия, сушат (MgSO4), фильтруют и упаривают. Остаток (3,6 г) очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 92/8/0,5) (15-40 мкм). Чистые фракции собирают и упаривают, получают 2,4 г продукта. Образец продукта (1,95 г) превращают в этаноле в соль (E)-2-бутендикислоты (1:1). Получают 1,95 г (53,8%) N-[2-[4-(5,6-дигидро-11H-[1,2,4]- триазол[5,1-b] [3]бензазепин-11-илиден)-1-пиперидинил] этил] -N-метилмочевины (Е)-2-бутендиоат (1:1); т.пл. 196,3oC (соединение 36).
Пример 14
Смесь 3-фуранкарбоновой кислоты (0,00741 моля) 2-хлор-1-метилпиридинийиодида (0,00744 моля) и N,N-диэтилэтанамина (1,5 г) в метиленхлориде перемешивают при комнатной температуре в течение 1 ч, затем по каплям добавляют раствор соединения (34) (0,00743) в метиленхлориде и полученную смесь перемешивают при комнатной температуре в течение 48 ч. Смесь выливают в 5%-ный карбонат калия, экстрагируют метиленхлоридом и промывают водой. Органический слой сушат (MgSO4), фильтруют и упаривают. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH, 95/5/0,5) (15-40 мкм). Чистые фракции собирают и упаривают. Остаток (1,9 г) перекристаллизовывают из 2-бутанона, получают 1,15 г (38%) N-[2-[4-(5,6-дигидро-11H-[1,2,4]-триазол[5,1-bl [3]бензазепин-11-илиден)-1-пиперидинил]этил] -3-фуранкарбоксамида полугидрат; т.пл. 167,2oC (соединение 37).
Пример 15
Смесь соединения (34) (0,00969 моля), 2-хлорпиримидина (0,0116 моля) и карбоната калия (0,0194 моля) в N,N-диметилформамиде (100 мл) перемешивают при температуре кипения в течение 12 ч. Реакционную смесь охлаждают до комнатной температуры и экстрагируют метиленхлоридом. Отделенный органический слой промывают водой, сушат (MgSO4), фильтруют и упаривают растворитель. Остаток (3,1 г) очищают колоночной хроматографией на силикагеле (100 г, 15-40 мкм; элюент: CH2Cl2/CH3OH/NH4OH, 95/5/0,2). Чистые фракции собирают и растворитель упаривают. Остаток (1,95 г) перекристаллизовывают из 2-бутанона. Остаток отфильтровывают и сушат, получают 1,1 г (29 %) N-[2-[4-(5,8-дигидро-11H-[1,2,4] - триазол[5,1-b] [3]бензазепин-11-илиден)-1-пиперидинил] этил]- 2-пиримидинамина; т.пл. 161,5oC (соединение 38).
Пример 16
а) Метиловый эфир 2-пропеновой кислоты (0,0176 моля) добавляют по каплям к смеси соединения (17) (0,0088 моля) в метаноле (30 мл) и смесь перемешивают при температуре кипения в течение 12 ч. Смесь упаривают досуха. Остаток очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH 97/3/0,1). Чистые фракции собирают в виде масла. Получают 2,8 г (61%) продукта. Продукт в этаноле превращают в соль (E)-2-бутендикислоты (1:1). Получают 2,7 г (61%) метилового эфира 4-(8-фтор-5,6-дигидро-11H-[1,2,4]-триазол[5,1-b] [3]бензазепин-11-илиден)-1-пиперидинпропановой кислоты в виде соли (E)-2-бутендикислоты (1:1), полугидрат; т.пл. 170,6oC (соединение 39).
Аналогичным образом получен:
Метиловый эфир 4-(5,6-дигидро-11H-[1,2,4]триазол- [5,1-b] [3] бензазепин-11-илиден)-1-пиперидинпропановой кислоты в виде оксалата (2:3), полугидрат; т.пл. 144,4oC (соединение 40).
б) Смесь соединения (39) (0,0081 моля) и гидроксида калия (0,45 г) в воде (10 мл) и тетрагидрофуране (80 мл) перемешивают при комнатной температуре в течение ночи. Смесь упаривают и остаток экстрагируют метиленхлоридом. Водный слой упаривают, полученный остаток нейтрализуют 1 н. соляной кислотой и упаривают досуха. Продукт (2,05 г) перекристаллизовывают из воды, получают 1,2 г (38%) 4-(8-фтор-5,6 -дигидро-11H-[1,2,4]триазол[5,1-b] [3]бензазепин-11-илиден)-1- пиперидинпропановой кислоты, дигидрат; т. пл. 120,1oC (соединение 41).
Пример 17
При температуре 0oC пропускают через метанол оксиран (2 экв.). Приготовленную смесь по каплям добавляют к раствору соединения (16) (0,0113 моля) в метаноле и перемешивают реакционную смесь при комнатной температуре в течение 24 ч. Затем упаривают растворитель и полученный остаток экстрагируют метиленхлоридом, промывают водой, сушат (MgSO4), фильтруют и упаривают растворитель. Остаток очищают колоночной хроматографией на силикагеле (260 г, 15-40 мкм, элюент: CH2Cl2/CH3OH/NH4OH , 95/5/0,3). Чистые фракции собирают и упаривают растворитель. Остаток (2,3 г) перекристаллизовывают из 2-бутанона, осадок отфильтровывают и сушат. Получают 1,62 г (46%) 4-(5,6-дигидро-11H-[1,2.4] триазол[5,1-b] -[3] бензазепин-11-илиден)-1-пиперидинэтанола; т. пл. 153,7oC (соединение 42).
Пример 18
Смесь соединения (17) (0,01 моля), (±)-[(4-фторфенокси)метил]оксирана (0,02 моля) и карбоната калия (1,38 г), в ацетонитриле (150 мл) перемешивают при температуре кипения в течение 20 ч. Смесь фильтруют и фильтрат упаривают. Остаток в виде масла растворяют в метиленхлориде. Органический слой промывают водой, сушат (MgSO4), фильтруют и упаривают досуха. Остаток очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH, 97/3/0,1). Чистые фракции собирают и растворитель упаривают. Получают 2,6 г (57%) продукта. Продукт кристаллизуют из 1,1'-оксибисэтана, выделяют 1,7 г (33%) (±)-4-(8-фтор-5,6-дигидро-11H-[1,2,4] триазол[5,1-b] [3]бензазепин-11-илиден)-aльфа- [(4-фторфенокси)метил] -1-пиперидинэтанол; т.пл. 134,4oC (соединение 43).
Пример 19
Соединение (5) (0,00767 моля) в этаноле (200 мл) гидрируют в аппарате Парра при 50oC и давлении 2,96 атм (3 бара) в присутствии в качестве катализатора палладия на активированном угле (2,2 г) в течение 5 ч. После поглощения водорода (1 экв.) катализатор отфильтровывают через целиты и фильтрат упаривают. Полученный остаток (2,1 г) очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH, от 94/6/0,5 до 90/10/0,5). Чистые фракции собирают и растворитель упаривают. Полученный остаток кристаллизуют из 1,1'-оксибисэтана, выделяют 1,22 г (83%) (±)-6,11-дигидро-11-(1-метил-4-пиперидинил)-5H-[1,2,4] триазол [5,1-b] [3] бензазепина; т. пл. 133,8oC (соединение 44).
Пример 20
Смесь соединения (8) (0,0327 моля) и ацетата натрия (несколько г) в формальдегиде (540 мл) и уксусной кислоте (80 мл) перемешивают при 130oC в течение ночи. Смесь охлаждают и выливают в лед, подщелачивают аммиаком и экстрагируют метиленхлоридом. Органический слой промывают водой, сушат (MgSO4), фильтруют и упаривают досуха. Полученный остаток растворяют в 3 н. соляной кислоте и промывают этилацетатом. Водный слой подщелачивают 3 н. гидроксидом натрия и экстрагируют этилацетатом. Органический слой сушат (MgSO4), фильтруют и упаривают досуха. Остаток очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH, 90/10/1). Чистые фракции собирают и растворитель упаривают, получают 7,71 г (76 %). Образец продукта (2 г) перекристаллизовывают из 2-пропанола, получают 1,2 г 6,11-дигидро-11-(1-метил-4-пиперидинилиден)-5H-[1,2,4] триазол[3,4-b] [3] бензазепин-3-метанол, полугидрат; т. пл. 250,1oC (соединение 45).
В. Примеры композиций.
Следующие рецептуры являются примерами фармацевтических композиций в единичной дозирующей форме, приемлемой для системного или локального введения теплокровным животным в соответствии с настоящим изобретением.
Понятие "Активный ингредиент" (А.И.), используемый в настоящих примерах, относится к соединению формулы (I) или формулы (VII), к их фармацевтически приемлемой кислотно-аддитивной соли или его стереохимически изомерной форме.
Пример 21 - Оральные капли.
500 г А.И. растворяют при 60-80oC в 0,5 л 2-гидроксипропионовой кислоты и 1,5 л полиэтиленгликоля. После охлаждения до 30-40oC к раствору добавляют 35 л полиэтиленгликоля и смесь тщательно перемешивают. Затем добавляют раствор 1750 г сахарида натрия в 2,5 л очищенной воды и при перемешивании добавляют 2,5 л отдушки какао и необходимое количество полиэтиленгликоля до объема 50 л, получают раствор для оральных капель, содержащий 10 мг/мл А.И. Полученным раствором заполняют подходящую упаковку.
Пример 22 - Оральные растворы.
9 г Метилового эфира 4-гидроксибензойной и 1 г пропилового эфира 4-гидроксибензойной кислоты растворяют в 4 л кипящей очищенной воды. В 3 л полученного раствора растворяют 10 г 2,3-дигидроксибутандикислоты, а затем 20 г А.И. Последний раствор смешивают с оставшейся частью предыдущего раствора и 12 л 1,2,3-пропантриола и 3 л 70%-ного раствора сорбита. 40 г Сахарида натрия растворяют в 0,5 л воды и добавляют 2 мл малиновой и 2 мл крыжовниковой эссенции. Последний раствор смешивают с предыдущим, добавляют необходимое количество воды до объема 20 л, получают оральный раствор, содержащий 5 мг А. И. на чайную ложку (5 мл). Полученным раствором наполняют подходящие упаковки.
Пример 23 - Капсулы.
20 г А.И., 6 г лаурилсульфата натрия, 56 г крахмала, 56 г лактозы, 0,8 г коллоидного диоксида кремния и 1,2 г стеарата магния энергично перемешивают. Полученной смесью впоследствии наполняют 1000 подходящих твердых желатиновых капсул, при этом каждая капсула содержит по 20 мг А.И.
Пример 24 - Таблетки, покрытые пленкой
Приготовление ядра таблеток
Здесь 100 г А.И., 570 г лактозы и 200 г крахмала тщательно смешивают и затем увлажняют раствором 5 г додецилсульфата и 10 г поливинилпирролидона (Kollidon - K 90) приблизительно в 200 мл воды. Влажный порошок смеси просеивают, сушат и снова просеивают. Затем добавляют 100 г микрокристаллической целлюлозы (Avisel) и 15 г гидрированного растительного масла (Sterotex). Всю смесь тщательно перемешивают и прессуют в таблетки, получают 10000 таблеток, каждая из которых содержит 10 мг активного ингредиента.
Покрытие.
К раствору 10 г метилцеллюлозы (Methocel 60 HG) в 75 мл денатурированного этанола добавляют раствор 5 г этилцеллюлозы (Ethocel 22 cps) в 150 мл метиленхлорида. Затем добавляют 75 мл метиленхлорида и 2,5 мл 1,2,3-пропантриола. Расплавляют 10 г полиэтиленгликоля и растворяют в 75 мл метиленхлорида. Последний раствор добавляют к первому и затем добавляют 2,5 г октадеканоат магния, 5 г поливинилпирролидона и 30 мл концентрированной цветной суспензии (Opasprey K-1-2109) и всю смесь гомогенизируют. Ядра таблеток покрывают полученной смесью с помощью оборудования для нанесения покрытия.
Пример 25 - Растворы для инъекций
1,8 г Метилового эфира 4-гидроксибензойной кислоты и 0,2 г пропилового эфира 4-гидроксибензойной кислоты растворяют приблизительно в 0,5 л кипящей воды для инъекций. После охлаждения до приблизительно 50oC при перемешивании добавляют 4 г молочной кислоты, 0,05 г пропиленгликоля и 4 г А.И. Раствор охлаждают до комнатной температуры и добавляют воду для инъекций до объема 1 л, получают раствор с концентрацией 4 мг А.И. на мл. Раствор подвергают стерилизации путем фильтрации (U.S.P. XVII р. 811) и наполняют стерильные упаковки.
Пример 26 - Свечи.
Растворяют 3 г А.И. в растворе 3 г 2,3-дигидроксибутандикислоты в 25 мл полиэтиленгликоля 400. Расплавляют вместе 12 г поверхностно-активного вещества (SPAN) и триглицериды (Wetepsol 555) в количестве, необходимом для получения 300 г смеси. Последнюю смесь тщательно перемешивают с первым раствором. Полученную таким образом смесь выливают в формы при температуре 37-38oC и получают 100 свечей, каждая из которых содержит 30 мг А.И.
Новые производные триазолбензазепина общей формулы (I) и фармацевтическая антигистаминная композиция отличаются использованием в качестве активного ингредиента терапевтически эффективного количества соединения формулы (I). Соединения формулы (I) обладают антиаллергической активностью. Заявлены соединения формулы (VII), их аддитивные соли или стереохимически изомерные формы, где каждая из пунктирных линий независимо друг от друга представляет собой необязательную связь; соединения формулы (XIII). Предложены способы получения соединений формулы (I) (всего восемь). Способы позволяют получить новые ценные производные триазолбензазепина, обладающие антиаллергической активностью, позволяющие создать фармацевтические композиции на их основе для лечения аллергических заболеваний. 13 с. и 4 з.п. ф-лы.
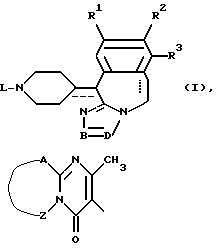
и его фармацевтически приемлемые аддитивные соли и стереохимически изомерные формы,
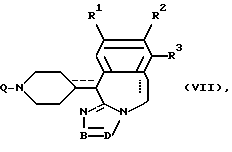
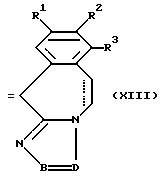
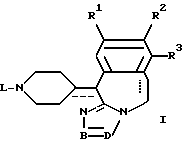
где каждая из пунктирных линий независимо друг от друга представляет собой необязательную связь;
R1 представляет собой атом водорода, атом галогена;
R2 представляет собой атом водорода, атом галогена, гидроксигруппу или C1-4-алкилоксигруппу;
R3 представляет собой атом водорода, С1-4-алкил;
фрагмент -B=D- представляет собой двухвалентный радикал формул C(R4)=N- (a-1) или -N=C(R5)- (а-2);
R4 представляет собой атом водорода;
R5 представляет собой атом водорода, C1-4 - алкил, гидрокси- C1-4 - алкил, фенил или пиридинил;
L представляет собой водород, C1-6 - алкил, C1-6 - алкил, замещенный одним из заместителей, выбираемых из группы, включающей гидроксигруппу, C1-4 -алкилоксигруппу, гидроксикарбонил, C1-4 - алкилоксикарбонил, C1-4 - алкиламинокарбониламино, фенил, замещенный гидроксилом или C1-4-алкокси, и фенокси, замещенный галогеном; C1-6-алкил, замещенный гидрокси и феноксигруппой, замещенной галогеном; C3-6-алкенил, замещенный фенилом, или остаток L представляет собой радикалы формул
-Alk - Y - Het1 (b-1)
- Alk-NH-CO-Het2 (b-2)
-Alk-Het3 (b-3)
где Alk представляет собой C1-4 - алкандиил,
Y представляет собой -NH-;
Het1 - пиримидинил;
Het2 - фуранил;
Het3 представляет собой 4,5-дигидро-5-оксо-1Н- тетразолил, замещенный C1-4 - алкилом, 2-оксо-3-оксазолидинил, 2,3-дигидро-2-оксо-1Н-бензимидазол-1-ил или радикал формулы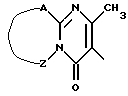
где фрагмент -A - Z - представляет собой -S-CH=CH-, -S-CH2-CH2-, -CH=CH - CH=CH-.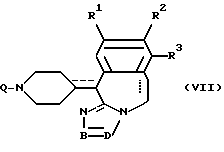
его аддитивные соли или стереохимически изомерные формы, где каждая из пунктирных линий независимо друг от друга представляет собой необязательную связь; где радикалы R1 - R3, -B = D- имеют указанные в п.1 значения, Q представляет собой C1-6-алкилоксикарбонил, C1-4-алкилкарбонил или C1-6-алкил, замещенный галогеном, циано- или аминогруппой, в качестве промежуточного продукта.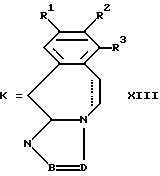
где K означает кислород или два атома водорода, а радикалы R1-R3, -B=D- имеют указанные в п. 1 значения, при условии, что исключается 11Н-1,2,4-триазол (3,4-b) (3) бензазепин, в качестве промежуточного продукта.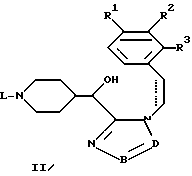
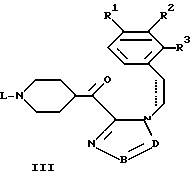
где R1-R3, L, -B = D- имеют указанные в п.1 значения,
подвергают циклизации в присутствии кислоты.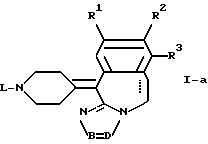
отличающийся тем, что спирт общей формулы V или VI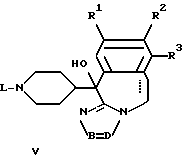
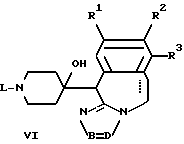
где R1-R3, L, -B = D имеют указанные в п.1 значения,
подвергают дегидратации с помощью дегидратирующего агента.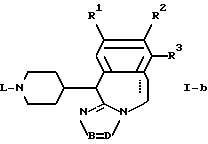
отличающийся тем, что соединение общей формулы I-a, как приведено в п. 11, подвергают каталитическому гидрированию.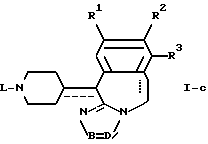
где R1-R3 и -B = D- имеют указанные в п.1 значения;
L означает C1-6-алкил или замещенный C1-6-алкил,
отличающийся тем, что соединения общей формулы I-d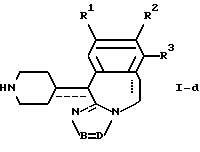
подвергают взаимодействию с соответствующим алкеном.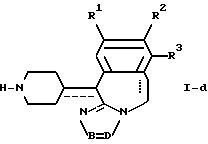
где R1-R3 и -B = D- имеют указанные в п.1 значения,
отличающийся тем, что соединение общей формулы I-c, как приведено в п. 13, подвергают взаимодействию с C1-4-алкилхлорформиатом в присутствии основания с последующим гидролизом полученного таким образом соединения формулы VII-a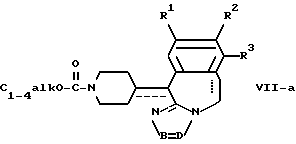
15. Способ получения производных триазолбензазепина общей формулы I-f по п.1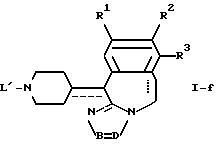
где R1-R3 и -B = D- имеют указанные в п.1 значения;
L1 имеет значения, приведенные для L в п.1, но отличное от атома водорода,
отличающийся тем, что соединение общей формулы I-d, как приведено в п. 13, подвергают N-алкилированию с помощью реагента формулы L1 - W (VIII) в инертном растворителе, необязательно в присутствии основания.
| WO 9206981, 15.04.92 | |||
| Воздухозаборное устройство челночной вакуумной установки для пневмотранспорта контейнеров | 1975 |
|
SU518435A1 |
| Способ брикетирования сланцевой мелочи | 1947 |
|
SU72029A1 |
| US 4894372, 1990 | |||
| СОЮЗНАЯ I(11ДТ?КШ-1ЕХНй1ЕСН^я1I БИБЛИОТЕКА | 0 |
|
SU299663A1 |
| US 4464300, 1984. | |||
Авторы
Даты
1999-02-27—Публикация
1993-11-25—Подача