Изобретение относится к способам получения продуктов из двух или более реагентов в реакции, предпочтительно к образованию связи между реагентами посредством нуклеиновой кислоты, имеющей способствующие свойства. Также включены в изобретение продукты, полученные способом. В особенности изобретение относится к способам для совместного выделения способствующей нуклеиновой кислоты и продукта, который образуется посредством вышеупомянутой способствующей нуклеиновой кислоты. Изобретение далее рассматривает способ для идентификации нуклеиновых кислот, имеющих способствующие свойства, и вышеупомянутые нуклеиновые кислоты.
Описание предшествующего уровня.
Способ для выделения in vitro молекул нуклеиновой кислоты с высокоспецифичным связыванием молекул мишени был разработан. Этот способ - Систематическое выделение лигандов экспоненциальным Обогащением, именуемый SELEX, был описан в заявке на патент Соединенных Штатов серийный N 07/536,428, где назывался Систематическое выделение лигандов экспоненциальным обогащением, в настоящее время отказная, в заявке на патент Соединенных Штатов серийный N 07/714,131, зарегистрированной 10 июня 1991, где назывался Лиганды нуклеиновой кислоты, в заявке на патент Соединенных Штатов серийный N 07/931,473, зарегистрированной 17 августа 1992, где назывался Лиганды нуклеиновой кислоты, сейчас в патенте Соединенных Штатов N 5,270,163 (см. также PCT/US91/04078), каждый из которых здесь специфически включен как ссылка. Каждая из этих заявок, совместно упоминаемых здесь как SELEX заявки на патент, описывает фундаментально новый метод для получения лиганда нуклеиновой кислоты к любой желаемой молекуле мишени.
Способ SELEX включает отбор из кандидатной смеси олигонуклеотидов и пошаговые итерации связывания, разделения и амплификации, используя одинаковую основную схему отбора, достигая фактически любого желаемого критерия аффинности связывания и селективности. Начиная со смеси нуклеиновых кислот, предпочтительно включающей сегменты случайно выбранной последовательности, SELEX-метод включает стадии взаимодействия смеси с мишенью при условиях, благоприятных для связывания, отделения несвязанных нуклеиновых кислот из тех нуклеиновых кислот, которые специфически связываются с молекулами мишени, диссоциации комплексов нуклеиновая кислота-мишень, амплификации нуклеиновых кислот, диссоциированных из комплексов нуклеиновая кислота-мишень для получения лиганд-обогащенной смеси нуклеиновых кислот, затем повторения стадий связывания, разделения, диссоциации и амплификации в течение стольких циклов, сколько желательно для получения высокоспецифичных, высокоаффинных лигандов нуклеиновой кислоты к целевой молекуле.
Настоящими изобретателями было указано, что SELEX-способ показывает, что нуклеиновые кислоты как химические соединения могут образовывать большое множество форм, размеров и конфигураций и обладают намного более широким репертуаром связывания и других функций, чем проявляемые ими в биологических системах.
В течение многих лет существовала догма, что нуклеиновые кислоты играют главным образом информационную роль. Посредством применения SELEX настоящими изобретателями было выяснено, что нуклеиновые кислоты имеют три пространственных структурных разновидности, не похожих на белковые. Таким образом, настоящие изобретатели показали, что SELEX или SELEX-подобные способы могут быть использованы для идентификации нуклеиновых кислот, которые могут способствовать любой выбранной реакции, в которой лиганды нуклеиновой кислоты могут быть идентифицированы для любой выбранной мишени. Теоретически внутри кандидатной смеси приблизительно от 1013 до 1018, настоящие изобретатели постулируют, что существует по крайней мере одна нуклеиновая кислота с подходящей формой, способствующая широкому ряду физических и химических взаимодействий.
Исследования на данный срок показали только несколько нуклеиновых кислот, которые имеют только узкое подмножество подходящих особенностей. Известно несколько кислот катализаторов (Cech, 1987. Science 236:1532-1539 и McCorcle и соавт., 1987. Concepts Biochem. 64:221-226). Эти встречающиеся в природе РНК ферменты (рибозимы) только, как было показано, действуют на олигонуклеотидные субстраты. Кроме того, эти молекулы показывают очень узкий диапазон химических возможностей, которые до сих пор в значительной степени представлены конденсацией/гидролизом фосфодиэфирной связи, за исключением участия РНК в биосинтезе белка. Несмотря на интенсивные недавние исследования идентификации РНК или ДНК катализаторов, показано мало успехов. Фосфодиэфирное расщепление, гидролиз аминосалициловых эфиров (Piccirilli и соавт. , 1992. Science 256: 1420-1424), лигирование олигонуклеотида с 3'ОН с 5'трифосфатным концом катализатора (Bartel и соавт. ,1993. Science 261: 1411-1418), расщепление амидной связи (Dai и соавт.,1995. Science 267:237-40), бифенильная изомеразная активность (Schultz и соавт.,1994. Science 264: 1924-1927) и полинуклеотидная киназная активность (Lorch и соавт., 1994. Nature 371: 31-36) были обнаружены. Illangasekare и соавт. (Science. 1995 267: 643-47) описали первые РНК молекулы, которые катализируют образование связи углерод-кислород. Нуклеиновые кислоты катализаторы, как известно, на данный момент имеют определенные недостатки, связанные с их эффективностями в реакциях образования/разрушения связи. Среди недостатков надо указать то, что они реагируют медленно по сравнению с белковыми ферментами, и, как описано выше, преобразуют в достаточно узком пределе химических возможностей.
Основной SELEX-способ был модифицирован для достижения ряда специфических целей. Например, заявка на патент Соединенных Штатов серийный N 07/960,093, зарегистрированная 14 октября 1992, называемая Способ для отбора нуклеиновых кислот на основе структуры, описывает использование SELEX в сочетании с гель-электрофорезом для отбора молекул нуклеиновых кислот со специфическими структурными характеристиками, таких как изогнутая ДНК. Заявка на патент Соединенных Штатов серийный N 08/123,935, зарегистрированная 17 сентября 1993, называемая Фотоселекция нуклеиновых кислот, описывает SELEX, основанный на способе отбора лигандов нуклеиновой кислоты, содержащих фотореакционные группы, способные к связыванию и/или фотосшиванию и/или фотоинактивации молекулы мишени. В соответствии с PCT/US 94/10562, зарегистрированной 19 сентября 1994, которая означает CIP заявку на патент Соединенных Штатов серийный N 08/123,935, специфически включенную как ссылка, обнаружено, что определенные последовательности нуклеиновых кислот, которые содержат 5-иодурациловые остатки, как было идентифицировано, которые ковалентно связываются с HIV-1 Rev белком. Заявка на патент Соединенных Штатов серийный N 08/134,028, зарегистрированная 7 октября 1993, называемая Высокоаффинные лиганды нуклеиновых кислот, которые различают теофиллин и кофеин, описывает способ идентификации высокоспецифичных лигандов нуклеиновых кислот, способных различать близко родственные молекулы, называемый обратный SELEX. Заявка на патент Соединенных Штатов серийный N 08/143,564, зарегистрированная 25 октября 1993, называемая Систематическая эволюция лигандов экспоненциальным обогащением: растворимый SELEX, описывает SELEX-основной способ, которым достигают высокоэффективного разделения между олигонуклеотидами, имеющими высокую и низкую аффинность к молекуле мишени. Заявка на патент Соединенных Штатов серийный N 08/400.440. зарегистрированная 8 марта 1995, называемая Систематическая эволюция лигандов экспоненциальным обогащением: химический SELEX, описывает способы для ковалентного связывания лиганда нуклеиновой кислоты с его мишенью.
SELEX-способ включает идентификацию высокоаффинных лигандов нуклеиновых кислот, содержащих модифицированные нуклеотиды, придающие улучшенные характеристики лиганду, такие как улучшенная стабильность in vivo или улучшенные характеристики подачи. Примеры таких модификаций включают химические замещения в рибозе и/или фосфате, и/или в основных положениях. SELEX-модифицированные лиганды нуклеиновых кислот, содержащие модифицированные нуклеотиды, описаны в заявке на патент Соединенных Штатов серийный N 08/l 17,991, зарегистрированной 8 сентября 1993, называемой Высокоаффинные лиганды нуклеиновых кислот, содержащие модифицированные нуклеотиды, которые описывают нуклеотиды, содержащие нуклеотидные производные, химически модифицированные по 5- и 2-положениям в пиримидинах. Заявка на патент Соединенных Штатов серийный N 08/134,028, supra, описывает высокоспецифичные лиганды нуклеиновых кислот, содержащих один или более нуклеотидов, модифицированный 2-амино(2-NH2), 2-фторо (2-F) и/или 2-O-метил (2-ОМе). Заявка на патент Соединенных Штатов серийный N 08/264,029, зарегистрированная 22 июня 1994, называемая Новый метод получения 2- модифицированных пиримидинов внутримолекулярным нуклеофильным замещением, описывает олигонуклеотиды, содержащие различные 2- модифицированные пиримидины.
SELEX-метод включает комбинирование выбранных нуклеотидов с другими выбранными нуклеотидами и ненуклеотидными функциональными единицами, как описано в патенте США 5270163. Эта заявка раскрывает комбинирование широкого множества форм и других свойств, а также амплификацию и репликативные свойства олигонуклеотидов относительно других молекул.
Недавно было сделано несколько попыток по использованию комбинаторной химии в качестве пути для создания новых лекарств. Было изобретено несколько тщательно разработанных схем для получения комбинаторных библиотек, имеющих множество различных структур. Структуры, связанные с известными комбинаторными библиотеками, включают нуклеиновые кислоты, как описано предварительно для SELEX-способа, пептиды (Brenner и соавт., 1992. PNAS 89:5381-5383; Needles и соавт., 1993. PNAS 90:10700-10704: Alper, l994.Science 264:1399-1401; Longman, 1994. In Vivo 23-31, Fodor и соавт., 1991, Science 251:767-773), и много меньшее число направлено на маленькие органические молекулы (Ohlmeyer и соавт. , 1993. PNAS 90:10922-10926). Существуют определенные недостатки, связанные с каждым из известных комбинаторных библиотечных подходов.
Во-первых, некоторые схемы, используемые для получения пептида или маленькой молекулы комбинаторных библиотек, требуют точные записывающе-запоминающие системы для сохранения пути каждого химического метода, попадающего в любую точку в множестве/матрице. Более того, пептиды и маленькие органические молекулы неамплифицируемы и поэтому относительно большие количества каждого индивидуального продукта должны быть представлены в библиотеке для возможности тестирования и идентификации желаемых продуктов. Для того чтобы получить достаточно большие количества специфических продуктов, реакции, которые составляют множество, должны быть высокоэффективны. Более важно для этих подходов в работе - это невозможность иметь смесь продуктов и побочные в одном и том же месте в множестве. Различие вырабатывается полимерной комбинацией многократных шагов, каждый из которых составляет одну реакцию с предсказанным результатом. Однако степень полимерного комбинирования ограничена выходом и записывающе-сохраняющими ограничениями.
Другое ограничение для маленьких молекул в комбинаторных подходах заключается в том, что схемы главным образом исключают реакции образования связи, в которых получают новые стереоцентры асимметрическими реакциями. В асимметрических реакциях элиминирования эти подходы не обеспечивают химического разнообразия, что может быть вызвано одиночным шагом. Часто асимметрические реакции трудно контролировать, таким образом, если бы реакции, которые образуют новые хиральные центры, были включены в комбинаторную химию, вероятно, что смеси рацемических продуктов были бы получены. Смеси рацемических продуктов могут приводить к фоновым проблемам. Например, возможно, что идеальные атомы и группы введены для сборки, но хиральность продукта является решающей для желаемых свойств, и правильный энантиомер присутствует только как маленький процент от общего количества. В этом примере вполне вероятно, что правильный энантиомер не может быть получен в количестве, достаточном для идентификации. Далее невозможно точно предсказать хиральность каждой индивидуальной реакции, когда большое множество реагентов включено в асимметрическую трансформацию. Поэтому невероятно, что трудность, связанная с рацемическими смесями, может быть преодолена традиционными способами. Усилие и время, необходимые для включения асимметрического катализа в обычные комбинаторные библиотечные подходы, главным образом недоступны. Поэтому асимметрические реакции исключены для обхождения описанных проблем.
Однако асимметрические реакции включают один из наиболее энергетических типов реакций образования связи. Отсутствие асимметрических реакций в комбинаторных библиотечных подходах значительно ограничивает типы продуктов, которые могут быть получены, и широту библиотеки. Следующий пример иллюстрирует неограниченное разнообразие, даваемое асимметрическими реакциями. Общее число возможных продуктов, получаемое из матрицы реагентов, составляет M•2n, где M= числу реагентов и n-число хиральных центров. Рассматриваем матрицу, включающую реакции образования связи, где образуется одна асимметрическая связь, число возможных продуктов увеличивается в 2 раза по сравнению с продуктом матрицы. Замечено, что для каждой образованной связи существует возможность получения двух хиральных центров, таким образом, для одного превращения число возможных комбинаций 4 или 22. Рассмотрим специфический пример асимметрической реакции, реакцию Дильса-Альдера, в которой две углерод-углеродные связи образуются, и существует возможность получения 4 хиральных центров.
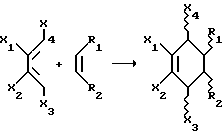
В течение реакции Дильса-Альдера относительная стехиометрия двух концов диенофильного реагента связана с двумя концами диенового реагента, поэтому число возможностей уменьшается до 23 для каждой диен/диенофил пары. Это означает, что для одного диенофила в комбинировании с 10 диенами число возможных молекул продукта, которые могут быть образованы, составляет 1•10•23= 80 (1 первичный реагент и 80 вторичных реагентов). Для достижения такого уровня разнообразия из традиционных подходов, используя только один формирующий связь шаг, потребуется прямой синтез 81 соединения. Для множества 10х10 реагентов стандартный комбинаторный подход дает 100 соединений. Расширение асимметрической реакции Дильса-Альдера множеством 10х10 реагентов дает возможность получить 800 новых соединений из начальных 20. Текущие комбинаторные стратегии не могут скринировать все возможные продукты асимметрических превращений, потому что главным образом невозможно получить каждый из желаемых продуктов. Как описано выше, удаление асимметрических реакций представляет серьезное ограничение стандартных комбинаторных библиотечных подходов.
В идеале комбинаторный библиотечный подход должен быть комплементарен SELEX-способу, где выход не имеет значения благодаря способности амплифицировать олигонуклеотидные продукты, и, кроме того, выход маленьких органических молекул, которые в основном орально активны и относительно недороги для производства. Настоящее изобретение сочетает производительность SELEX с новым подходом для получения большой, структурно разнообразной библиотеки продуктов. Подход, представленный в настоящем изобретении, покрывает многие несоответствия требованиям, связанные с другими комбинаторными библиотечными подходами и представляет революционную концепцию для будущего в открытии лекарств.
Краткое изложение сущности изобретения.
Настоящее изобретение представляет библиотеки продуктов, которые выделяют одновременно с соответствующим помощником нуклеиновой кислотой, требуемой для получения каждого члена библиотеки из одного или более химических реагентов. Более важно, что продукты, которые могут быть идентифицированы из библиотеки продуктов, имеют заранее определенные желательные характеристики. Этот способ, упоминаемый здесь как параллельный SELEX, означает SELEX-подобный способ, который используют для получения такой библиотеки продуктов и затем для идентификации продуктов с желательными характеристиками. Как и в SELEX способе, представлена огромная, разнообразная тестируемая смесь нуклеиновых кислот. Каждая нуклеиновая кислота связана с определенным химическим реагентом. Изобретение основано на предположении, что в довольно большой библиотеке нуклеиновых кислот можно идентифицировать нуклеиновые кислоты в тестируемой смеси нуклеиновых кислот посредством проведения химической реакции между химическим реагентом, присоединенным к нуклеиновой кислоте, и свободным химическим реагентом. Кроме того, среди подмножества нуклеиновых кислот, способных к проведению химической реакции, существует несколько высокоспецифичных для получения каждого или значительной доли всех возможных продуктов. Более того, библиотека продуктов может содержать по крайней мере несколько из всех возможных продуктов для данной реакции. Нуклеиновая кислота обеспечивает способствующую специфичность для продукта, и продукт в свою очередь обеспечивает специфичность для заранее определенного желаемого действия на мишень.
Параллельный SELEX облегчает многие недостатки предшествующих комбинаторных библиотечных подходов. В своей наиболее основной форме параллельный SELEX включает образование библиотеки продуктов взаимодействием двух или более реагентов, где один реагент, связанный с нуклеиновой кислотой, способен к образованию промежуточной связи, выбор продукта, имеющего заранее определенные желаемые характеристики, и идентификацию продукта, используя энергию способа SELEX для амплификации. Схематическое изображение способа, параллельного SELEX представлено на фиг. 1.
Изобретение представляет способ для идентификации желаемого продукта из библиотеки продуктов, где вышеупомянутый желаемый продукт выбран по его способности преобразовывать заранее выбранную функцию мишени, вышеупомянутый способ включает: получение тестируемой смеси нуклеиновая кислота-реагент, включающей нуклеиновые кислоты, которые имеют ряд случайных полученных последовательностей, и каждая связана с первым реагентом; реакция вышеупомянутой тестируемой смеси нуклеиновая кислота-реагент со свободным реагентом для образования библиотеки продуктов, включающей нуклеиновые кислоты, связанные с продуктом, полученным реакцией вышеупомянутых первого и свободного реагентов; и разделение компонентов вышеупомянутой библиотеки продуктов, основанное на их сравнительной способности преобразовывать вышеупомянутую заранее выбранную функцию, посредством чего желаемые продукты могут быть идентифицированы.
Изобретение представляет библиотеку продуктов, которые являются результатом реакции между по крайней мере связанным реагентом и свободным реагентом, где вышеупомянутый связанный реагент связывается с нуклеиновой кислотой, что помогает реакции между вышеупомянутыми реагентами.
Параллельный SELEX не требует сохранения трэка матрицы продуктов и по отношению к химии также не требует высокоэффективной или скоростной реакций. Это достоинство связано с тем, что образование продукта направляется специфическими нуклеиновыми кислотами. Этот направленный подход контрастирует с кодированным подходом, используемым другими комбинаторными библиотечными подходами. Нуклеиновая кислота, которая особенно удобна для образования желаемого продукта, может быть легко амплифицирована, и продукт достоверно воспроизводится в последующих циклах производства. Этот способ позволяет изначально случаться множеству реакций, которые можно рассортировать позже, это определяет, что продукты, которые показывают заранее определенные характеристики, могут быть получены. Этим способом продукты могут быть выделены при отсутствии подробной структурной информации.
Параллельный SELEX может включать образование библиотек продуктов, используя асимметрические реакции. В отличие от традиционных комбинаторных библиотечных подходов, даже если невозможно предсказать стереохимический выход в начале реакции, асимметрические реакции могут быть включены. Специфическая химия, не имеющая намеченного пути, для параллельного SELEX является эффективной. Есть только одно требование - нуклеиновая кислота принимает участие в по крайней мере ограниченном подмножестве общего числа возможных реакций.
В другом воплощении представляются способствующие нуклеиновые кислоты. Нуклеиновые кислоты, имеющие способствующие свойства, способны к проведению химических реакций связывания, таких как образование связи или разрыв связи. Нуклеиновые кислоты могут быть модифицированы различными путями для включения других химических групп, которые обеспечивают дополнительный заряд, поляризацию, водородные связи, электростатическое взаимодействие и подвижность, которые присутствуют в химической реакционной среде. Другие химические группы могут включать, inter alia, алкильные группы, аминокислотные цепи, различные кофакторы и металлоорганические части. Изобретение требует, чтобы способствующие нуклеиновые кислоты направляли синтез продуктов, которые имеют заранее определенные желаемые характеристики.
В изобретение включены фармацевтические соединения, содержащие изобретенные продукты и методы назначения соединений. Также включены диагностические реагенты, сельскохозяйственные соединения и промышленные соединения, содержащие изобретенные продукты.
Краткое описание чертежей.
Фиг. 1 изображает схематическое представление процесса, параллельного SELEX в его наиболее основной форме.
Фиг. 2 изображает схематическое представление процесса, параллельного SELEX, где способствующая нуклеиновая кислота принимает участие в общей реакции Дильса-Альдера между диеном и диенофилом.
Фиг. 3 изображает, как лигированные последовательности могут быть использованы для расширения множества вторичных молекул реагентов в параллельном SELEX. Фиг. 3A-E изображает пять из возможных 16,384 вероятностей, соответствующих фиг. 2.
Фиг. 4 изображает схематическое представление процесса параллельного SELEX, где способствующая нуклеиновая кислота принимает участие в общем образовании связи реакцией альдольной конденсации между кетоном и альдегидом.
Фиг. 5A-C изображает влияние смешанной альдольной реакции, описанной на фиг. 4, на структурное разнообразие продуктов. Фиг. 5A изображает реагенты. Фиг. 5B изображает диастереомеры, образованные когда A является нуклеофилом и B является электрофилом. Только диастереомеры показаны, и каждая структура может иметь еще соответствующий энантиомер.
Фиг. 6A изображает циклотримеризацию трех алкинов с выходом замещенного бензольного кольца. Фиг. 6B изображает матрицу вероятностей для сообщества бензольных соединений при циклотримеризации трех алкинов, изображенных на фиг. 6A. Фиг. 6C изображает механизм циклотримеризации алкинов. Только один из возможных продуктов показан.
Фиг. 7 изображает возможную стратегию для ретросинтеза типичного продукта изобретения.
Подробное описание изобретения.
Параллельный SELEX представляет библиотеки продуктов, которые образованы соединением пула первых химических реагентов, связанных с нуклеиновой кислотой, с пулом свободных химических реагентов. Связанная нуклеиновая кислота способна к химическим реакциям связывания, которые приводят к библиотеке продуктов, и далее нуклеиновая кислота амплифицируется, таким образом, можно повысить содержание продукта, который имеет заранее выбранные свойства, и выделить его из библиотеки продуктов.
В своем общем виде параллельный SELEX может быть описан на фиг. 1. Тестируемая смесь нуклеиновая кислота-реагент, образуется при воздействии первого реагента (R) на каждую из нуклеиновых кислот в тестируемой смеси (содержащей от 102 до 1018 нуклеиновых кислот со случайными последовательностями). Тестируемая смесь нуклеиновая кислота-реагент обрабатывается свободными реагентами (обозначаемыми как треугольник, пятиугольник и шестиугольник), которые могут связываться с первым реагентом (R) с образованием различных продуктов. Важно заметить, что в тестируемой смеси нуклеиновых кислот (NA) отдельные последовательности нуклеиновых кислот могут быть ассоциированы для облегчения образования различных продуктов с определенной формой, обозначаются как последовательность-A, последовательность-B, последовательность-C на фиг. 1. Продукты могут различаться по форме, реакционной способности или по форме и реакционной способности вместе. Отделение желаемого продукта по форме или реакционной способности осуществляется связыванием или реакцией с мишенью. Белки, маленькие молекулы, липиды, сахариды и т.д. являются примерами мишени (Т). После связывания или реакции с мишенью непрореагировавшие продукты, которые связаны с последовательностью-В и последовательностью-С как показано на фиг. 1, отделяются от последовательности-A и отбрасываются. Последовательность A нуклеиновой кислоты затем амплифицируют рядом известных способов. Последовательность A затем используют для сообщества желаемого продукта для облегчения специфической реакции по образованию выбранного продукта и реагента при обработке смеси начальных реагентов. В типичной реакции последовательность А может быть снова обработана первым реагентом, однако вышеупомянутое повторное воздействие не всегда требуется. Это идеализированный случай и во многих примерах помощник нуклеиновая кислота может сообщаться более чем с одним продуктом из начальной смеси, но все выбранные продукты будут иметь желаемые свойства связывания или химического реагирования с мишенью.
I. Определения.
Определенные термины, использованные здесь для описания изобретения, объясняются следующим образом:
"Нуклеиновая кислота" означает или ДНК, РНК одноцепочечную или двухцепочечную и любые их химические модификации. Модификации включают, но этим не ограничиваются, те, которые обеспечиваются другими химическими группами, которые вносят дополнительный заряд, поляризацию, водородное связывание, электростатическое взаимодействие и подвижность в индивидуальные нуклеиновые основания или нуклеиновую кислоту в целом. Такие модификации включают, но этим не ограничиваются, модифицированные основания, такие как модифицированные основания по 2'-положению, пиримидиновые модификации по 5-положению, пуриновые модификации по 8-положению, модификации по цитозиновому экзоциклическому амину, замещение 5-бромурацила; модификации остова, метилирование, неканонические взаимодействия нуклеотидов, таких как, например, изооснований - изоцитидина и изогуанидина и т.д. Модификации могут также включать 3'- и 5'- модификации, такие как кэпирование. Модификации, которые появляются после каждого цикла амплификации, также соответствуют этому изобретению. Постамплификационные модификации могут быть обратимо или необратимо добавлены после каждого цикла амплификации. В сущности любую модификацию нуклеиновой кислоты рассматривают этим изобретением. Длина случайного сегмента нуклеиновой кислоты в основном между 8 и 250 нуклеотидами, предпочтительно между 8 и 160 нуклеотидами.
"Тестируемая смесь нуклеиновых кислот" является смесью нуклеиновых кислот различных случайных последовательностей, включая несколько, имеющих форму, которая дает им возможность содействовать образованию и/или разрушению химических связей. Источником "тестируемой смеси нуклеиновых кислот" могут быть встречающиеся в природе нуклеиновые кислоты или даже фрагменты, химически синтезированные нуклеиновые кислоты, энзиматически синтезированные нуклеиновые кислоты или нуклеиновые кислоты, полученные комбинированием предшествующих технологий. В предпочтительном виде каждая нуклеиновая кислота имеет фиксированные последовательности вокруг случайного района для облегчения амплификационного процесса.
"Нуклеиновая кислота, имеющая способствующие свойства", или "способствующая нуклеиновая кислота", или "облегчающая нуклеиновая кислота", или "помощник нуклеиновая кислота" относится к нуклеиновой кислоте, которая способна к проведению или облегчению химической реакции. Химическая реакция может быть связь-образующая или связь-разрушающая. Предпочтительные представления этого изобретения направлены в сторону связь-образующих реакций. Нуклеиновая кислота не нуждается особо в показе каталитической стороны для объяснения имеющихся способствующих свойств. Сворачивание способствующих нуклеиновых кислот такое, что их трехмерная структура способствует специфической химической реакции. Нуклеиновая кислота может проводить химическую реакцию или самостоятельно, в комбинации с другой каталитической частью, связанной непосредственно с нуклеиновой кислотой, или в комбинации с другой каталитической частью, которая может находиться в растворе. Другие каталитические части могут включать металлоорганические части, ионы металлов и т.д. Нуклеиновая кислота может вызывать образование различных стереоизомеров. Нуклеиновая кислота может участвовать в образовании или разрыве связей различных типов, включая, но не ограничиваясь этим, реакции конденсации/гидролиза, циклообразующие реакции (такие как реакция Дильса-Альдера, реакция Ене и 1,3-диполярная реакция), конъюгирование α,β- ненасыщенных соединений, альдольные конденсации, реакцию Кляйзена, гликозилирование пептидов, сахаров и липидов. Дополнительно, когда модификация нуклеиновой кислоты включает металлоорганическую часть, другие реакции могут появиться, которые будут давать симметрические или асимметрические продукты, включая, но не ограничиваясь этим, циклопропанирование, эпоксидирование, азридинирование, гидрогенирование, циклотримеризацию алкинов [3+2] и [4+1] циклоприсоединение ненасыщенных молекул и олефиновую реакцию обмена.
"Реагент" относится к любому химическому представителю, который может быть включен в связь-образующую или связь-разрушающую реакцию, который похож по термической и химической стабильности с нуклеиновыми кислотами, включая модификации, описанные выше. Термин "реагент" может относится к одному химическому представителю или к классу химических соединений, включая несколько реагентов некоторых общих химических структур или несколько реагентов различных химических структур. Реагент обычно имеет молекулярный вес в пределах от 2 до 1000, предпочтительно от 26 до 500. Особенно предпочтительные реагенты включают маленькие органические молекулы, такие как алкены, алкины, спирты, альдегиды, кетоны, сложные эфиры, карбоновые кислоты, ароматические карбоциклы, гетероциклы, диены, тиолы, сульфиды, дисульфиды, эпоксиды, сложные эфиры, амины, имины, фосфаты, амиды, тиоэфиры, сульфонаты и галогенированные соединения. Неорганические реагенты также рассматриваются этим изобретением. Однако в некоторых проявлениях изобретения и более крупные реагенты могут быть включены, такие как полимеры или белки. Выбор использованного химического реагента может быть случайным или основанным на ряде критериев, включая природу желаемого продукта, активность продукта, которую предполагается иметь, или информация основана на природе мишени, на которую предполагают действовать.
"Связанный реагент", или "первый реагент", или "первый химический реагент" относится к тем реагентам, которые связаны с нуклеиновой кислотой для образования тестируемой смеси нуклеиновая кислота-реагент. Связывание первого реагента с нуклеиновой кислотой может быть или ковалентным или нековалентным. Первый химический реагент может быть одиночным химическим представителем или классом химических молекул, включая несколько реагентов различных основных химических структур. Например, первый реагент может быть одним алкеном (например, 1-пропен), или 10 различными алкенами и 10 различными алкинами.
"Свободный реагент", или "второй реагент", или "свободный химический реагент" относится к тем реагентам, которые не связаны нуклеиновой кислотой. Свободные реагенты могут быть одинаковыми или отличными друг от друга или от связанного реагента. Например, свободный реагент может быть одним алкеном (например, 1-пропен), или 10 различными алкенами и 10 различными алкинами.
"Тестируемая смесь нуклеиновая кислота-реагент" соответствует смеси нуклеиновых кислот, каждая из которых связана с первым химическим реагентом. Связывание может быть ковалентным иди нековалентным, прямым или с линкером между нуклеиновой кислотой и реагентом. Тестируемая смесь нуклеиновая кислота-реагент взаимодействует с пулом свободных химических реагентов, что дает возможность получить библиотеку продуктов.
"Продукт" соответствует соединению, получающемуся из связь-образующей или связь-разрывающей реакции между одним или более реагентов, которой способствует нуклеиновая кислота. В предпочтительном виде продукт обычно формируют между связанным реагентом и свободным реагентом. Два реагента, которые реагируют с образованием продукта, необязательно должны быть различными химическими структурами. Предпочтительные продукты этого изобретения означают маленькие органические молекулы, которые могут быть медицински активны и показывать терапевтический эффект, или быть полезными как диагностические средства, или сельскохозяйственные средства. Обычно молекулярный вес находится в пределе от 40 до 2000, предпочтительно от 100 до 1000. Однако в определенных менее предпочтительных воплощениях продукты могут быть более крупными молекулами, которые представлены пептидами, белками, полимерами и т.д. В определенных менее предпочтительных воплощениях реакция означает реакцию связь-разрывающую и может происходить только со связанным реагентом или между двумя и более реагентами.
"Библиотека продуктов" соответствует набору продуктов, полученных химической реакцией между реагентом, связанным со способствующей нуклеиновой кислотой и предпочтительно по крайней мере с одним свободным реагентом. Благодаря природе изобретения библиотека продуктов может содержать много разнообразных продуктов различающихся химических структур.
"Продукт, способный изменять заранее выбранную функцию мишени", или "продукт, имеющий заранее определенную характеристику", или "желаемый продукт" означает продукт, который действует на мишень заранее выбранным желательным образом. Примеры заранее выбранных желательных действий на мишень включают, но не ограничиваются этим, связывание мишени, каталитическое изменение мишени, реакцию с мишенью таким образом, чтобы модифицировать/изменить мишень или функциональную активность мишени, ковалентное воздействие на мишень в качестве суицидного ингибитора, способствующего реакции между мишенью и другой молекулой. В качестве одного примера в библиотеке продуктов продукт, имеющий заранее определенную характеристику, которая означает связывание мишени с большей аффинностью, чем у большей части окружения. В любой данной библиотеке продуктов может существовать более чем один продукт, имеющий заранее определенную характеристику для данной мишени. Продукты, имеющие заранее определенные характеристики, могут отличаться друг от друга по своей аффинности связывания с мишенью или по их другим свойствам действия на мишень.
"Мишень" означает любое соединение, на которое продукт, идентифицированный способом параллельного SELEX, может действовать заранее выбранным желательным способом. Молекула мишени может быть белком, пептидом, полисахаридом, гликопротеином, гормоном, рецептором, антигеном, антителом, вирусом, субстратом, метаболитом, аналогом переходного состояния, кофактором, ингибитором, лекарством, красителем, питательным веществом, фактором роста, клеткой, тканью и т.д., без ограничений.
"Разделение" означает любой процесс, в котором члены тестируемой смеси нуклеиновых кислот или тестируемой смеси нуклеиновая кислотa-реагент могут быть отделены от большей части тестируемой смеси, основанный на способности нуклеиновой кислоты способствовать реакции, включающей связанный реагент, давая желательный продукт. Разделение может быть проведено различными известными способами. Связывание фильтром, аффинная хроматография, жидко-жидкостное разделение, фильтрация, перемещение в геле, центрифугирование в градиенте плотности, разделение по молекулярному весу на фильтре, гель-фильтрационная хроматография, гель-фильтрационное мембранное разделение и изоэлектрическое фокусирование представляют примеры подходящих методов разделения. Выбор метода разделения может зависеть от свойств мишени и продукта, и может быть проведен согласно известным принципам и свойствам.
Дополнительно это может быть желательная начальная стадия разделения между нуклеиновыми кислотами, которые связаны с продуктом (и, кроме того, способствующими нуклеиновыми кислотами), от тех, которые ассоциированы только с одним реагентом (способствующие нуклеиновые кислоты). Эта стадия разделения может быть проведена различными известными методами, например, гель-фильтрацией, аффинной хроматографией. После такой стадии разделения тестируемая смесь нуклеиновой кислоты будет обогащена способствующими нуклеиновыми кислотами.
"Амплифицирование" означает любой процесс или комбинацию стадий процесса, которые увеличивают количество или число копий молекулы или класса молекул. В предпочтительных проявлениях амплификация происходит после того, как компоненты тестируемой смеси разделились, и амплифицируется способствующая нуклеиновая кислота, ассоциированная с желаемым продуктом. Например, амплифицирование молекул РНК может быть проведено последовательностью из трех реакций: получение кДНК копий, выбранных РНК, использование полимеразной цепной реакции для увеличения числа копий каждой кДНК, и транскрибирование кДНК копий для получения РНК молекул, имеющих такие же последовательности, как выбранные РНК. Любые известные реакции и комбинация реакций могут быть использованы как подходящие, включая прямую репликацию ДНК, прямую амплификацию РНК и т.д. Способ амплификации должен приводить к пропорциям в амплифицированной смеси, причем существенно более представительным пропорциям различных последовательностей в смеси, чем до амплификации. Известно, что многие модификации нуклеиновых кислот совместимы с ферментной амплификацией. Модификации, которые не совместимы с амплификацией, могут быть получены после каждого цикла амплификации, если необходимо.
"Случайно полученный" означает термин, используемый для описания фрагмента нуклеиновой кислоты, имеющего в принципе любую последовательность на данной длине. Случайно полученные последовательности могут быть различной длины, желательно в пределах от 8 и более чем одна сотня нуклеотидов. Химические или ферментативные реакции, которыми получают фрагменты случайных последовательностей, не могут давать математически случайные последовательности благодаря неизвестным отклонениям или нуклеотидным предпочтениям, которые могут существовать. Термин "случайно полученный" используют в отличие от "случайный" для отражения возможности таких отклонений от неидеальности. В известных в настоящее время методиках, например в последовательном химическом синтезе, неизвестно, появляются ли большие отклонения. Для коротких фрагментов из 20 нуклеотидов или меньше любое минорное отклонение, которое может существовать, имеет несущественное значение. Чем длиннее последовательности одного синтеза, тем больше эффект от любого отклонения.
Отклонение может быть умышленно введено в случайно полученную последовательность, например, изменением молярного соотношения предшественника нуклеозид (дезоксинуклеозид) трифосфатов в реакции синтеза. Умышленное отклонение может быть желательно, например, для влияния на вторичную структуру, для введения отклонения прямо известными молекулами, имеющими подходящую активность, для введения определенных структурных характеристик, или основывается на предыдущих результатах.
SELEX-методология включает комбинирование выбора лигандов нуклеиновой кислоты, которые взаимодействуют с мишенью желательным образом, например связывание с белком, с амплификацией этих выбранных нуклеиновых кислот. Итерационное повторение шагов выбор/амплификация позволяет выбрать одну или небольшое число нуклеиновых кислот, которые наиболее сильно взаимодействуют с мишенью из пула, который содержит большое число нуклеиновых кислот. Повторение процедуры выбор/амплификация продолжают, пока заданная цель не будет достигнута. В настоящем изобретении методология SELEX используется для амплификации нуклеиновой кислоты, связанной с желаемым продуктом.
"Параллельный SELEX" означает способ, в котором нуклеиновые кислоты в тестируемой смеси нуклеиновых кислот связаны с химическим реагентом, который затем связывается с пулом других свободных химических реагентов при условиях наибольшего благоприятствования для получения библиотеки продуктов. Библиотеку продуктов скринируют для идентификации продуктов, имеющих заранее определенные желательные свойства. Продукт можно тестировать по его способности действовать на данную мишень заранее определенным образом (например, связываться с мишенью, модифицировать мишень некоторым образом и т.д.). Желательные продукты могут быть затем отделены от нежелательных продуктов. Желательный продукт остается связанным со способствующей нуклеиновой кислотой, которая направляла его синтез. Способствующая нуклеиновая кислота может быть удалена из остатка пула и амплифицирована, как описано в способе SELEX. Амплифицированные нуклеиновые кислоты обогащены нуклеиновыми кислотами, которые способны к накоплению желаемых продуктов. Амплифицированные нуклеиновые кислоты затем повторно соединяют с первым реагентом, реконтактируют со свободными реагентами и, итерационно повторяя шаги выбор/амплификация процесса SELEX, включают в синтез, выбор и идентификацию желаемых продуктов. Выбранные нуклеиновые в конечном счете производят достаточное число желаемого продукта, чтобы можно было определить структуру.
II. Реакция.
A. Нуклеиновая кислота.
Параллельный SELEX зависит от способности нуклеиновой кислоты участвовать в образовании продукта. Способ требует предварительного получения тестируемой смеси нуклеиновой кислоты. В основном объяснение и способы для получения тестируемой смеси нуклеиновой кислоты описаны в SELEX в заявках на патент, описанных ранее, которые здесь приведены ссылками. Кратко готовят тестируемую смесь нуклеиновых кислот различных последовательностей. Каждая нуклеиновая кислота в тестируемой смеси в основном включает районы с фиксированными последовательностями (т.е. каждый из компонентов тестируемой смеси содержит одинаковые последовательности в одинаковых местах) и районы со случайно полученными последовательностями. Фиксированные районы последовательности выбирают или: (а) с помощью амплификационных шагов, описанных детально в SELEX-патентах, (b) имитируют известную последовательность для участия в реакции или (с) увеличением концентрации нуклеиновой кислоты данного структурного окружения в тестируемой смеси. Случайно полученные последовательности могут быть полностью случайно получены (т.е. вероятность нахождения основания в любой позиции равна один к четырем) или частично случайно получены (т. е. вероятность нахождения основания в любой позиции может быть любого уровня между 0 и 100%). Обнаруженные нуклеиновые кислоты в тестируемой смеси нуклеиновых кислот могут включать способность правильного сворачивания для того, чтобы проводить различные химические реакции.
Тестируемая смесь нуклеиновых кислот может быть модифицирована различными путями для усиления вероятности нуклеиновых кислот, имеющих способствующие свойства. Модификации, рассматриваемые изобретением, означают любые модификации, которые вводят другие химические группы, дающие правильный заряд, поляризацию, водородное связывание, электростатическое взаимодействие или подвижность и, более того, могут придавать необходимую форму для выполнения реакции. Не желая ограничения какой-либо теорией, предполагают, что механизм для выполнения реакции может включать, но не ограничиваться этим, стабилизацию переходного состояния реакции, способствование специфическим химическим реакциям и связывание свободного реагента способом, который приводит его в тесное взаимодействие со связанным реагентом без ограничений. Модификации, которые могут увеличивать активный участок нуклеиновой кислоты, включают гидрофильные части, гидрофобные части, атомы металла в различных степенях окисления, жесткие структуры, функциональные группы, найденные в белковых ферментных активных сайтах, такие как имидазолы, первичные спирты, карбоксилаты, гуанидиновые группы, аминогруппы, тиолы и подобные. Дополнительно металлоорганические и металлонеорганические катализаторы могут быть включены как другая химическая группа нуклеиновой кислоты, как возможные окислительно-восстановительные реагенты.
Индивидуальные компоненты тестируемой смеси нуклеиновых кислот могут быть модифицированы различными путями. Подходящие модификации включают, но не ограничиваются этим, модификации каждого остатка нуклеиновых кислот, случайных остатков, всех пиримидинов или пуринов или всех специфических оснований (т. е. G, C, A, T или U) или одну модификацию на нуклеиновую кислоту. Также признано, что определенные молекулы (например, металлические катализаторы и т.д.) могут быть в растворе, не воздействуя на нуклеиновую кислоту, и использоваться в проведении реакции во взаимодействии с посредническим действием нуклеиновой кислоты. Предполагают, что то, как долго нуклеиновая кислота связана с первым химическим реагентом, означает некоторый путь, связанный с проведением химической реакции, по которому метод и продукты попадают в пределы этого изобретения. Также установлено, что модификация не является предпосылкой для способствующей активности нуклеиновых кислот в изобретении.
При некоторых обстоятельствах может быть желателен предварительный отбор для нуклеиновых кислот, которые связываются с мишенью. В этом случае случайный пул нуклеиновых кислот подвергают нескольким циклам (1-10) SELEX против молекулы мишени перед тем, как реагент соединят с пулом нуклеиновых кислот.
i. Модифицирование нуклеотидов другими химическими группами.
Нуклеотиды могут быть модифицированы любым числом путей, включая модификации положений в рибозе и/или фосфате, и/или основании. Определенные модификации описаны в соответствующих US заявках на патент N 08/117,991, называемых "Высокоаффинные лиганды нуклеиновых кислот, содержащие модифицированные нуклеотиды" и N 08/076.735 "Способ для катализируемого палладием углерод-углеродного связывания и продукты", которые здесь приводятся как ссылки. В одном случае модификации, это когда другой химической группой воздействуют на 5-положение пиримидина, 8-положение пурина или 2'-положение сахара. Нет ограничения на тип другой химической группы, которая может быть присоединена на индивидуальные нуклеотиды. В предпочтительных случаях уже модифицированный нуклеотид амплифицируют или можно модифицировать последовательно на амплификационных стадиях.
Как пример, который не ограничивает изобретение в любом направлении, можно рассмотреть биомиметическую способствующую нуклеиновую кислоту. Выбор модификации нуклеиновых кислот включает модификацию, которая должна сделать определенные основания способными походить на белки в их химических и физических свойствах. Определенные модификации пиримидиновых и пуриновых нуклеотидных оснований могут быть сделаны для придания нуклеиновой кислоте появления "участков цепи", похожих на аминокислотные участки цепи белков. Несколько синтетических методов пригодны для воздействия другими химическими группами, в этом случае аминокислотными производными на 5-положение пиримидина или 8-положение пурина. Методы для модификации пиримидинов в 5-положение могут быть описаны в заявках на US патент 08/076,735, 08/347,600 и 08/458,421 так же хорошо, как другие опубликованные процедуры. Множество опубликованных процедур известны для модифицирования нуклеиновых кислот, включая, но не ограничиваясь этим, следующие Limbach, PA, et al., 1994. Nucleic Acids Res. 22:2183-2196 и ссылки, приведенные здесь; Hayakawa H, et al., 1985. Tetrahedron 41:1675-83; Crouch GJ et.al., 1994. Nucleosides Nucleotides 13:939-44; Scheit KH, 1996. Chem.Ber. 99:3884; Bergstrom DE et al.,1975. J.Am.Chem.Soc. 98:1587-89; Bergstrom DE et al.,1978, J.Am.Soc. 100:8106-12; Bergstrom DE et al. , 1978, J. Org.Chem. 43:2870; Bergstrom DE et al.,1981, J.Org.Chem. 46: 1432-41; Bergstrom DE. 1982. Nucleosides Nucleotides 1:1-34; Crisp GT et al. , 1990. Tetrahedron Lett. 31:1347-50; HobbsFWJr. 1989. J. Org. Chem. 54: 3420-22; Hirota К et al., 1993. Synthesis 213-5; Nagamachi T et al.,1974. J. Med.Chem. 17:403-6; Barton DHR et al.,1979. Tetrahedron lett. 279-80; Hirota К et al., 1992.J.Org.Chem. 57:5268; Mamos P et al., 1992. Tetrahedron Lett. 33: 2413-16; Sessler JL et al.,1990. J.Am.Chem.Soc. 115:10418-19; Long RA et al. , 1967. J.Org.Chem. 32:2751-56; Prakash TP et al.,1993. Tetrahedron 49: 4035; Janokowski AJ et al.,1989. Nucleosides Nucleotides 8:339; Norris AR et al. , 1984. J.Inorg.Biochem. 22:11-20; Moffat JG. 1979. in Nucleoside Analogues, eds. RT Walker, E De Clercq, F Eckstein pp. 71-163 New York:Plenum Press; Townsend LB.1988. Chemystry of Nucleosides and Nucleotides pp.59-67 New York: Plenum Press; Verheyden JPH et al., 1971. J.Org.Chem. -36:250-54; Wagner D. et al. ,1972. J.Org.Chem. 37:1876-78; Sproat BS et al.,1991. In Oligonuceotides and Analogues A Practical Approach, ed. F.Eckstein pp.49-86. New York: Oxford University Press; Lesnik et al., 1993. Biochemistry 32: 7832-38: Sproat BS et al.,1991. Nucleic Acids Res. 19:733-38; Matsuda A et al. ,1991. J.Med. Chem. 34:234-39; Schmit C. 1994. Synlett 238-40; Imasawa M et al.,1979. J.Org.Chem. 44:2039-4; Schmit C. 1994. Synlett 241-42; McCombie SW et al. , 1987. Tetrahedron Let. 28:383-6; Imasawa M. et al.,1975. Chem. Pharm. Bull. 23: 604-10; Divakar KJ et al.,1990. J.ChemSoc., Perkin Trans.l 969-74: Marriott JH et al.,1991 Carbohydrate Res. 216:257-69; Divakar KJ et al. , 1982. J.Chem.Soc., Perkin Trans. l 1625-28; Marriott JH et al.,1990. Tetrahedron Lett. 31:2646-57.
Описанные выше аминокислотно- модифицированные нуклеотиды могут быть замещены на нативные нуклеотиды и включаться в последовательности тестируемой смеси нуклеиновых кислот. Нуклеотиды, модифицированные другими химическими группами в месте упомянутых аминокислот, также рассматриваются в этом изобретении. Часто, можно сделать предположение о том, какие модифицированные нуклеотиды будут наиболее желательны для добавления в тестируемую смесь нуклеиновых кислот. Например, если реакция, которая предназначается для проведения альдольной конденсации, проводится структурой из альдолаз Класса 1, нужная другая химическая группа может быть аминокислотным производным, которое содержит первичную аминогруппу для образования имина с карбониловым субстратом и другую основную группу для удобства образования енамина, который служит как нуклеофил в реакции.
ii. Модифицирование нуклеиновой кислоты металлоорганическими группами.
Другая модификация тестируемой смеси нуклеиновых кислот, рассматриваемая этим изобретением, включает металлоорганический реагент в последовательности, которые составляют тестируемую смесь нуклеиновых кислот. Использование металлоорганических катализаторов в синтезе усложненных органических структур революционизировало органические синтезы. Металлоорганический катализатор означает любой металлический или органический лиганд сферы, способный к проведению реакции. Лиганды, которые составляют координационную сферу, известны и включают пиридиновые лиганды, фосфиновые лиганды, оксимовые лиганды, порфирины, изоцианаты, цианаты, карбоксилаты, тиолы, монооксид углерода, алкены, простые эфиры и подобные. Используемые металлы включают никель, родий, кобальт, палладий, цирконий, алюминий, железо, марганец, титан, рутений, молибден и бор. Например, пиридиновые никелевые комплексы, как известно, катализируют гидролиз мочевины; ацетат родия катализирует циклопропанирование; комплексы кобальта катализируют циклотримеризацию и [3+2] циклоприсоединение, палладий катализирует гидрогенирование и [3+2] циклоприсоединение; комплексы рутения и молибдена катализируют олефиновую реакцию обмена. Взятые вместе эти реакции могут давать 3,4,5,6 и 7-членные кольца, все из которых, как известно, используют, в структуре многих медицинских соединений. Большие кольца могут быть получены π-аллильным палладиевым катализом. Образование хиральных центров является решающим в синтезе многих биологически-активных веществ и во многих случаях ошибочный энантиомер может иметь вредные фармакологические эффекты. Асимметрическое гидрогенирование для образование единичных энантиомеров может осуществляться палладиевыми и циркониевыми комплексами.
В этом воплощении несколько опций доступны для связывания металлоорганического комплекса с олигонуклеотидом. Металлорганическим комплексом могут воздействовать прямо на нуклеотидное основание, такое как 5-положение пиримидина. Модифицированные олигонуклеотиды могут амплифицироваться с хорошей целостностью.
В некоторых случаях связь между нуклеиновой кислотой и металлоорганическим комплексом может быть разрушена, оставляя олигонуклеотид неповрежденным. Примеры разрушаемых связей включают, но не ограничиваются этим, фотохимически лабильные линкеры, дисульфиды и карбонаты. Эти химические связи хорошо известны в обычном применении и могут быть использованы для воздействия металлорганического комплекса на 5' или 3' конец нуклеиновой кислоты или на 5-положение пиримидиновых остатков в нуклеиновой кислоте.
Другой опцией является использование кассеты олигонуклеотида, которая может быть синтезирована для включения металлорганического комплекса. Кассета олигонуклеотидов может включать фиксированную последовательность нуклеиновй кислоты, имеющую металлорганический комплекс, связанный с ней, который может присоединяться к нуклеиновой кислоте в начале каждого цикла отбора. Каждый компонент тестируемой смеси нуклеиновых кислот может иметь идентичный фиксированный район, комплементарный фиксированным последовательностям в кассете. Эта кассета олигонуклеотидов может устранять необходимость других методов конъюгации.
Может быть также желательным вставлять металлоорганический катализатор внутрь олигонуклеотида. Для некоторых из этих проявлений модификация может происходить после каждого цикла амплификации. В случае вставки металлоорганического комплекса внутрь олигонуклеотида более, чем одна разрушаемая связь может потребоваться, и химия каждой разрушаемой связи может требовать уникальности. Лиганд бипиридина используют как пример в схеме, показанной ниже.
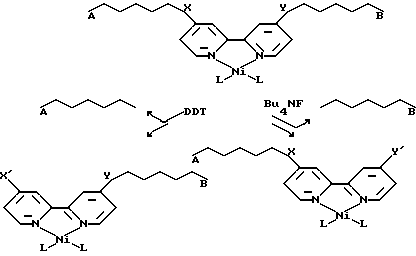
X-S-S
Y = O-Si[CH(CH3)2]2
DTT = дитиотретол
Так как олигонулеотидные компоненты, названные А и B, могут хемоселективно отщепляться от основы, их последовательности могут быть определены независимо. Дополнительно, A и B могут содержать относительно короткие последовательности, которые могут быть легко синтезированы химическими способами. Для нескольких металлоорганических комплексов может потребоваться, чтобы металл был введен после синтеза или транскрипции. В этих случаях хелатирующие лиганды, которые связывают металл, могут взаимодействовать с олигонуклеотидом, как обсуждалось выше, и металл вводят после синтеза нуклеиновой кислоты или амплификации посредством лигандных обменных реакций.
Как можно было увидеть из примеров, приведенных выше, существует множество путей модификации нуклеиновой кислоты, делая их годными для проведения химических реакций, таких как образование связи или расщепление связи. Все модификации нуклеиновой кислоты раскрываются в этом изобретении.
B. Реагенты.
В своем широком смысле термин реагенты относится к любым химическим представителям, которые сходны по термической и химической стабильности с нуклеиновыми кислотами, и могут вовлекаться в связь- образующую или связь-разрушающую реакции. Это изобретение не должно ограничиваться типом реагента. Следующие классы маленьких органических молекул подразумеваются неограничивающими примерами потенциальных реагентов: алкены, алкины, спирты, альдегиды, кетоны, сложные эфиры, карбоновые кислоты, ароматические карбоциклы, гетероциклы, диены, тиолы, сульфиды, дисульфиды, эпоксиды, простые эфиры и галогенированные соединения. Реагенты предпочтительно имеют молекулярный вес в пределах от 2 до 1000, наиболее предпочтительно в пределах от 26 до 500. Где желательны продукты большей массы, реагенты также будут больше, такие как пептиды, белки и полимеры. Реагенты могут содержать более, чем одну из перечисленных функциональных групп, и могут содержать хиральные центры. В основном термин реагенты представляет класс химических реагентов, определенный по их химически реакционной единице (например, диен, сложный эфир и т. д.). Как пример, химический реагент может быть классом реагентов, который может включать от 1 до 10n различных членов класса. Реагенты, выбранные для любой данной реакции, могут также включать несколько классов реагентов.
На некотором уровне в процессе определения подходящих реагентов для процесса параллельного SELEX мишень должна быть идентифицирована и способ действия, по которому желаемый продукт может действовать на такую мишень, должен быть определен. Сразу же как определение сделано, класс продуктов, вероятно имеющих желательные свойства, может быть выбран. Подходящие реагенты, которые подходят для получения желаемого класса продуктов, могут затем быть выбраны и включены в процесс параллельного SELEX.
Выбор реагентов может быть определен случайно. Однако предпочтительно, чтобы выбор реагентов был основан на ряде критериев, включая, но не ограничиваясь этим, выбор реагентов, основанный на желаемом классе продуктов, который может быть определен по начальным структурным предположениям, основанным на сходстве с известными соединениями, имеющими желаемую характеристику, другими известными лигандами, компьютерным моделированием, ЯМР и рентгеновским анализом данных/структуры, ферментным и химическим футпринтингом. Сразу после идентификации класса продукта реагенты выбирают для максимизирования разнообразия, которое может быть получено. Часто ретросинтетические процедуры применяют для выбора возможных реагентов. Множество классов реагентов может быть использовано одновременно.
Для целей этого изобретения реагент, который связан с нуклеиновой кислотой, будут называть первым реагентом или связанным реагентом. Типично что первый реагент может взаимодействовать по крайней мере с одним свободным реагентом при условиях, благоприятных для облегчения образования связи, и конечный продукт можно попробовать определить, если он имеет заранее определенную желательную характеристику. Рассмотрено, что первый реагент может химически реагировать более чем с одним другим реагентом (например, вторым, третьим, четвертым и т.д. реагентами) для образования продукта. Также рассмотрено, что более чем один тип химической реакции может быть приведен одновременно. Также рассмотрено, когда множество реакций могут проходить одновременно, возможно использовать множество нуклеиновых кислот для облегчения образования продукта различных порций. Идеально реагенты выбирают так, что в зависимости от способствующих нуклеиновых кислот специфически вырабатывать продукт, образуется библиотека продуктов.
C. Связывание реагента с нуклеиновой кислотой.
Параллельный SELEX требует, чтобы первый реагент был связан с нуклеиновой кислотой, имеющей способствующие свойства, которая присутствует в тестируемой смеси нуклеиновых кислот. Первый реагент связан с нуклеиновой кислотой или ковалентно или нековалентно. Связывание может быть теоретически в любом месте нуклеиновой кислоты. Однако для практических целей, связывание обычно проводят по 5'- и 3'-концам нуклеиновой кислоты. Типично связывание через реакцию лигирования, но применяется любая известная реакция связывания. Связывание может быть прямым, что может быть сделано с 5'GMPS, 3'-дидезокси терминальной трансферазой, или подобным образом.
Связывание между нуклеиновой кислотой и реагентом может также включать линкерную группу. Такая линкерная группа может позволять нуклеиновой кислоте сворачиваться в наиболее удобную конформацию так, чтобы она лучше взаимодействовала с реагентами для проведения реакции образования связи. Линкерная группа может позволять первому реагенту исследовать полную поверхность и каталитические карманы свернутой нуклеиновой кислоты.
Линкерная группа может быть любой подходящeй спейсерной частью. Линкерная группа может быть значительной длины, предпочтительно сделанной из полимерных звеньев, что способствует гибкой привязи, которая дает возможность доступа различным реагентам ко всей поверхности и карманам связывания свернутой нуклеиновой кислоты. Оптимальный размер линкерной группы зависит от размера нуклеиновой кислоты. В основном размер линкерной группы может быть между 10 и 1000 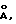 предпочтительно между 50 и 300
предпочтительно между 50 и 300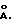 Линкерная группа может варьировать в тестируемой смеси нуклеиновая кислота-реагент для выбора оптимальной длины для желаемой реакции. Линкерная группа может быть также легко растворена в реакционных условиях. Подходящие линкерные группы, например, бывают из ПЭГ, поливинилового спирта, полиакрилатов и полипептидов.
Линкерная группа может варьировать в тестируемой смеси нуклеиновая кислота-реагент для выбора оптимальной длины для желаемой реакции. Линкерная группа может быть также легко растворена в реакционных условиях. Подходящие линкерные группы, например, бывают из ПЭГ, поливинилового спирта, полиакрилатов и полипептидов.
Связь между линкерной группой и нуклеиновой кислотой предпочтительно расщепляется, оставляя нуклеиновую кислоту неизмененной. Примеры подходящих расщепляемых связей включают, но не ограничиваются этим, фотохимически лабильные связи, дисульфиды и карбонаты. Связь может также быть расщепляемой ферментами, такими как ДНКазы и протеиназы.
Дополнительно связь может быть по щепящему смешанному методу, описанному в US серийный N 08/234,997, зарегистрированному 28 апреля 1994, который здесь приводится как ссылка.
D. Образование продукта.
Химическая реакция присутствует, когда первый реагент и по крайней мере второй реагент взаимодействуют и образуют продукт, или когда первый реагент отщепляется по некоторому пути, что обусловлено им связанной нуклеиновой кислотой. Любое число химических реакций совместимо с методом параллельного SELEX. Одно требование, чтобы реакция проводилась нуклеиновой кислотой, связанной с первым реагентом. Предпочтительно посредничество нуклеиновой кислоты является специфичным для реагентов и желаемого продукта, что, однако, может быть не всегда. Химические реакции включают и связь-образующие и связь-расщепляющие реакции. Различные реакции образования связи рассматриваются этим изобретением, и, кстати, примеры включают реакции конденсации/гидролиза, циклоприсоединяющие реакции, такие как Дильса-Альдера и Ене реакции, конъюгацию присоединением к α,β- ненасыщенным соединениям, альдольные конденсации, гликозилирование пептидов, cахаров и липидов. Дополнительно, когда нуклеиновые кислоты в тестируемой смеси модифицированы, включают встраивание металлоорганического катализатора в нуклеиновую кислоту, другие реакции, включающие, но не ограничиваются этим, циклопропанирование, гидрогенирование, циклотримеризацию алкинов, [3+2] и [4+1] циклоприсоединение ненасыщенных молекул, и олефиновые реакции обмена могут встречаться, все из которых могут образовывать асимметрические молекулы. Это изобретение рассматривает использование этих реакций по одной или вместе в любой комбинации. Изобретение далее рассматривает последовательные реакции, где первый продукт может быть сделан двумя или более реагентами, и затем этот продукт может стать "реагентом" с другими свободными реагентами для образования второго продукта и т.д.
Реакции расщепления связи также включены в изобретение. Реакция расщепления связи имеет несколько проявлений, включая, но не ограничиваясь этим, отщепление первого реагента для образования продукта, который взаимодействует с мишенью, отщепление первого реагента так, что он тут же способен лучше реагировать со вторым реагентом для образования связи и т.д.
Изобретение также включает воплощения, где продукты, образованные способом изобретения, действуют на другие молекулы, включая, но не ограничиваясь этим, меченые атомы, антитела, другие маленькие молекулы и т.д.
Реакцию(ции) можно проводить при различных известных условиях, которые согласуются с требованиями стабильности нуклеиновых кислот. Реакцию можно проводить в любых водных растворителях с буфером или без буфера, таких как вода, Трис, HEPES и т.д., или в органической системе растворителей с подходящими алкиламмониевыми или подобными противоионами, таких как метанол/вода, ДМСО, ДМФ/вода, с триэтиламмониевой солью. Температурный предел в основном от -10 до 100oC, предпочтительно от 10 до 50oC. Концентрация тестируемой смеси случайно полученной нуклеиновой кислоты-реагента в основном лежит в пределах от 1 пМ др 10 мМ, предпочтительно от 1 до 100 мкМ, и концентрация второго реагента в основном в пределе от 1 мкМ до 10 М, предпочтительно от 10 мкМ до 10 мМ.
E. Разделение продуктов, имеющих заранее выбранные желательные характеристики.
Сразу после проведения химической реакции должны скринировать библиотеку продуктов на продукты, имеющие заранее определенные желательные характеристики. Как описано ранее, заранее определенные желательные характеристики могут включать связывание с мишенью, каталитическое изменение мишени, химическое реагирование с мишенью таким образом, который изменяет/модифицирует мишень или функциональную активность мишени, и ковалентное воздействие на мишень в виде суицидного ингибитора.
Мишень может быть любым соединением из интересующих. Мишень может быть белком, пептидом, полисахаридом, гликопротеином, гормоном, рецептором, антигеном, антителом, вирусом, субстратом, метаболитом, аналогом переходного состояния, кофактором, ингибитором, лекарством, красителем, питательным веществом, фактором роста, клеткой, тканью и т.д. без ограничений. Условия, при которых продукт скринируют, не ограничены условиями для образования продукта, описанными в разделе D выше. Условия скринирования известны из предшествующего уровня.
Продукты имеющие предопределенные желательные характеристики могут быть отделены от остальной части библиотеки продуктов, причем еще соединясь с нуклеиновой кислотой, которая способствует их образованию различными известными методами. Ключом является отделение желаемых продуктов из всей библиотеки продуктов без химической деградации воздействуемой нуклеиновой кислоты, таким образом, что нуклеиновые кислоты амплифицируемы. Нуклеиновая кислота может затем быть амплифицируема, или еще соединяясь с желаемым продуктом или после отделения от желаемого продукта, как учат в основном методе SELEX.
В наиболее предпочтительном воплощении желаемый продукт действует на мишень без какого-либо взаимодействия между нуклеиновой кислотой, связанной с желаемым продуктом и мишенью. Нуклеиновая кислота обеспечивает реакцию между связанным ею реагентом и свободным реагентом, давая желательный продукт, и также амплифицируется так, что желаемый продукт может быть затем повторно получен и в конечном счете идентифицирован из многочисленных продуктов библиотеки. Однако, что не рассмотрено в этом предпочтительном воплощении, нуклеиновая кислота действует прямо на мишень.
Нуклеиновая кислота может быть модифицирована до взаимодействия с мишенью, чтобы обеспечить отсутствие взаимодействия с мишенью. Модификация проводится несколькими путями, включая становление нуклеиновой кислоты двухцепочечной, при этом она менее способна взаимодействовать с мишенью. В какой-то мере в наименее предпочтительном воплощении нуклеиновая кислота может действовать на мишень или независимо или во взаимодействии с желаемым продуктом, синтез которого она обеспечивает. В этом воплощении конечный пункт может быть комбинацией продукта с присоединенной нуклеиновой кислотой.
В одном воплощении продукт связывает мишень, и связанный комплекс нуклеиновая кислота-продукт-мишень может быть отделен от несвязанных продуктов рядом методов. Методы включают связывание нитроцеллюлозным фильтром, колоночную хроматографию, фильтрацию, аффинную хроматографию, центрифугирование и другие хорошо известные методы. Кратко, библиотеку продуктов подвергают методу разделения, например, на колонке, которая связывает мишень. Все нуклеиновые кислоты, которые имеют образовавшиеся продукты или которые ассоциированы с нежелательными продуктами, будут проходить через колонку или могут быть удалены контр-SELEX. Желаемые продукты связываются колонкой и могут быть элюированы изменением условий колонки (т.е. соль и т.д.), или нуклеиновая кислота, связанная с желаемым продуктом, может быть отщеплена от продукта и элюирована прямо.
Дополнительно, продукты, которые реагируют с мишенью, могут быть отделены от тех продуктов, которые не реагируют с мишенью. В одном примере, продукт, который ковалентно связан с мишенью (такой как суицидный ингибитор) может быть отмыт при очень жестких условиях. Конечный продукт-мишень комплекс может затем обрабатываться протеиназой, ДНКазой или другим подходящим реагентом для расщепления линкера и высвобождения нуклеиновой кислоты, которые ассоциированы с желаемыми продуктами. Освобожденные нуклеиновые кислоты могут быть амплифицированы.
В другом примере заранее определенная требуемая характеристика желательного продукта означает способность продукта переносить химическую группу (например, перенос ацила) на мишень и таким образом инактивировать мишень. Можно иметь библиотеку продуктов, где все продукты имеют тиоэфирную химическую группу. При контакте с мишенью желаемые продукты могут переносить химическую группу на мишень, что сопутствует превращению желаемого продукта из тиоэфира в тиол. Кроме того, способ разделения, которым можно идентифицировать продукты, которые стали тиолами (лучше, чем тиоэфиры) может давать возможность выбора желаемых продуктов и амплификации нуклеиновой кислоты, связанной с ним.
Существуют другие известные разделяющие и скринирующие процессы, которые рассматриваются этим изобретением. В одном воплощении продукты могут быть фракционированы рядом общеизвестных методов и затем каждую фракцию исследуют на активность. Методы фракционирования могут включать размер, pH, гидрофобность и т.д.
Как описано ранее, SELEX процесс может включать другие воплощения, которые могут быть включены для успешного фракционирования желаемых продуктов, включая, но не ограничиваясь этим, фото-SELEX, контр-SELEX и т.д.
В одном воплощении перед шагом разделения нуклеиновую кислоту обрабатывают таким образом, чтобы вероятность взаимодействия с мишенью была наименьшей. Как пример нуклеиновая кислота может быть сделана двухцепочечной перед разделением. В другом воплощении, до связывания реагента с нуклеиновой кислотой тестируемая смесь нуклеиновых кислот может быть разделена через контр-SELEX для удаления нуклеиновых кислот, которые действуют прямо на мишень.
F. Амплификация.
Амплификация нуклеиновой кислоты, которая направляет синтез продукта, имеющего желательные характеристики, проводится как описано в основном SELEX-способе, используя методы известного уровня знаний. Если необходимо или желательно, любая модификация или другое дополненное свойство (такое как линкерная группа) могут быть удалены перед амплификацией. Полимеразная цепная реакция (PCR) является типичным методом для амплифицирования нуклеиновых кислот. Описания PCR методов обнаружены, например в Saiki et al., 1985. Science 230: 1350- 1354; Saiki et al., 1986. Nature 324:163-166; Scharfet al., 1986. Science 233:1076-1078; Innis et al., 1988. Proc. Natl. Acad. Sci. 85: 9436-9440; и в U. S. Pat. N 4,683,195 (Mullis et al.) и U.S. Pat. No. 4,683,202 (Mullis et al.). В своем основном виде PCR амплификация включает повторение циклов репликации требуемой одноцепочечной ДНК, или кДНК копии РНК, использование специфических олигонуклеотидных праймеров, комплементарных 3'- и 5'-концам одноцепочечной ДНК, удлинение праймера ДНК полимеразой и денатурацию ДНК. Продукты, полученные удлинением одного праймера, служат матрицей для удлинения с другого праймера. Другие известные амплификационные методы рассматриваются этим изобретением.
Амплификация с вытеснением нити (SDA) является одним примером альтернативного разделяющего метода (Walker et al., 1992. Proc. Natl. Acad. Sci. 89: 392-396, Walker et al., 1992. Nucieic Acids Research 20:1691-1696). SDA - это техника амплифицирования одноцепочечной ДНК с одноцепочечной ДНК, которая работает несколько схоже с PCR. Подобно PCR SDA использует набор двух конвергентных праймеров для амплифицирования ДНК, которая лежит между праймерами, и требуется активность ДНК полимеразы для выполнения этого. Также SDA использует экспоненциальную амплификационную схему, в которой новосинтезированная ДНК служит как матрица для дальнейшего ДНК синтеза. В отличие от PCR, SDA проводится при постоянной температуре (≈40oC) и основан на способности определенного класса полимераз замещать предварительно синтезированную цепь ДНК матрицы, когда она синтезирует новую цепь. Это заменяет стадию температурной денатурации, используемую в PCR. SDA требует действия дополнительного фермента, эндонуклеазы рестрикции, для получения разрыва в двухцепочечной ДНК матрице. ДНК на 3'-стороне разрыва служит как праймер для синтеза новой ДНК, при этом ДНК на 5'-стороне разрыва вытесняется в раствор ДНК полимеразой, где она может отжигаться с одним из SDA праймеров и служить опять матрицей для синтеза ДНК. Если ДНК лиганды требуются, SDA имеет ряд преимуществ для параллельного SELEX. Способ SDA использует ДНК полимеразу Кленова экзо (-) для синтеза ДНК, хорошо характеризированную полимеразу, которая, как известно, легко добавляет модифицированные dNTPs. Так как она хорошо охарактеризована, рациональные решения о том, какие модифицированные dNTPs сделать, могут быть легко приняты. Может быть придумана простая схема, в которой удлинение праймера замещает лигирование для подхода ДНК лиганда к намеченной реактивной группе. SDA имеет амплификационные свойства, подобные PCR (для ДНК < 200 н.п. длиной), но может применяться, используя менее специализированное оборудование в более короткое время.
Амплифицированная нуклеиновая кислота затем подвергается любой требуемой постамплификационной модификации, повторно соединяется с первым реагентом и процесс продолжается, как описано выше. Процесс повторяется несколько раз, сколько необходимо для увеличения нуклеиновых кислот, имеющих подходящую требуемую способствующую активность, и/или до получения желаемых продуктов, имеющих максимальные требуемые характеристики. Весьма вероятно, что один цикл параллельного SELEX - это все, что требуется для получения продукта, имеющего требуемые характеристики. Конечная точка может быть определена многими методами, которые могут быть поняты обычными способами из предшествующего уровня знаний, включая кривые связывания, ингибирование, определяемое по IC50 значениям, скорости инактивации, профили токсичности, биоактивность, фармакинетики и т.д.
G. Анализ желаемых продуктов.
После амплифицирования помощника нуклеиновой кислоты и получения достаточных количеств желаемого продукта, структура одного или серии желаемых продуктов может быть исследована подходящими известными методами. Для того чтобы сделать это, начальные реакционные условия должны быть соответственно повторены. Первый реагент может быть повторно присоединен к нуклеиновой кислоте помощнику, результирующая нуклеиновая кислота-реагент, смешанная с пулом вторых реагентов, и результирующий желаемый продукт образуются и выделяются. Предположение, которое делает этот процесс эффективным, означает, что нуклеиновая кислота будет специфически способствовать индивидуальным реакциям или по крайней мере относительно маленькому числу реакций, включая требуемую реакцию. Подходящие спектроскопические методы включают, но не ограничиваются этим, ЯМР спектроскопию, масс-спектроскопию, ВЭЖХ спектроскопию, ИК спектроскопию, УФ видимую спектроскопию, круговой дихроизм, поляриметрию и рентгено-кристаллографию. Когда структура желаемого продукта идентифицирована, его можно получать в больших количествах или стандартными химическими синтетическими процедурами, или процедурами, описанными здесь для получения, используя способствующую нуклеиновую кислоту.
III. Характерные примеры.
Следующие характерные примеры включены для дополнительного описания способа, параллельного SELEX. Наиболее основная схема для параллельного SELEX-способа представлена на фиг. 1. Следующие примеры описывают более детально маленькие примеры реакций, которые рассмотрены в изобретении. Это означает, что эти примеры служат для иллюстрации целей и не ограничивают изобретение в любом направлении.
а. Реакция Дильса-Альдера.
Следующее рассуждение описывает, как РНК помощники и циклогексеновый небольшой молекулярный продукт, который связывает характерную мишень, могут быть совместно использованы в реакции Дильса-Альдера, представленной на фиг. 2. Другой версией примера, параллельного SELEX может служить ДНК, и в некоторых случаях ДНК предпочтительней РНК. Стартовая РНК (A на фиг. 2) может содержать 3'- и 5'-определенные районы для участия в транскрипции и сайт связывания для конъюгации с ПЭГ спейсером, который обратимо связывается с первым реагентом диенофилом.
Стартовая РНК (A) может иметь случайно полученный набор, состоящий из примерно 4N различных последовательностей, где N означает число нуклеотидов в РНК последовательности; точное число будет зависеть от длины случайного района и масштаба синтеза РНК, использованного для получения. ПЭГ спейсер может содержать значительное число полимерных единиц для образования гибкой связи, что дает возможность первому реагенту диенофилу доступа ко всей поверхности и связывающим карманам свернутой РНК (C и D фиг. 2). Стартовая РНК (A), которая связана с первым реагентом, показана как линейная структура для ясности. Нужные РНК структуры могут состоять из различных связанных свернутых единиц, что представлено С и D.
В этом примере стадия 1 может включать пул из 10 вторых реагентов диеновых субстратов, названных B1-10, где группы R1, R2 и R3 означают не водород. Нет причины, чтобы пул не мог увеличиваться включением вторых реагентов диенов, где одна или все группы R1, R2 и R3 означают водород. Это может только привести к меньшему числу стереоцентров, которые образуются. Структуры С и D представляют две возможности для подхода первого реагента диенофила. Каждый региостереомер может иметь 4 возможных стереизомера, которые могут образовываться, и если все получаются, 11 соединений могут быть преобразованы в 80. Диаграмные структурные элементы а и b представляют стерические выпуклости в РНК, которые могут взаимодействовать со вторым реагентом диеном или первым реагентом диенофилом в РНК, определяя ориентацию второго реагента диена в переходном состоянии. Например, для E1-10, если R3 меньше, чем R2, предпочтительная ориентация диена может благоприятствовать образованию E/E* и F/F* в отличие от G/G* и H/H* из-за стерических препятствий между РНК структурами и диенофильной группой R2. При получении С энантиомеры E/E* и F/F* будут образовываться. Взаимодействия притяжения, такие как H-связывание между диенофильным карбоксильным кислородом и РНК районом, возможно облегчают образование эндо продукта. Силы притяжения между R1 и РНК поверхностью, названной b, могут также благоприятствовать эндо взаимодействию. Напротив, РНК структурные компоненты а и b могут иметь взаимодействия отталкивания карбоксилата и R1 диенофила, что может приводить к образованию экзо продукта. Замечено, что пары E/E* и F/F* являются диастереомерами, так как они имеют различные свойства даже для идентичных заместителей R1, R2 и R3. При получении D энантиомеры G/G* и H/H* будут образовываться и взаимосвязь между парами G/G* и H/H* в их диастереомерности. Однако, так как олигонуклеотид имеет свойственную хиральность, РНК способствующий сайт может иметь энергетически различное, диастереомерное взаимодействие с переходным состоянием энантиомерных пар, что может обеспечивать высокую энантиоселективность, даже если различие энергии мало ( ΔΔ G 3-4 ккал/моль).
Выбор циклогексенового требуемого продукта показан на стадии 2. Если мишень является белком и желаемый продукт выбран для связывания мишени, стадия 2 может проводиться в избытке белка мишени в течение начальных стадий, и концентрация белка может быть затем уменьшена по мере увеличения выхода желаемого циклогексенового продукта. Примеры белков мишеней могут включать ферменты, гормоны, клеточные рецепторы, клеточные адгезионные молекулы и т.д. При конкурентном связывании будут связываться желаемые продукты с высокой активностью. Это можно проводить изначально при выборе целых групп таких как E/E* и F/F*. Для этого примера было предположено, что ряд одного энантиомера может быть выбран, скажем, E, потому что он связывается более плотно с мишенью белком, и, например, только 5 или 10 возможных структур существуют со сравнимой активностью. (Можно заметить, что a priori нет причины не верить, что желаемые продукты не могут быть получены, когда производились из каждого диастереомера.)
Выбранные желаемые продукты и их связывающие, совместно выделяемые РНК помощники отделяются от нежелательных продуктов и РНК помощники амплифицируются стандартными процедурами SELEX стадий с 3 по 5. После стадии 5 РНК могут быть увеличены в количестве для способствующей активности, которая специфически образует E группу соединений. Может быть, больше, чем 5 РНК-т в этой точке. Проведение последующих стадий SELEX может требовать стадии 6, при которой начальный ПЭГ спейсер с первым реагентом диенофилом соединяют с новым увеличенным пулом РНК-т. Повторяя со стадии 1 по 6 можно далее увеличивать способствующую активность РНК, полученную после стадии 5. Дополнительно аффиность связывания циклогексеновых желаемых продуктов может достигать максимума. Предполагая, что РНК пул сейчас не случайный, клонированием и удлинением РНК-т индивидуальные РНК молекулы могут быть тестированы по их способствующей активности. Обрабатывание этих РНК молекул одинаковым первым и вторым реагентом диенофилом и диенами может по необходимости привести к образованию совместно выделяемого циклогексенового желаемого продукта. После получения значительных количеств РНК помощника, структура одного или серии циклогексановых желаемых продуктов исследуют подходящими спектроскопическими методами.
Пример, приведенный выше, был для одного реагента диенофила, взаимодействующего с пулом 10 вторых реагентов диенов. Число первых реагентов диенофилов, включаемых в процесс совместного выделения, может быть расширено просто взаимодействием ряда различных первых реагентов диенофилов со связывающей последовательностью. После совместного выделения, клонирования и секвенирования индивидуальные РНК посредники могут затем взаимодействовать со смесью первого и второго реагентов диенов и диенофилов, так что индивидуальный желаемый продукт, образованный способствующей РНК, может быть сделан в значительном количестве для возможности спектроскопической структурной идентификации. Хотя в примере параллельного SELEX, показанном выше, первый реагент диенофил взаимодействует с РНК, предполагают, что способствующий РНК может быть специфичен для реакции взаимодействующего первого реагента диенофила в противоположность взаимодействия того с другими РНК. Может оказаться, что взаимодействие одной способствующей РНК с пулом первого и второго реагентов диенов и диенофилов приведет к очень специфической реакции по отношению ко второму реагенту диену, потому что так было выбрано, но с низкой селективностью для первого реагента диенофила, который является связанным в течение реакции.
С другой стороны, если оба первый и второй реагенты различны, специфичность для обoих реагентов может быть получена. Улучшенным проявлением может быть использование связанной последовательности кодирования для первого реагента диенофила, который связан с определенной нуклеиновой кислотой, как показано на фиг.3, и таким образом, становится возможным расширение матрицы. Используя этот подход, при клонировании и секвенировании индивидуальных способствующих РНК последовательность участка связывания может указывать первый реагент диенофил, который был связан с ней через ПЭГ линкер. Таким образом, только первый реагент диенофил, соответствующий определенной способствующей РНК, может быть использован для конечного получения выделенного желаемого продукта. Необходимо заметить, что нет причины, по которой дополнительный эксперимент к представленному на фиг. 2 не может быть использован, где один первый реагент диенофил связан с РНК связывающей последовательностью и пул вторых реагентов диенофилов вводится в стадии 1. Также возможно использование множества первых реагентов и одного второго реагента.
Реакция Дильса-Альдера является только одной из ряда очень энергетических асимметрических реакций образования связи.
b. Альдольная реакция.
Другим типом реакции, используемым в синтетической и биосинтетической химии является реакция альдольной конденсации. Основные концепции, обсуждавшиеся для реакции Дильса-Альдера, применимы к альдольной реакции, где один или больше альдегид - один реагент и один или больше кетон - другой реагент. Логическая вариация, как приспособить параллельный SELEX к альдольной конденсации, описана в следующем примере на фиг.4. РНК (или ДНК) содержат 3'- и 5'- фиксированные районы для транскрипции. РНК связана с ПЭГ линкером (20-50 этиленовых единиц длиной), который с другой стороны связан с первым реагентом альдегидом. Первый реагент альдегид служит электрофилом в альдольной реакции благодаря своей большей реакционной способности по сравнению со вторым реагентом кетоном. Пул РНК последовательностей, названный A, может сворачиваться в различные структурные глобулы. Вторые реагенты кетоны, названные B1-10, с различными химическими группами R1 и R2 могут взаимодействовать с A в стадии 1 на фиг. 4. РНК может нуждаться в содержании амина, способного связываться с карбонилом кетонов и образовывать енамин, обозначенный как C1-10, D1-10, E1-10 и F1-10. Поверхность РНК может определять, образуются ли E- или Z-енамины. Енамин может затем служить как нуклеофил в альдольной реакции с добавленным альдегидом. Стерическое и электронное окружение РНК вокруг енамина может определять степень энантиоселективности, обнаруженной для данной РНК последовательности.
Для целей этого примера продукты альдольной конденсации G1-10, H1-10, G*1-10 и H*1-10 получают при атаке первым реагентом альдегидом с той же стороны. Возможно образование такого же продукта при подходе с другой стороны, если другие енамин и относительная ориентация первого реагента альдегида появятся и это одновременно случиться. Важно, что если два новых хиральных центра образуются, то все сорок продуктов представлены как G1-10, H1-10, G*1-10 и H*1-10. Альдольные продукты G1-10/G*1-10 являются энантиомерами, как и H1-10/H*1-10.
В воде иминовая связь G1-10, H1-10, G*1-10 и H*1-10 может быть обратимой и гидролизоваться, давая соответствующие продукты β- кетоспирты. Отбор высокоаффинных β- кетоспиртовых желаемых продуктов может быть сделан разделением полученной библиотеки продуктов при помощи белка, связанного с биотином, или на носителе колонки. После достижения равновесия выбранная РНК амплифицируется стандартными SELEX методами как показано стадиями 3-5 на фиг. 3.
Как только максимальный уровень взаимодействия достигается или аффинность связывания с мишенью достигнет высокого уровня, способствующая РНК, связанная с желаемым продуктом, будет клонирована и секвенирована. Способствующая РНК может затем быть получена отдельно, и синтез этих соответствующих β- кетоспиртовых желаемых продуктов приходит на более значительный масштаб для выделения для последующей структурной характеристики спектроскопическими методами.
Как в примере реакции Дильса-Альдера, множество первых реагентов альдегидов, применяемых в параллельном SELEX, может быть расширено связыванием различных первых реагентов альдегидов с ПЭГ линкером и кодированием лигированной последовательности, в которой первые реагенты альдегиды связаны с нуклеиновыми кислотами.
Для примера реакции Дильса-Альдера, рассмотренного выше, фактор 4 получали для создания двух стереоцентров. Однако альдольная конденсация имеет потенциал для образования много больше возможностей, чем эти. Рассмотрим смешанную альдольную реакцию, где два кетона используются как первый и второй реагенты, они имеют сравнимую электрофильность на карбонильном углероде и похожую нуклеофильность на α-углеродах (фиг. 5). Обычно в органическом синтезе реакций этого типа избегают, потому что образуется очень сложная смесь продуктов. В стратегии параллельного SELEX это увеличение разнообразия может быть дополнительной пользой. Структуры С, D, E, F, G, H, I и J все являются различными диастереомерами. Каждый из этих продуктов имеет соответствующий энантиомер, что означает, что для реакции смешанной альдольной конденсации на фиг. 4 1600 продуктов с различными структурами могут быть образованы из исходных 20 (A1-10 и B1-10).
c. [2+2+2] Реакции циклотримеризации.
Параллельный отбор и совместное выделение способствующей РНК и желаемого продукта не ограничивает образование продуктов, имеющих структуры, которые создают хиральные центры. Многие важные медицинские соединения содержат ахиральные ароматические группы с присоединенными хиральными заместителями. Один из наиболее энергетических методов для конструирования продуктов, включающих ароматические кольцевые системы (бензолы, нафталины, пиридины и т.д.) означает циклопентадиенил кобальт (CpCo), опосредованную циклотримеризацию первого, второго и третьего алкинов. Она, обозначаемая как [2+2+2] циклотримеризация, не ограничивается алкиновыми реагентами, и неароматические шестичленные кольцевые продукты могут быть собраны объединением алкиновых и алкеновых реактантов.
Пример, рассматриваемый здесь, включает воплощение изобретения, где металлоорганический катализатор включается в РНК (или ДНК) и используется в параллельном SELEX. Стадии 1-6, описанные выше и показанные на фиг. 2 и 4, общие для всего параллельного SELEX, таким образом, только влияние циклотримеризации на возможное число структур образованного продукта будет обсуждаться здесь. Для циклотримеризации трех алкиновых реагентов для образования продукта, включающего бензольное кольцо, максимальное число возможностей получают, используя три различных алкиновых реагента, которые имеют различные заместители, связанные с каждым концом каждого реагента (показано на фиг. 6).
Для циклотримеризации алкиновых реагентов, как показано на фиг. 6, где 4MN2 возможные структурно-изомерные продукты, где М= числу несимметричных алкиновых первых реагентов, связанных с РНК, и N=число несимметричных алкиновых вторых и третьих реагентов, которые реагируют с РНК-первый реагент смесью. Фиг. 6 показывает матрицу возможностей только для 3 алкиновых реагентов, где первый реагент связан с РНК, а второй и третий реагенты свободны. Если параллельный SELEX расширен включением 10 алкиновых первых реагентов, связанных с РНК молекулами, и 10 вторыми и третьими реагентами, возможно получение 4000 бензольных продуктов.
Механизм CpCo катализируемой циклотримеризации алкиновых реагентов дан в нижней части фиг. 6. При действии CpCo (или другого комплекса металлов, способного циклизовать алкины) на олигонуклеотид, как описано выше, возможно образование циклотримеризующей способствующей РНК. РНК структуры, которые свернуты вокруг металлоорганического центра, обеспечивают карман, который обуславливает специфичность в каждой из образующих связь стадий, обозначенных на фиг.6 В ->С или С ->D. Используя разделение параллельного SELEX, можно обеспечить специфичность для синтеза желаемых бензольных продуктов. При клонировании и приготовлении значительных количеств способствующей РНК совместно выделяемый продукт(ы) может быть получен обработкой РНК смесью алкиновых реагентов, используемых при селекции. Полученный ароматический продукт затем может быть структурно охарактеризован подходящими методами.
d. Ретросинтетические стратегии.
В основном рассматривают, что все схемы параллельного SELEX будут иметь в общем стадии 1-6, как описано выше и на фиг. 2 и 4. Различные химии будут только изменять тип и число образованных продуктов. Когда рассматривают, какую химию или химии лучше включать в параллельный SELEX, может быть полезно проведение ретросинтетического анализа для структурного продукта класса интереса. Рассмотрим фиг. 7 и возможные направления для показанного продукта. Направление A может включать превращение Дильса-Альдера и В - альдольную конденсацию. Обе реакции образования связи были обсуждены выше. Существует много разных направлений, которые могут быть сделаны для данного продукта. В основном желаемы ретросинтетические стратегии, которые включают образующие кольцо превращения продукта, так как образуется наибольшее число связей или стереоцентров. Когда рассматривают, какие типы реакций наиболее энергетические для параллельного SELEX, другие факторы могут нуждаться в рассмотрении. Например, пригодность реагентов и реакционная способность и стабильность олигонуклеотидов при реакционных условиях. Очень важно число возможных стерео- или структурноизомерных продуктов, которые могут быть образованы. Тогда как реакции Дильс-Альдера и альдольной конденсации дают возможность создавать большое число продуктов в результате образования новых стереоцентров, ретросинтетический путь С может обеспечивать значительное число структурноизомерных продуктов. Предполагается, что изобретение может включать несколько химических реакций, включающих одну или более способствующих нуклеиновых кислот и два или более различных реагентов, или одновременно или последовательно, для получения продуктов изобретения.
Введение и использование.
Применение желаемых продуктов этого изобретения включает различные терапевтические, профилактические, диагностические и косметические использования. Любое использование, где желаемый продукт может потребоваться, означает сферу этого изобретения. Специфические классы состояний включают, но не ограничиваются этим, воспаление, сердечно-сосудистые расстройства, неопластические состояния, метаболические расстройства, паразитические болезни и инфекционные болезни. Более специфично продукты изобретения используют при лечении или предотвращении рака, ангины, артрита, аллергий, ринита, шока, воспалительных кишечных заболеваний, низкого кровяного давления, и систематическом лечении боли и воспаления, локальных травм, таких как раны, ожоги, сыпи.
Желаемые продукты этого изобретения сразу после идентификации методом параллельного SELEX могут быть получены для производства подходящими химическими синтетическими путями или при использовании подходящей нуклеиновой кислоты для проведения реакции между реагентами. Продукты изобретения могут содержать асимметрический атом. Асимметрический атом может быть выбран из углерода, фосфора, кремния, серы, нескольких упомянутых. Таким образом, изобретение включает стереоизомеры и смеси их. Индивидуальные стереоизомеры могут быть получены или выделены известными методами.
Желаемые продукты могут быть введены любым известным способом. Методы введения включают, но не ограничиваются этим, энтеральное (оральное) введение, парэнтеральное (внутривенозное, подкожное и внутримышечное) введение, местное применение и введение через слизистую (носовое, респираторное и т.д. ).
Способ лечения согласно этому изобретению включает внутреннее или местное введение субъекту, нуждающемуся в лечение, эффективного количества желаемого продукта. Дозы желаемых продуктов в способе изобретения и фармацевтические композиции, содержащие одинаково, представляют собой эффективное, нетоксическое количество, в основном выбранное из диапазона от 0.01 до 500 мг/кг желаемого продукта, предпочтительно от 0.1 до 50 мг/мг. Пациенты, при применении известных рутинных клинических тестов, использовались для определения оптимальных доз для определенного недомогания, причем были вылечены. Требуемая доза в основном вводилась субъекту от 1 до 6 или больше раз ежедневно, внутривенозно, орально, ректально, парэнтерально, местно или ингаляцией.
Действие желаемых продуктов изобретения может быть определено известными стандартными методами.
Получение продуктов для введения в фармацевтические препараты может быть проведено рядом известных способов. Подходящими фармацевтически приемлемыми солями являются производные из минеральных кислот, таких как соляная кислота, бромистоводородная кислота, фосфорная кислота, азотная кислота и серная кислота; и органических кислот, таких как винная кислота, фумаровая кислота, молочная кислота, щавелевая кислота, этилсульфокислота, р-толуолсульфокислота и т.п., из которых соответственно получают соли гидрохлорид, сульфат, фосфат, нитрат, метансульфонат, тартрат, бензолсульфонат, р-толуолсульфонат и т.п.
Желаемые продукты изобретения для парэнтерального введения могут быть представлены в виде водных инъекционных растворов, которые могут содержать антиоксиданты, буферы, антисептические агенты, солюбилизирующие агенты, хемопротектанты и т.д. Приготовляемые на месте инъекционные растворы могут быть получены из стерильных пилюль, гранул или таблеток, которые могут содержать растворители, диспергирующие и поверхностно-активные вещества, связывающие и смазывающие вещества, которые являются известными материалами.
В случае орального введения, тонкие порошки или гранулы желаемого продукта могут быть представлены с растворителями и диспергирующими и поверхностно-активными агентами, и могут быть приготовлены в воде или сиропе, в капсулах или облатках в сухом виде или в неводной суспензии, куда может быть включен суспендирующий агент. Желаемые продукты могут также вводится в форме таблеток вместе с необязательными связывающими и смазывающими веществами, или в виде суспензии воды, или сиропа, или масла, или воды/масляной эмульсии, или в твердом высвобождающемся виде из биодеградирующих и биоразрушающихся полимеров и могут включать ароматизирующие, консервирующие, суспендирующие, сгущающие и эмульгирующие агенты. Гранулы или таблетки для орального введения могут быть в оболочке или другие фармацевтически подходящие агенты и формы могут быть использованы на основании известных медицинских приемов.
Твердые или жидкие носители могут быть также использованы. Твердые носители включают крахмал, лактозу, дигидрат сульфата кальция, гипс, сахарозу, тальк, желатин, агар, пектин, гуммиарабик, стеарат магния и стеариновую кислоту. Жидкие носители включают сироп, ореховое масло, оливковое масло, физиологический раствор и воду. Мази и кремы получают, используя различные хорошо известные гидрофильные и гидрофобные основания. Временные упаковки соответственно получают, используя известные полимерные материалы, такие как различные полимеры на основании акрила, выбранные для обеспечения требуемых высвобождающих характеристик. Свечи могут быть получены из стандартных оснований, таких как полиэтиленгликоль и масло какао. Липосомы могут также использоваться как носители для продуктов изобретения.
Дополнительно, желаемые продукты могут быть гербицидами, пестицидами, регуляторами роста и т.д. Использование и введение продуктов изобретения для сельскохозяйственных целей, как известно, одни из обычных применений знаний. Продукты изобретения могут также использоваться в химических промышленных процессах.
Примеры.
Следующие примеры иллюстрируют предпочтительные представления способов получения и продуктов изобретения и кроме того не истолковываются как ограничивающие изобретение.
Пример 1.
Использование немодифицированных РНК для облегчения реакции Дильса-Альдера в синтезе ПЭГ линкера.
Линкер из полиэтиленгликоля (ПЭГ) был синтезирован для действия в качестве спейсера между нуклеиновыми кислотами (в случае 40N8 ДНК) (SEQ ID N0:2) и первым реагентом (в этом случае малеимидом). Схема для синтеза линкера показана ниже.
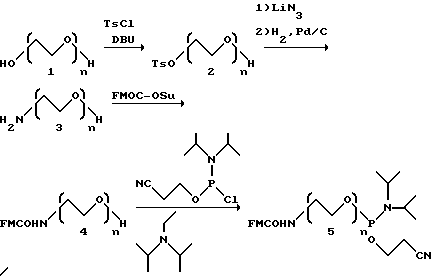
Синтез тозилированного ПЭГ (Ts-ПЭГ) (2) - Полиэтиленгликоль 1, 1.0 г (0.670 ммоль, средний молекулярный вес 1500) растворяли в 15 мл сухого ТГФ и растворитель удаляли in vacuo. К оставшемуся остатку, растворенному в 15 мл сухого ТГФ, было добавлено 52 мг (0.335 ммоль) DBU, за которым последовали 64 мг (0.335 ммоль) р-толуолсульфонилхлорид. Смесь перемешивали под аргоном при комнатной температуре в течение 10 дней, за это время сформировался белый осадок. Через 10 дней реакционную смесь отфильтровали и растворитель удалили in vacuo. Очистка монотозилированного продукта тонкослойной хроматографией на силикагеле (7% МеОН/CH2Cl2) дала выход 320 мг (58%) слабо желтого твердого (Rf= 0.31). Продукт идентифицировали на основании его 1H ЯМР спектра.
Синтез амино-ПЭГ (2) В 2 мл сухого ДМФ растворили 400 мг (0.243 ммоль) Ts-ПЭГ (2), за которым последовали 119 мг (2.43 ммоль) азида лития. При перемешивании и в атмосфере аргона реакционную смесь нагревали до 80oC в течение 5 ч. После охлаждения до комнатной температуры смесь профильтровали через кремниевый фильтр и фильтр промывали 10% MeOH/CH2Cl2 до тех пор, пока продукт перестал обнаруживаться в элюенте. Комбинированный фильтрат выпарили досуха при пониженном давлении. Оставшийся осадок растворили в 4 мл MeOH, в который добавили 30 мг 5% Pd/C, и раствор перемешивали при одной атмосфере водорода в течение 16 ч. Смесь затем отфильтровали через целит. Целитовый фильтр промывали MeOH, комбинированный фильтрат и растворитель выпаривали при пониженном давлении, получая не совсем белое твердое. Очистка тонкослойной хроматографией на силикагеле (12% MeOH•NH3/CH2Cl2) дала выход 279 мг (77%) желаемого амино-ПЭГ продукта 3 (Rf=0.38, 15% MeOH•NH3/CH2Cl2) в виде белого твердого.
Синтез FMOC-ПЭГ (4) Амино-ПЭГ (3) был высушен добавлением 840 мг (0.563 ммоль) в 75 мл сухого ТГФ, за которым последовало удаление растворителя на роторном испарителе. В атмосфере аргона амино-ПЭГ затем растворили в 50 мл сухого ТГФ, обработанного 190 мг (0.563 ммоль) 9-флуоренилметил сукцинимидил карбоната, и раствор перемешивали при комнатной температуре под аргоном в течение 2 ч. Растворитель затем удалили на роторном испарителе и продукт очищали тонкослойной хроматографией на силикагеле (8% MeOH•NH3/CH2Cl2), получая 863 мг (92%) белого твердого (Rf=0.28, 10% MeOH•NH2/CH2Cl2).
Синтез FMOC-ПЭГ фосфорамидита (5) - FMOC-ПЭГ (4) высушили растворением 173 мг (0.104 ммоль) в 25 мл сухого ТГФ, за которым последовало удаление растворителя на роторном испарителе. В атмосфере аргона FMOC-ПЭГ затем растворили в 25 мл сухого CH2Cl2, обработанного 34.8 мл (0.208 ммоль) диизопропилэтиламина, а затем 36.2 мл (0.156 ммоль) 2-циано N,N- диизопропилхлорфосфориамидита. Смесь затем перемешивали в течение одного часа при комнатной температуре. Растворитель и остаток основания затем удалили при пониженном давлении. Желаемый продукт фосфорамидит очистили тонкослойной хроматографией на силикагеле (8% MeOH•NH3/CH2Cl2), получая 190 мг (97%) белого твердого (Rf=0.30, 10% MeOH•NH3/CH2Cl2).
ДНК-ПЭГ конъюгирование и добавление первого реагента.
Защищенный ПЭГ линкер, синтезированный выше, затем конъюгировали с 5'-концом ДНК 10-мера (для облегчения лигирования со случайной РНК), а затем последовало связывание с первым реагентом (в данном случае малеимидом), как показано на схеме ниже.
Примененный Biosystems DNA synthesier использовался для синтеза ДНК 10-мера (5'-CCAGGCACGA) (SEQ ID NO. 1) и конъюгирования FMOC-ПЭГ фосфорамидита, синтезированного выше, в одной процедуре, используя стандартные фосфорамидитидные методики, указанные выше. ДНК-ПЭГ конъюгат отделили от CPG (controlled pore glass) твердофазной подложки и полностью сняли защиту, используя стандартную инкубацию в течение ночи в концентрированном гидроксиде аммония, получая ДНК-ПЭГ свободный амин вида 6. Любой субстрат может быть затем добавлен к концу ПЭГ-цепи, используя ряд реакций. Например, диенофил малеимид добавляют для реакции Дильса-Альдера реагированием амина ДНК-ПЭГ с малеимидом активированным эфиром 7 для получения амида 8.
Получение пула случайных РНК, имеющих 5'-монофосфат.
Пул случайных последовательностей 40N8 RNA (SEQ ID NO.2) получали, используя стандартные SELEX стратегии и методы, из синтетической случайной последовательности одноцепочечной ДНК (ssDNA) образца, полученного из Ореrон (Alameda, CA). Случайная область была получена использованием смеси четырех нуклеотидов (молярные отношения которых подобраны для выхода 1:1:1:1 соотношений включенных нуклеотидов) в течение олигонуклеотидного синтеза. Одноцепочечные ДНК, содержащие 40 нуклеотидов смежных случайных последовательностей ограничены определенными 5'- и 3'-концами, что дает возможность гибридизации праймера. Двухцепочечные ДНК (dsDNA) молекулы, синтезированные Taq-полимеразой, имеют T7 RNA полимеразный промотор на 5'-конце для облегчения транскрипции.
Каждая реакция транскрипции состоит из 100 пмоль 40N8 двухцепочечной ДНК с 80 мкл 5Х Т7 РНК полимеразного буфера (200 мМ Трис -pH8.0, 60 мМ MgCl2, 5 мМ спермадин, 25 мМ DTT, 20% глицерин, 0.01% Тритон-X-100), 40 мкл 10 мМ ГТФ, 40 мкл 10 мМ ЦТФ, 40 мкл 10 мМ АТФ, 40 мкл 10 мМ УТФ, 40 мкл 500 мМ ГТФ, 8 мкл РНазина (Promega, 40,000 ед/мл), 24 мкл Т7 РНК полимеразы (New England Biolabs, 50,000 ед/мл), и дистиллированной воды до конечного объема 400 мкл.
После инкубации в течение ночи при 37oC 5'-монофосфат РНК был очищен, используя 8%-ный денатурирующий полиакриламидный гель. 5'-монофосфат необходим для лигирования РНК с ДНК частью линкерной последовательности, как описано ниже.
Лигирование случайной РНК с ДНК-ПЭГ-малеимидом.
Пул случайной последовательности РНК получали, как описано выше. ДНК 10-мер (SEQ ID NO. 1) и ДНК мостик олиго (5'-CTTGTCTCCCGCGTGCCTGG) (SEQ ID N0.3), использованные в реакции лигирования, были получены из Operon (Alameda, CA) и очищены в геле перед использованием. 100 пмоль случайной 40N8 РНК (SEQ ID NO.2) были мечены по концам дефосфорилированием бактериальной щелочной фосфатазой (Gibco BRL) и последующим фосфорилированием T4 полинуклеотидной киназой (New England Biolabs) и γ- [32P]АТФ.
Реакция лигирования включала 50 пмоль случайной 40N8 РНК, приблизительно 60,000 спм случайной, меченной по 5'-концу 40N8 РНК, 100 пмоль ДНК-ПЭГ-малеимида, 150 пмоль ДНК олигомостика, 2.5 мл 10X T4 ДНК лигазного буфера (50 мМ Трис-pH 7.8, 10 мМ MgCl2, 10 мМ DDT, 1 мМ АТФ, 25 мг/мл альбумина бычьей сыворотки), 0.5 мкл РНазина (Promega, 40,000 ед/мл), T4 ДНК лигазы до конечной концентрации 1.2 Weiss ед/мл (New England Biolabs), и дистиллированной воды до конечного объема 25 мкл. 1.2 Weiss ед/мл были получены переведением New England Biolabs единиц в Weiss единицы, используя фактор переведения, обнаруживаемый в любом из этих каталогов (1 NEB=0.015 Weiss единиц).
Все компоненты, за исключением РНазина и T4 ДНК лигазы, были смешаны, инкубированы при 70oC в течение 3 мин и медленно охлаждены до менее 37oC. Затем добавили РНазин и T4 ДНК лигазу и смесь инкубировали в течение 90 мин при 37oC. После инкубации добавили РНК насыщенный буфер и смесь нагревали до 70oC в течение 3 мин и затем нанесли в заранее нагретый 8%-ный денатурирующий полиакриламидный гель. Выход лигирования определяли авторадиографически. Полученный РНК-ДНК-ПЭГ-малеимид является тестируемой смесью нуклеиновая кислота-реагент.
Получение биотинилированного диенового конъюгата.
NHS-биотин (Pierce, 99.3 мг, 0.291 ммоль) и 2,4-гексадиен-1-ол (66.2 мг, 2.3 эк. ) были смешаны в 10 мл сухого пиридина под аргоном при 0oC и перемешивались в темноте в течение ночи, поддерживаясь при температуре окружающей среды. Мониторинг реакционной среды ТСХ (50% EtAc/гексан) показывал медленную реакцию и раствор затем поставили кипятить с обратным холодильником под аргоном в течение ночи. Удаление растворителя in vacuo, за которым последовала тонкослойная хроматография на силикагеле с 5% MeOH/EtOAc, затем 6% MeOH/CH2Cl2, что позволило получить чистый продукт 9, который был охарактеризован на основании его 1H и 1H-1H COSY ЯМР спектров.
Химическая реакция.
Тестируемая смесь нуклеиновая кислота-реагент, полученная выше (РНК-ДНК-ПЭГ-малеимид), реагирует со вторым реагентом (биотинилированным диеном) при следующих условиях. 1-2 нмоль (≈50,000 спм) тестируемой смеси нуклеиновая кислота-реагент растворили в 50 мкл реакционного буфера (10 мМ MES, 200 мМ NaCl, pH 6.5), может быть альтернативный реакционный буфер (10 мМ Трис, 300 мМ NaCl, pH 7.0). Смесь нагревали до 70oC в течение 5 мин. Затем добавили MgCl2 до конечной концентрации 100 мкМ и 10 мкМ соответственно и смесь инкубировали при комнатной температуре в течение 12 ч. Затем раствор поместили на иммобилизованную стрептавидином колонку и колонку интенсивно промывали реакционным буфером, содержащим 10 мкМ MgCl2. Связанная РНК снимается с колонки обработкой протеиназой К, за которой следует промывание колонки реакционным буфером. Альтернативно РНК могут быть обратно транскрибированы, причем еще связанные со смолой или с дисульфидно связанным биотиндиен субстратом могут быть использованы в том случае, если РНК элюируют с колонки, используя 50 мМ DTT. Увеличение пула следует за числом спм, вымываемых следующей стандартной обработкой протеиназой К. Элюированные РНК затем обратно транскрибируются, получающаяся кДНК амплифицируется PCR и двухцепочечная ДНК транскрибируется как в обычных SELEX экспериментах. ДНК-ПЭГ-малеимид конъюгат лигируют с РНК, как описано выше, и процесс повторяют до тех пор, пока количество конечного продукта не станет достаточно значительным для определения его структуры.
Пример 2.
Использование немодифицированной РНК и металлов в растворе для облегчения проведения реакции Дильса-Альдера.
Процедуру, проводимую в примере 1, повторили точно, с включением ионов металлов алюминия (III) и кобальта (II) в реакционном растворе.
Пример 3.
Использование модифицированной РНК (включающей пиридин-модифицированный УТФ) для облегчения реакции Дильса-Альдера.
Нуклеиновые кислоты изобретения могут быть модифицированы различными процедурами, описанными предварительно. Приводится один пример модифицированной нуклеиновой кислоты, где УТФ молекулы могут быть модифицированы включением пиридинового остатка в 5-положение. Пиридин-модифицированный УТФ включается в случайную РНК, описанную предварительно. Модифицированные РНК связываются через ПЭГ-линкер и используются для облегчения реакции Дильса-Альдера.
Следующая процедура была сделана для синтеза уридин трифосфат (УТФ) производного, который имеет пиридиновый остаток в 5-положении основания.
Карбоксиамидирование
Раствор 5-иодоуридина-2', 3'- изопропилидена (0.225 г, 0.545 ммоль), Pd(PPh3)4 (0.1 эк., 56 мг), триэтиламина (10 эк., 0.76 мл) и 4-(аминометил)-пиридина (4 эк. , 0.23 мл) приготовили в 10 мл сухого ТГФ под аргоном в высушенном пламенем стеклянном баллоне, оборудованным тефлоновым краном. Баллон был предварительно загружен 50 psi СО и вакуумирован три раза, затем герметизирован 50 psi СО и закрыт. Колба тщательно перемешивалась при нагревании до 70oC. После 2 ч начиналась видимая металлизация палладия. Колбу перемешивали дополнительно 18 ч, охлаждали и удаляли газ, и раствор упаривали до желтоватого масла. Хроматография на силикагеле с 8-10% MeOH/CH2Cl2 градиенте элюции дает 0.177 г (78%) В в виде белого твердого. Характеризуют по его 1H, 13С ЯМР спектру. Аналитические образцы могут быть получены перекристаллизацией из метанола.
Получение трифосфата.
Трифосфат получали процедурой Ludwig и Eckstein (J. Org. Chem. 1989, 54, 631-635), используя 5'-гидроксил модифицированный уридин, полученный выше. Трифосфат был очищен при пропускании реакционной смеси в дистиллированной воде через анионобменную колонку (Сефадекс ДЭАЭ) с 0.05-1.00 М ТВК (триэтил аммоний бикарбонат) буферным раствором. Лиофилизация фракций, которые содержат трифосфат, дает изопропилиден-защищенный трифосфат, который был охарактеризован по его 31ЯМР спектру. Изопропилиденовую защитную группу удалили нагреванием трифосфата в 5 мл дистиллированной воды с 100 мг Dowex 50WX8 смолы (H+ форма) в течение 15 мин при 70oC, за которым последовала нейтрализация с 2 М ТВК буфером (с pH 8). Конечную очистку этого раствора проводили обращеннофазной препаративной ВЭЖХ (C18 колонка) с 3-5% градиентом CH3CN в 0.05 М ТВК буфере. Полученный таким образом трифосфат (II) был охарактеризован на основе его 1H и 13P ЯМР спектров как трис(триэтиламмония) соль и определен количественно по УФ поглощению (277 нм, ε = 14,600 M-1см-1).
Реакция продолжалась как описано в примере 1 выше.
Пример 4.
Использование модифицированной РНК (включающей гистидин-модифицированный УТФ) для облегчения расщепления GRB.
Нуклеиновые кислоты этого изобретения могут быть модифицированы различными процедурами, описанными ранее. Приводится один пример модифицированной нуклеиновой кислоты, где УТФ молекулы модифицированы включением гистидинового остатка в 5 положение. Гистидин-модифицированный УТФ включают в случайную РНК (SEQ ID NO.2), описанную ранее. Модифицированные РНК связываются с реагентом через ПЭГ линкер и используются для облегчения расщепления гастрин расщепляющего пептида (Gastrin Realising Peptide, GBR).
Синтезирование гистидин-модифицированного УТФ.
Следующая процедура была сделана для синтеза уридин трифосфат (УТФ) молекул, которые имеют гистидиновый остаток в 5-положении.
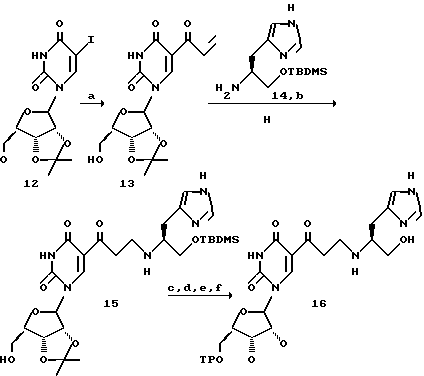
Ключ: (a) Pd(OAc)2, CuI. Pph3, CH2CHSn(Bu)3, CO, ТГФ, 70oC, 5 ч, (b) основание Хьюнига, ДМФ, комн. температура, 1 ч, (с) 2-хлоро-4H- 1,2,3-бензо-диоксофосфорин-4-он, P2O7 4- (HNBu3)2 2+, пиридин, диоксан, (d) I2, пиридин/H2O (98:2), (е) NH4OH, (f) Dowex 50w x8, H2O, 70oC, 15 мин.
В автономном связывающем аппарате, оборудованный уравновешенной давлением наполнительной воронкой в инертной атмосфере бокса с перчатками было взвешено 702.3 мг (2.0 ммоль) 12, 44.9 мг (0.20 ммоль) ацетата палладия, 114.3 мг (0.60 ммоль) иодида меди (I) и 157.4 мг (0.60 ммоль) трифенилфосфина. Аппарат закрыли, удалили из бокса и 30 мл безводного ТГФ в круглую нижнюю часть аппарата через трубку. В наполнительную воронку добавили через трубку продутый аргоном раствор 0.643 мл (2.2 ммоль) винилтрибутилтина в 40 мл безводного ТГФ. Колбу последовательно вакуумировали и заполняли три раза СО, затем нагревали при 70oC в течение 1.0 ч до тех пор, пока желтый раствор стал слабо оранжевым. Раствор винилтрибутилтина затем добавили со скоростью 1 капля в 10 с. Раствор превратился в темно-красный после добавления 5-10% реагента. Раствор нагревали при 70oC в течение 5 ч, после чего охлаждали и концентрировали in vacuо. Осадок растворяли в CH2Cl2, помещали на кремниевый фильтр, промывали 200 мл гексана, 200 мл CH2Cl2 и продукт элюировали 5% CH3ОН/CH2Cl2. Элюент концентрировали и проводили тонкослойную хроматографию на силикагеле с 5% CH3ОН/CH2Cl2, получая 0.294 г 2 как твердого белого.
Гистидинол-продукт реакции присоединения Михаэлиса.
TBDMS защищенный гистидинол 14 - В перемешиваемый раствор 205 мг (5.1 ммоль) NaH, промытого 3 раза гексаном, под аргоном в 3.0 мл ДМФ добавляли частями 500 мг (2.3 ммоль) гистидинол дигидрохлорида, получая умеренное выделение газа. Раствор перемешивали в течение 1.5 ч, затем добавили 1.8 мл (23 ммоль) безводного пиридина и 693.0 мг (4.6 ммоль) TBDMSCI. Раствор перемешивали в течение 1.5 ч, концентрировали in vacuо и проводили хроматографию на силикагеле с 15% CH3ОН•NH3/CH2Cl2, получая 3.
Продукт реакции присоединения Михаэлиса 15 - В перемешиваемый раствор 167.9 мг (0.6 ммоль) 13 в 10 мл безводного ДМФ добавили 0.105 мл (0.6 ммоль) диизопропилэтиламина, затем по каплям раствор 185 мг (0.72 ммоль) 3 в 1.85 мл безводного ДМФ. Раствор перемешивали в течение 1 ч, концентрировали in vacuo и проводили тонкослойную хроматографию на силикагеле с 15% CH3ОН•NH3/этилацетат, получая 90.0 мг 15 в виде белого твердого, охарактеризованного на основании его 1H ЯМР спектра.
Получение трифосфата.
В раствор 15 в диоксане/пиридине добавили по каплям раствор 2-хлор-4H-1,2,3-бензо-диоксофосфорин-4-он в ТГФ и рствор перемешивали в течение 20 мин, затем последовательно добавили 0.5 М раствор бис(трибутиламмония)пирофосфата в ДМФ и трибутиламин. Раствор перемешивали в течение дополнительных 20 мин и добавили пиридин/вода раствор I2, и раствор перемешивали в течение 20 мин. Излишек иода уничтожили 5%-ным бисульфитом натрия, перемешивая 15 мин, раствор сконцентрировали и гидролизовали концентрированным гидроксидом аммония. Аммиак удалили in vacuо, оставшийся раствор промыли дважды CH2Cl2, один раз этилацетатом И сконцентрировали in vacuо. Осадок растворили в воде и перемешивали с Dowex смолой в течение 15 мин при 70oC. Раствор отфильтровали, нейтрализовали 2 М ТВК буфера, поместили сразу на ДЭАЭ сефадекс и элюировали с градиентом 0.05 М триэтиламмоний бикарбонатном буфере (ТВК буфер) в 1.0 М ТВК буфере, получая продукт, слегка загрязненный салицилатом и небольшим количеством с еще целыми TBDMS и изопропилиденовой защитными группами. Материал еще раз обработали dowex смолой и очистили на обращеннофазной ВЭЖХ С 18 колонке с градиентом 0-5% ацетонитрила в 0.05 М ТВК буфере за 15 мин, получая чистый 16 по 1H, 13C и 31P ЯМР.
Эксперимент продолжают как описано в примере 1 выше, однако, прежде чем образуется циклогексеновый продукт, нуклеиновая кислота гидролизует GBR белок.
Пример 5.
5'-фосфоротиоат-модифицированная РНК, связанная с N-бромацетил-брадикинином.
Пример описывает процедуру параллельного SELEX, где связанным реагентом является 5'гуанозин монофосфоротиоат (GMPS), непосредственно связанный с тестируемой смесью случайных нуклеиновых кислот. Свободный реагент является бромацетиловой группой, связанной с брадикининовой мишенью (BrBK). Этот пример описывает выбор и анализ 5'гуанозин монофосфоротиоат-замещенной РНК (GMPS-PHK), которая специфически реагирует с N- бромацетилированным брадикинином (BrBK) и облегчает образование тиоэфирной связи между РНК и BrBK пептидом. Предварительная работа в этой области показала, что трудно получить лиганды к брадикинину как в свободном растворе, так и конъюгированием с твердой матрицей. Как будет описано ниже, РНК, показывающая 6700-кратное увеличение kcat/Km и 100-кратное увеличение аффинности связывания для N-бромацетил-брадикинина по сравнению с начальным пулом, была идентифицирована. Эта РНК связывает этот субстрат с высокой специфичностью, требуя и амино- и карбоксиконцевые аргининовые остатки пептида для оптимальной активности.
A. Параллельный SELEX.
Реакция параллельного SELEX проводилась, используя 5'гуанозин монофосфоротиоат (GMPS) как связанный реагент, добавляемый к тестируемой смеси РНК, и бромацетилированный брадикинин (BrBK) и как свободный реагент и как мишень. GMPS-PHK выбирали по способности быстро замещать тиогруппу РНК на бромидгруппу BrBK. Продукт, BK-S-PHK, затем отделяли удалением от оставшихся непрореагировавших GMPS-PHK и реамплифицировали до продолжения другого отборочного цикла.
1. GMPS-PHK.
Параллельный SELEX проводили с начальным случайным набором приблизительно 5•1013 GMPS-PHK молекул длиной 76 нуклеотидов, имеющих центральный район из 30 случайно выбранных нуклеотидов (30N1) (SEQ ID NO: 4), описанный подробно Schneider и соавт. (FASEB, 7, 201 (1993)), с определенными участками, использующимися в амплификации. Тестируемая смесь нуклеиновая кислота-реагент формировалась при включении GMPS в начальные и последующие реакции транскрипции таким образом, что предпочтительно использовалось свыше эквимолярного ГТФ в начале транскрипции T7 РНК полимеразой, чтобы приблизительно 80% полных цепей продукта начинались GMPS. GMPS-PHK транскрибировали и очищали на Amicon Microcon-50 центрифугированием, удаляя излишек GMPS. GMPS-PHK отделяли от не-GMPS- PHK, используя тиопропил сефарозу 6B, элюируя с матрицы дитиотретолом (DTT) и очищая от DTT другим Microcon-50 spin-разделением. Тиопропил сефароза 6B (Pharmacia) предварительно промывалась на колонке буфером (500 мМ NaCl, 20 мМ HEPES pH 7.0) и затем spun dry при 12000 g перед использованием. Для GMPS-PHK очистки, очищенную на Microcon-50 колонке помещали до конечной концентрации в 500 мМ NaCl, 10 мМ ЭДТА и 20 мМ HEPES pH 7.0 и добавляли к матрице в расчете 25 мкл на 60 мкл пустого объема. Смесь затем реагировала при 70oC в течение 5 мин, spun при 12000 g, spin-промывали 4 объемами колонки 90% формамидом, 50 мМ MES pH 5.0 при 70oC, spin-промывали 4 объемами колонки 500 мМ NaCl в 50 мМ MES, pH 5.0 и spin-промывали 4 объемами колонки 100 мМ DTT в 50 мМ MES, pH 5.0. Эти условия оптимизированы для удерживания и последующего элюирования только GMPS-PHK.
2. Бромацетилированный брадикинин.
Бромацетилированный брадикинин (BrBK) использовали и как свободный реагент, и как мишень в этом примере. Бромацетильная группа является свободным реагентом. BrBK синтезировали реакцией 50 мкл 5 мМ брадикинина с тремя последовательными 250 мкл порциями 42 мМ бромуксусной кислоты N-гидроксисукцинимидного эфира при 12-мин интервалах при комнатной температуре. Излишек бромуксусной кислоты N-гидроксисукцинимидного эфира удаляли фильтрацией на 5 мл аминоэтилакриламида (пять минут реакции при комнатной температуре), за которой последовало отделение BrBK на GS-10 сефарозе. Концентрация BrBK определялась на 220 нм, используя коэффициент абсорбции 12000 см-1М-1.
3. Реакция отбора.
Все виды GMPS-PHK, которые наиболее подходят для проведения реакции BrBK, выбирали итерационно посредством множества циклов SELEX. Циклы отбора проводились в реакционном буфере с 1.1 мМ BrBK. и с GMPS-PHK концентрациями для данных времен и температур, представленных в таблице.
В течение отбора концентрация BrBK пептида сохранялась 1.1 мМ, концентрация 12-кратно ниже, чем Km цикла 0 пула с BrBK. При проведении отбора реакционное время было ограничено и температура реакции была уменьшена, для того, чтобы ограничить реакцию 5% или меньше общей GMPS-РНК. Объект поддерживался в условиях реакции второго порядка для того, чтобы выбрать улучшения и в связывании, и в химии. Активность BrBK проверяли при 12.5 мкМ BrBK с 25 мкМ GMPS-PHK; когда реакция проходила полностью, 50% РНК ковалентно связывались с BrBK, показывая, что бромацетилирование пептида было практически полным.
Реакцию заканчивали конечной концентрацией или 235 мМ трифосфата натрия (циклы 1-8) или тиосульфата натрия (циклы 9-12) и разделяли или на денатурирующих с 7 М мочевиной 8% полиакриламидных АМР гелях (циклы 1-6), или аффинной хроматографией (циклы 7-12); % прореагировавшей РНК представляет собой процент от общего GMPS-PHK, представленный как BK-S-РНК из разделения в акриламидном геле, или как свободно элюированный BK-S-PHK в разделении аффинной хроматографией. Фон вычитался из извлеченной РНК в обоих этих случаях; фон представляет собой количество РНК, извлеченной из контрольной обработки, когда реакцию останавливали перед добавлением BrBK. Степень фона означает соотношение прореагировавшей РНК к той, что присутствует как фон. Пытались сохранить это соотношение между 2 и 10 во всех циклах SELEX, регулируя время реакции.
Разделение проводили или удаляя GMPS-PHK на тиопропил сефарозе 6B, или разделением двух видов на АМР полиакриламидном геле. [(В-акриламино)фенил] хлорид ртути (II) (АМР) синтезировали и использовали в концентрации 25 мкМ в денатурирующем полиакриламидном геле электрофорезе для задержания тиол-содержащих РНК, как показано G.L.Igloi, Biochemistry 27, 3842(1988). GMPS-PHK очищали из АМН полиакриламида элюированием в присутствии 100 мМ DTT. Совпадая с приведенной литературой, обнаружили, что свежеочищенная АМР-задержанная GMPS-PHK при повторном прохождении на АМР геле, дает отдельную группу незадерживаемых РНК, составляющую приблизительно три процента от общего количества использованной GMPS-PHK. Свободнопроходящие РНК являлись проблемой, так как они бежали очень близко к ВК-РНК (задержка уменьшается в зависимости от процента акриламида, использованного в геле), и, таким образом, увеличивали фон в течение разделения. Когда эти свободнопроходящие РНК очистили из геля и снова прогнали на АРМ геле, приблизительно 50% этих РНК остались свободнопроходящими, в балансе с РНК, бегущими как GMPS-PHK. Количество свободнопроходящих РНК было пропорционально количеству времени, затраченному на преципитацию, но не зависело от влияния pH, присутствия или отсутствия DTT, ацетата магния, формамида, мочевины или нагревания.
Обратную транскрипцию и полимеразную цепную реакцию проводили как описано Schneider и соавт., (FASEB, 7, 201 (1993)). Величина kobs пула GMPS-PHK увеличивалась 100-кратно между циклами 4 и 6, увеличиваясь только 2-кратно при дальнейших циклах. Реакции по определению величин kobs проводили при 0oC в реакционном буфере (50 мМ HEPES, pH 7.0, 5 мМ MgCl2, 150 мМ NaCl) для 2 мкМ GMPS-PHK и 130 мкМ BrBK с мониторингом 0, 1, 3, 10, 30 и 90 мин. GMPS-PHK денатурировали при 70oC в течение 3 мин и медленно охлаждали при комнатной температуре перед разбавлением реакционным буфером до конечных условий, помещали в лед и добавляли BrBK. Реакцию останавливали льдом с 235 мМ тиосульфата натрия и прогоняли на 7 М мочевины 8% полиакриламида АРМ геле. Величины-kobs определяли как отрицательный наклон линейной части точек данных из графика, связывающего концентрацию непрореагировавшего GMPS-PHK в зависимости от времени. Пулы циклов 10 и 12 использовались для клонирования и секвенирования.
В. Клоны.
Пятьдесят шесть независимых клонов были секвенированы. 16 реагентов сравнивались с 30N1 объемным пулом по реакционной способности с BrBK; все протестированные реагенты показали от 10- до 100-кратного увеличения kobs относительно первоначального пула. Реагент 12.1 (SEQ ID NO:5) был выбран для дальнейшего кинетического анализа по трем критериям: (i) в предварительном изучении реакции ингибирования с соответствующим брадикинином он имел наименьшую Ki для брадикинина (данные не показаны); (ii) он был наиболее часто встречаемой молекулой в популяции цикла 12; и (iii) он имел вторую наиболее быструю kobs из тестируемых реагентов.
Выбранное увеличение kobs реагента 12.1 является характерным признаком увеличения и реакционной способности и связывания. В реакции с BrBK реагент 12.1 показывает 67-кратное увеличение kcat, чем у объема 30N1 GMPS-PHK, при 100-кратном уменьшении Km, давая более чем 6700-кратное увеличение kcat/Km (см. таблицу).
C. Специфичность.
Структурные элементы BrBK., требуемые для оптимального связывания реагентом 12.1, изучались через ингибирование реакции брадикининовыми аналогами. Так как ингибирование незначительно в реакции объема 30N1 GMPS-PHK с BrBK (данные не показаны), нативный брадикинин (BK) имеет Ki 140 ± 60 мкМ для реакции между реагентами 12.1 и BrBK. Эта величина близко идентична Km реакции ингибирования. Des-Arg9-BK ( аналог BK, не имеющий карбоксильного концевого аргинина) имеет Ki 2.6 ± 0.5 мМ. Таким образом, удаление карбоксильного концевого аргинина уменьшает связывание между BK и реагентом 12.1 приблизительно 18-кратно. Более того, des-Arg1-BK (аналог BK, не имеющий аминоконцевого аргинина) не показывает какого-либо значительного ингибирования реакции между реагентами 12.1 и BrBK, показывая, что аминоконцевой аргинин является абсолютно обязательным для обнаружения связывания между реагентом 12.1 и BrBK.. Узнавание аргинина должно быть в связи с пептидом, поскольку, после освобождения L-аргинина, он один не дает какого-либо ингибирования реакции. Таким образом, увеличение аффинности реагента 12.1 по сравнению с объемом 30NI GMPS-PHK для BrBK частично характерное свойство для узнавания реагентом аминоконцевого аргинина BrBK, и в меньшей степени карбоксильного концевого аргинина.
Собственную реакционную активность реагента 12.1 изучали, используя N-бромацетамид (BrAcNH2) как минимальную бромацетильную структуру. Величины Km и kcat в реакциях реагента 12.1 и 30NI РНК пула с BrAcNH2 приблизительно равны. Кроме того, увеличенная скорость реакции реагента 12.1 с BrBK, по-видимому, появляется не из-за увеличенной нуклеофильности тиогруппы, а скорее как результат стерических и/или энтропийных факторов в расположении двух субстратов. Таким образом реакция является облегченной, что и требуется для параллельного SELEX.
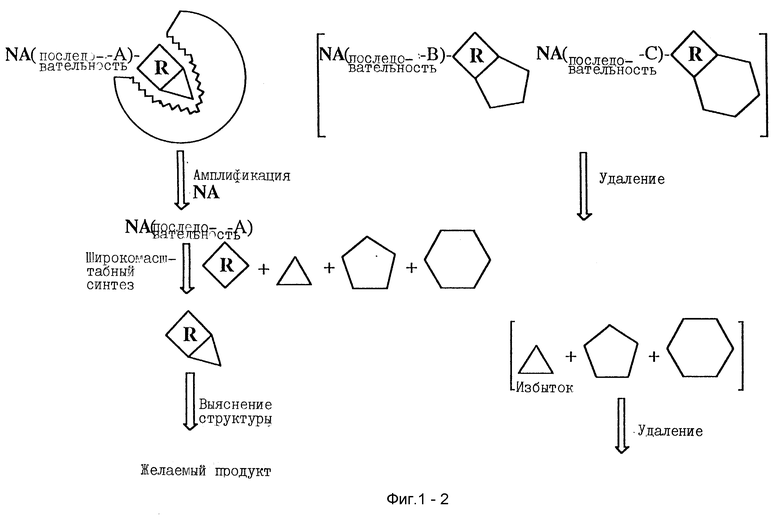
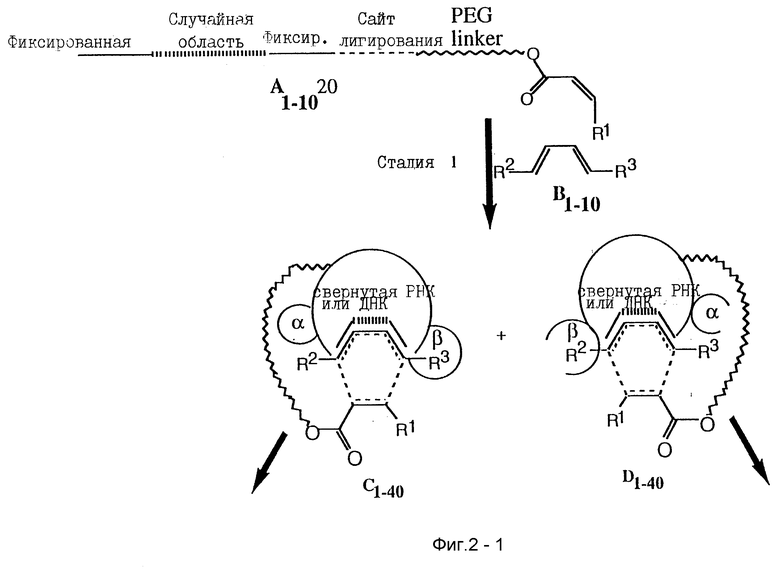
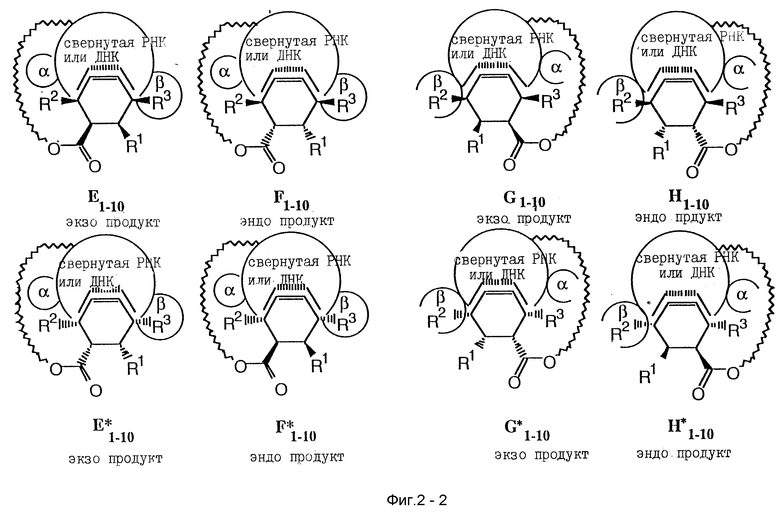
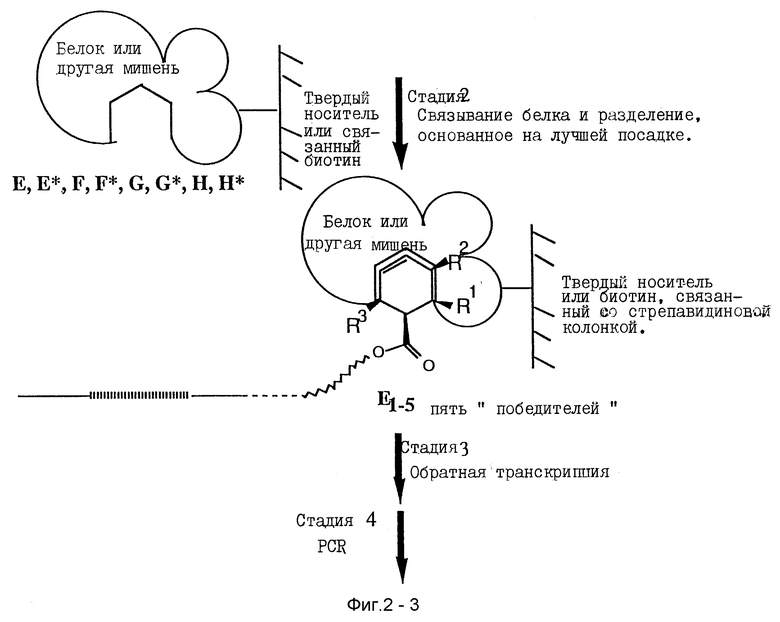
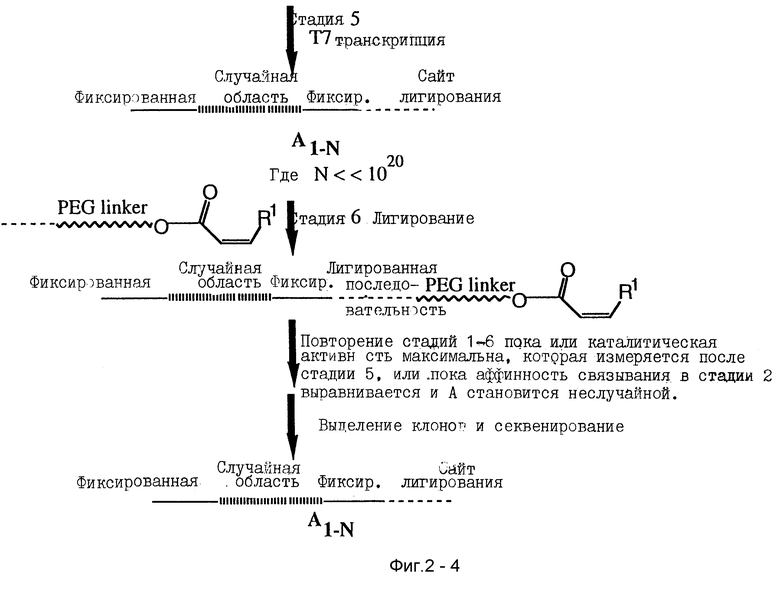
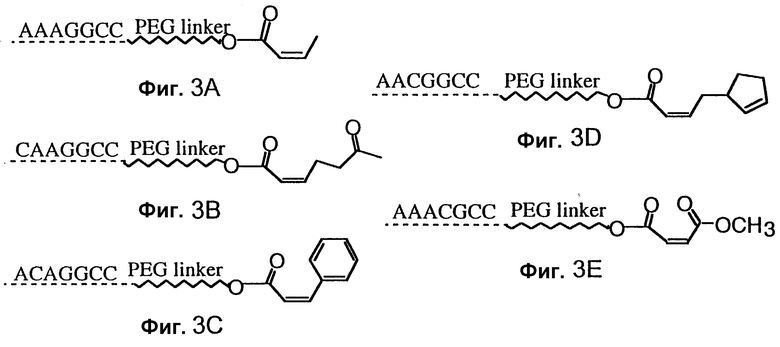
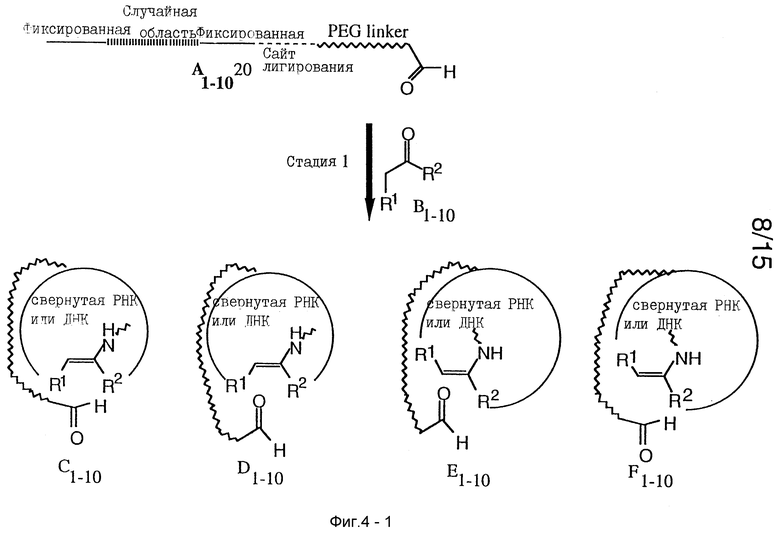
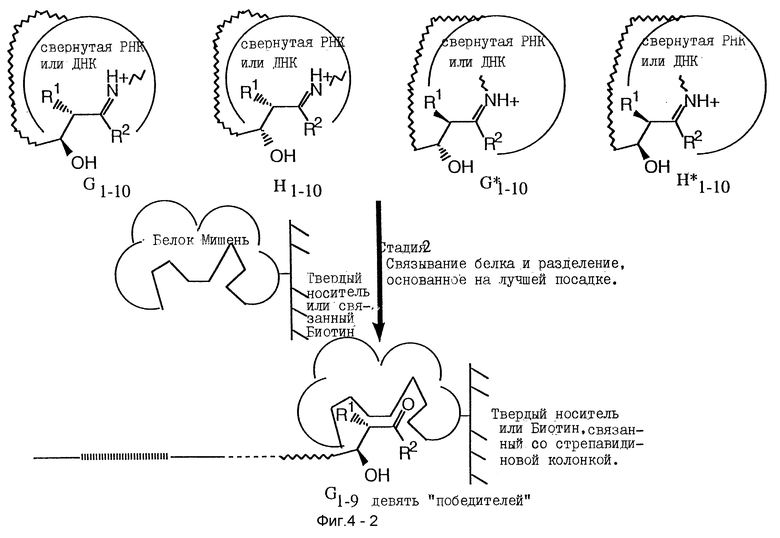
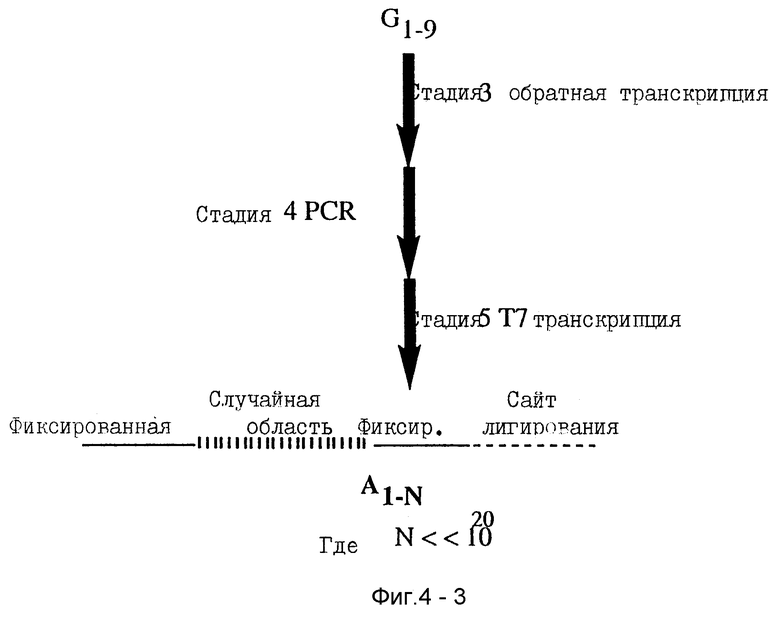
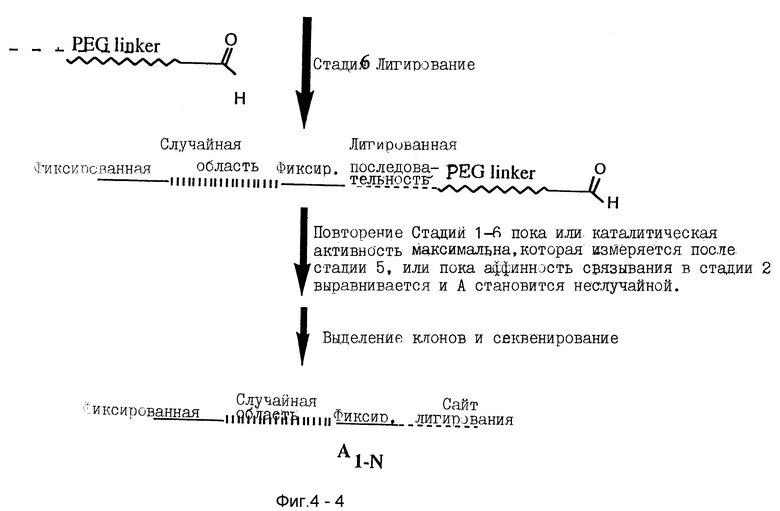
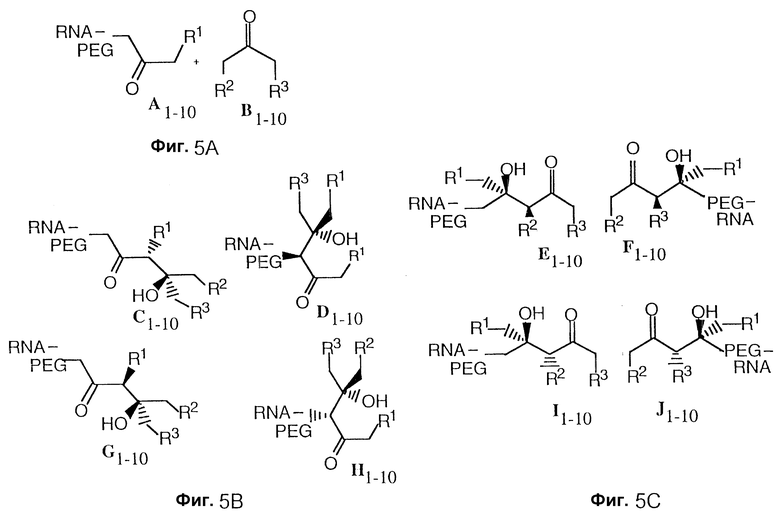
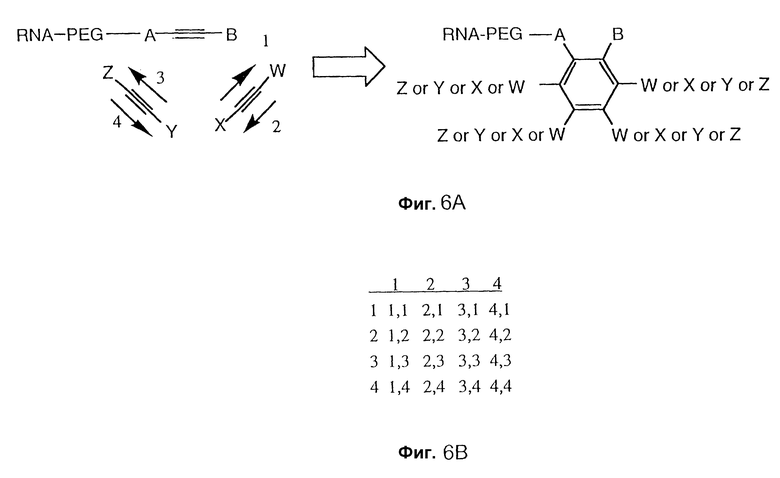
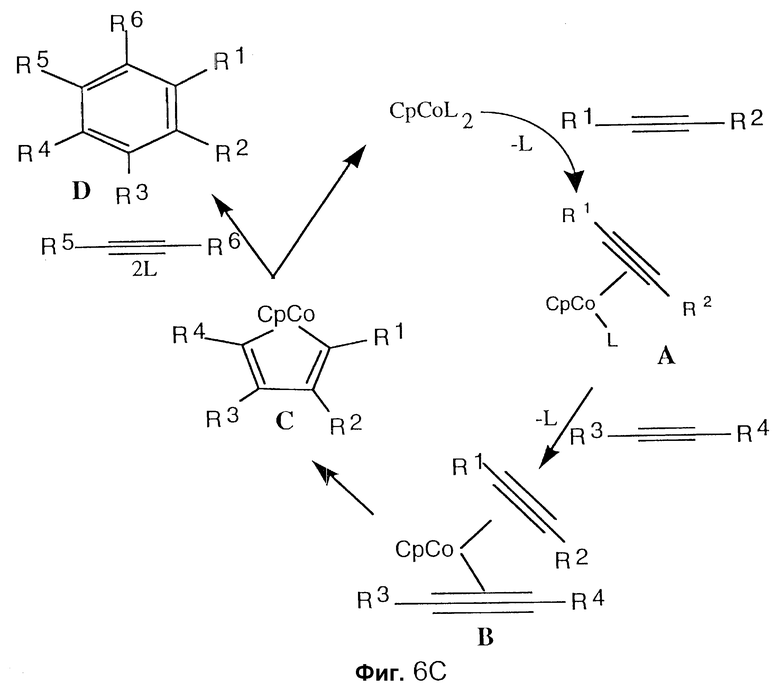
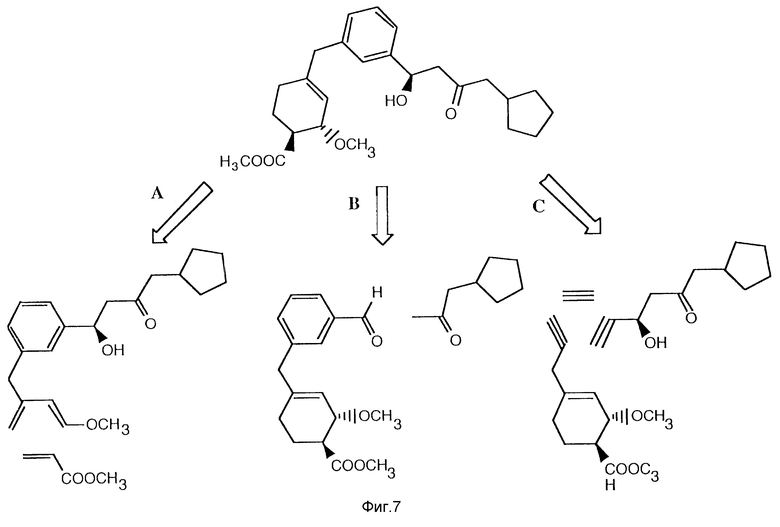
Изобретение относится к биохимии и может быть использовано при идентификации соединений. Получают смесь свободного реагента с нуклеиновыми кислотами. Каждая нуклеиновая кислота связана с первым реагентом. Осуществляют взаимодействие смеси со свободным реагентом. Разделяют продукты реакции по способности изменения свойств свободного реагента. Использование изобретения помогает идентифицировать нуклеиновые кислоты. 4 с. и 19 з.п. ф-лы, 1 табл., 22 ил.
 .
.
| US 5270163 A, 14.12.93 | |||
| US 4968602 A, 06.11.90 | |||
| Способ получения динуклеотидов | 1983 |
|
SU1404512A1 |
Авторы
Даты
1999-07-10—Публикация
1995-09-19—Подача