Изобретение относится к микробиологии и может быть использовано в исследовательской работе НИИ и практической работе бактериологических лабораторий клинических учереждений, определяющих персистентные характеристики микроорганизмов для установления их этиологической значимости при патологических процессах.
В настоящее время характер течения большинства инфекций изменился в сторону увеличения доли затяжных и хронических форм [1].
Длительное переживание бактерий в организме хозяина (бактерионосительство), а также переход инфекционного процесса в хроническую форму обеспечивают факторы персистенции микроорганизмов, инактивирующие ряд факторов естественной противоинфекционной резистентности: лизоцим, комплемент, интерферон и др. [2].
В настоящее время все большее внимание уделяется изучению свойств патогенных микроорганизмов, направленных на инактивацию факторов естественной резистентности организма хозяина.
Известны способы определения антилизоцимной [3], антиинтерфероновой [4], антииммуноглобулиновой [5] и антикомплементарной [6] активностей микроорганизмов.
Известно, что природный дипептид карнозин обладает рядом защитных свойств: антистрессорным, иммуномодулирующим [7], проявляет мембраностабилизирующие свойства [8] , оказывает противоаллергическое [9], антиоксидантное [10] и антимикробное действие [11].
Актуальность разработки способа определения антикарнозиновой активности микроорганизмов определяется открывающейся при этом возможностью повышения точности диагностики и прогнозирования заболеваний микробной этиологии, а также выбора рациональной антибактериальной терапии для борьбы с бактерионосительством.
Задачей заявляемого технического решения является создание способа определения антикарнозиновой активности (АКрА) микроорганизмов.
Для решения указанной задачи в заявляемом способе исследуемую культуру микроорганизмов выращивают на мясопептонном агаре, из выросших культур готовят одномиллиардную взвесь, добавляют мясопептонный бульон и карнозин; параллельно с опытной готовят три контрольные пробы, при этом в контроль 1 вместо взвеси исследуемых культур микроорганизмов добавляют физиологический раствор, в контроль 2 вместо карнозина также добавляют физиологический раствор, а контроль 3 готовят из физиологического раствора и мясопептонного бульона, опытную и контрольные пробы инкубируют, после инкубации все пробы обрабатывают хлороформом и отделяют супернатант от бактериальных клеток центрифугированием, затем к супернатанту добавляют мясопептонный бульон и тест-культуру M.luteus ГИСК N211001, инкубируют все пробы, замеряют оптическую плотность взвесей в опыте и контролях и рассчитывают антикарнозиновую активность по формуле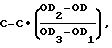
где С - исходная концентрация карнозина;
OD - оптическая плотность взвеси в опыте;
OD1 - оптическая плотность взвеси в контроле 1;
OD2 - оптическая плотность взвеси в контроле 2;
OD3 - оптическая плотность взвеси в контроле 3.
Аналогов изобретения в патентной и научно-технической литературе не обнаружено.
Авторами экспериментально установлено, что микроорганизмы, независимо от их видового происхождения, способны инактивировать бактерицидное действие карнозина. В результате проведенных исследований было сделано предположение о наличии у бактерий определенных механизмов защиты от влияния карнозина. Данное предположение было подтверждено проведенными исследованиями. Культуры S.aureus 209p, S.epidermidis, E.coli O-111 выращивали на мясопептонном агаре при T 37oC в течение 24 часов, готовили их взвеси в концентрации 1 млрд/мл. Затем в равных объемах смешивали взвесь и раствор, содержащий 30 мг (суббактериостатическая концентрация) карнозина, смесь инкубировали в течение 20 минут, центрифугировали при 3000 об/мин в течение 15 минут, получали бесклеточный супернатант, в котором с помощью фотоэлектроколориметра определяли остаток карнозина. Оказалось, что культура S.aureus 209p инактивировала 78,5±6,7% препарата, S. epidermidis - 54,3±7,2%, E.coli O-111 - 68,2±4,4% карнозина.
При разработке настоящего способа авторами были проведены исследования по выбору индикаторной культуры, позволяющей тестировать наличие или отсутствие в среде карнозина, поскольку для осуществления способа необходим высокочувствительный к карнозину штамм микроорганизма.
Авторами с помощью определения минимальной бактерицидной концентрации (МБК) карнозина для различных групп микроорганизмов экспериментально отобрана тест-культура. Для этого в жидких питательных средах создавались определенные концентрации карнозина (от 1 до 15 мг/мл). Затем к 0,3 мл раствора карнозина добавляли по 0,2 мл взвеси исследуемых микроорганизмов. В качестве контроля использовали взвесь исследуемых микроорганизмов в мясопептонном бульоне. Смеси инкубировали в течение 24 часов при T 37oC и замеряли оптическую плотность на фотоэлектрокалориметре КФК-2МП. Минимальную бактерицидную концентрацию определяли по 50% подавлению роста бактерий относительно контроля без карнозина. Изучено 180 клинических и музейных штаммов грамотрицательных и грамположительных бактерий. Результаты исследований представлены в таблице. Как видно из таблицы, наиболее чувствительным к действию карнозина является M.luteus, так как подавляется карнозином в максимальном разведении, равном 1,0 мг/мл.
Таким образом, в результате проведенных исследований авторами в качестве тест-культуры был выбран штамм M.luteus, проявляющий наибольшую чувствительность к бактерицидному действию карнозина. Штамм депонирован в ГИСК им. Л. А. Тарасевича под регистрационным номером 211001 [12].
Предлагаемый штамм M.luteus растет на простых питательных средах, клетки сферические, 0,5-3,5 мкм в диаметре, не подвижный, грамположительный, аэроб, образует каталазу, не сбраживает глюкозу.
Для осуществления способа используется L-карнозин β- Аланил- Гистидин) C9P14N4O3, кристаллический, молекулярная масса 226.2, производства фирмы "Sigma" (США) [13].
Способ осуществляется следующим образом.
1) Исследуемые культуры микроорганизмов выращиваются на мясопептонном агаре при 37oC в течение 24 часов.
2) Из выросших культур готовят одномиллиардную взвесь, отбирают 0,1 мл, добавляют 1,7 мл мясопептонного бульона и 0,2 мл карнозина (разведение карнозина готовят таким образом, чтобы его конечная концентрация в МПБ с тест-штаммом составляла 1 мг/мл).
3) Параллельно с опытной готовят 3 контрольные пробы: а) контроль 1. К 0,2 мл карнозина в указанном выше разведении добавляют 0,1 мл физиологического раствора и 1,7 мл мясопептонного бульона, б) контроль 2. К 0,2 мл физиологического раствора добавляют 0,1 мл одномиллиардной взвеси испытуемой культуры и 1,7 мл мясопептонного бульона. в) контроль 3. К 0,3 мл физиологического раствора добавляют 1,7 мл мясопептонного бульона.
4) Опытную и контрольные пробы инкубируют в течение 24 часов при T 37oC.
5) Во все пробы добавляют по 0,1 мл хлороформа и выдерживают в течение 40 минут.
6) Все пробы центрифугируют при 3000 об/мин в течение 15 минут.
7) Из опытной и контрольных проб отделяют супернатант (по 0,6 мл), добавляют к нему 1,1 мл мясопептонного бульона и 0,1 мл взвеси тест-культуры M.luteus (способ приготовления взвеси: 16-18-часовую агаровую культуру M.luteus смывают физиологическим раствором и готовят одномиллиардную взвесь по стандарту мутности. Полученную взвесь разводят физиологическим раствором в 10 раз и используют).
9) Все пробы инкубируют 24 часа при 37oC.
10) Замеряют оптическую плотность взвесей на фотоэлектроколориметре и рассчитывают антикарнозиновую активность исследуемой культуры по формуле
где C - исходная концентрация карнозина;
OD - оптическая плотность взвеси в опыте;
OD1 - оптическая плотность взвеси в контроле 1;
OD2 - оптическая плотность взвеси в контроле 2;
OD3 - оптическая плотность взвеси в контроле 3.
Антикарнозиновая активность выражается в мг/гл.
Примеры выполнения способа.
Пример 1. У хирурга Е. регистрировались послеоперационные осложнения. Было предположено, что он является носителем стафилококка, способного вызывать гнойно-воспалительные заболевания. Со слизистой оболочки переднего отдела у хирурга был выделен золотистый стафилококк. Однако отсутствие антилизоцимной, антиинтерфероновой, антикомплементарной активностей поставило под сомнение высказанное предположение. Для решения вопроса об этиологической роли выделенного микроорганизма, у культуры золотистого стафилококка была определена способность к инактивации карнозина в большом количестве встречающегося в клетках эпителия слизистой оболочки переднего отдела носа и выполняющего защитную роль. Наличие подобного свойства, даже в отсутствие иных факторов персистенции, определяет возможность этиологического агента длительно находиться в организме и инициировать воспалительный процесс.
Для достижения поставленной цели исследуемую культуру выращивали на мясопептонном агаре при 37oC в течение 24 часов. Из выросших культур готовили одномиллиардную взвесь, отбирали 0,1 мл, добавляли 1,7 мл мясопептонного бульона и 0,2 мл карнозина (разведение карнозина готовили следующим образом: 30 мг карнозина растворяли в 1 мл физиологического раствора и его конечная концентрация в МПБ с тест-штаммом составляла 1 мг/мл). Параллельно готовили 3 контрольные пробы: а) контроль 1. К 0,2 мл карнозина в указанном выше разведении добавляли 0,1 мл физиологического раствора и 1,7 мл мясопептонного бульона. б) контроль 2. К 0,2 мл физиологического раствора добавляли 0,1 мл одномиллиардной взвеси испытуемой культуры и 1,7 мл мясопептонного бульона, в) контроль 3. К 0,3 мл физиологического раствора добавляли 1,7 мл мясопептонного бульона. Полученные смеси инкубировали в течение 24 часов при T 37oC. Во все пробирки добавляли по 0,1 мл хлороформа и выдерживали в течение 40 минут. Все пробы центрифугировали при 3000 об/мин в течение 15 минут. Из всех пробирок отделяли супернатант (по 0,6 мл), добавляли 1,1 мл мясопептонного бульона и 0,1 мл взвеси тест-культуры M.luteus (способ приготовления взвеси: 16-18-часовую агаровую культуру M.luteus смывали физиологическим раствором и готовили одномиллиардную взвесь по стандарту мутности. Полученную взвесь разводили физиологическим раствором в 10 раз и использовали). Посевы инкубировали 24 часа при 37oC. Замеряли оптическую плотность взвесей на фотоэлектроколориметре и рассчитывали АкрА исследуемой культуры по формуле
где 3,0 - исходная концентрация карнозина;
0,107 - оптическая плотность взвеси в опыте;
0,037 - оптическая плотность взвеси в контроле 1;
0,129 - оптическая плотность взвеси в контроле 2;
0,142 - оптическая плотность взвеси в контроле 3.
Таким образом, данный штамм инактивировал 2,37 мг/мл карнозина.
Трехкратное выделение идентичного стафилококка в течение месяца, идентифицированного как золотистый и обладающего антикарнозиновой активностью, позволило подтвердить его роль в возникновении послеоперационных осложнений.
Пример 2. У больного К., с диагнозом "хронический гайморит" были выделены в чистой культуре и по совокупности признаков идентифицированы как Echerichia coli и Staphylococcus epidermidis. Для подтверждения этиологической значимости у выделенных штаммов были изучены антилизоцимная, "антиинтерфероновая", антикомплементарная активности. У штаммов Е. coli и S. epidermidis данные факторы персистенции не были выявлены. В связи с этим была сделана попытка оценить этиологическую значимость возбудителя по способности к инактивации карнозина. Определение антикарнозиновой активности микроорганизмов осуществлено согласно примеру 1. Выявлено, что Е. coli инактивировала 0 мг/мл карнозина, тогда как S. epidermidis - 3,0 мг/мл карнозина. У S. epidermidis методом индикаторных дисков установлена чувствительность к тетрациклину, гентамицину, бензилпенициллину, ампициллину, рифампицину, цефалексину. Курс антибиотикотерапии с использованием ампициллина по 1 млн. ЕД 2 раза в день в течение 7 дней не привел к элиминации возбудителя и не сопровождался положительной динамикой клинических симптомов. В связи с этим было изучено влияние субингибиторных концентраций названных антибиотиков на антикарнозиновую активность S. epidermidis. Установлено, что ампициллин и бензилпенициллин не оказывают на нее выраженного действия (что, очевидно, объясняет неэффективность использования ампициллина в данном случае), гентамицин, цефалексин и рифампицин снижают АКрА активность незначительно, а тетрациклин оказывает выраженное ингибирующее влияние: штамм стафилококка, выращенный в контакте с суббактериостатической концентрацией тетрациклина, утрачивал способность к инактивации карнозина. Проведение курса антибиотикотерапии с использованием тетрациклина как препарата, снижающего антикарнозиновую активность возбудителя, привело к клиническому выздоровлению.
Таким образом, использование предлагаемого способа позволяет выявить и изучить новое свойство микроорганизмов - антикарнозиновую активность, а, как следствие, повысить точность диагностики и прогнозирования заболеваний микробной этиологии. Также заявляемый способ способствует выбору рациональной антибактериальной терапии, изучению механизмов персистенции микроорганизмов и формирования бактерионосительства.
Список литературы
1. Бухарин О.В., Усвяцов Б.Я. Бактерионосительство (медико-экологический аспект). Екатеринбург: УрО РАН, 1996. 208 с.
2. Бухарин О. В. Биомедицинские аспекты персистенции бактерий. Журн. микробиол., эпидемиол. и иммунобиол. - 1994, приложение, с. 4-13.
3. Бухарин О.В., Усвяцов Б.Я., Малышкин А.П., Немцова Н.В. Методы определения антилизоцимной активности микроорганизмов. Журн. микробиол., эпидемиол. и иммунобиол. - 1984, N 2, с. 27-29.
4. Авторское свидетельство N 1564191, кл. C 12 Q 1/02, 1990.
5. Михайлова Е. А. , Луда А.П., Бигеев М.И. Антииммуноглобулиновая активность бактерий / Под ред. О.В. Бухарина. -Куйбышев; 1990, с. 107-111.
6. Патент N 2010860, кл. C 12 Q 1/02, 1/04, 1994.
7. Гуляева Н.В., Дупин А.М., Левшина И.П. и др., Карнозин предотвращает активацию свободнорадикального окисления липидов при стрессе / Бюлл.экспер. биологии и медицины. -1989, N 2, с.144-147.
8. Алабовский В. В. , Болдырев А. А. , Винокуров А.А, Щаврацкий В.Х. Действие гистидинсодержащих дипептидов в условиях ишемии и реперфузии изолированного сердца / Биохимия. -1997, т.62, вып.1, с.91- 102.
9. Шарпань Ю.В. Влияние карнозина на иммуносупрессивный эффект гистамина / Бюлл.экспер. биологии и медицины. -1984, N 11, с.603-604.
10. Перельман М.И., Корнилова З.Х., Пауков B.C. и др. Влияние карнозина на заживление раны легкого / Бюлл.экспер. биологии и медицины. -1989, N 9, с.352-356.
11.Antibacterial actions of carnosine and homocarnosine. French Patent N 71.07856 of March 1, 1971.
12. Каталог штаммов Всесоюзного музея патогенных бактерий. Вып. 1. -М; 1982.
13. Каталог фирмы "Sigma" (chemical company): Biochemicals organic compounds and diagnostic reagents. - 1996, с.222.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ АНТИТРОМБОЦИТАРНОЙ КАТИОННО-БЕЛКОВОЙ АКТИВНОСТИ МИКРООРГАНИЗМОВ | 1997 |
|
RU2120999C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АНТИЛАКТОФЕРРИНОВОЙ АКТИВНОСТИ МИКРООРГАНИЗМОВ | 1999 |
|
RU2156807C2 |
| Способ дифференциации энтерококков кишечной микрофлоры животных | 2015 |
|
RU2612141C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ЭФФЕКТИВНОЙ ДОЗЫ АНТИСЕПТИЧЕСКОГО ПРЕПАРАТА, ЭЛЕКТРОЛИЗНОГО РАСТВОРА ГИПОХЛОРИТА НАТРИЯ, ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ГНОЙНО-ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ | 1995 |
|
RU2114913C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АНТИГИСТОНОВОЙ АКТИВНОСТИ МИКРООРГАНИЗМОВ | 2001 |
|
RU2203956C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АНТИЛИЗОЦИМНОЙ АКТИВНОСТИ МИКРООРГАНИЗМОВ | 1997 |
|
RU2126051C1 |
| СПОСОБ ВЫЯВЛЕНИЯ У БАКТЕРИЙ ИНГИБИТОРОВ КАТАЛАЗЫ МИКРООРГАНИЗМОВ | 2000 |
|
RU2180353C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АНТИГЕМОГЛОБИНОВОЙ АКТИВНОСТИ МИКРООРГАНИЗМОВ | 2004 |
|
RU2262705C2 |
| СПОСОБ ДИАГНОСТИКИ ХРОНИЧЕСКОГО ТОНЗИЛЛИТА | 2000 |
|
RU2188422C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АНТИЛАКТОФЕРРИНОВОЙ АКТИВНОСТИ МИКРООРГАНИЗМОВ | 2003 |
|
RU2245923C2 |

Изобретение предназначено для определения в эксперименте персистентных характеристик микроорганизмов, а также установления их этиологической значимости в клинике при патологических процессах. Способ осуществляется путем выращивания исследуемой культуры на мясопептонном агаре. Из выросших культур готовят одномиллиардную взвесь. Добавляют мясопептонный бульон и карнозин. Параллельно готовят три контрольные пробы. Инкубируют, обрабатывают хлороформом и центрифугируют. Далее добавляют в опытную и контрольные пробы тест-культуры M.luteus ГИСК N 211001. После инкубации полученных смесей замеряют их оптическую плотность. По разнице оптических плотностей в опыте и контролях рассчитывают антикарнозиновую активность исследуемой культуры. Изобретение позволяет выявить новое свойство микроорганизмов - антикарнозиновую активность и, как следствие, повысить точность диагностики и прогнозирования заболеваний микробной этиологии. Изобретение способствует выбору рациональной антибактериальной терапии, изучению механизмов персистенции микроорганизмов и формирования бактерионосительства. 1 табл.
Способ определения антикарнозиновой активности микроорганизмов, заключающийся в том, что исследуемую культуру микроорганизмов выращивают на мясопептонном агаре, из выросших культур готовят одномиллиардную взвесь, добавляют мясопептонный бульон и карнозин, параллельно с опытной готовят три контрольные пробы, при этом в контроль 1 вместо взвеси исследуемых культур микроорганизмов добавляют физиологический раствор, в контроль 2 вместо карнозина также добавляют физиологический раствор, а контроль 3 готовят из физиологического раствора и мясопептонного бульона, опытную и контрольные пробы инкубируют, после инкубации все пробы обрабатывают хлороформом и отделяют супернатант от бактериальных клеток центрифугированием, затем к супернатанту добавляют мясопептонный бульон и тест-культуру M.luteus ГИСП N211001, вновь инкубируют все пробы, замеряют оптическую плотность взвесей в опыте и контролях и рассчитывают антикарнозиновую активность по формуле
где С - исходная концентрация карнозина;
OD - оптическая плотность взвеси в опыте;
OD1 - оптическая плотность взвеси в контроле 1;
OD2 - оптическая плотность взвеси в контроле 2;
OD3 - оптическая плотность взвеси в контроле 3.
| СПОСОБ ОПРЕДЕЛЕНИЯ АНТИГИСТОНОВОЙ АКТИВНОСТИ МИКРООРГАНИЗМОВ | 1992 |
|
RU2065879C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АНТИКОМПЛЕМЕНТАРНОЙ АКТИВНОСТИ МИКРООРГАНИЗМОВ | 1991 |
|
RU2010860C1 |
| Способ определения антиинтерфероновой активности микроорганизмов | 1988 |
|
SU1564191A1 |
Авторы
Даты
1999-07-10—Публикация
1998-04-27—Подача