Изобретение относится к микробиологии и может быть использовано для прогнозирования реконвалесцентного бактерионосительства, микробиологического мониторинга антропогенного загрязнения окружающей среды, диагностики дисбиозов, изучения влияния лекарственных препаратов и биологически активных веществ на персистентные характеристики микроорганизмов.
Известен электрооптический способ определения антилизоцимной активности (АЛА) микроорганизмов путем измерения степени гидратации бактериальных клеток после взаимодействия с лизоцимом [1].
Однако указанный способ трудоемок, требует наличия специальной регистрирующей аппаратуры. Также существенным недостатком указанного способа является то, что возможна регистрация лишь начальных этапов взаимодействия лизоцима с бактериальной клеткой.
Известен способ определения антилизоцимной активности микроорганизмов, при котором исследуемые штаммы бактерий засевают на плотную питательную среду с определенной концентрацией лизоцима в агаре и после инкубации в течение 24 ч выросшие исследуемые культуры убивают парами хлороформа в течение 30 мин. Затем на колонии исследуемых культур вторым слоем заливают питательную агаровую среду с 0,5 мл 20-миллиардной взвеси предварительно убитой хлороформом тест-культуры Micrococcus lysodeikticus (штамм N 2665 ГИСК им. Л.А. Тарасевича). Эффект инактивации лизоцима определяют по наличию зоны мутности вокруг антилизоцимактивных штаммов. Количественную оценку антилизоцимной активности исследуемого штамма производят по максимальной концентрации лизоцима в среде, которая инактивируется данным штаммом [2].
Однако, учитывая отсутствие четкости зон лизиса бактерий [3] и нередкое окрашивание геля бактериальными продуктами (например, пиоцианином Pseudomonas aeruginosa), визуальная оценка АЛА часто затруднена. Недостатками метода являются также низкая чувствительность и длительное время, требующееся для определения антилизоцимной активности.
Наиболее близким к заявленному способу по назначению и совокупности существенных признаков является способ определения антилизоцимной активности бактерий, согласно которому исследуемую культуру выращивают в жидкой питательной среде, отделяют супернатант, смешивают его с лизоцимом и суспензией тест-культуры Micrococcus lysodeikticus, инкубируют смесь, параллельно готовят две контрольные пробы, антилизоцимную активность культуральной жидкости исследуемого штамма рассчитывают по оптической плотности опытной смеси и обоих контролей, затем показатель антилизоцимной активности исследуемой культуры сравнивают с показателями антилизоцимной активности референс-штамма Klebsiella pneumoniae ГИСК N 151 и определяют концентрацию лизоцима, которую способна инактивировать исследуемая культура [4].
Однако указанный способ имеет ряд существенных недостатков. Известно, что при длительном хранении штаммов бактерий уровень АЛА последних может изменяться [5]. В связи с этим необходим постоянный контроль АЛА референс-штамма либо культивирование его на средах с антибиотиками, что делает данный способ длительным и трудоемким. В известном способе проводится однократное измерение оптической плотности в опыте и контроле, что ведет к большой погрешности при количественной оценке АЛА микроорганизмов. Также в способе-прототипе используется дополнительный контроль с супернатантом штамма, показывающий полное подавление лизоцима, что делает указанный способ трудоемким. В известном способе выращивание культур микроорганизмов осуществляют на минимальной питательной среде. Однако известно, что минимальные среды пригодны для культивирования отдельных групп бактерий. Кроме того, при совместном культивировании плазмидных и бесплазмидных штаммов в лимитированных по субстрату условиях происходит вытеснение плазмидсодержащих клеток из смешанной популяции [6]. Последнее обстоятельство представляется существенным, принимая во внимание клональную гетерогенность популяций по антилизоцимному признаку [7, 8] и плазмидный характер антилизоцимной активности [9].
Заявляемый способ решает задачу ускорения и упрощения определения антилизоцимной активности микроорганизмов и повышения точности количественной оценки АЛА.
Для решения указанной задачи в заявляемом способе определения антилизоцимной активности микроорганизмов исследуемую культуру микроорганизма выращивают в жидкой питательной среде, отделяют супернатант и смешивают его с лизоцимом, параллельно готовят контроль, опытную пробу и контроль смешивают с суспензией тест-культуры Micrococcus lysodeikticus и определяют антилизоцимную активность по оптической плотности полученных смесей, при этом в качестве контроля используют смесь питательного бульона с лизоцимом, осуществляют инкубирование супернатанта с лизоцимом, вводят инкубированную смесь в предварительно обработанную трилоном Б тест-культуру и проводят измерение оптической плотности опытной пробы и контроля через 30 и 150 с, затем рассчитывают антилизоцимную активность по формуле
где A - антилизоцимная активность, мкг инактивированного лизоцима /мл супернатанта • ед. оптической плотности бульонной культуры;
V1- объем раствора лизоцима исходной концентрации;
V2- объем супернатанта бульонной культуры исследуемого штамма;
C - исходная концентрация лизоцима;
Y - оптическая плотность бульонной культуры исследуемого штамма, ед. оптической плотности;
ΔD0 - изменение оптической плотности суспензии тест-культуры в опыте между 30 и 150 с;
ΔDк - изменение оптической плотности суспензии тест-культуры в контроле между 30 и 150 с.
Новым в заявленном способе является то, что
- в качестве контроля используют смесь питательного бульона с лизоцимом;
- суспензию тест-культуры Micrococcus lysodeikticus предварительно обрабатывают трилоном Б;
- осуществляют инкубирование супернатанта с лизоцимом с последующим введением инкубированной смеси в обработанную трилоном Б тест-культуру;
- измерение оптической плотности опытной пробы и контроля проводят через 30 и 150 с;
- рассчитывают антилизоцимную активность микроорганизмов по формуле:
где A - антилизоцимная активность, мкг инактивированного лизоцима /мл супернатанта • ед. оптической плотности бульонной культуры;
V1 - объем раствора лизоцима исходной концентрации;
V2 - объем супернатанта бульонной культуры исследуемого штамма;
C - исходная концентрация лизоцима;
Y - оптическая плотность бульонной культуры исследуемого штамма, ед. оптической плотности;
ΔD0 - изменение оптической плотности суспензии тест-культуры в опыте между 30 и 150 с;
ΔDк - изменение оптической плотности суспензии тест-культуры в контроле между 30 и 150 с.
Известно использование в качестве субстрата для лизоцима бактериальных клеток Micrococcus lysodeikticus [3,10] . Авторами экспериментально установлено повышение чувствительности микрококка к литическому действию фермента под влиянием трилона Б.
Трилон Б (динатриевая соль этилендиаминтетрауксусной кислоты; C10H14O8N2Na2 • 2H2O, М 372.3; ГОСТ 10652-73) - белый кристаллический порошок, хорошо растворимый в воде и щелочах; pH водного раствора около 6. Известно использование трилона Б в текстильной, кожевенной, пищевой, бумажной, лакокрасочной промышленности, в производстве металлов, каучука, в цветной кинематографии, для очистки нефти, воска, жиров, для разделения редкоземельных элементов, для смягчения воды, очистки и получения ряда элементов, соединений и смесей, в качестве ингибитора окислительных процессов и др. [11]. В медицине трилон Б используют при гиперкальциемии, при патологической оссификации скелета, суставов, мышц, почек, стенок вен, при склеродермии, порфирии, в качестве антикоагулянта при консервировании крови [12].
Использование трилона Б для обработки взвеси микрококка с целью повышения его чувствительности к литическому действию лизоцима в источниках патентной и научно-технической литературы не обнаружено.
Проводился следующий эксперимент.
В опытной серии суточную агаровую культуру М. lysodeikticus убивали парами хлороформа, смывали, дважды отмывали фосфатным буфером с трилоном Б и один раз фосфатным буфером без трилона Б. В контроле взвесь микрококка трижды отмывали фосфатным буфером без трилона Б. Оптическую плотность суспензий тест-культур доводили до 0,300. Измерения проводили на спектрофотометре СФ-46 (длина волны 540 нм). Ход анализа: к 2,0 мл суспензии субстрата добавляли 0,5 мл раствора лизоцима (20 мкг/мл) и измеряли оптическую плотность реакционной смеси через 30 и 150 с против 0,2 М фосфатного буфера ( ΔD ). В опытной серии изменение оптической плотности составило 0.080±0.001 против 0.069±0.005 в контроле (P<0.05).
Таким образом, за счет повышения чувствительности тест-культуры М. lysodeikticus к литическому действию лизоцима увеличивается точность количественного определения АЛА, что обеспечивает повышение достоверности определения антилизоцимной активности микроорганизмов.
Известно измерение оптической плотности суспензии тест-культуры M. lysodeikticus, лизоцима и супернатанта исследуемой культуры для определения АЛА микроорганизмов. Однако в известном способе-прототипе [4] проводится однократное измерение оптической плотности в опыте и контроле, что ведет к большой погрешности при количественной оценке АЛА микроорганизмов.
В заявляемом способе проводится двукратное измерение оптической плотности исследуемой смеси через 30 и 150 с, что позволяет более точно судить о литической активности остаточной концентрации лизоцима по степени лизиса суспензии тест-культуры.
Интервал времени, через который проводится измерение оптической плотности исследуемой смеси, авторами установлен экспериментально. Проведенные авторами исследования показали, что измерение оптической плотности реакционной смеси является наиболее целесообразным через 30 и 150 с ( см.табл.1). Измерение оптической плотности реакционной смеси ранее чем через 30 с после начала гидролиза субстрата невозможно вследствие необходимости настройки спектрофотометра. Длительное измерение изменения оптической плотности реакционной смеси нецелесообразно, поскольку скорость ферментативной реакции максимальна лишь в начальный период, а потом, по мере истощения субстрата либо фермента, при различных концентрациях компонентов скорость реакции выравнивается [13].
Как видно из табл. 1, измерение оптической плотности реакционной смеси через более длительный интервал чем 150 с после начала лизиса не выявляет значительных различий изменения оптической плотности в опыте и контроле, поэтому авторы предлагают, как наиболее оптимальный интервал определения изменения оптической плотности реакционной смеси через 30 - 150 с.
Способ осуществляется следующим образом.
Бактериальную массу исследуемых культур стандартной бактериологической петлей засевают в 3 мл жидкой питательной среды (для каждого вида микроорганизмов используют соответствующий тип питательной среды) и культивируют при 37oC 24-96 ч. На спектрофотометре СФ-46 (длина волны 540 нм) измеряют оптическую плотность бульонной культуры против питательного бульона (Y). Супернатант отделяют от бактериальных клеток центрифугированием в течение 15 мин при 3000 об/мин.
Для определения антилизоцимной активности микроорганизмов в качестве тест-культуры используют суточную агаровую культуру Micrococcus lysodeikticus (штамм N 2665 ГИСК им. Л.А. Тарасевича). Выросшие бактериальные клетки тест-штамма убивают хлороформом в течение 60 мин, смывают, фильтруют через крупнопористый фильтр, дважды отмывают 1/15 М фосфатным буфером (калия фосфата однозамещенного [KH2PO4 - 7.72 г, натрия фосфата двузамещенного [Na2HPO4 • 2H2O - 1.78 г, воды дистиллированной - до 1000 мл; pH 6.0-6.2) с динатриевой солью этилендиаминтетрауксусной кислоты (трилоном Б) (0.372 г/л буфера) и один раз 1/15 М фосфатным буфером, после чего оптическую плотность суспензии микрококка доводят до 0.300.
На 1/15 М фосфатном буфере готовят раствор лизоцима с концентрацией 20 мкг/мл.
Супернатант исследуемых культур микроорганизмов объемом 0.9 мл смешивают с 0.1 мл приготовленного раствора лизоцима и инкубируют 60-120 мин при 37oC. Затем 0.5 мл смеси супернатанта и лизоцима добавляют к 2.0 мл суспензии тест-культуры Micrococcus lysodeikticus и измеряют оптическую плотность полученной смеси через 30 и 150 с на спектрофотометре СФ-46 (длина волны 540 нм) против 1/15 М фосфатного буфера.
В контрольной пробе смесь питательного бульона с лизоцимом в соотношении 9: 1 также добавляют к 2.0 мл суспензии тест-культуры Micrococcus lysodeikticus и измеряют оптическую плотность полученной смеси через 30 и 150 с на спектрофотометре СФ-46 (длина волны 540 нм) против 1/15 М фосфатного буфера.
Антилизоцимную активность исследуемой культуры рассчитывают по формуле:
где A - антилизоцимная активность, мкг инактивированного лизоцима /мл супернатанта • ед. оптической плотности бульонной культуры;
V1- объем (0.1 мл) раствора лизоцима исходной концентрации (20 мкг/мл);
V2- объем (0.9 мл) супернатанта бульонной культуры исследуемого штамма;
C - исходная концентрация лизоцима (20 мкг/мл);
Y - оптическая плотность бульонной культуры исследуемого штамма, ед. оптической плотности;
ΔD0 - изменение оптической плотности суспензии тест-культуры в опыте между 30 и 150 с [D0(30'') - D0(150'')];
ΔDк - изменение оптической плотности суспензии тест-культуры в контроле между 30 и 150 с [Dк(30'') - Dк(150'')].
Пример 1. У штамма Stapbylococcus haemolyticus, выделенного из гнойного содержимого при дренировании абсцесса была определена антилизоцимная активность.
Для этого бактериальную массу исследуемой культуры стандартной бактериологической петлей посеяли в 3 мл мясо-пептонного бульона и культивировали при 37oC 24 ч. На спектрофотометре СФ-46 (длина волны 540 нм) измерили оптическую плотность бульонной культуры против питательного бульона (Y): она составила 1.821. Супернатант отделили от бактериальных клеток центрифугированием в течение 15 мин при 3000 об/мин.
В качестве тест-культуры использовали суточную агаровую культуру Micrococcus lysodeikticus (штамм N 2665 ГИСК им. Л.А. Тарасевича). Выросшие бактериальные клетки тест-культуры убили хлороформом в течение 60 мин, смыли, профильтровали через крупнопористый фильтр, дважды отмыли 1/15 М фосфатным буфером (калия фосфата однозамещенного [KH2PO4] - 7.72 г, натрия фосфата двузамещенного [Na2HPO4•2H2O] - 1.78 г, воды дистиллированной - до 1000 мл; pH 6.0-6.2) с динатриевой солью этилендиаминтетрауксусной кислоты (трилоном Б) (0.372 г/л буфера) и один раз 1/15 М фосфатным буфером, после чего оптическую плотность суспензии микрококка довели до 0.300.
На 1/15 М фосфатном буфере приготовили раствор лизоцима с концентрацией 20 мкг/мл.
Супернатант исследуемых культур микроорганизмов объемом 0.9 мл смешали с 0.1 мл приготовленного раствора лизоцима и инкубировали 60 мин при 37oC. Затем 0.5 мл смеси супернатанта и лизоцима добавили к 2.0 мл суспензии тест-культуры Micrococcus lysodeikticus и измерили оптическую плотность полученной смеси через 30 и 150 с на спектрофотометре СФ-46 (длина волны 540 нм) против 1/15 М фосфатного буфера.
В контрольной пробе смесь питательного бульона с лизоцимом в соотношении 9: 1 также добавили к 2.0 мл суспензии тест-культуры Micrococcus lysodeikticus и измерили оптическую плотность полученной смеси через 30 и 150 с на спектрофотометре СФ-46 (длина волны 540 нм) против 1/15 М фосфатного буфера.
Были получены следующие значения оптической плотности:
Dо(30'') = 0.266. Dо(150'') = 0.252. ΔD0 = 0.266 - 0.252 = 0.014; Dк(30'') = 0.263, Dк(150'') = 0.221, ΔDк = 0.263 - 0.221 = 0.042.
По степени лизиса суспензии тест-культуры рассчитали АЛА исследуемого штамма по формуле
мкг инактивированного лизоцима /мл супернатанта • ед. оптической плотности бульонной культуры.
Пример 2. Для сравнения точности определения антилизоцимной активности известным способом и заявляемым были отобраны штаммы микроорганизмов с одинаковыми значениями антилизоцимной активности, определенной способом-прототипом. Величина признака составляла 0.38. При определении у данных штаммов бактерий АЛА заявляемым способом были получены различные значения (табл.2). Это связано с тем, что в формуле расчета АЛА в заявляемом способе проводят пересчет на величину оптической плотности бульонной культуры, которая выражает количество биомассы тестируемого штамма. Так как известно, что количество метаболитов (в данном случае антилизоцимного фактора) находится в прямой зависимости от количества биомассы, которая в свою очередь определяется видом микроорганизма и составом питательной среды, заявляемый способ существенно повышает точность количественного определения АЛА.
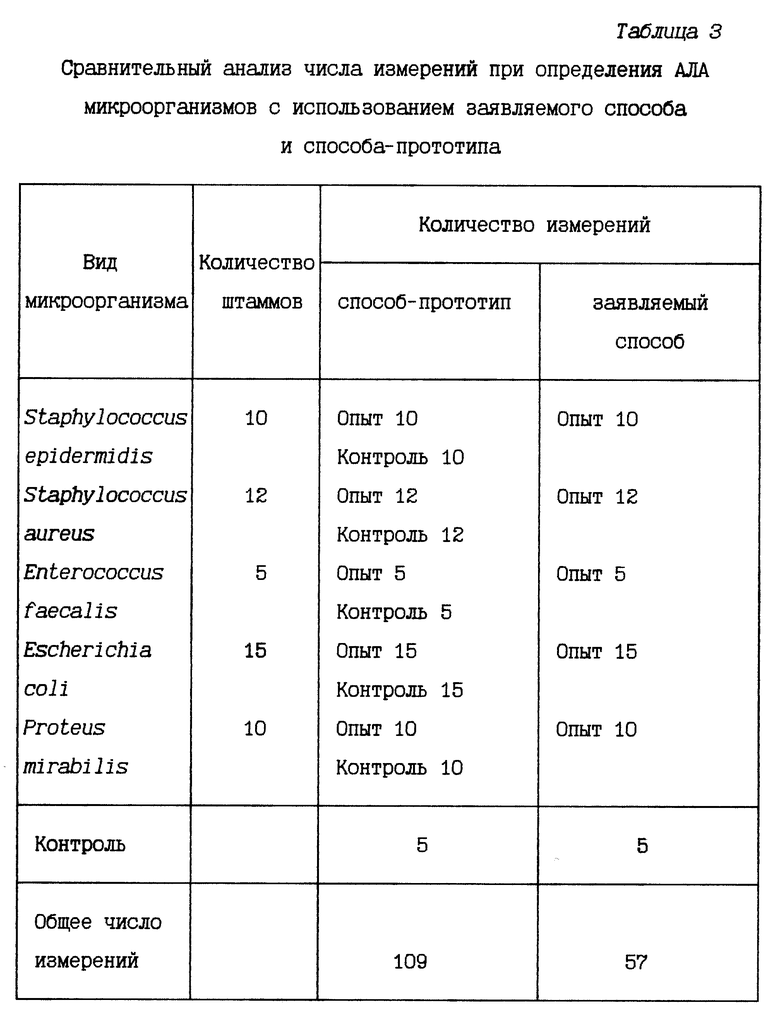
Пример 3. У 52 штаммов микроорганизмов из коллекции Института клеточного и внутриклеточного симбиоза УрО РАН (г. Оренбург) была определена антилизоцимная активность с использованием заявляемого способа и способа-прототипа. Сравнительный анализ результатов определения АЛА микроорганизмов различными способами представлен в таблице 3.
Как видно из таблицы, использование заявляемого способа позволило уменьшить количество измерений за счет того, что в заявляемом способе отсутствует контроль (используемый в способе-прототипе) с супернатантом штамма без лизоцима, показывающий полное подавление лизоцима. Для постановки этого контроля необходимо произвести количество измерений, равное количеству исследуемых штаммов, чтобы воспроизвести оптическую плотность каждого отдельного образца. Количество измерений во втором контроле в способе-прототипе равно числу измерений в заявляемом способе, поскольку в этом контроле культуральная жидкость заменена на стерильную питательную среду, используемую для выращивания микроорганизмов в обоих способах.
Таким образом, предлагаемый способ позволяет ускорить, упростить и повысить точность количественного определения антилизоцимной активности микроорганизмов.
Источники информации, в которых содержатся сведения об аналогах изобретения
1. Луда А.П., Сирота А. Н. Электрооптический метод выявления антилизоцимной активности микроорганизмов //Факторы естественного иммунитета. - Куйбышев, 1983.- С. 73-77.
2. Бухарин 0.В., Васильев Н.В., Усвяцов Б.Я. Лизоцим микроорганизмов.- Томск: Изд-во Том. ун-та, 1985.- С. 177.
3. Каграманова К.А., Ермольева 3.В. Сравнительная характеристика методов определения активности лизоцима //Антибиотики. - 1966.- Т. 11, N 10.- С. 917-919.
4. Авторское свидетельство СССР N 1537689, МПК 5 C 12 N 15/00, C 12 Q 1/00, 23.01.90. (прототип)
5. Немцова Н. В. Питательная среда для хранения шигелл //Персистенция микроорганизмов.- Сб. научн. трудов. - Куйбышев: КМИ, 1987.- С. 68-71.
6. Ермоленко 3. M., Литвинов В.В., Колесниченко И.Ф., Самойленко В. А. Сохранение плазмид в клетках кишечной палочки при периодическом и непрерывном культивировании //Журн. микробиол.- 1982.- N 4.- С. 64-68.
7. Бухарин О.В., Борисов С.Д., Езепчук Ю.В. и др. Антилизоцимная активность менингококков //Журн. микробиол.- 1991.- N 7.- С. 17-20.
8. Бухарин О.В., Немцева Н.В., Валышев А.В. Популяционная характеристика факторов персистенции кишечных палочек, выделенных из различных экониш //Бюлл. экспер. биол. мед.- 1996.- N 9.- С. 356-358.
9. Соколов В. Ю. Механизм антилизоцимной активности бактерий: Автореф. дисс. ... канд. мед. наук.- Челябинск, 1989.
10. Gorin G., Wang S. F., Papapavlou L. Assay of lysozyme by its lytic action on M. lysodeikticus cells //Anal. Blochem.- 1971.- Vol. 39, N 1.- P. 113-127.
11. Краткая химическая энциклопедия. Ред. кол. И.Л. Кнунянц (отв. ред.) и др. - M.: Советская энциклопедия.- Т. 2.- 1963.- С. 671.
12. Большая медицинская энциклопедия: [в 30-ти т. АМН СССР]. Гл. ред. Б. В. Петровский. - 3-е изд. - M.: Советская энциклопедия. - Т. 28.- 1986.- С. 371-372.
13. Келети Т. Основы ферментативной кинетики: Пер. с англ.- М.: Мир, 1990.- С. 131-142.


Изобретение относится к микробиологии и может быть использовано для прогнозирования реконвалесцентного бактерионосительства, микробиологического мониторинга антропогенного загрязнения окружающей среды, диагностики дисбиозов, изучения влияния лекарственных препаратов на персистентные характеристики микроорганизмов. Способ осуществляют путем выращивания исследуемой культуры в жидкой питательной среде, отделения супернатанта, инкубирования его с лизоцимом, добавления полученной смеси к суспензии тест-культуры Micrococcus lysodeikticus, предварительно обработанной трилоном Б, измерения оптической плотности полученной смеси. Об уровне антилизоцимной активности (АЛА) судят по степени лизиса суспензии тест-культуры микрококка, которую рассчитывают по формуле. Изобретение позволяет повысить эффективность определения антилизоцимной активности микроорганизмов за счет ускорения и увеличения точности количественной оценки АЛА. 3 табл.
Способ определения антилизоцимной активности микроорганизмов, заключающийся в том, что исследуемую культуру микроорганизма выращивают в жидкой питательной среде, отделяют супернатант и смешивают его с лизоцимом, параллельно готовят контроль, опытную пробу и контроль смешивают с суспензией тест-культуры Micrococcus Lysodeikticus и определяют антилизоцимную активность по оптической плотности полученных смесей, отличающийся тем, что в качестве контроля используют смесь питательного бульона с лизоцимом, осуществляют инкубирование супернатанта с лизоцимом, вводят инкубированную смесь в предварительно обработанную трилоном Б тест-культуру и проводят измерение оптической плотности опытной пробы и контроля через 30 и 150 с, затем рассчитывают антилизоцимную активность по формуле
где A - антилизоцимная активность, мкг инактивированного лизоцима/мл супернатанта • ед. оптической плотности бульонной культуры;
V1 - объем раствора лизоцима исходной концентрации;
V2 - объем супернатанта бульонной культуры исследуемого штамма;
C - исходная концентрация лизоцима;
Y - оптическая плотность бульонной культуры исследуемого штамма, ед. оптической плотности;
ΔDo - изменение оптической плотности суспензии тест-культуры в опыте между 30 и 150 с;
ΔDк - изменение оптической плотности суспензии тест-культуры в контроле между 30 и 150 с.
| Штамм бактерий КLевSIеLLа рNеUмоNIае, используемый в качестве референс-штамма при определении антилизоцимной активности бактерий, и способ определения антилизоцимной активности бактерий | 1988 |
|
SU1537689A1 |
| Бухарин О.В | |||
| и др | |||
| Метод определения антилизоцимной активности микроорганизмов | |||
| Журнал микробиологии, эпидемиологии и иммунологии, 1984, N2, с | |||
| Прибор с двумя призмами | 1917 |
|
SU27A1 |
| Gorin G., Wang S.F., Papapavlou L | |||
| Assay of lysozyme by its lytic action of M | |||
| Lysodeikticus cells | |||
| Anal | |||
| Biochem., 1971 v | |||
| Машина для изготовления проволочных гвоздей | 1922 |
|
SU39A1 |
Авторы
Даты
1999-02-10—Публикация
1997-01-27—Подача