Изобретение относится к микробиологии и может быть использовано в исследовательской работе НИИ и практической работе бактериологических лабораторий клинических учреждений, определяющих характеристики микроорганизмов, играющих роль в формировании нормальных микробиоценозов тела человека.
Длительное переживание бактерий в организме хозяина и нормальных микробиоценозах тела человека в условиях перекисного окисления, вызванного перекисью водорода, вырабатываемой клетками иммунной системы хозяина [1] и представителями нормофлоры [2], объясняется разрушением перекиси водорода каталазой микроорганизмов [3, 4].
Каталаза (ЕС 1.11.1.6) - фермент, выполняющий важные функции в микробной клетке: детоксикацию Н2O2, как эндогенного происхождения, образующейся в результате дисмутации супероксидного аниона и аэробного окисления восстановленных флавопротеинов [4], так и экзогенного характера, вырабатываемой клетками иммунной системы хозяина [1] и представителями нормофлоры [2], кроме того, каталаза участвует в окислительном фосфорилировании [3]. Специфическим ингибитором каталазы является 3-амино-1Н-1,2,4-триазол [5].
Задачей заявляемого технического решения является создание способа выявления у бактерий ингибиторов каталазы микроорганизмов.
Для решения указанной задачи в заявляемом способе выявления у бактерий ингибиторов каталазы микроорганизмов исследуемую культуру бактерий выращивают в жидкой питательной среде, отделяют бактериальные клетки от супернатанта, готовят из бактериальных клеток взвесь и обрабатывают ее хлороформом, отделяют клеточный экстракт центрифугированием, параллельно готовят контроль, в опытную пробу и контроль добавляют тест-культуру Staphylococcus aureus ГИСК 201108, инкубируют, отделяют клетки тест-культуры центрифугированием и готовят из них микробную взвесь, затем определяют активность каталазы тест-культуры в опыте и контроле, затем рассчитывают степень ингибирования каталазной активности тест-культуры по формуле
[(Ак-Ао)/Ак]•100%,
где Ак - активность каталазы тест-культуры в контроле;
Ао - активность каталазы тест-культуры в опыте,
и далее судят о наличии или отсутствии у исследуемой культуры бактерий ингибиторов каталазы микроорганизмов.
Аналогов изобретения в патентной и научно-технической литературе не обнаружено.
Авторами экспериментально установлено новое свойство бактерий - способность ингибировать каталазную активность микроорганизмов.
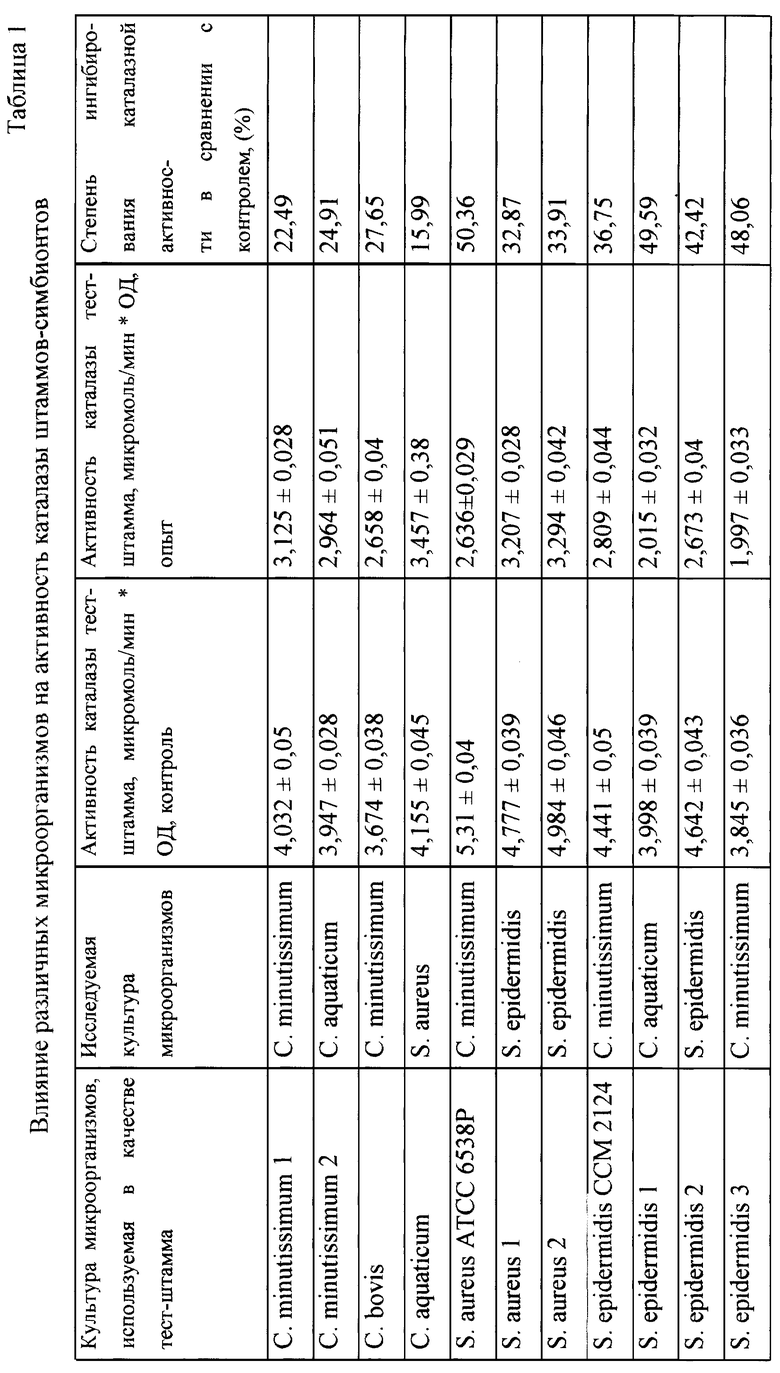
При изучении влияния клеточных экстрактов на каталазную активность каталазопозитивных микроорганизмов авторами было обнаружено ингибирование активности каталазы микроорганизмов клеточными экстрактами бактерий различных видов. В результате этих исследований было сделано предположение о наличии у бактерий ингибиторов каталазы микроорганизмов. Данное предположение было подтверждено проведенными исследованиями. Культуры Corynebacterium minutissimum, Staphylococcus epidermidis, выделенные из женского репродуктивного тракта, Corynebacterium minutissimum, С. aquaticum, Staphylococcus epidermidis, выделенные из мужского репродуктивного тракта, Staphylococcus epidermidis, S. aureus, выделенные с кожных покровов человека, музейные штаммы Staphylococcus epidermidis CCM 2124 и S. aureus ATCC 6538P выращивали в жидкой питательной среде при 37oС в течение 24 часов. Бульонные культуры микроорганизмов центрифугировали (3000g в течение 15 минут), супернатант отделяли от бактериальных клеток. Бактериальные клетки отмывали от жидкой питательной среды центрифугированием (3000g в течение 15 минут). Из отмытых бактериальных клеток готовили взвеси в концентрации 1 млрд/мл в 0,9% растворе хлорида натрия.
Взвеси бактериальных клеток различных микроорганизмов обрабатывали хлороформом в течение часа (0,2 мл хлороформа на пробу). Параллельно готовили контрольные пробы - 0,9% раствор хлорида натрия, обрабатывали хлороформом в течение часа (0,2 мл хлороформа на пробу). Центрифугировали контрольные и опытные пробы для удаления хлороформа (3000g в течение 15 минут). В опытные пробирки разливали по 0,8 мл приготовленых клеточных экстрактов, в контрольные - 0,8 мл 0,9% раствора хлорида натрия, обработанного хлороформом. В опытные и контрольные пробирки добавляли по 0,4 мл микробных взвесей культур каталазопозитивных микроорганизмов-S. aureus, С. bovis, С. minutissimum, С. aquaticum, или S. epidermidis (способ приготовления взвесей: 24-часовую агаровые культуры каталазопозитивных микроорганизмов смывали 0,9% раствором хлорида натрия и готовили микробные взвеси, густота которых соответствует оптической плотности 0,27 при 591 нм на СФ-46). Полученные смеси инкубировали в течение 40-60 минут при 37oС. Инкубированные смеси центрифугировали (3000g в течение 15 минут), отделенные клетки культур каталазопозитивных микроорганизмов дважды отмывали 0,9% раствором хлорида натрия и готовили из них микробные взвеси, густота которых соответствует оптической плотности 0,20 при 591 нм на СФ-46. Определяли активность каталазы каталазопозитивных микроорганизмов в опыте и контроле. Наблюдали снижение активности каталазы каталазопозитивных микроорганизмов в опыте. Результаты исследований приведены в таблице 1. Как видно из таблицы 1, клеточные экстракты бактерий различных видов снижали активность каталазы каталазопозитивных микроорганизмов, на основе чего авторами был сделан вывод о наличии у исследуемых культур бактерий ингибиторов каталазы микроорганизмов
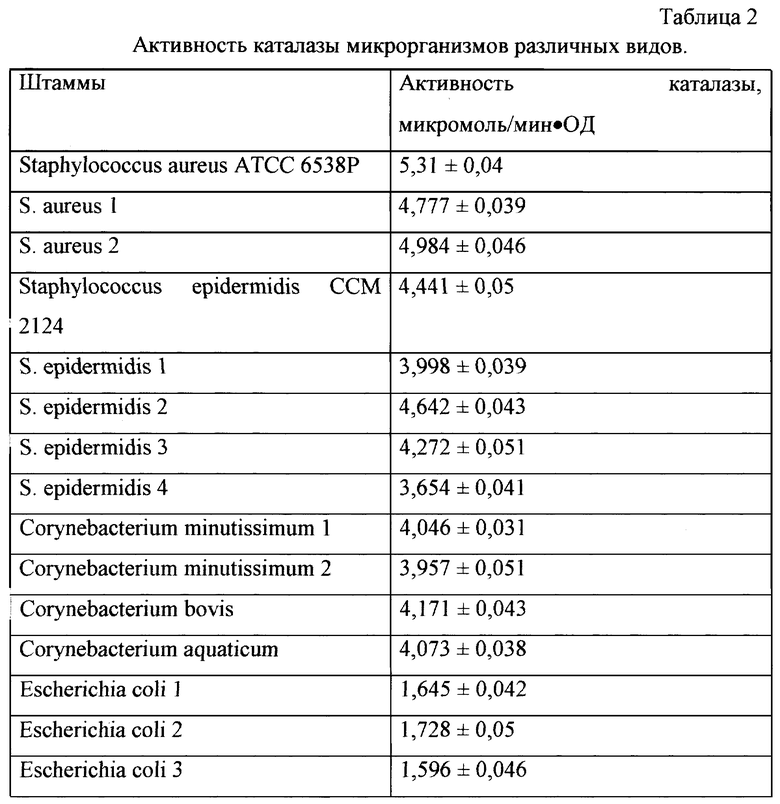
Для создания настоящего способа авторами были проведены исследования по выбору индикаторной культуры, обладающей высокой каталазной активностью, позволяющей тестировать наличие или отсутствие у исследуемых бактерий ингибиторов каталазы микроорганизмов. Были изучены 50 клинических и музейных штаммов каталазопозитивных бактерий.
В таблице 2 представлены микроорганизмы различных видов, обладающие высокой каталазной активностью. Как видно из таблицы 2, наибольшей каталазной активностью обладают различные штаммы Staphylococcus aureus.
Авторами в качестве тест-культуры был выбран штамм Staphylococcus aureus ATCC 6538Р. Выбор в качестве тест-культуры Staphylococcus aureus АТСС 6538Р обусловлен высоким уровнем его каталазной активности. Штамм депонирован в ГИСК им. Л.А.Тарасевича под регистрационным номером 201108 [6].
Предлагаемый штамм Staphylococcus aureus ATCC 6538Р растет на простых питательных средах в виде желтых непрозрачных колоний диаметром 2-3 мм, грамположительный, неспорообразующий, микроаэрофил, каталазоположительный, растет на твердых питательных средах с 10-15% хлорида натрия, образует кислоту из сахарозы, мальтозы, D-маннитола, D-маннозы, D-трегалозы, α-лактозы, D-галактозы, β-D-фруктозы, D-рибозы, α-гемолитический, коагулазоположительный, восстанавливает нитраты, продуцирует гиалуронидазу, щелочную фосфотазу, аргинингидролазу, уреазу, фибринолизин, β-гликозидазу, дезоксирибонуклеазу, термоустойчивую нуклеазу, фактор слипания.
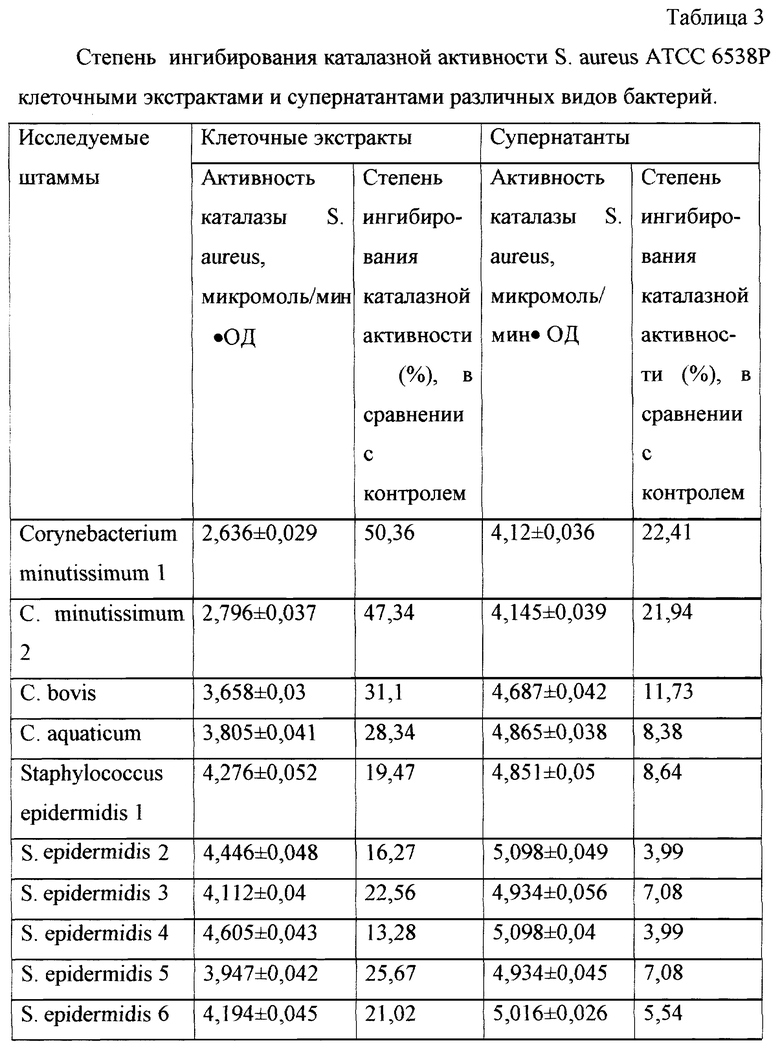
В результате исследования влияния клеточных экстрактов и супернатантов исследуемых культур микроорганизмов на каталазную активность тест-культуры S. aureus выявлено, что ингибирование каталазы S. aureus клеточными экстрактами исследуемых культур микроорганизмов выраженнее по сравнению с гомологичными супернатантами (таблица 3), поэтому для выявления у исследуемых культур бактерий ингибиторов каталазы микроорганизмов предлагается использовать клеточные экстракты.
Способ осуществляется следующим образом.
1. Исследуемые культуры бактерий выращивают в 2-3 мл жидкой питательной среды (для каждого вида бактерий используется соответствующий тип питательной среды) при 37oС в течение 24 часов.
2. Бульонные культуры центрифугируют (3000g в течение 15 минут), супернатант отделяют от бактериальных клеток. Бактериальные клетки отмывают от жидкой питательной среды центрифугированием (3000g в течение 15 минут). Из отмытых бактериальных клеток готовят взвесь в концентрации 1 млрд/мл в 0,9% растворе хлорида натрия.
3. Взвесь бактериальных клеток обрабатывают хлороформом в течение часа (0,2 мл хлороформа на пробу).
4. Параллельно готовят контрольную пробу - 0,9% раствор хлорида натрия, обработанного хлороформом в течение часа (0,2 мл хлороформа на пробу).
5. Центрифугированием отделяют клеточные экстракты от хлороформа и разрушенных бактериальных клеток (3000g в течение 15 минут), аналогичным образом центрифугируют контроль.
6. В опытную пробирку разливают 0,8 мл клеточного экстракта, в контрольную - 0,8 мл 0,9% раствора хлорида натрия, обработанного хлороформом.
7. В опытную и контрольную пробирки добавляют по 0,4 мл взвеси S. aureus (способ приготовления взвеси: 24-часовую агаровую культуру S. aureus смывают 0,9% раствором хлорида натрия и готовят микробную взвесь, густота которой соответствует оптической плотности 0,27 при 591 нм на СФ-46).
8. Полученные смеси инкубируют в течение 40-60 минут при 37oС.
9. Инкубированные смеси центрифугируют (3000g в течение 15 минут), отделенные клетки тест-культуры S. aureus дважды отмывают 0,9% раствором хлорида натрия центрифугированием (3000g в течение 15 минут) и готовят микробную взвесь, густота которой соответствует оптической плотности 0,20 при 591 нм на СФ-46.
10. Определяют активность каталазы тест-культуры S. aureus в опыте (Ао) и контроле (Ак) по известной методике [7], модифицированной заявителями способа. Модификация заключается в изменении концентраций исходных растворов пероксида водорода и иодида калия. Рассчитывают активность каталазы тест-культуры: а) К 0,2 мл взвеси S. aureus добавляют 1 мл свежеприготовленного 0,0125 М раствора H2O2 и инкубируют 10 минут при комнатной температуре; б) реакцию разложения Н202 каталазой останавливают добавлением 5 капель 2н. раствора НС1; в) добавляют 1 мл свежеприготовленного 0,025 М раствора KI, тщательно перемешивают; г) осаждают клетки S. aureus центрифугированием в течение 15 минут при 3000 g; д) замеряют светопоглощение образовавшегося в надосадочной жидкости комплекса I2-KI (λ = 492 нм, СФ-46) не позднее чем через 10 минут после центрифугирования; е) расчет активности каталазы ведут по формуле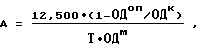
где А - активность каталазы, микромоль /мин•ОД;
12,500 - количество H2O2, микромоль/мл;
ОДоп - оптическая плотность комплекса I2-KI в опыте;
ОДк - оптическая плотность комплекса I2-КI в контроле, полученном путем смешивания исходных растворов Н2O2 и KI с добавлением НСl;
Т - время инкубации исследуемой культуры с Н2О2;
ОДм - оптическая плотность взвеси исследуемой культуры, взятой для определения активности каталазы.
11. Рассчитывают степень ингибирования каталазной активности тест-культуры по формуле:
[(Ак-Ао)/Ак]•100%,
где Ак - активность каталазы тест-культуры в контроле;
Ао - активность каталазы тест-культуры в опыте.
12. Судят о наличии или отсутствии у исследуемой культуры бактерий ингибиторов каталазы микроорганизмов.
Примеры конкретного выполнения способа.
Пример 1. Из влагалища здоровой женщины в монокультуре выделен представитель нормофлоры Corynebacterium minutissimum. Исследуемую культуру выращивали в жидкой питательной среде 24 часа при 37oС, отделяли супернатант, отмывали клетки бактерий от питательной среды, приготавливали из них взвесь в 2-3 мл 0,9% раствора хлорида натрия, обрабатывали бактериальную взвесь хлороформом (0,2 мл на пробу), параллельно готовили контроль из 0,9% раствора хлорида натрия, обработанного хлороформом. Отделяли клеточные экстракты центрифугированием (3000g в течение 15 минут). В опытную пробирку разливали 0,8 мл клеточного экстракта, в контрольные 0,8 мл 0,9% раствора хлорида натрия, обработанного хлороформом. В обе пробирки добавляли по 0,4 мл взвеси тест-культуры S. aureus (способ приготовления взвеси: 24-часовую агаровую культуру S. aureus смывали 0,9% раствором хлорида натрия и готовили микробную взвесь, густота которой соответствует оптической плотности 0,27 при 591 нм на СФ-46). Полученные смеси инкубировали в течение часа при 37oС. Инкубированные смеси центрифугировали (3000g в течение 15 минут), отделенные клетки тест-культуры дважды отмывали 0,9% раствором хлорида натрия и готовили микробную взвесь, густота которой соответствует оптической плотности 0,20 при 591 нм на СФ-46.
Определяли активность каталазы тест-культуры S. aureus в опыте и контроле: К 0,2 мл взвеси S. aureus добавляли 1 мл свежеприготовленного 0,0125 М раствора Н2О2 и инкубировали 10 минут при комнатной температуре; реакцию разложения Н2O2 каталазой останавливали добавлением 5 капель 2н. раствора НС1; добавляли 1 мл свежеприготовленного 0,025 М раствора KI, тщательно перемешивали; осаждали клетки S. aureus центрифугированием в течение 15 минут при 3000 g; замеряли светопоглощение образовавшегося в надосадочной жидкости комплекса I2-KI (λ= 492 нм, СФ-46) не позднее чем через 10 минут после центрифугирования.
Расчет активности каталазы S. aureus в опыте с клеточными экстрактами исследуемых культур вели по формуле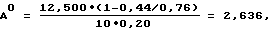
где Ао - активность каталазы S. aureus в опыте, микромоль /мин•ОД;
12,500 - количество Н2О2, микромоль/мл;
0,44 - оптическая плотность комплекса I2-KI в опыте;
0,76 - оптическая плотность комплекса I2-КI в контроле, полученном путем смешивания исходных растворов Н2O2 и KI с добавлением НС1;
10 - время инкубации исследуемой культуры S. aureus с Н2O2;
0,20 - оптическая плотность взвеси исследуемой культуры S. aureus, взятой для определения активности каталазы.
Расчет активности каталазы S. aureus в контроле вели по формуле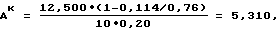
где Ак - активность каталазы S. aureus в контроле, микромоль /мин•ОД;
12,500 - количество Н2O2, микромоль/мл;
0,114 - оптическая плотность комплекса I2-КI в контроле с S. aureus;
0,76 - оптическая плотность комплекса I2-KI в контроле, полученном путем смешивания исходных растворов Н2О2 и KI с добавлением НС1;
10 - время инкубации исследуемой культуры S. aureus с H2O2;
0,20 - оптическая плотность взвеси исследуемой культуры S. aureus, взятой для определения активности каталазы.
Степень ингибирования каталазной активности S. aureus определяли по формуле
[(5,310-2,636)/5,310]•100%=50,36%,
где 50,36% - степень подавления каталазной активности S. aureus под влиянием клеточных экстрактов С. minutissimum;
5,310 - активность каталазы S. aureus в контроле;
2,636 - активность каталазы S. aureus в опыте с клеточными экстрактами С. minutissimum.
Данный штамм Corynebacterium minutissimum угнетал активность каталазы S. aureus по сравнению с контролем на 50,36%; (соответственно активность каталазы S. aureus 2,636 микромоль/мин•ОД в опыте; 5,310 микромоль/мин•ОД в контроле). Делали вывод о наличии у исследуемой культуры С. minutissimum ингибиторов каталазы микроорганизмов, причем с высокой степенью ингибирования (50,36%).
Пример 2. Из уретры здорового мужчины выделены представители нормофлоры Corynebacterium minutissimum, Staphylococcus epidermidis. Обработку исследуемых культур хлороформом, S. aureus клеточными экстрактами исследуемых культур, определение активности каталазы S. aureus и определение степени угнетения каталазной активности S. aureus вели аналогично вышеописанному способу. Исследуемые штаммы угнетали активность каталазы S. aureus по сравнению с контролем: в случае с использованием клеточных экстрактов С. minutissimum на 47,34% (активность каталазы S. aureus в опыте 2,796 микромоль/мин•ОД при контроле активности каталазы S. aureus 5,310 микромоль/мин•ОД); в случае с S. epidermidis клеточные экстракты угнетали активность каталазы на 31,86%, (активность каталазы S. aureus в опыте 3,618 микромоль/мин•ОД при контроле активности каталазы S. aureus 5,310 микромоль/мин•ОД). Делали вывод о наличии у исследованных культур бактерий ингибиторов каталазы микроорганизмов с различной степенью ингибирования (С. minutissimum - 47,34%, S. epidermidis - 31,86%).
Таким образом, использование предлагаемого способа позволяет выявить новое свойство бактерий - способность ингибировать каталазу микроорганизмов, которое может быть использовано для изучения физиологии микробных клеток и расшифровки механизмов взаимодействия бактерий в биоценозах.
Источники информации
1. Маянский А.Н., Маянский Д.Н. Очерки о нейтрофиле и макрофаге. - Новосибирск: Наука, 1989. - С. 344.
2. Hillier S.L., Krohn M.A., Klebanoff S.J., Eschenbach D.A. The relationship of hydrogen peroxide-producing lactobacilli to bacterial vaginosis and genital microflora in pregnant women// Obstet. Gynekol. - 1992. - Vol. 79, 3. - P. 369-373.
3. Варвашевич Т.Н., Никифорова Л.С., Богомазова Т.В. Метод определения каталазной активности бактерий // Лаб. дело. - 1989. - 2. - С. 61-62.
4. Королюк М.А., Иванова Л.И., Майорова И.Г., Токарев В.Е. Метод определения активности каталазы // Лаб. дело. - 1988. 1. С. 16-18.
5. Досон Р., Эллиот Д., Эллиот У., Джонс К. Справочник биохимика. - М.: Изд. "Мир", 1991. - С. 251.
6. Каталог штаммов Всесоюзного музея патогенных бактерий, вып. 1. - М. 1982.
7. Сгибнев А.В. Метод определения каталазной активности микоорганизмов // Тезисы докладов научно-практической конференции молодых ученых и специалистов Оренбуржья (часть II). - Оренбург: Издательство ОГУ, 1999. - С. 68.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ВЫЯВЛЕНИЯ У МИКРООРГАНИЗМОВ ПРОТЕКТИВНОГО ДЕЙСТВИЯ В ЭФФЕКТЕ ФЕНТОНА | 2004 |
|
RU2279079C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АНТИКАРНОЗИНОВОЙ АКТИВНОСТИ МИКРООРГАНИЗМОВ | 1998 |
|
RU2132879C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АНТИТРОМБОЦИТАРНОЙ КАТИОННО-БЕЛКОВОЙ АКТИВНОСТИ МИКРООРГАНИЗМОВ | 1997 |
|
RU2120999C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АНТИГИСТОНОВОЙ АКТИВНОСТИ МИКРООРГАНИЗМОВ | 2001 |
|
RU2203956C2 |
| СПОСОБ ВЫБОРА ШТАММОВ МИКРООРГАНИЗМОВ-ДЕСТРУКТОРОВ НЕФТИ И НЕФТЕПРОДУКТОВ | 2009 |
|
RU2426781C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АНТИЛАКТОФЕРРИНОВОЙ АКТИВНОСТИ МИКРООРГАНИЗМОВ | 1999 |
|
RU2156807C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АНТИЛИЗОЦИМНОЙ АКТИВНОСТИ МИКРООРГАНИЗМОВ | 1997 |
|
RU2126051C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ КОЛОНИЗАЦИОННОЙ РЕЗИСТЕНТНОСТИ ЭКОЛОГИЧЕСКОЙ НИШИ ТЕЛА ЧЕЛОВЕКА | 2000 |
|
RU2175673C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ЭФФЕКТИВНОЙ ДОЗЫ АНТИСЕПТИЧЕСКОГО ПРЕПАРАТА, ЭЛЕКТРОЛИЗНОГО РАСТВОРА ГИПОХЛОРИТА НАТРИЯ, ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ГНОЙНО-ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ | 1995 |
|
RU2114913C1 |
| СПОСОБ УСИЛЕНИЯ АДГЕЗИИ БАКТЕРИЙ К ВАГИНАЛЬНЫМ ЭПИТЕЛИОЦИТАМ | 2014 |
|
RU2580247C2 |
Изобретение относится к микробиологии и может быть использовано в исследовательской работе НИИ и практической работе бактериологических лабораторий клинических учреждений, определяющих характеристики микроорганизмов, играющих роль в формировании нормальных микробиоценозов тела человека. Способ осуществляют путем выращивания исследуемой культуры микроорганизмов в жидкой питательной среде, отделения бактериальных клеток от супернатанта, приготовления из бактериальных клеток взвеси, обработки ее хлороформом и отделения клеточных экстрактов центрифугированием. Готовят контроль, добавляют в опытную пробу и контроль тест-культуру Staphylococcus aureus ГИСК 201108, инкубируют, отделяют клетки тест-культуры центрифугированием и приготавливают из них микробную взвесь. Определение активности каталазы тест-культуры в опыте и контроле и рассчет степени ингибирования каталазной активности тест-кульруры ведут по формуле, после чего судят о наличии или отсутствии у исследуемой культуры бактерий ингибиторов каталазы микроорганизмов. Данный способ позволяет выявить и изучить новое свойство бактерий - способность ингибировать каталазу микроорганизмов. 3 табл.
Способ выявления у бактерий ингибиторов каталазы микроорганизмов, заключающийся в том, что исследуемую культуру бактерий выращивают в жидкой питательной среде, отделяют бактериальные клетки от супернатанта, готовят из бактериальных клеток взвесь, обрабатывают ее хлороформом и отделяют клеточные экстракты центрифугированием, параллельно готовят контроль, в опытную пробу и контроль добавляют тест-культуру Staphylococcus aureus ГИСК 201108, инкубируют, отделяют клетки тест-культуры центрифугированием и готовят из них микробную взвесь, определяют активность каталазы тест-культуры в опыте и контроле, затем рассчитывают степень ингибирования каталазной активности тест-культуры по формуле
[(Ак-Ао)/Ак] •100%,
где Ак - активность каталазы тест-культуры в контроле;
Ао - активность каталазы тест-культуры в опыте,
и далее судят о наличии или отсутствии у исследуемой культуры бактерий ингибиторов каталазы микроорганизмов.
| БЕЗБОРОДОВ А.М | |||
| Микробные метаболиты - ингибиторы ферментов | |||
| - М.: Наука, 1986, с.78-79 | |||
| ВАРВАШЕВИЧ Т.Н | |||
| и др | |||
| Методы определения каталазной активности бактерий | |||
| Лабораторное дело, 1989, № 2, с.61-62 | |||
| ДОСОН Р | |||
| и др | |||
| Справочник биохимика | |||
| - М.: Мир, 1991, с.251. |
Авторы
Даты
2002-03-10—Публикация
2000-04-20—Подача