Изобретение относится к биотехнологии, в частности к генетической инженерии, и позволяет получать микробиологическим синтезом по оптимизированной технологии триметилглицин - бетаин, важный донор метильных групп, служащий осмопротектором при воздействии различных абиотических стрессов. Экзогенный бетаин может быть использован в биотехнологии для активации биосинтеза B12 при крупномасштабной ферментации Pseudomonas denitrificans.
Витамин В12 (кобаламин): витамин является антианемическим фактором. В животном организме играет значительную роль в процессе кроветворения, работе красного костного мозга и биосинтезе нуклеиновых кислот. В своем составе содержит кобальт. С помощью витамина В12 осуществляется ресинтез в организме незаменимой аминокислоты - метионина. Этот витамин оказывает влияние на рост животных, активизацию белкового обмена, способствует усвоению аминокислот [Sych M.J., Lacroix C, Stevens MJA (2016) Vitamin B12 - physiology, production and application. In Industrial Biotechnology of Vitamins, Biopigments, and Antioxidants. Wiley-VCH Verlag GmbH & Co. KGaA:129-159].
Недостаточная обеспеченность свиней, птицы, молодняка жвачных животных витамином В12 вызывает у них злокачественную анемию (малокровие), сопровождающуюся резким снижением продуктивности, прекращением роста и полным истощением организма из-за низкого усвоения белков и кормов растительного происхождения. У птиц наблюдается снижение выводимости яиц в результате повышенной эмбриональной смертности в последнюю неделю инкубации с признаками атрофии мышц конечностей, кровоизлиянием в мышцы, аллантоис и желточный мешок. У взрослого крупного рогатого скота и овец наблюдается появление злокачественной анемии и ее последствий при нарушении микробного синтеза витамина В12 в преджелудках, когда животные получают корма, бедные кобальтом [Букин В.Н. Роль витамина В12 его биосинтез, функции и применение. - М.: Из-во АН СССР, 1961, в. 5. - С. 5-18.; Sych M.J., Lacroix C, Stevens MJA (2016) Vitamin B12 - physiology, production and application. In Industrial Biotechnology of Vitamins, Biopigments, and Antioxidants. Wiley-VCH Verlag GmbH & Co. KGaA:129-159].
Известными продуцентами кобаламина являются прокариоты и, прежде всего, пропионовые и метанообразующие бактерии, которые и в естественных условиях образуют этот витамин. Высоких титров кобаламина (до 200 мг/л) удавалось достичь для факультативного анаэроба Propionibacterium shermanii, однако самым распространенным продуцентом в промышленности на сегодняшний день является Pseudomonas denitrificans, который производит аналогичные титры целевого продукта - B12 [Вальдман А.Р. Роль витамина В12 в питании с.-х. животных v // Витамин В12 и его применение в животноводстве. - М.: Наука, 1971. - С. 157-169.; Marie Sych J, Lacroix C., Stevens MJA: Vitamin B12 - physiology, production and application. In Industrial Biotechnology of Vitamins, Biopigments, and Antioxidants. Wiley-VCH Verlag GmbH & Co. KGaA; 2016:129-159].
Однако каким бы перспективным не был продуцент, без случайного или направленного мутагенеза, и/или метаболической (генной) инженерии, достигнуть конкурентоспособного выхода целевого продукта, особенно витамина В12, на сегодняшний день невозможно [Revuelta JL, Buey RM, Ledesma-Amaro R., Vandamme EJ. Microbial biotechnology for the synthesis of (pro) vitamins, biopigments and antioxidants: challenges and opportunities. Microbial Biotechnology 2016; 9:564-567].
В отличие от традиционного продуцента Propionibacterium, анаэробные процессы жизнедеятельности которого связаны с постоянным жестким контролем низкого уровня концентрации кислорода в среде, что увеличивает стоимость и усложняет технически производство витамина B12, продуцент P. denitrificans показал более быстрый рост клеток и хорошую эффективность синтеза кобаламина в условиях полной аэрации.
Тем не менее зависимость интенсивности биосинтеза от уровня растворенного в культуральной среде кислорода тоже существует, как одного из факторов оптимизации производства [Wang ZJ, Wang HY, Li YL, Chu J, Huang MZ, Zhuang YP, et al. Improved vitamin B12 production by step-wise reduction of oxygen uptake rate under dissolved oxygen limiting level during fermentation process. Bioresour Technol 2010; 101:2845-52].
Однако больший вклад в оптимизацию условий культивирования P. denitrificans как продуцента В12 могут дать такие известные индукторы синтеза витамина, как бетаин, холин и кобальт.
Бетаин существенно увеличивает формирование предшественников и промежуточных продуктов синтеза кобаламина, таких как δ-аминолевулиновая кислота (ALA, первый предшественник В12), глютамат (интермедиат ALA через C5-путь биосинтеза B12), глицин (интермедиат ALA через C4-путь биосинтеза B12), и метионин (прямой предшественник B12 в реакции метилирования) [Xia W, Peng WF, Chen W, Li KT. Interactive performances of betaine on the metabolic processes of Pseudomonas denitrificans. J Ind Microbiol Biotechnol 2015; 42:273-278].
Бетаин (N,N,N-триметилглицин) является важным донором метильных групп для образования аминокислоты - метионин, которая затем преобразуется в S-аденозилметионин, необходимый для образования корроидного кольца кобаламина. Обычно для увеличения продукции В12 в культуральную среду продуцента добавляют химически чистый бетаин в концентрации 5-7 г/л в течение 50-140 часов ферментации [Li KT, Liu DH, Li YL, Chu J, Wang YH, Zhuang YP, Zhang SL. Improved large-scale production of vitamin B12 by Pseudomonas denitrificans with betaine feeding. Bioresour Technol 2008; 99:8516-8520].
В качестве дополнительного источника бетаина может быть использована меласса сахарной свеклы из-за высокого содержания в ней глицинбетаина (производное глицина - триметилглицин). Однако необходимость постоянного внесения экзогенного бетаина приводит к увеличению себестоимости производства В12, а использование мелассы затруднено для такого производства невозможностью стандартизации сырья по количеству глицинбетаина и нежелательных побочных химических компонентов, таких, например, как пестицидов [Li KT, Liu DH, Li YL, Chu J, Wang YH, Zhuang YP, Zhang SL. Improved large-scale production of vitamin B12 by Pseudomonas denitrificans with betaine feeding. BioresourTechnol 2008; 99:8516-8520; Xia W, Peng WF, Chen W, Li KT. Interactive performances of betaine on the metabolic processes of Pseudomonas denitrificans. J Ind Microbiol Biotechnol 2015; 42:273-278].
В качестве одного из альтернативных источников бетаина может быть использован его внутриклеточный синтез рекомбинантной бактерией-продуцентом B12, например за счет гетерологичной экспрессии генов его биосинтеза из доступных субстратов.
Накопление органических осмолитов, таких как пролин, глицинбетаин, сахароспирты и полиамины играет ключевую роль в поддержании низкого внутриклеточного осмотического потенциала и предотвращения вредного влияния солевого стресса [Verslues PE, Agarwal M, Katiyar-Agarwal S, Zhu JH, Zhu JK. Methods and concepts in quantifying resistance to drought, salt and freezing, abiotic stresses that affect plant water status. Plant Journal 2006; 45:523-539]. Многие галотолерантные организмы, в ответ на абиотический стресс, такой как повышенная солёность почвы или низкая температура, накапливают низкомолекулярные полярные растворимые вещества.
Глицинбетаин наиболее широко распространен у высших растений, животных и бактерий [Hayashi H, Alia, Mustardy L, Deshnium P, Ida M, Murata N. Transformation of Arabidopsis thaliana with the codA gene for choline oxidase; accumulation of glycinebetaine and enhanced tolerance to salt and cold stress. Plant J 1997; 12:133-142]. Глицинбетаин защищает клетки от солевого стресса путем поддержания осмотического баланса с окружающей средой [Annunziata MG, Ciarmiello LF, Woodrow P, Dell'Aversana E, Carillo P. Spatial and temporal profile of glycine betaine accumulation in plants under abiotic stresses. Front Plant Sci 2019; 10:230] и стабилизируя четвертичную структуру сложных белков [Incharoensakdi A, Takabe T, Akazawa T. Effect of betaine on enzyme activity and subunit interaction of ribulose-1,5-bisphosphate carboxylase/oxygenase from Aphanothece halophytica. Plant Physiol 1986; 81:1044-1049]. Есть данные, что глицинбетаин участвует в защите ферментов и мембранных структур [Ashraf M, Foolad MR. Roles of glycine betaine and proline in improving plant abiotic stress resistance. Environmental and Experimental Botany 2007; 59:206-216].
Эукариотические организмы синтезируют глицинбетаин [(CH3)3NCH2COOH] из холина в 3 стадии. На первой стадии происходит окисление холина [(CH3)3N(CH2)2OH] до гидрата бетаин альдегида [(CH3)3NCH2CH(OH)2]. Вторая реакция - спонтанная дегидратация с образованием бетаин-альдегида [(CH3)3NCH2CHO]. Третий этап - окисление бетаин альдегида до глицинбетаина, сопряжённое с восстановлением никотинамидадениндинуклеотидфосфата (НАД). Первая и третья стадии катализируются, соответственно, холинмонооксидазой (CMO) и бетаинальдегиддегидрогеназой (BADH). У бактерий первая стадия катализируется мембраносвязанной холиндегидрогеназой (CDH). Например Escherichia coli имеет генный кластер, состоящий из betA, betB, betT и betI, которые кодируют CDH, BADH, транспорт холина и регуляторные белки соответственно [Lamark T, Kaasen I, Eshoo MW, Falkenberg P, McDougall J,  DNA sequence and analysis of the bet genes encoding the osmoregulatory choline-glycine betaine pathway of Escherichia coli. Mol Microbiol 1991; 5:1049-1064].
DNA sequence and analysis of the bet genes encoding the osmoregulatory choline-glycine betaine pathway of Escherichia coli. Mol Microbiol 1991; 5:1049-1064].
Однако доступность холина - субстрата для синтеза глицинбетаина является ограничивающим фактором биосинтеза данного соединения [McNeil SD, Rhodes D, Russell BL, Nuccio ML, Shachar-Hill Y, Hanson AD. Metabolic modeling identifies key constraints on an engineered glycine betaine synthesis pathway in tobacco. Plant Physiol 2000; 124:153-162].
Несмотря на путаницу в литературе, возникающую из-за неточного использования термина «синтез бетаина» для описания ситуаций, в которых молекулы-предшественники, такие как холин или карнитин, ферментативно превращаются в бетаин [Landfald B,  Choline-glycine betaine pathway confers a high level of osmotic tolerance in Escherichia coli. J Bacteriol 1986; 165:849-855], синтез бетаина de novo у бактерий встречается редко, ограничиваясь некоторыми фототрофными эубактериями, особенно те, которые проявляют солеустойчивость [Galinski EA,
Choline-glycine betaine pathway confers a high level of osmotic tolerance in Escherichia coli. J Bacteriol 1986; 165:849-855], синтез бетаина de novo у бактерий встречается редко, ограничиваясь некоторыми фототрофными эубактериями, особенно те, которые проявляют солеустойчивость [Galinski EA,  Betaine, a compatible solute in the extremely halophilic phototrophic bacterium Ectothiorhodospira halocloris. FEMS Microbiol Lett 1982; 13:357-360; Mackay MA, Norton RS, Borowitzka LJ. Organic osmoregulatory solutes in cyanobacteria. J Gen Microbiol 1984; 130:2177-2191; Imhoff JF. Osmoregulation and compatible solutes in eubacteria. FEMS Microbiol Rev 1986; 39:57-66].
Betaine, a compatible solute in the extremely halophilic phototrophic bacterium Ectothiorhodospira halocloris. FEMS Microbiol Lett 1982; 13:357-360; Mackay MA, Norton RS, Borowitzka LJ. Organic osmoregulatory solutes in cyanobacteria. J Gen Microbiol 1984; 130:2177-2191; Imhoff JF. Osmoregulation and compatible solutes in eubacteria. FEMS Microbiol Rev 1986; 39:57-66].
Несмотря на неспособность de novo синтезировать бетаин, бактерии способны энзимотически преобразовывать холин в бетаин в двухэтапной ферментативной реакции. При этом сам холин, транспортируемый в клетку через системы с высоким и низким сродством - BetT и ProU, соответственно [Lamark T, Styrvold OB, Strøm AR. Efflux of choline and glycine betaine from osmoregulating cells of Escherichia coli. FEMS Microbiol Lett 1992; 96:149-154], сначала окисляется до глицинбетаин альдегида ферментом холин дегидрогеназой (BetA). Вторая стадия окисления, катализируемая глицинбетаин альдегиддегидрогеназой (BetB), затем превращает глицинбетаин альдегид в глицинбетаин [Landfald B, Strøm AR. Choline-glycine betaine pathway confers a high level of osmotic tolerance in Escherichia coli. J Bacteriol 1986; 165:849-855].
Как и большинство прокариот, представители рода Pseudomonas не способны синтезировать холин и бетаин de novo [Geiger O, López-Lara IM, Sohlenkamp C. Phosphatidylcholine biosynthesis and function in bacteria. Biochim Biophys Acta 2013; 1831:503-513], при этом транспортеры экзогенного холина повсеместно встречаются в этой группе на основе анализа текущих последовательностей генома [Winsor GL, Lam DK, Fleming L, Lo R, Whiteside MD, Yu NY, Hancock RE, Brinkman FS. Pseudomonas Genome Database: improved comparative analysis and population genomics capability for Pseudomonas genomes. Nucleic Acids Res 2011;39 (Database issue):D596-600]. Помимо трансформации в бетаин, экзогенный холин может быть использован в псевдомонадах в качестве предшественника для образования бактериального фосфатидилхолина. Предполагается, что фосфатидилхолин служит запасным источником холина в мембране клеток, который высвобождается при необходимости синтеза бетаина [Wilderman PJ, Vasil AI, Martin WE, Murphy RC, Vasil ML. Pseudomonas aeruginosa synthesizes phosphatidylcholine by use of the phosphatidylcholine synthase pathway. J Bacteriol 2002; 184:4792-4799]. Интересно отметить, что у псевдомонад и холин и бетаин могут использоваться в качестве единственного источника углерода в условиях стресса [Fitzsimmons LF, Hampel KJ, Wargo MJ. J Bacteriol. Cellular choline and glycine betaine pools impact osmoprotection and phospholipase C production in Pseudomonas aeruginosa. J Bacteriol 2012; 194:4718-4726].
В настоящее время известно всего два альтернативных пути биосинтеза глицинбетаина у живых организмов. В первом случае, обнаруженном у почвенной бактерии Arthrobacter globiformis, биосинтез бетаина из холина катализируется одним флавоферментом, холиноксидазой (COD) [Ikuta S, Mamura S, Misaki H, Horiuti Y. Purification and characterization of choline oxidase from Arthrobacter globiformis. Journal of Biochemistry 1977; 82:1741-1749]. Основным преимуществом использования COD A. globiformis, в отличие от пар CMO/BADH или CDH/BADH, в качестве инструмента для разработки синтеза бетаина является то, что введение только одного гена (codA) достаточно для превращения холина в бетаин [Hayashi H, Alia, Mustardy L, Deshnium P, Ida M, Murata N. Transformation of Arabidopsis thaliana with the codA gene for choline oxidase; accumulation of glycinebetaine and enhanced tolerance to salt and cold stress. The Plant Journal 1997; 12:133-142]. Следует заметить, что A. globiformis также использует экзогенный холин [Niewerth H, Schuldes J, Parschat K, et al. Complete genome sequence and metabolic potential of the quinaldine-degrading bacterium Arthrobacter sp. Rue61a. BMC Genomics 2012; 13:534], а значит для биоинженерии синтеза бетаина с использованием codA необходимо обеспечивать его доступность, например путем внесения в питательные среды.
Недавно был описан еще один альтернативный путь биосинтеза бетаина в котором в качестве предшественника используется доступная аминокислота - глицин [Waditee R, Tanaka Y, Aoki K, Hibino T, Jikuya H, Takano J, Takabe T, Takabe T. Isolation and functional characterization of N-methyltransferases that catalyze betaine synthesis from glycine in a halotolerant photosynthetic organism Aphanothece halophytica. J Biol Chem 2003; 278:4932-4942].
Новый путь был обнаружен у галотолерантной цианобактерии Aphanothece halophytica и заключается в 3-стадийной последовательной реакции метилировании глицина, которое осуществляется парой N-метилтрансферазных ферментов. Один фермент [А. halophytica глицинсаркозин метилтрансфераза (ApGSMT)] катализирует реакцию метилирования глицина в саркозин и саркозина в диметилглицин, соответственно, а другой [A. halophytica диметилглицинметилтрансфераза (ApDMT)] катализирует специфическое метилирование диметилглицина до бетаина [Waditee R, Tanaka Y, Aoki K, Hibino T, Jikuya H, Takano J, Takabe T, Takabe T. Isolation and functional characterization of N-methyltransferases that catalyze betaine synthesis from glycine in a halotolerant photosynthetic organism Aphanothece halophytica. J Biol Chem 2003; 278:4932-4942]. Было показано, что совместная гетерологичная экспрессия этих двух ферментов в цианобактерии Synechococcus sp. PCC 7942 и растениях Arabidopsis thaliana и Oryza sativa приводит к накоплению значительного количества бетаина, уровень которого значительно превышал показатели трансгенных клеток, экспрессирующих ферменты холин-зависимого пути [Waditee R, Bhuiyan MN, Rai V, et al. Genes for direct methylation of glycine provide high levels of glycinebetaine and abiotic-stress tolerance in Synechococcus and Arabidopsis. Proc Natl Acad Sci U S A 2005; 102:1318-1323; Niu X, Xiong F, Liu J, Sui Y, Zeng Z, Lu B-R, Liu Y. Co-expression of ApGSMT and ApDMT promotes biosynthesis of glycine betaine in rice (Oryza sativa L.) and enhances salt and cold tolerance. Environmental and Experimental Botany 2014; 104:16-25].
Важно отметить, что как в исходной бактерии, так и в трансгенных организмах, несущих ферменты GSMT и DMT, синтез бетаина осуществляется de novo и добавление экзогенного глицина не оказывало существенного влияние на его продукцию [Waditee R, Bhuiyan MN, Rai V, et al. Genes for direct methylation of glycine provide high levels of glycinebetaine and abiotic-stress tolerance in Synechococcus and Arabidopsis. Proc Natl Acad Sci U S A 2005; 102:1318-1323]. Показано, что накопление бетаина в клетках про- и эукариот значительно повышает их устойчивость к абиотическим стрессам [Cleland D, Krader P, McCree C, Tang J, Emerson D. Glycine betaine as a cryoprotectant for prokaryotes. J Microbiol Methods 2004; 58:31-38; Giri J. Glycinebetaine and abiotic stress tolerance in plants. Plant Signal Behav 2011; 6:1746-1751].
Таким образом, способ биоинженерии биосинтеза бетаина с использованием в качестве предшественника не молекулы энергетически ценного холина, а распространенной аминокислоты глицина является в настоящее время наиболее перспективным. Реализация такой стратегии у промышленно ценных микробных продуцентов может не только улучшить их продуктивные свойства, но и позволит упростить технологию культивирования при крупномасштабном производстве.
В настоящее время известен единственный пример прокариотической гетерологичной экспрессии генов ApGSMT и ApDMT в цианобактерии Synechococcus sp. PCC 7942 [Waditee R, Bhuiyan MN, Rai V, et al. Genes for direct methylation of glycine provide high levels of glycinebetaine and abiotic-stress tolerance in Synechococcus and Arabidopsis. Proc Natl Acad Sci U S A 2005; 102:1318-1323].
Недостатком этого способа является использование специфичного плазмидного вектора - pUC303, который предназначен для сине-зеленых водорослей [Kuhlemeier CJ, Thomas AA, van der Ende A, van Leen RW, Borrias WE, van den Hondel CA, van Arkel GA. A host-vector system for gene cloning in the cyanobacterium Anacystis nidulans R2. Plasmid 1983; 10:156-163]. К тому же гетерологичная экспрессия обеспечивалась собственными промоторами генов ApGSMT и ApDMT, вследствие чего ее уровень зависел от содержания NaCl в среде [Waditee R, Bhuiyan MN, Rai V, et al. Genes for direct methylation of glycine provide high levels of glycinebetaine and abiotic-stress tolerance in Synechococcus and Arabidopsis. Proc Natl Acad Sci USA 2005; 102:1318-1323].
Таким образом, одной из задач изобретения является разработка универсальной векторной системы, позволяющей переносить и экспрессировать в клетках промышленно важных прокариот ферменты A. halophytica GSMT и DMT, катализирующие de novo биосинтез бетаина из глицина, что позволит создавать рекомбинантные штаммы микроорганизмов с комбинированными свойствами.
Задача, на решение которой направлено заявляемое изобретение - конструирование рекомбинантного штамма Pseudomonas denitrificans CCUG 1783, несущего такую экспрессирующую конструкцию (плазмиду), которая позволит получать целевой продукт - глицинбетаин (сокращенно бетаин).
Поставленная задача решена путем конструирования рекомбинантной плазмидной ДНК pMF230-GSMT/DMT, кодирующей гетерологичный гибридный белок, состоящий из слитых через гибкий пептидный линкер ферментов цианобактерии A. halophytica - глицинсаркозин метилтрансферазы (GSMT) и диметилглицин метилтрансферазы (DMT), катализирующих синтез глицинбетаина путем поэтапного метилирования глицина.
Технический результат заявленного изобретения - получение с высоким выходом глицинбетаина (бетаина) в промышленно важной бактерии Pseudomonas denitrificans.
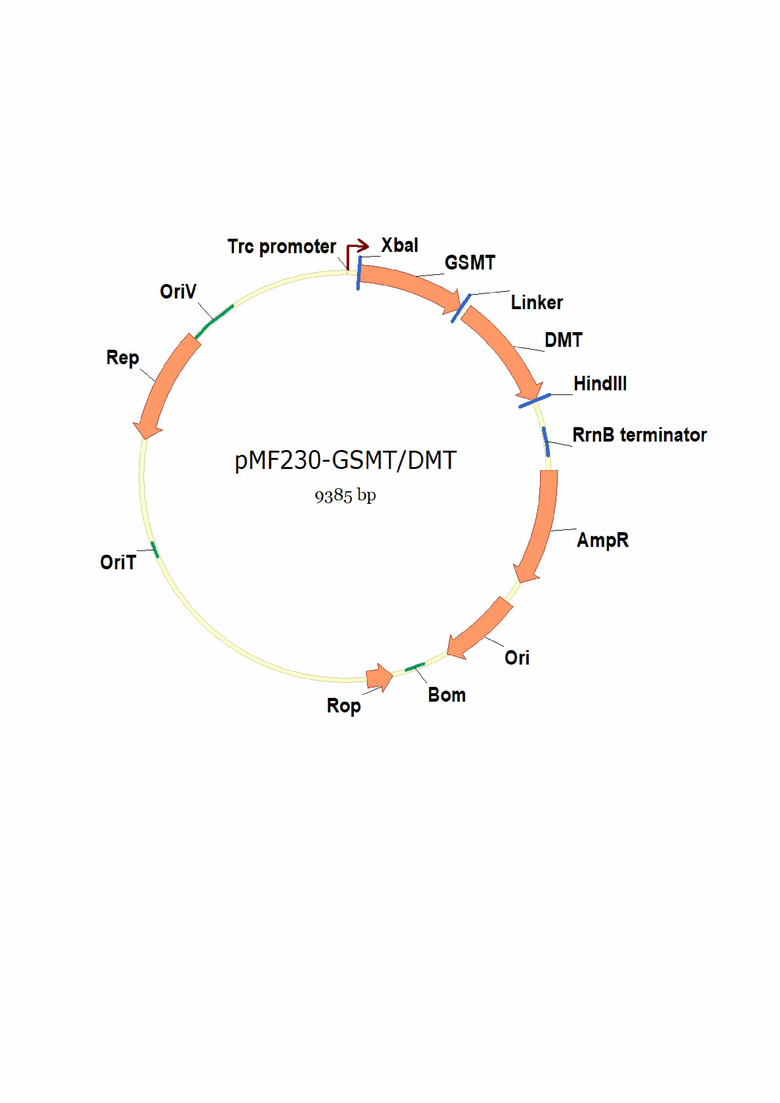
Плазмида pMF230-GSMT/DMT имеет 9385 пар оснований (п.о.) и характеризуется наличием XbaI/HindIII-фрагмента плазмиды с широким кругом хозяев pMF230 [Nivens DE, Ohman DE, Williams J, Franklin MJ. Role of alginate and its O acetylation in formation of Pseudomonas aeruginosa microcolonies and biofilms. J Bacteriol 2001; 183:1047-1057] и последовательности фрагмента ДНК размером 1686 п.о., содержащим кодирующую последовательность гибридного белка, состоящего из ферментов GSMT и DMT, слитых между собой с помощью последовательности гибкого пептидного линкера из 3-х кратного повтора GGGGS (где G - аминокислота глицин, S - аминокислота серин).
На чертеже представлена физическая карта плазмиды pMF230-GSMT/DMT и область плазмиды, ответственная за экспрессию гибридного белка GSMT/DMT.
Нуклеотидная последовательность фрагмента плазмиды pMF230-GSMT/DMT, фланкированная сайтами XbaI и HindIII, содержит последовательность слитых между собой структурных генов, кодирующих ферменты GSMT и DMT, соединенных между собой искусственной последовательностью, кодирующей гибкий пептидный линкер (GGGGS)х3. Экспрессия химерного гена, кодирующего гибридный белок GSMT/DMT, регулируется сильным бактериальным гибридным промотором trc и терминатором rrnB.
Рекомбинантный штамм Pseudomonas denitrificans/pMF230-GSMT/DMT - продуцент глицинбетаина (бетаина), получен трансформацией клеток P. denitrificans CCUG 1783 плазмидой pMF230-GSMT/DMT с использованием традиционного метода электропорации [Sambrook J., Fritsch E.F., Maniatis T. // Molecular Cloning. A. Laboratory Manual. 2bd ed. Cold Spring Harbor, NY, 1989].
Рекомбинантный штамм Pseudomonas denitrificans/pMF230-GSMT/DMT характеризуется следующими признаками:
1) культурально-морфологические признаки: колонии на агаризованной среде LB Луриа Бертани быстро растущие, достигающие 2-3 мм в диаметре через сутки культивирования, имеют беловатый/желтовато-коричневый цвет. Колонии образуются одиночно или небольшими группами. Штамм хорошо растет на любых богатых средах, таких как LB, SB, SOB и др., при температуре 25°С в аэробных условиях.
2) физико-биологические признаки: штамм характеризуется способностью к продукции кобаламина (B2). Также способен проводить денитрификацию как часть азотного цикла, в котором нитрат (NO3-) превращается в газообразный азот (N2).
Штамм не патогенен и не токсичен для теплокровных животных.
Штамм хранится обычным способом в суспензии с глицерином (30%) при -70°С.
Способ получения глицинбетаина (бетаина) заключается в следующем: инокулюм индивидуальной колонии штамма Pseudomonas denitrificans/pMF230-GSMT/DMT культивируют в жидкой питательной среде LB в течение суток при 25°С при интенсивном перемешивании (200 об/мин), затем биомассу осаждают центрифугированием, суспензию дезинтегрируют в смеси метанол/вода 1/1 (V/V). Получившуюся суспензию инкубировали при комнатной температуре на ультразвуковой бане в течение 1 часа. После инкубации суспензию центрифугировали при 17000 g в течение 20 минут. После этого прозрачный супернатант отбирали и переносили в новые пробирки для повторного центрифугирования при тех же условиях с последующим отбором супернатанта для ВЭЖХ и МС анализа.
Глицинбетаин имеет молекулярную массу 117,1 и полностью соответствует природному глицинбетаину, т.е. не содержит каких-либо дополнительных химических групп.
Существенными преимуществами вышеописанного способа получения бетаина с использованием рекомбинантного гибридного белка GSMT/DMT с комбинированными каталитическими свойствами являются использование рекомбинантного штамма-продуцента Pseudomonas denitrificans/pMF230-GSMT/DMT, что позволяет получать при de novo биосинтезе большое количество функционального глицинбетаина, биологически равноценного природному.
Изобретение иллюстрируется следующими примерами.
Пример 1. Конструирование плазмиды pMF230-GSMT/DMT.
Рекомбинантную плазмиду pMF230-GSMT/DMT, содержащую кодирующую последовательность гибридного белка, состоящего из ферментов GSMT и DMT, слитых между собой с помощью последовательности гибкого пептидного линкера из 3-х кратного повтора GGGGS, фланкированную сайтами рестрикции XbaI и HindIII, конструируют на основе плазмиды широким кругом прокариотических хозяев pMF230 [Nivens DE, Ohman DE, Williams J, Franklin MJ. Role of alginate and its O acetylation in formation of Pseudomonas aeruginosa microcolonies and biofilms. J Bacteriol 2001;183:1047-1057].
Фрагмент ДНК, содержащий химерный ген для биосинтеза гибридного белка GSMT/DMT, получают в два этапа.
На первом этапе проводят выделение ДНК из культуры цианобактерии A. halophytica. Для этого клетки растирают в жидком азоте до получения гомогенной массы и экстрагируют при помощи буфера следующего состава: 100 mM Трис-HCl (pH 8,0), 2M NaCl, 25 mM ЭДТА, 2% ЦТАБ, 2% ПВП, 2% 2-меркаптоэтанол. Полученный лизат инкубируют 5 минут при температуре 65°С, периодически перемешивая. По истечении времени инкубации раствор дважды обрабатывают смесью хлороформ/изоамиловый спирт (24/1) с последующим центрифугированием 10 мин при 18000 g и верхнюю фазу, содержащую фракцию нуклеиновых кислот, переносят в новые пробирки. ДНК осаждают добавлением 2,5 объема охлажденного 96% этанола с последующим центрифугированием 15 мин при 18000 g. Осадок ДНК промывают последовательно 70%-ным раствором этанола и подсушивают на воздухе. ДНК растворяют в 0,02 мл стерильной бидистиллированной воды. Количество ДНК определяют спектрофотометрическим методом по величине оптической плотности раствора при 260 нм. Качество ДНК оценивают по соотношению оптической плотности при 260 нм, с поглощением раствора при 230 и 280 нм.
На втором этапе проводят полимеразную цепную реакцию (ПЦР) с использованием ДНК A. halophytica в качестве матрицы. Для получения гена ApGSMT использовали праймеры ApGSMT-XbaI-dir и ApGSMT-linker-rev, где ApGSMT-XbaI-dir - праймер, специфичный по отношению к N-концевой последовательности ApGSMT, включающий сайт для рестриктазы XbaI; ApGSMT-linker-rev - обратный праймер, специфичный по отношению к С-концевой последовательности ApGSMT, включающий последовательность GGGGS линкера:
ApGSMT-XbaI-dir: 5'-TATCTAGAATGGCTATCAAAGAAAAAC-3'
ApGSMT-linker-rev: 5'-CAGAGCCACCTCCGCCTGAACCGCCACCACCTGAATCTTTTTTCGCAACGTG-3'.
Для получения гена ApDMT использовали праймеры ApDMT-linker-dir и ApDMT-HindIII-rev, где ApDMT-linker-dir - праймер, специфичный по отношению к N-концевой последовательности ApDMT, включающий последовательность GGGGS линкера; ApDMT-HindIII-rev - обратный праймер, специфичный по отношению к С-концевой последовательности ApDMT, включающий сайт для рестриктазы HindIII:
ApDMT-linker-dir: 5'-CAGGCGGAGGTGGCTCTGGCGGTGGCGGATCGACTAAAGCAGACGCAGTCGC-3'
ApDMT-HindIII-rev: 5'-TTAAGCTTCTAGGGTTTGTGGAACTTG-3'.
Реакции с каждой специфичной парой праймеров проводят в следующих условиях: 10х Encyclo буфер, 50х смесь полимераз Encyclo («Encyclo PCR kit», Евроген, Москва), 50х смесь dNTP (10 mM каждого), смесь праймеров (5 μМ каждого), 20 нг ДНК. Процесс амплификации состоит из следующих стадий: 30 циклов ПЦР (15 с - 95°С, 15 с - 55°С, 1 мин - 72°С) и инкубация 10 мин при 72°С.
После амплификации ПЦР-продукты смешивают и проводят повторную ПЦР с праймерами ApGSMT-XbaI-dir и ApDMT-HindIII-rev при тех же условиях. В этой реакции за счет наличия гомологичного участка, ПЦР продукты первой реакции амплификации объединяются между собой с образованием химерной последовательности, состоящей из кодирующей части генов ApGSMT и ApDMT, слитых между собой с помощью последовательности, кодирующей гибкий пептидный линкер (GGGGS)х3, далее GSMT/DMT.
После последней амплификации ПЦР-продукт очищают электрофоретически в 1% агарозном геле. Фрагмент (1 мкг) обрабатывают рестриктазами XbaI и HindIII в оптимальном буфере (Fermentas) в течение 24 ч, затем ферменты удаляют из реакционной среды по стандартной методике фенолом (1:1) [Sambrook J. et. al. // Molecular Cloning. A. Laboratory Manual. 2bd ed. Cold Spring Harbor, NY, 1989]. В водную фракцию, содержащую фрагмент, добавляют 1/10 объема 0,3 М ацетата Na, pH 5,2 и 1/2 объема изопропилового спирта и оставляют на -20°С в течение 30 мин. Затем центрифугируют при 18000 g в течение 20 мин, осадок промывают 70% этанолом и высушивают при комнатной температуре. Осадок растворяют в 20 мкл деионизованной воды. Для сравнения нуклеотидной последовательности полученного фрагмента с последовательностью целевого гена его секвенируют с использованием смеси флуоресцентно-меченных терминаторов BigDye™ Terminator v3.1 Cycle Sequencing Kit по методике производителя (Applied Biosystems).
2 мкг плазмидной ДНК pMF230 обрабатывают рестриктазами XbaI и HindIII в соответствии с методикой, описанной выше, и из полученного гидролизата выделяют векторную часть плазмиды в 1% геле легкоплавкой агарозы.
Полученный фрагмент химерного гена, кодирующий гибридный белок GSMT/DMT, и векторную часть плазмиды pMF230 сшивают при помощи лигазной реакции в 50 мкл буфера для лигирования согласно инструкции (Fermentas). 10 мкл реакционной смеси используют для трансформации компетентных клеток E. coli Rosetta (DE3). Трансформанты высевают на LB-агар, содержащий 50 мкг/мл ампициллина. После инкубирования в течение 16 ч при 37°С клоны отсевают, выделяют плазмидную ДНК и анализируют на наличие мутаций при помощи автоматического секвенирования. Отбирают плазмидную ДНК pMF230-GSMT/DMT, содержащую последовательность GSMT/DMT.
Пример 2. Получение рекомбинантного штамма P. denitrificans/pMF230-GSMT/DMT - продуцента бетаина.
Рекомбинантный штамм-продуцент P. denitrificans/pMF230-GSMT/DMT получают путем электропорации клеток штамма P. denitrificans CCUG 1783 рекомбинантной плазмидой pMF230-GSMT/DMT.
Колонии P. denitrificans собирают с поверхности LB-агара и культивируют в течение суток в жидкой LB-среде. После культивирования клетки собирают центрифугированием при 3000 g и переводят в 10% раствор глицерина. Суспензию клеток в глицерине повторно центрифугируют и смешивают с 10 мкг плазмидной ДНК в объеме 250 мкл и помещают в ячейку для электропорации с зазором 0,2 см (Bio-Rad). Процедуру электропорации проводят в кюветном электропораторе Gene Pulser Xcell (BioRad) в следующем режиме: два импульса по 1 мс каждый при 1,70 кВ с интервалом 5 с.
Для определения эффективности трансформации и наличия вставки гена запасного белка амаранта конидии штамма P. denitrificans после электропорации высевают на агаризованную среду LB с ампицилином, инкубируют в течение суток при 25°С. Далее отбирают отдельно стоящие колонии в качестве матрицы для проведения ПЦР с парами специфических праймеров для плазмиды pMF230:
Prom-D: 5'-ATCATCCGGCTCGTATAATG-3'
Term-R: 5'-TGAGCCTTTCGTTTTATTTG-3'.
Размер ПЦР продукта плазмиды pMF230-GSMT/DMT составлял 1982 п.о.
Для определения продуктивности штамма по рекомбинантному белку экстракты грибной биомассы в буфере с 8 М мочевиной анализируют электрофорезом в 12,5% ПААГ. Гель окрашивают Кумасси R-250 по стандартной методике и определяют относительное количество белка в полосе целевого продукта. Содержание рекомбинантного белка в клеточной фракции составляет не менее 30% от всех белков этой фракции.
Пример 3. Выделение и характеристика бетаина.
Штамм-продуцент бетаина - P. denitrificans/pMF230-GSMT/DMT, инкубируют в трехлитровой колбе в жидкой среде LB в течение суток при 25°С при интенсивном перемешивании (200 об/мин). Биомассу отделяют от культуральной среды центрифугированием и промывают физраствором на фильтровальной бумаге. Суспензию дезинтегрируют в смеси метанол/вода 1/1 (V/V). Получившуюся суспензию инкубировали при комнатной температуре на ультразвуковой бане в течение 1 часа. После инкубации суспензию центрифугировали при 17000 g в течение 20 минут. После этого прозрачный супернатант отбирали и переносили в новые пробирки для повторного центрифугирования при тех же условиях с последующим отбором супернатанта для ВЭЖХ и МС анализа. Содержание бетаина в штамме P. denitrificans/pMF230-GSMT/DMT составляет не менее 50 мкг на 1 г сырой массы клеток.
Продуктивность штамма составляет до 85 мкг из 1 л культуры.
Идентификацию полученного рекомбинантного полипептида проводят по характеристичным пикам масс-спектра глицин бетаина: [M+H]+=118.1 и [2M+H]+=235.
Заявленное изобретение позволяет с помощью использования рекомбинантного штамма-продуцента P. denitrificans/pMF230-GSMT/DMT получать путем de novo биосинтеза большое количество бетаина, что может быть использовано биотехнологической промышленности для повышения устойчивости рекомбинантных штаммов бактерий к неблагоприятным абиотическим факторам, а также активации синтеза ценных метаболитов, например кобаламина.
--->
Перечень нуклеотидных и аминокислотных последовательностей
<110> Шкрыль Ю.Н., Балабанова Л.А., Дегтяренко А.И.,
Григорчук В.П., Слепченко Л.В., Марченок М.В.,
Подволоцкая А.Б., Сон О.М., Текутьева Л.А.
<120> Рекомбинантная плазмидная ДНК pMF230-GSMT/DMT, кодирующая
химерный фермент биосинтеза бетаина, и рекомбинантный
штамм Pseudomonas denitrificans/pMF230-GSMT/DMT –
продуцент бетаина
<160> 1
<210> 1
<211> 1686
<212> ДНК
<213> Aphanothece halophytica
<223> Нуклеотидная последовательность фрагмента плазмиды
pMF230-GSMT/DMT, фланкированная сайтами XbaI и HindIII,
содержащая последовательность, кодирующую химерный фермент
биосинтеза бетаина GSMT/DMT.
<400> 1
XbaI
85 TCTAGAATGG CTATCAAAGA AAAACAAGTT CAAGACTACG GCGAGAATCC CATTGAAGTT
AGATCTTACC GATAGTTTCT TTTTGTTCAA GTTCTGATGC CGCTCTTAGG GTAACTTCAA
145 CGCGATAGTG ACCACTACCA AAATGAGTAC ATCGAAGGCT TTGTTGAAAA GTGGGATGAA
GCGCTATCAC TGGTGATGGT TTTACTCATG TAGCTTCCGA AACAACTTTT CACCCTACTT
205 CTGATTAACT GGCACGCCCG TTCTAGCAGC GAAGGGGAAT TTTTTATTAA AACCCTCAAA
GACTAATTGA CCGTGCGGGC AAGATCGTCG CTTCCCCTTA AAAAATAATT TTGGGAGTTT
265 GAACACGGTG CAAAGCGTGT CCTCGATGCT GCAACTGGAA CTGGATTCCA CTCCATTCGT
CTTGTGCCAC GTTTCGCACA GGAGCTACGA CGTTGACCTT GACCTAAGGT GAGGTAAGCA
325 CTCATTGAAG CTGGCTTTGA TGTCGCAAGC GTCGATGGTA GTGTGGAAAT GCTGGTCAAA
GAGTAACTTC GACCGAAACT ACAGCGTTCG CAGCTACCAT CACACCTTTA CGACCAGTTT
385 GCATTTGAAA ACGCCACTCG TAAAGACCAA ATCCTCAGAA CCGTTCACTC TGACTGGCGA
CGTAAACTTT TGCGGTGAGC ATTTCTGGTT TAGGAGTCTT GGCAAGTGAG ACTGACCGCT
445 CAAGTGACTC GGCATATTCA GGAACGGTTT GATGCAGTGA TTTGTCTAGG AAACTCCTTT
GTTCACTGAG CCGTATAAGT CCTTGCCAAA CTACGTCACT AAACAGATCC TTTGAGGAAA
505 ACTCACCTCT TCTCAGAAGA AGATCGTCGC AAAACCCTCG CTGAGTTCTA TTCCGTCTTA
TGAGTGGAGA AGAGTCTTCT TCTAGCAGCG TTTTGGGAGC GACTCAAGAT AAGGCAGAAT
565 AAACATGACG GAATTTTAAT TTTAGACCAA CGGAATTATG ACTTGATTCT GGATGAAGGG
TTTGTACTGC CTTAAAATTA AAATCTGGTT GCCTTAATAC TGAACTAAGA CCTACTTCCC
625 TTTAAGAGCA AGCATACCTA CTACTACTGT GGCGATAATG TCAAAGCAGA ACCCGAATAT
AAATTCTCGT TCGTATGGAT GATGATGACA CCGCTATTAC AGTTTCGTCT TGGGCTTATA
685 GTTGATGATG GGTTAGCGCG TTTCCGTTAC GAATTCCCTG ATCAGAGTGT TTATCACCTC
CAACTACTAC CCAATCGCGC AAAGGCAATG CTTAAGGGAC TAGTCTCACA AATAGTGGAG
745 AATATGTTCC CATTGCGGAA AGATTATGTT CGTCGTCTGC TTCATGAAGT GGGCTTTCAA
TTATACAAGG GTAACGCCTT TCTAATACAA GCAGCAGACG AAGTACTTCA CCCGAAAGTT
805 GATATCACGA CTTATGGTGA TTTCCAAGAA ACCTATCATC AAGATGATCC CGACTTTTAT
CTATAGTGCT GAATACCACT AAAGGTTCTT TGGATAGTAG TTCTACTAGG GCTGAAAATA
865 ATTCACGTTG CGAAAAAAGA TTCAGGTGGT GGCGGTTCAG GCGGAGGTGG CTCTGGCGGT
TAAGTGCAAC GCTTTTTTCT AAGTCCACCA CCGCCAAGTC CGCCTCCACC GAGACCGCCA
925 GGCGGATCGA CTAAAGCAGA CGCAGTCGCC AAACAAGCAC AAGATTACTA CGACAGTGGT
CCGCCTAGCT GATTTCGTCT GCGTCAGCGG TTTGTTCGTG TTCTAATGAT GCTGTCACCA
985 AGTGCCGACG GCTTCTACTA TCGGATTTGG GGGGGAGAAG ATCTCCACAT CGGGATTTAT
TCACGGCTGC CGAAGATGAT AGCCTAAACC CCCCCTCTTC TAGAGGTGTA GCCCTAAATA
1045 AACACCCCTG ATGAACCAAT TTATGATGCA AGTGTCCGCA CTGTCAGTCG CATTTGTGAC
TTGTGGGGAC TACTTGGTTA AATACTACGT TCACAGGCGT GACAGTCAGC GTAAACACTG
1105 AAAATTAAAA ATTGGCCAGC AGGAACCAAG GTGCTTGACC TTGGCGCAGG TTATGGTGGC
TTTTAATTTT TAACCGGTCG TCCTTGGTTC CACGAACTGG AACCGCGTCC AATACCACCG
1165 TCCGCTCGTT ATATGGCAAA GCATCACGGC TTTGATGTGG ATTGTTTGAA TATCAGTTTG
AGGCGAGCAA TATACCGTTT CGTAGTGCCG AAACTACACC TAACAAACTT ATAGTCAAAC
1225 GTACAAAACG AGCGCAATCG CCAGATGAAC CAAGAACAGG GACTCGCTGA TAAAATTCGT
CATGTTTTGC TCGCGTTAGC GGTCTACTTG GTTCTTGTCC CTGAGCGACT ATTTTAAGCA
1285 GTTTTTGACG GCAGTTTTGA AGAGTTACCC TTTGAAAATA AGAGTTACGA TGTTCTCTGG
CAAAAACTGC CGTCAAAACT TCTCAATGGG AAACTTTTAT TCTCAATGCT ACAAGAGACC
1345 TCACAAGATT CTATCCTCCA TAGCGGGAAT CGTCGGAAAG TCATGGAAGA AGCCGATCGC
AGTGTTCTAA GATAGGAGGT ATCGCCCTTA GCAGCCTTTC AGTACCTTCT TCGGCTAGCG
1405 GTCCTCAAGT CTGGAGGCGA TTTTGTTTTT ACTGATCCCA TGCAAACCGA TAATTGTCCA
CAGGAGTTCA GACCTCCGCT AAAACAAAAA TGACTAGGGT ACGTTTGGCT ATTAACAGGT
1465 GAAGGGGTCT TAGAGCCAGT CTTAGCTCGG ATTCATTTAG ATAGTTTGGG TTCAGTTGGT
CTTCCCCAGA ATCTCGGTCA GAATCGAGCC TAAGTAAATC TATCAAACCC AAGTCAACCA
1525 TTCTATCGAC AAGTGGCGGA AGAACTCGGT TGGGAATTTG TTGAATTTGA TGAACAAACT
AAGATAGCTG TTCACCGCCT TCTTGAGCCA ACCCTTAAAC AACTTAAACT ACTTGTTTGA
1585 CACCAGTTAG TTAACCACTA TAGTCGAGTG CTGCAAGAAC TGGAAGCCCA TTATGATCAA
GTGGTCAATC AATTGGTGAT ATCAGCTCAC GACGTTCTTG ACCTTCGGGT AATACTAGTT
1645 TTGCAACCTG AATGCTCGCA AGAATATTTA GACCGCATGA AGGTTGGCTT AAATCACTGG
AACGTTGGAC TTACGAGCGT TCTTATAAAT CTGGCGTACT TCCAACCGAA TTTAGTGACC
1705 ATTAATGCAG GTAAAAGTGG TTACATGGCT TGGGGAATTC TCAAGTTCCA CAAACCCTAG
TAATTACGTC CATTTTCACC AATGTACCGA ACCCCTTAAG AGTTCAAGGT GTTTGGGATC
1765 AAGCTT
1771 TTCGAA
HindIII
<---
Изобретение относится к биотехнологии и представляет собой плазмиду pMF230-GSMT/DMT, определяющую синтез бетаина. Плазмида включает XbaI/HindIII – фрагмент плазмиды pMF230 и фрагмент ДНК размером 1686 пар оснований (п.о.), который содержит химерную последовательность, состоящую из кодирующей части генов ApGSMT и ApDMT, слитых между собой с помощью последовательности, кодирующей гибкий пептидный линкер. Предложен также рекомбинантный штамм P. denitrificans/pMF230-GSMT/DMT, трансформированный указанной плазмидой, пригодный для продукции бетаина. Изобретение позволяет получать бетаин без добавления предшественников в питательную среду и может быть использовано в биотехнологической промышленности для повышения устойчивости рекомбинантных штаммов бактерий к неблагоприятным абиотическим факторам, а также активации синтеза ценных метаболитов, например кобаламина. 2 н.п. ф-лы, 1 ил., 3 пр.
1. Плазмида pMF230-GSMT/DMT, определяющая синтез гибридного белка, состоящего из слитых между собой ферментов глицинсаркозинметилтрансферазы (GSMT) и диметилглицинметилтрансферазы (DMT), и характеризующаяся наличием XbaI/HindIII фрагмента ДНК размером 1686 пар оснований (п.о.), который встроен в исходную плазмиду pMF230, в результате чего получилась заявляемая плазмида размером 9385 п.о., приведенная на фиг. 1, и содержит химерную последовательность, состоящую из кодирующей части генов глицинсаркозинметилтрансферазы А. halophytica (ApGSMT)и диметилглицинметилтрансферазы А. halophytica (ApDMT), слитых между собой с помощью последовательности, кодирующей гибкий пептидный линкер из 3-кратного повтора GGGGS.
2. Рекомбинантный штамм P. denitrificans/pMF230-GSMT/DMT, полученный путем модификации штамма P. denitrificans CCUG 1783 плазмидой pMF230-GSMT/DMT по п.1, – продуцент бетаина.
| Waditee R, Bhuiyan MN, Rai V, et al | |||
| Genes for direct methylation of glycine provide high levels of glycinebetaine and abiotic-stress tolerance in Synechococcus and Arabidopsis | |||
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Nivens DE, Ohman DE, Williams J, Franklin MJ | |||
| Role of alginate and its O acetylation in formation of Pseudomonas aeruginosa | |||
Авторы
Даты
2021-09-28—Публикация
2020-09-02—Подача