1
Изобретение относится к генной инженерии и.касается способа получения рекомбинантного многокопийного дрожжевого вектора.
Целью изобретения является повышение стабильности рекомбинантных векторов.
Стабильность векторов YCR р2-4 обеспечивается за счет помещения СЕЫЗ-последовательиости перед промотором алкоголь-гидрогеназы И (ADH2). При этом трансформированные с помо-, щью АПН2-СЕКЗ-ш1азмиды слияния дрожжи культивируются в присутствии глюкозы, то ADH2-npoMOTOp дезактивируется (ADH2-AUS), а CEN3 митотически стабилизирует УСКр-плазмиду (CEN3-AN), При переводе источника углерода на этанол ADH2-npOMOTop реактивируется и полностью блокируется экспрессией с помощью.рагиона CEN3, что обеспечивает возможность амплификации до желаемого числа копий,
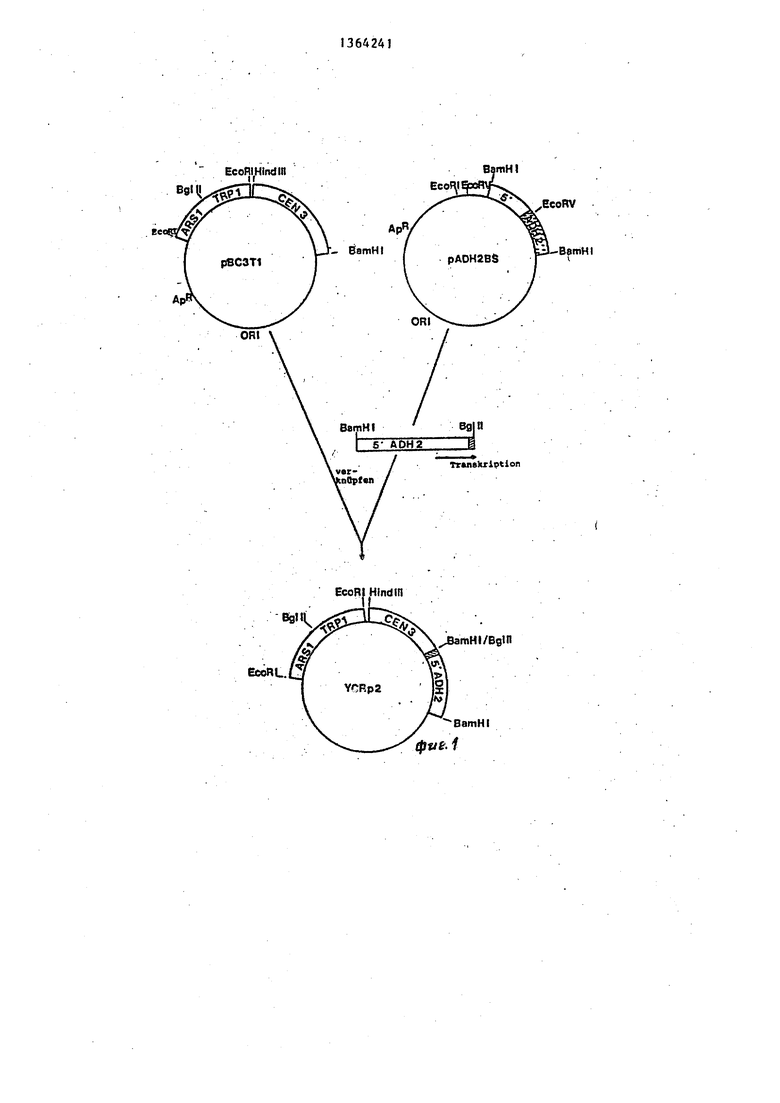
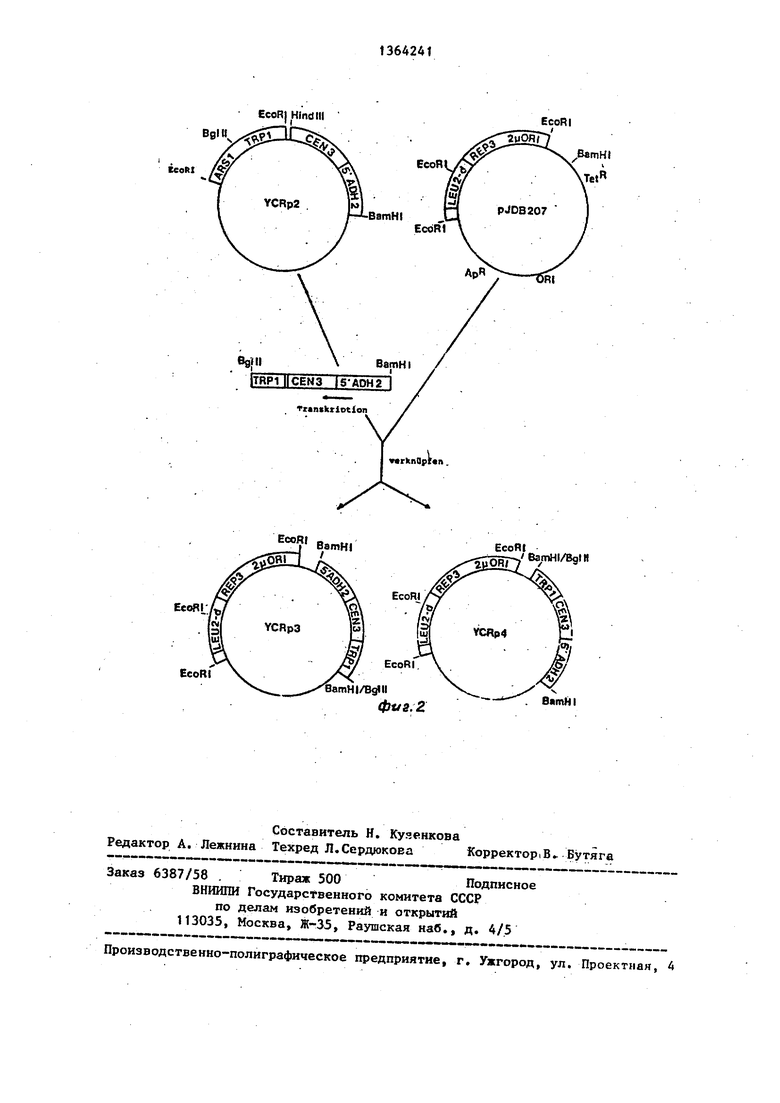
На фиг.1 схематически изображены карты сайтов рестрикции и генетические карты плазмид рВСЗТ и ADH2-BS и показано получение YCK р2-плазмиды , на фиг.2 - карта сайтов рестрикции и генетическая карта плазмиды IDB 20/ и показано получение YCR рЗ- и yCR р4-плазмид.
Способ осуществляют следующим образом.
Пример 1. Плазмида рВСЗТ содержит часть pBR 322 с геном устойчивости к ампицилину (ApR) OR1 для селекции и стабильного роста в E.coli. Кроме того, плазмида содержит ген trp I на Есо R 1/Есо R I-1- рагменте (45 kb), которьй происходит иэ хромосомы дрожжей III. Этот ген позволяет осуществлять отбор нужных клонов на штамме дрожжей trpl На том же са мом DHK-фрагменте находится ARSI- фрагмент (автономно реплицирующаяся последорательность). ARSI-фрагмент позволяет DHK реплицироваться в дрок- жах. рВСЗТ1-плазмида содержит к тому же и СЕНЗ-последовательность на . 2,0 kb Hind III Bam HI-фрагменте, которьй происходит от хромосомы дрожжей III. Плазмиды, которые содержат СЕЫЗ-последовательность, { итоти- чески стабильны ив клетке имеется 1-2 копни.
Плаэмида AD H2BS - это PBR 322 с клонированным в BamHI сайте, kb BaraHI - Sau ЗА-фрагментом хро
1 2
мосомной DHK дрожжей, который содержит ген ADH2. При этом в результате соединений концов BamHI и Sau ЗА генерируются места рестрикции BamHI, так что ген ADH2 из АОН25-плазмиды может вырезаться.
Из опубликованной ДНК-последовательности для гена ADH2 и 5 фланки- рующих регионов известно наиболее благоприятное место рестрикции в позиции +67 (причем +1 является А ATG- кодона). Это место выреза EcoRV совместно с местом выреза BamHI было использовано в позиции -1027 против течения, чтобы изолировать ADH2- промотор со всеми его 5 фланкирующими регуляционньми последовательностями.
5 мкг АГ1Н2В8-плазмидной ДНК полностью переваривают с помощью EcoRV (фиг. 1)., очищают с помощью экстракции фенолом и осаждают этанолом, связывают тупьм концом с 2 мкг
фосфолированных BglII-звеньев
(5 CAGATCTG3) (биологическая лаборатория) и вновь разрезают с помощью ВАт lil и Bglll; после препаративного арагоза-гель-электрофореза изолируют 1300 b р-фрагмент. Этот фрагмент содержит полньсй ADH2-npoMOTop со всеми регуляционными последовательностями и небольшой участок кодирующего ADH2 региона.
5 мкг рВСЗТ1-плазм1адной ДНК полностью переваривают с помощью BamHI- эндонуклеазы, очищают с помощью экстракции фенола и осаждения этанола и с помощью телячьей кишечной фосфатовы.
После новой экстракции фенолом и
осаждения Этанолом 100 нг BamHI разрезают и дефосфолированной рВСЗТ - плазмидной ДНК соединяют с 200 нг 1,3 кЬ-фрагмента BamHI/BglII, ADH2промотора, Т.ДНК-лигазой. После этого компетентные RRI-клетки трансформируют с помощью 1/5 этой смеси. Резистентные к ампицилину колонии отбирают путем гибр1адизации колоний благодаря тому, что маркированный радиоактивно с помощью ник-трасляции 1,3 кЬ BamHI/Bglll АВН2-промоторный фрагмент был использован в качестве пробы. Из 12 проявивших себя положительно колоний получают плазмидную ДНК и перерабатывают различными ре- стрикционными эндонуклеазами, чтобы идентифицировать клоны, которые имеют АВН2-вставку с ориентацией, кото20 мл Bottom-Agar (182 г сорбитола, 20 г глюкозы, 0,7 г YNB и 30 г Difeo Agar на 1 л HjO), и 10 мл 50°С Тор- g Agar (тот же состав, что и Bot.tom- Agar, однако дополнительно с добавлением 1 мл алеина (1,2 мг/мл), 1 мл урацина (2,4 мг/мл) и 1 мл смесн без триптофана на 50 мл Bottom-Agar 10 (смесь без триптофана содержит следующие аминокислоты на 100 мл 0,2 г аргинина; 0,1 г гистидина; 0,6 г изолейцина; 0,6 г лейцина; 0,4 г лизина; 0,1 метионина; 0,6 г 15 фенилаланина и 0,5 г треонина, эта Тгр -селекция дала 10 трансформантов дрожжей на 1 мкг плазмидной ДНК.
Стабильность плазмид в дрожжах проверяют благодаря тому, что клетки ра 1 М сорбитола, 25 мМ EDTA (рН 8) и 20 после селективного или неселективно- 50 мМ дитиотрейтола в течение 10 мин при 30°С и затем промывают 10 мл 1 М сорбитола. После этого пеллетирован- ные клетки ресуспендируют в 10 мл SCE (1М сорбитол, 0,1 М цитрат натрия, рН 5,8, и 0,01, М EDTA) и обраба- тьшают при 30°С с помощью 1 мг цимо- лиза 5000 (фирма Кирин брауэрай). 80%-ную сферопластификацию осуществляют путем добавки 100 мл суспензии к 0,9 мл 10%-ного раствора SDS; измерения проводят при AbS ggg с применением клеточного раствора перед добавкой фермента как 0%-ное выравнивание/лизис в 10%-ном растворе SDS при- gg,Соузерна. Всю ДНК SHU 32-(YCR р)рая дает возможность транскрипцию ADH2-npoMOTopa с помощью CEN 3-после- довательности. Этот клон изолируют.
С целью определения количества копий и стабильности плазмиды в дрожжах с помощью YCR Р2-плазмидной ДНК трансформируют в штамм дрожжей SHU, 32(trp-, leu , cw, аЗ). TRP-транс- форманты были изолированы и прове-. рены на стабильность и количество копий.
Трансформацию дрожжей осуществляют в соответствии с известным способом со следующими модификациями.
200 мл клеток с концентрацией 2x10 клетка/мл очищают промыванием в 25 мл Hjp путем центрифугирования. Эти клетки обрабатывают 10 мл раство. го выращиван ия разбавлены водой и плакированы на УРД-пластины (неселективно) . После 30 ч роста при 28°С эти пластины плакируют на YNB+CAA
25 пластины (TRP или LEU селекция). Процентную стабильность плазмид определяют путем деления количества в колониях, которые выращены селективно, на количество в колониях, кото30 рые выращены неселективно, и последующим .умножением на 100.
Определение количества копий плазмид осуществляют птуем анализа
вел к осаждению осадка AbS р) .
Затем клетки- трехкратно промывают 10 мл 1 М сорбитола, один раз 1. М сорбитола, 10 мМ CaClj и 10 мМ трис- НС1 (рН 7,4) и затем ресуспендируют 0 в 1 мл того же раствора. Затем добавляют 5-15 мкг очищенной плазмидной ДНК и осторожно смешивают со 100 мкл ресуспензйрованных клеток в течение
t5 мин. При осторожном перемещивании g рый содержит 1ШАЗ-ген дрожжей). Пос- в течение 15 мин добавляют 1 мл раст- ле экспонирования на рентгеновскую вора, который содержал 20% (W/V) по- лиэтнленгликоля 4000 (Мег ск), 10 мМ CaClj и 10 мМ трис-.НС (рН 7,5). Затем клетки центрифугируют и нкубиру- gg ioT в течение 20 мин при в 200 ыкл . .раствора SOS (tM сорбитола, 33,5% ,(V/V) УЕРД-бульона и 6,5 мМ СаС,). Затем too мкл этой суспензии помещают на чашку Петри, которая содержит
трансформантов, которые выращены в селективной среде, перерабатывают с помощью Есо R 1-рестриктироваиной эндонуклеазы и фракционируют путем агарозногр-гель-электрофореза. После переноса на нитроцеллюлозные фильтры ДНК гибридизуют маркированной радиоактивно ник-трансляцпей YIp5-плas- :мидой ДНК (YIp5 - это pBR 322, котопленку наблюдают по меньшей мере две полосы. В .качестве другого контроля .- служит ДНК-проба трансформированного с помощью УСр-плазмнды SHU 32; благодаря этому оказалось возможным непосредственное сравнение количества копий. YGp- и YCR р-центромерных плазмид.
Данные приведены в табл. 1.
Стабильность плазмид в дрожжах проверяют благодаря тому, что клетки после селективного или неселективно- Соузерна. Всю ДНК SHU 32-(YCR р)го выращиван ия разбавлены водой и плакированы на УРД-пластины (неселективно) . После 30 ч роста при 28°С эти пластины плакируют на YNB+CAA
пластины (TRP или LEU селекция). Процентную стабильность плазмид определяют путем деления количества в колониях, которые выращены селективно, на количество в колониях, которые выращены неселективно, и последующим .умножением на 100.
Определение количества копий плазмид осуществляют птуем анализа
Стабильность плазмид в дрожжах проверяют благодаря тому, что клетки после селективного или неселективно- ,Соузерна. Всю ДНК SHU 32-(YCR р) рый содержит 1ШАЗ-ген дрожжей). Пос- ле экспонирования на рентгеновскую
трансформантов, которые выращены в селективной среде, перерабатывают с помощью Есо R 1-рестриктироваиной эндонуклеазы и фракционируют путем агарозногр-гель-электрофореза. После переноса на нитроцеллюлозные фильтры ДНК гибридизуют маркированной радиоактивно ник-трансляцпей YIp5-плas- :мидой ДНК (YIp5 - это pBR 322, кото рый содержит 1ШАЗ-ген дрожжей). Пос- ле экспонирования на рентгеновскую
пленку наблюдают по меньшей мере две полосы. В .качестве другого контроля служит ДНК-проба трансформированного с помощью УСр-плазмнды SHU 32; благодаря этому оказалось возможным непосредственное сравнение количества копий. YGp- и YCR р-центромерных плазмид.
Данные приведены в табл. 1.
SHU 32
YCRp2
Этайол
% стабильности .плазмиды определяется по 25 генерациям на неселективном выращивании,
Количество копий определялось по 12 генерациям на селективной
среде..
Штамм культивировался (12 генераций) на селективной среде этанолаJ затем на 12 генерациях проверялся на селективной Ьреде глюкозы и инркулят этой культуры был взят для определения
стабильности и количества копий,
АААЛ Штамм культивировался в тех же условиях, что и в пункте , однако для 50 генераций на этайоле.
Выла подтверждена стабильность YCR р2 плазмиды5, после того как на различных источниках углерода бьши выращены трансформанты. Если их культивируют только ча среде глнжозы, стабильность йлазмид перемещается в сферу других УСр-плазмид (примерно 80%); количество копий бьшо незначи- тельным (1-2 копии на клеткуг см. примеры 1 и 3 в табл. 1). Глюкоза дезактивирует АВН2 промотор (ADH2-AUS а CEN 3-последрвательность может ра- ботать нормально (CEN 3-AN).
Однако если YCR р2-трансформантъ культивируют на содержащей этанол среде, то стабильность плазмиды резко снижается (примерно до 36%), одна- ко количество копий возрастает (до 5-10 копий на клетку). УСр-плазмиды при одинаковых учловиях прежде были стабильны ив наличии имелось незначительное количество копий (см. приме- ры 2 и 4 в табл, 1). Это показывает, как транскрипция вновь реактивированного ADH2-npoMOTopa (ADH2-AK) блокирует CEN 3-последовательность (CEN
Таблица 1
Глюкоза
95%
8-12
3-AUS). Как результат УСН2р-ш1азмида ведет теперь себя, как УЕр-плазмидаг очень нестабильна, однако с большим количеством копий.
Стабильность УСКр2-ш1азмида стала выше, чем прежде, когда среда была вновь перемещена на глюкозу. Стабильность на зтой среде составила почти 95%, а количество копий на клетку осталось постоянным: 5-10 копий (см. пример 5 в табл, 1), Таким образом, глюкоза вновь дезактивирует ADH2-npo- мотор (ADH2--AUS) и реактивирует СЕНЗ-функцию (CEN 3-AN). Однако дрожтки во время культивирования на этаноле не могли больше аккумулировать УСЕр2-гшазмиду, Даже после 50 генераций на среде этанола yNB-s-CAA количество копий не превышало копий на клетку (см, пример 6 в табл.)
П р и м е р 2, Получение УСК рЗ- и yCR р4-плазмид схематически представлено на фиг, 2. Вектор P.IDB207 содержит бактериальную рАТ15З-плазми ДУ (34) с резистентными генами ампи- цилина (ApR) и тетрациклина (Tet) и
7 13 OKI для селекции и стабильного роста в E.coli. Кроме того, плазмида содержит 2,7 кЬ - EcoRI/EcoRI фрагмент 2р-ДНК. На этом фрагменте локализова- но как 2/вместо репликации, что дает возможность вектору экстрахромосомно реплицироваться и проявляться, так и КЕРЗ-локус 2|и-ДНК, Этот локус является важным элементом 2 системы ам- плификации и должен занимать цис-по- ложение, чтобы сделать плазмиду способной к амплификации. Селекционный маркер LEU 2, из которого происходит дрожжевая хромосома III, был клонирован после нескольких модификаций в PSt 1 места разреза Упомяну;того 2 (U ДНК фрагмента. Этот ген LEU2-d дает возможность осуществлять селекциони- ройание на Leu2 -дрожжевых мутантах и дополняет мутацию Leu2 только тогда, когда она существует в много- копийном векторе.
Для получения YCR рЗ- и YCR р4- плазмид перерабатывают 5 мкг YCR р2-ДНК с Bgl II- и Ваш Н1-рестршс- ционной эндонуклеазой. После препаративного электрофореза в арагозном геле изолируют фрагмент Bgl II/Bam HI размером 4,2 кЬ. Этот фрагмент содержал TRPI-ген дрожжей и ADH2-CEN 3-слияние. 5 мкг pIDB207 плазмидного ДНК перерабатывают с Ваш HI и очищают путем экстракции фенолом и осаждеНИН этанолом и дефосфорилируют с помощью телячьей-кишечной фрсфатазы. 100 нг полученной таким образом р1ВВ207-плазмидной ДНК лигируют с по- мощью-200 нг 4,2 кЬ - Bgl II/Bam Hi YCR р2-фрагмента. E.coli RR I клетки
трансформируют с помЬщью 1/5 этой смеси и изолируют колонии ApR. Все без исключения колонии проверяют путем их, гибридизации с применением пик-транслированного 4,2-кЬ-фраг мента YCR р2 в качестве пробы. Из проявивших себя положительно колоний изолируют плазмидную ДНК и составляют карту сайтов рестрикции этих плаз- МИД.: Так как Bgl II/Bam HI-фрагмент- клонируют в двух различных ориекта циях в Ват Н1-местах разреза pIDB207
8
5 О с . 0
Q
5
возникает две плазмиды: YCR p J и YCR р4 (фиг. 2).
Ориентирование кланиропанногю влияния ADH2-CEN 3-слияния не оказывает никакого влияния на стябп.пь 1ость и количество копий YCR р-плазмид1.1 в дрожжах. YCR рЗ-плазмида теперь содержит два маркирующих гена дрожжей: LEU 2-d и TRPI-ген, дополняют одну trpl -мутацию в самих дрожжах тогда, ко.гда он содержится только в одной копии на клетку, LEU 2-d-reH дополняет leu 2 -мутацшо только тогда, когда он находится на многокопийной плазмиде (50-100 копий на клетку). Эта система дает возможность осуществлять проверку количества копий путем простого плакирования на селективной среде. Все LED клетки должны содержать по меньшей мере 50 плазмид- ных копий на клетКу, в то время как TRP -клетки содержат по меньшей мере одну копию плазмиды. Кроме того, существует SHU 32-штаммы cir, т.е. он имеет дикий тип 2/i. ДНК, что обеспечивает YCRp3-BeKTOp двумя другими компонентами системы амплификации 2iu: REP1 и REP2. Полностью активная Система амплификации 2fj. требует REP1 и REPZ в транс и REP3 и OR1 в цис.
Дрожжевой штамм SHU 32 (cir, trpl, leu 2 иг аЗ) трансформируют с помощью YCRpЗ-плaзмиднoй ДНК, TRP -трансформанты изолируют и проверяют на Leu и ига. Все трансфор- манты которые были проверены, являлись Leu .и . ига и показали, что ТСКрЗ-плазмида существует в незначительном количестве копий. Этот результат не был неожиданным, так как в качестве источника углерода использовалась только глюкоза, т.е. CEN 3 должен был быть полностью функционально способным. CEN 3-функция преодолевает систему амплификации и стабилизирует количество копий плазмид в пределах 1-2 копии на клетку (пример 2 в табл. 2), Стабильность YCRp3 в дрожжевом штамме SHU 32 при вьфащи- вании на глюкозе также характерна для уСр-1шазмиды (около 80%),
fSHU 32pIDB207Глюкоза
2SHU 32YCRi)3Глюкоза
3SHU 32YCRp3Этанол
4SHU 32YCRp3Этанол Однако если трансформированный с помощью YCR рЗ штамм SHU 32 культивировался на селективной - leu - этанол-среде, то стабильность плазм ид снижалась, когда было измерено количество leu колоний, примерно на 65%, Предполагается, что CEN 3-последова- тельность в присутствии этанола транскрибируется реактивированным ADH2- ..промотором. С помощью селекции на LEU и нефункционального центромера система амплификации 2 берет на себя контроль и амплифицирует YCR рЗ в большое количество копий. SHU 32- трансформанты стали LEU, а стабиль™ ность YCR рЗ-плазмид является при этих условиях характерной для 2 (л химерной плазмиды (см. примеры 1 и 4 в табл. 2). Эти ожидания нашли подтверждение, после того, как SHU 32-трансформанты затем культивирова- лись на этаноле и глюкозе, и было определено количество копий плазмид. Количество копий YCR рЗ достигает прм мерно 100 на клетку. Кроме того,с, плазмида была очень стабильна (бо- лее 90%),, что можно подтвердить с помощью количества leu колоний.
В табл. 3 представлены данные о стабильности YCR р4-плазмид.
Таблица 3
Глюкоза
75
85
1-2
Таблица 2
too
85% , 1-2
85% He определено
Глюкоза 98%
99%
100
Продолже ние табл.3
Этанол , 70% 88% Не определенов Этанол -f Глюкоза
98% 99% 100
Примечания к табл. 2 и 3 те же, что и для табл. 1,
Получение плазмид с регулируемыми центромером функциями, как показано для YCR р-плазмид, имеет большую пользу для размножения как гетерологичес- ких ДНК, так и для выражения гетеро- логических белков и дрожжах.
Если например, в полученный в соответствии с изобретением многокопиЙ- ный дрожжевой вектор соответствуюпрш образом вводится гетерологическая ДНК, то она путем смены воздействующих на регулируемый промотор факторов (наприм р, в случае АВН2-промотора замены источника углерода), будет размножаться с помощью вектора до желаемой концентрации.
Еще большую пользу приносят полученные в соответствии с изобретением векторы, если гетерологическая ДНК с помощью системы вьфжения для экспрессии гетерологических белков встраивается в векторы в правильной ориентации,.
Эффективность процесса ферментации зависит от вида белка. Если, на 13
пример, экспрессируется белок, -который, начиная с определенной концентрации, является токсичным для орга- низма, то весь процесс ферментации может стать неэффективнь м, если количеством белков нельзя управлять непосредственно или косвенно.
С помощью полученных в соответс Т ВИИ с изобретением векторов можно только путем смены воздействующих на регулируемый проМотор факторов, HanpiiMep, путем смены источника углерода, количество копий экспрессной
ных плазмид устанавливать на низкое, is (pIDB207);
6) 0,2 мкг всей ДНК штамма SHU 32 (pIDB207);
; . 7) 0,05 мкг всей ДНК штамма SHU32 (pIDB207);
8) 5 мкг всей ДНК mxaMi-sa SHU 32 (YCRp3) - глюкоза; 9) 1 мкг всей ДНК .a SHU 32 (YCRpS) - этанол -f- глюкоза;
10) 0,05 мкг всей ДНК штампа
среднее или высокое значение и на соответствующем уровне стабилизировать. С помощью этих векторов даже можно цолучать токсичньш для организма про- дукт благодаря тому, что количество 20 копий векторов выражения в основании ферментации нескольких генераций мало и отдельные плазмиды поддерживают стабильными. Если затем образовано достаточно клеточно го материала, про- 25 SHU 32 (YCRp 3) - этанол - глюкоза; мотор переключается, напрш-iep, пу- 11) 0,05 шсг всей ДНК штамма SHU 32 тем смены источника углег ода, и коли- (УСКрЗ) - эта чество копий в зкспрессионньгх плаз- мидах резко увеличивается. Тем caj tbiM
одновременно производится желательный 30 Формула белок в большой концентрации; токсичность белка к этому моменту времени маловажна.
Полученные в соответствии с изобретением векторы дают возможность выби- 5 в том, что плазмиду рВСЗТ1 расщепля- рать неселективные условия культиви- ют рестрнкционной эндонуклеаэсй BamHI
глюкоза.
изобретения
Способ конструирования рекомби- нантных векторов YCRp2, YCRp3 и YCRp4, заключающийся
рования; значительное преимущество прежде всего с точки зрения использования для получения белков на гено- технологическом пути,
28 декабря 1984 г в Немецкую коллекцию кикроорганизмов (DSM), Гризе- бахштрассе, 8, Д-3400 Геттинген бьти сданы на хранение;
E.coli штамм RRI (обозначение-НИ) под номером DSM3t76;
Saccharomyces cerevisiae штагам SHU 32 (обозначение- S.HU 32) под номе- ром DSM 3182;
шхазмида: рВСЗТ1, трансформированная в E.coli RRI (обозначение рВСЗХ1) ПОД номером DSM 3180;
плазмидаг pAD П2Ъ, тpaнcфop шpb- ванная в E.coli RRI (обозначенная pAD Н2В) под номером DSM 3179 и
плазмида: pID В207, трансформированная в E.coli RRI(обозначенная pID В207) под номером DSM 3181.
1
12
Все пробы ДНК были обрезаны с по Мощью EcoRI и гибридиэированы У1р5 плазмидной ник-трансляционной ДНК.
1)3 мкг всей ДНК SHU 32 (рЕВ 108) - типичная УСр плазм11да;
2)3 мкг всей ДНК штамма SHU 32 (YCRp2) - глюкоза;
3)3 мкг всей ДНК штамма SHU 32 (YCRp2) - этанол -« глюкоза;
4)3 мкг всей ДНК штамма SHU 32 (YCRp2) - этанол (50 генераций) - глюкоза;
5)1 мкг всей ДНК штамма SHU 32
6) 0,2 мкг всей ДНК штамма SHU 32 (pIDB207);
; . 7) 0,05 мкг всей ДНК штамма SHU32 (pIDB207);
8) 5 мкг всей ДНК mxaMi-sa SHU 32 (YCRp3) - глюкоза; 9) 1 мкг всей ДНК .a SHU 32 (YCRpS) - этанол -f- глюкоза;
10) 0,05 мкг всей ДНК штампа
SHU 32 (YCRp 3) - этанол - глюкоза; 11) 0,05 шсг всей ДНК штамма SHU 32 (УСКрЗ) - эта
- глю К штамма
глюкоза.
изобретения
Формула
в том, что плазмиду рВСЗТ1 расщепля ют рестрнкционной эндонуклеаэсй Bam
Способ конструирования рекомби- нантных векторов YCRp2, YCRp3 и YCRp4, заключающийся
с последующей очисткой и дефосфорили- рованием полученной линейной ДНК, плазмиду ADI-12BS. расщепляют рестрик- ционной эндонуклеазэй EcoRV с последующей очисткой полученной линейной ДНК и ее связыванием с фосфолирован- ньм линкеро Bglll и полученный при этом фрагмент расщепляют рестрикцион- ной эндонуклеазой BamHI и Bglll с последующей очисткой фрагмента размером 1,3 Kbj полученные фрагменты связьшают Т4-ДНК лигазой с. получением вектора YCRp25 которьй расщепляют рестршсционной эндонуклеазой BamHI. и Bglll с последующи. выделением и очисткой-фрагмента 4,2 кЬ, а плазми- . ду pIDB207 расщепляют рестрккцион- ной эндонуклеазой BamHI с последующщей очисткой и дефосфорилированиек полученной при этом линейной ДНК и полученные фрагменты связывают с ДНК-лнгаасй с получением векторов YCRp3 и YCRp4,
Bgl
BaiTiHI
.eeoRV
SL.B«mHI
Truiehrlption
EcoRIHIndin
EeoRL.
mHi/Bgin
BamHI
.f
EcoR) Hind Ml
ceoRt
BamHI
EeoRIEcoRI
/BamHI/BgtH
EcoR)
EcoRI
iHI/B II
фча.г
. Вити I




Изобретение относится к генной инженерии и качается способа получения рекомбинантного многокопийного дрожжевого вектора. Цель изобретения- повышение стабильности рекомбинаятных векторов. Способ получения векторов YCR р 2-4 заключается в том, что sek- тор, который имеет стабшгазирукщую функцию, вводят в регулируемый промотор так,что имеется возможность с помощью этого промотора управлять регулирукщей функцией. 2 шт. 3 табл.
Составитель H. Куяенкова Редактор A. Лежнина Техред Л.СердюковаКорректоров Бутяга
Заказ 6387/58 .Тираж 500Подписное
ВНИИПИ Государственного комитета СССР
по делам изобретений и открытий 113035, Москва, Ж-35, Раушская наб., д. 4/5
Производственно-полиграфическое предприятие, г, Ужгород, ул. Проектная, 4
| Stinchcomb D.T | |||
| Устройство для видения на расстоянии | 1915 |
|
SU1982A1 |
| Mol | |||
| Biol | |||
| Система механической тяги | 1919 |
|
SU158A1 |
| Clarke and Carbon | |||
| J | |||
| Способ получения фтористых солей | 1914 |
|
SU1980A1 |
| Способ получения целлюлозы из стеблей хлопчатника | 1912 |
|
SU504A1 |
Авторы
Даты
1987-12-30—Публикация
1985-12-03—Подача