Изобретение относится к иммунологии и может быть использовано в промышленном производстве антигенов для серодиагностики сифилиса.
Открытие бледных трепонем как возбудителей сифилиса положило начало серологическим методам исследования сифилиса.
Традиционным способом серодиагностики сифилиса является реакция Вассермана, в которой антигеном может быть как протеиновый специфический комплекс, получаемый из культур бледных трепонем органов плода, зараженного сифилисом, так и неспецифический кардиолипиновый, извлекаемый из мышц бычьего сердца /К.Д.Пяткин, Ю.С.Кривошеев - Микробиология, "Медицина", 1980, с. 362-363/.
Специфичность и чувствительность этого метода недостаточны, в частности в первичном периоде сифилиса реакция бывает положительной в половине случаев, но не ранее, чем через 2-3 недели после появления шанкра, или на 5-6-й неделе от момента заражения. Она может быть неспецифической при беременности, после родов, при туберкулезе, вирусных заболеваниях и т.д.
Получение применяемых антигенов в промышленных условиях для массового применения нереально.
На начальном этапе повышения эффективности серодиагностики сифилиса была доказана целесообразность использования в качестве антигена для PCK цельных клеток культур бледных трепонем.
С целью более полного использования их антигенных свойств был получен бесклеточный препарат путем разрушения клеток ультразвуком /Овчинников Н.М. Новые серологические реакции на сифилис. М., "Медицина", 1961/. С 1982 г. начат производственный выпуск этого препарата и включение его в комплекс серологических реакций для диагностики сифилиса.
Однако при использовании этого препарата еще высоко количество отрицательных результатов PCK при наличии заболевания и неспецифически-положительных реакций у лиц, свободных от инфекции. Это обусловлено состоянием иммунной системы пациентов, наличием в бледных трепонемах "убиквитерного" липида.
Экспериментальные исследования антигенных свойств культуральных бледных трепонем различных штаммов выявили их иммунологические различия в перекрестной реакции агглютинации с истощением сывороток крови кроликов. По антигенным свойствам штаммы можно разделить на 3 группы:
1 - I, VI, IX штаммы;
2 - II, VII, VIII штаммы;
3 - IV, V, Reiter штаммы
/Зебницкая Л.В. - Вести. дерматол., 1955, N 4, с. 24-27/.
Известны работы по изучению химического состава наружной оболочки культуральных бледных трепонем. Выделены и изучены антигенные свойства белковых фрагментов наружных фибрилл культуральных трепонем штамма Reiter. /Petersen C. J. , Pedersen S.N., Axelsen N.H. - Acta path. microbiol Scand, 1981, vol. 89, p. 379-385/.
Однако эти работы не имеют системного подхода к решению проблемы, способы выделения, например, полипептидов, известные в биотехнологии, отличаются большой сложностью и дороговизной аппаратуры и не могут быть использованы в промышленном производстве антигенов.
Известны работы по дезинтеграции культуральных бледных трепонем. /Berg R. N. , Dunlan W.P., Thoruton C.Y. - Brit, J. vener. Dis., 1972, vol. 48, p. 489-495/, Скадене М. - Д.А. Получение и сравнительная оценка протеиновой фракции бледных трепонем в реакции связывания комплемента при сифилисе. Автореферат дис. к.мед.н., М., 1980/.
При исследовании дезинтеграта культуральных бледных трепонем были определены в центрифугате и супернатанте как термостабильные, так и термолабильные антигены. Исследование белковых фракций, полученных из дезинтеграта культуральных и тканевых бледных трепонем, показано наличие пяти различных по молекулярной массе белков. Высокой антигенной активностью обладали первые белковые фракции тканевых и культуральных бледных трепонем.
Однако в этих работах не определен структурный состав культуральных бледных трепонем, что затрудняет их промышленную обработку.
Известен способ выделения отдельных клеточных структур культуральных бледных трепонем с целью изучения их антигенных свойств в PCK /Пожарская В. О. - Вест. дерматол., 1985, N 9, с. 16-18/.
Согласно этому способу, отмытую изотоническим раствором натрия хлористого взвесь /1012 микробных клеток/мл/ культуральных бледных трепонем I, V, VIII штаммов /по одному представителю из трех антигенных групп с различными иммунологическими свойствами/ разрушают до 96 ± 1% клеток в дезинтеграторе системы Евстюгова-Бабаева и Жванецкой с добавлением бус. Центрифугированием при 5500 g в течение 10 мин отделяют от дезинтеграта неразрушенные трепонемы, затем дезинтеграт центрифугируют при 10000 g в течение 30 мин и отделяют осадок клеточных стенок трепонем и незначительные количества наружных фибрилл, оставшуюся надосадочную жидкость центрифугируют при 30200 g в течение 30 мин с выделением осадка цитоплазматических мембран, незначительного количества блефаропластов, мезосом, внутренних фибрилл и наконец из оставшейся надосадочной жидкости путем добавления абсолютно охлажденного этилового спирта выделяют цитоплазму трепонем. Структуры, выделенные при разделенном центрифугировании, выявляют с помощью электронной микроскопии.
Выделенные структуры были консервированы и изучены в PCK с сыворотками крови больных с различными формами сифилиса, с последующим сравнением с результатами стандартного комплекса реакций на сифилис.
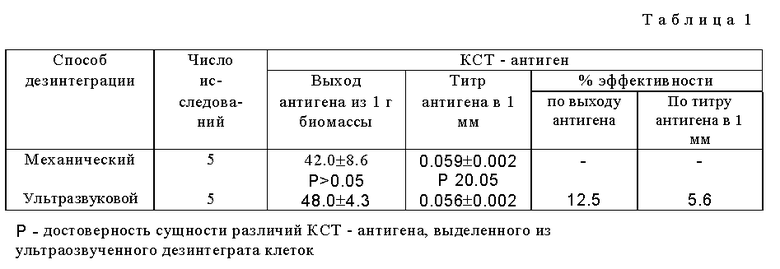
Выявлено, что по чувствительности антиген из клеточных стенок трепонем /средние титры 1:124/ превосходит ультраозвученный и кардиолипиновый антигены /средние титры 1:80/.
Цитоплазма обладает низкой чувствительностью /средние титры 1:10/. Цитоплазматические мембраны имеют средние титры 1:104.
Выявлены преимущества по диагностической ценности клеточных структур.
По специфичности все клеточные структуры имеют преимущества перед ультраозвученным и кардиолипиновым антигенами.
Проведенные эксперименты представляют большую ценность в оценке антигенных свойств отдельных клеточных структур культуральной бледной трепонемы.
Недостатком способа является то, что для применения в промышленном производстве он недостаточно эффективен. Применение механической дезинтеграции с наполнителем замедляет процесс из-за необходимости постоянной промывки и замены бус. Нецелесообразен процесс отделения цитоплазматических мембран, так как их количество незначительно.
Кроме того, при исследовании химического состава антигена из клеточных стенок трепонем выявлено недостаточное содержание белковых соединений, что снижает чувствительность антигена.
Наиболее близким по существу и назначению является способ получения антигенов из культуральных трепонем I, V, VIII штаммов /по одному представителю от каждой антигенной группы/ /А. с. СССР N 1650098, A 61 B 10/00, 23.05.95 г, БИ N 19/.
Способ включает приготовление биомассы трепонем на печеночном бульоне с добавлением кусочков печени крупного рогатого скота, pH 8.2 в анаэробных условиях в течение 8 дней. Выросшую культуру фильтруют, центрифугируют в течение при 5500 g 30 мин. Из полученного осадка готовят взвесь трепонем 1012 микр. кл/мл, затем смесь дезинтегрируют в течение 20 мин, и дезинтеграт центрифугируют при 10000 g в течение 30 мин. Полученный осадок - клеточные стенки и наружные фибриллы культуральных бледных трепонем используют для промышленного получения трепонемного антигена, а супернатант, содержащий цитоплазматические мембраны, мезосомы, внутренние фибриллы, цитоплазмы клеток используют в качестве сорбента при серодиагностике сифилиса в РИФ-абс.
Недостатком прототипа является то, что процесс выращивания биомассы трепонем является длительным и дорогостоящим, что затрудняет промышленное производство антигенов.
Кроме того, при исследовании химического состава антигена из клеточных стенок трепонем выявлено недостаточное содержание белковых соединений, что снижает чувствительность антигена.
Целью изобретения является обеспечение безотходного промышленного производства антигена для серодиагностики сифилиса с повышенной антигенной активностью за счет использования штаммов трех антигенных групп и получения отдельных клеточных культур бледных трепонем.
Поставленная цель достигается тем, что способ получения антигенов из культуральных бледных трепонем включает выращивание биомассы трепонем из полного набора штаммов трех антигенных групп на искусственной тиогликолевой среде, дезинтеграцию клеток ультразвуком, центрифугирование взвеси, отделение неразрушенных трепонем, центрифугирование надосадочной жидкости, выделение осадка клеточных стенок трепонем и супернатанта.
По отношению к прототипу изобретение имеет следующие отличительные признаки.
Подготовка биомассы на искусственной тиогликолевой среде удешевляет и ускоряет процесс при увеличении роста биомассы.
Использование в биомассе полного набора штаммов из трех антингенных групп обеспечивает содержание в антигене протеинового, полисахаридного и липидного компонентов, что способствует специфичности антигена.
Дезинтеграция клеток трепонемы ультразвуком упрощает процесс по сравнению с механическим способом, обеспечивая достаточную степень разрушения клеток до 96 ± 1% при тех же затратах времени, снижение потери биомассы антигена после дезинтеграции и отделения от бус, снижение трудозатрат.
Использование осадка клеточных стенок культуральных бледных трепонем для получения антигена, а осадка цитоплазмы - для получения сорбента обеспечивает безотходность производства.
Возможность реализации заявляемого способа показана в примере конкретного выполнения.
Пример 1. Готовят искусственную тиогликолевую питательную среду по известной методике /Инструкция по изготовлению питательной среды для контроля чистоты живых вакцин. Всесоюзный ордена Трудового Красного Знамени научно-исследовательский противочумный институт "Микроб", г. Саратов. Утв. ГУ карантинных инфекций Минздрава СССР 28.09.81/.
Пересевают культуральные трепонемы полного набора штаммов из трех антигенных групп на приготовленную питательную среду, добавляют сыворотку крупного рогатого скота. Полученную взвесь центрифугируют в течение 30 мин при 6000 об/мин, осадок отмывают трижды 0.9% раствором натрия хлористого.
Отмытый от питательной среды осадок культуральной трепонемы суспендируют в 0.9% раствора натрия хлористого /pH 7,3 ± 1/ из расчета 10-20 мл натрия хлористого на 1 г осадка и разливают суспензию поштаммно, затем направляют на дезинтеграцию.
Дезинтеграцию проводят на УЗ-генераторе УЛА-1000 В, напряжение 220 В, мощность 2-3 кВ, сила тока 50 А, интенсивность 8-12 Вт/см2.
Ультраозвучивание ведут в течение 25-30 мин. Полученную смесь центрифугируют в течение 10 мин при 5500 g, при этом удаленные обломки неразрушенных трепонем возвращаются на дезинтеграцию. Надосадочную жидкость, которая является дезинтегратом трепонем, направляют на центрифугирование, которое проводят при 10000 g в течение 30 мин с 9000 об/мин в центрифугах ЦЛМ-ОС-6М, ШХ-2.779.043 со сменным ротором CH/1.
Надосадочную жидкость направляют в технологический процесс получения сорбента.
Осадок, который является антигеном из клеточных стенок трепонем /КСТ-антиген/, суспендируют в 0.9% растворе натрия хлористого, pH 7.3 ± 1 из расчета 40-50 мл на 1 г осадка, затем разливают, консервируют с добавлением стабилизатора, сушат на сублимационной установке, затем в вакууме, герметизируют флаконы и направляют на контроль.
В таблицах 1-3 представлены сравнительные характеристики антигена из клеточных стенок трепонем /КСТ-антигена/ и сорбента, полученных по заявляемому способу перед ультраозвученными антигенами, полученными без структурного разделения клеточной системы.
В таблице 1 представлена эффективность производства КСТ-антигена при различных способах дезинтеграции.
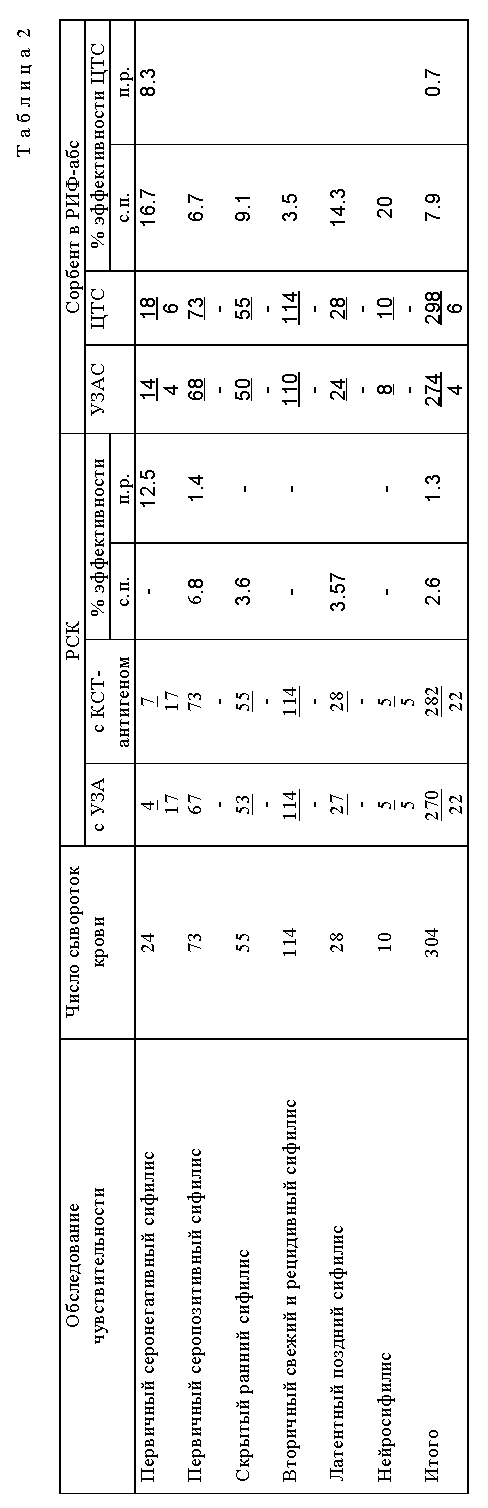
В таблице 2 представлена сравнительная оценка чувствительности антигена в PCK и сорбента для РИФ-абс.
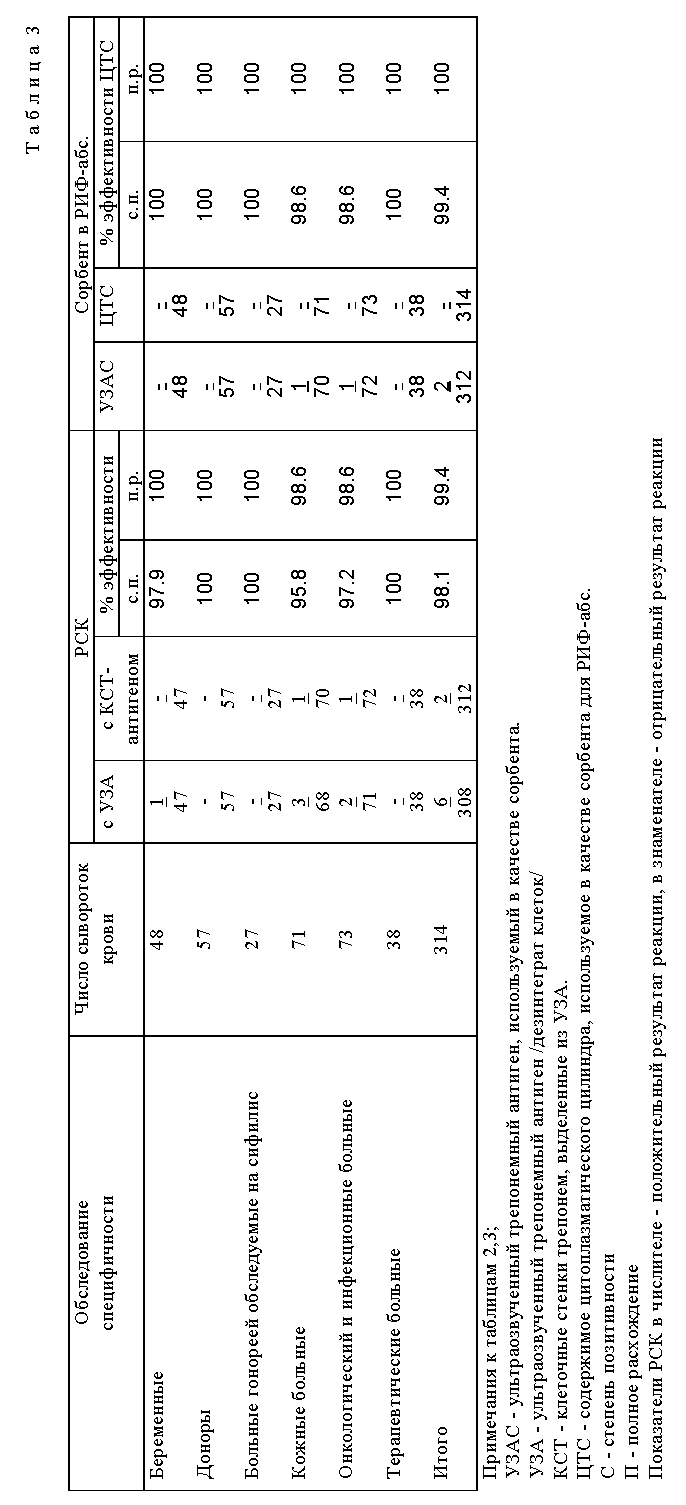
В таблице 3 представлены сравнительная оценка КСТ-антигена в PCK и сорбента для РИС-абс.
Сравнительные данные показывают преимущества антигена и сорбента, полученных по заявляемому способу.
Способ был испытан в ЦКВИ, СПГ "Аллерген", Ставропольском кожно-венерологическом диспансере, что подтверждает возможность и целесообразность его использования в промышленности.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ КОНТРОЛЬНОЙ СЫВОРОТКИ ДЛЯ ДИАГНОСТИКИ АНТИКАРДИОЛИПИНОВЫХ АНТИТЕЛ В КОЛИЧЕСТВЕННОЙ РЕАКЦИИ МИКРОПРЕЦИПИТАЦИИ НА СИФИЛИС | 2009 |
|
RU2399383C1 |
| СПОСОБ НЕСПЕЦИФИЧЕСКОЙ СЕРОЛОГИЧЕСКОЙ ДИАГНОСТИКИ СЕРОНЕГАТИВНЫХ ФОРМ ТЕЧЕНИЯ ЗАБОЛЕВАНИЯ СИФИЛИСОМ | 2010 |
|
RU2442536C2 |
| Способ серодиагностики сифилиса | 1987 |
|
SU1650098A1 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ВЫРАЩИВАНИЯ БИОМАССЫ ТРЕПОНЕМ | 2001 |
|
RU2198920C2 |
| ИММУНОСТИМУЛИРУЮЩИЙ ПРЕПАРАТ, ОБЛАДАЮЩИЙ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2015 |
|
RU2597837C1 |
| СПОСОБ КОНТРОЛЯ ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ СИФИЛИСА | 2011 |
|
RU2474820C2 |
| ИММУНОФЕРМЕНТНАЯ ТЕСТ-СИСТЕМА ДЛЯ ВЫЯВЛЕНИЯ АНТИТЕЛ К ВОЗБУДИТЕЛЮ СИФИЛИСА | 1998 |
|
RU2156467C2 |
| СПОСОБ СОХРАНЕНИЯ ЖИЗНЕСПОСОБНОСТИ КУЛЬТУРАЛЬНЫХ ШТАММОВ БЛЕДНЫХ ТРЕПОНЕМ С ИСПОЛЬЗОВАНИЕМ КРИОКОНСЕРВАЦИИ | 2015 |
|
RU2600883C1 |
| СПОСОБ СОХРАНЕНИЯ ЖИЗНЕСПОСОБНОСТИ ШТАММА ПАТОГЕННЫХ БЛЕДНЫХ ТРЕПОНЕМ | 2005 |
|
RU2292388C1 |
| СПОСОБ СЕРОДИАГНОСТИКИ РАННЕГО НЕЙРОСИФИЛИСА | 2001 |
|
RU2205409C2 |
Изобретение относится к медицине, а именно к иммунологии, и касается способа получения антигенов из культуральных бледных трепонем. Сущность изобретния: биомассу бледных трепонем выращивают на искусственной тиогликолевой среде из полного набора штаммов трех антигенных групп с последующей дезинтеграцией клеток ультразвуком, центрифугированием, отделением неразрушенных трепонем, центрифугированием надосадочной жидкости, выделением осадка стенок трепонем и супернатанта. Технический результат заключается в обеспечении безотходного промышленного производства антигена для серодиагностики сифилиса с повышенной антигенной активностью. 3 табл.
Способ получения антигенов из культуральных бледных трепонем, включающий выращивание биомассы трепонем из штаммов трех антигенных групп, дезинтеграцию клеток, центрифугирование взвеси, отделение неразрушенных трепонем, центрифугирование надосадочной жидкости, выделение осадка клеточных стенок трепонем и супернатанта, отличающийся тем, что биомассу выращивают на искусственной тиогликолевой среде из полного набора штаммов трех антигенных групп, дезинтеграцию клеток осуществляют ультразвуком.
| Способ серодиагностики сифилиса | 1987 |
|
SU1650098A1 |
| US 4464470 A, 07.08.84 | |||
| US 4514498 A, 30.04.85 | |||
| Огнетушитель | 0 |
|
SU91A1 |
| EP 04473322 A2, 18.09.91 | |||
| СПОСОБ ДИАГНОСТИКИ СИФИЛИСА | 1994 |
|
RU2084894C1 |
Авторы
Даты
1999-11-20—Публикация
1996-03-26—Подача