Изобретение относится к биотехнологии, в частности к производству ферментов, имеющих значение в решении проблемы универсального донорства, и может быть использовано для получения высокоактивной α-N- ацетилгалактозаминидазы, применяемой в медицине, генной инженерии, молекулярной биологии.
Разработка эффективного способа получения на местах универсальных по групповым свойствам эритроцитов для неотложной трансфузиологической помощи пострадавшим в нашей стране продолжает быть весьма актуальной.
Большой практический интерес представляют α-N- ацетилгалактозаминидазы, способные удалять α-1,3-связанные остатки N-ацетилгалактозамина из гликопротеинов групповых веществ группы крови A(II) с превращением последних в вещества группы O(H). α-N-ацетилгалактозаминидазы - довольно редко встречающиеся в природе ферменты. Известны микробные α-N-ацетилгалактозаминидазы из Clostridium perfringens [2] , Aspergillus niger [3], Acremonium sp. [4], инактивирующие групповую специфичность А(11) эритроцитов. Фермент, выделенный из A. niger, не действует на природные субстраты, гликозидазы анаэробной патогенной бактерии C.perfringens трудно получить в значительном количестве, кроме того, штаммы C.perfringens токсин. Гликозидаза из почвенного микромицета Acremonium sp. проявляет активность в нефизиологических условиях (pH 4,5), что значительно усложняет процедуру обработки эритроцитов, для которых комфортными являются только физиологические условия (pH 7,0). Таким образом, для широкого практического применения трансформированных эритроцитов необходимы высокоочищенные специфические ферменты, с оптимумом действия при нейтральных pH, которые можно получать из доступного и легко воспроизводимого сырья.
В США запатентован способ перевода редкой A2 группы крови в нулевую (первую) группу с помощью фермента, выделенного из куриной печенки [1]. Этот фермент имеет оптимум действия при pH 4,0 и специфичен только по антигену довольно редкой группы крови.
Наиболее технологичными источниками ферментов все-таки являются микроорганизмы, так как они обладают огромной скоростью размножения и осуществляют синтез биологически активных веществ в контролируемых человеком условиях. Ферменты с требуемой специфичностью обнаружены среди изоформ α-N-ацетилгалактозаминидаз в культуральной жидкости штаммов анаэробных бактерий наземного происхождения Ruminococcus torques IX-70, выделенных из человеческих фекалий, нуждающихся в особых условиях культивирования и факторах роста [5].
Кроме узкой субстратной специфичности огромное значение имеет pH оптимум фермента. Так, все описанные выше эффективные на эритроцитах ферменты [1, 2, 3, 4] имеют оптимум в кислой области pH, что крайне нежелательно для эритроцитов. У α-N- ацетилгалактозаминидаз из бактерий Ruminococcus torques IX- 70 таковой охватывает область pH от 5,8 до 6,8.
Морские бактерии как источники ферментов с уникальной специфичностью привлекают все большее внимание исследователей. Тихоокеанский институт биоорганической химии ДВО РАН является обладателем обширной коллекции морских бактерий, собранной в различных районах Мирового океана во время экспедиций научно-исследовательского судна "Академик Опарин". Скрининг среди более 800 штаммов морских бактерий различных родов и акваторий обитания [6] позволил выявить несколько перспективных штаммов-продуцентов α-N- ацетилгалактозаминидаз, инактивирующих групповую специфичность эритроцитов человека группы крови A(II).
Задача изобретения - выявление нового штамма, продуцирующего α-N-ацeтилгaлaктoзaминидaзы с указанными выше свойствами (узкая субстратная специфичность, оптимум действия при pH 7,0-8,0), необходимыми для биотехнологии.
Поставленная задача решена тем, что из морского грунта выделен штамм бактерий Flavobacterium sp. , отобранный по признаку высокой исходной α-N-ацетилгалактозаминидазной активности по п-нитрофенил-N-ацетил α-D-галактозаминиду.
Штамму бактерий Flavobacterium sp. авторами присвоен номер КММ 426, он депонирован во Всероссийской коллекции микроорганизмов под номером ВКМ В2137-Д.
Штамм выделен методом прямого высева на агаризованную среду следующего состава (г/л): пептон - 5, дрожжевой экстракт - 2,5, глюкоза - 1, MgSO4 - 0,5, K2HPO4 - 0,2; морская вода - 750 мл, дистиллированная вода - 250 мл, pH - 7,5.
Культуру хранят в пробирках под слоем минерального масла на полужидкой среде приведенного выше состава, при температуре 10oC.
Штамм имеет следующие характеристики.
Культурально-морфологические признаки.
Штамм КММ 426 образует на твердых средах круглые (1-2 мм) выпуклые слизистые полупрозрачные колонии, накапливающие оранжевый пигмент. Клетки представляют собой неподвижные мелкие (0,5х1,5 мм) грамотрицательные палочки, имеющие строго респираторный тип метаболизма, способные расти при 5-30oC, которые не образуют кислоту из глюкозы, мелибиозы, раффинозы, фруктозы, трегалозы, глицерина, адонита, дульцита, инозита и сорбита, не утилизируют цитрат, N-ацетилглюкозамин, не гидролизует альгинат, крахмал, эластин, твин-80, требует для роста присутствие ионов хлористого натрия. Штамм КММ 426 устойчив к рифампицину, канамицину, пенициллину, стрептомицину, неомицину, гентомицину, оксациллину, но чувствителен к ристомицину, римфамицину, ампициллину, цефалоридину, полимиксину В, линкомицину, эритромицину. На основании изученных физиолого-биохимических свойств штамм КММ 426 был идентифицирован как Flavobacterium sp.[7].
Физиолого-биохимические признаки
Штамм КММ 426 не гидролизует желатин, крахмал, твин-80. Аргининдегидролаза отсутствует, не денитрификатор. Индол и сероводород не образует. Мелибиозу, мальтозу, сахарозу, глицерин не утилизирует.
Штамм КММ 426 не патогенен и не токсичен для теплокровных животных.
Пример использования штамма морской бактерии Flavobacterium sp. КММ 426 для получения фермента α-N- ацетилгалактозаминидазы.
Культивирование штамма КММ 426 проводят на модифицированной питательной среде Y-K следующего состава, г/л:
Бактопептон (Difco) - 5,0
Глюкоза - 1,0
K2HPO4 - 0,2
Дрожжевой экстракт (Difco) - 2,0
Дистиллированная вода - 500 мл
Морская вода - 500 мл
pH - 7,8
Посевной материал Flavobacterium sp. КММ 426 выращивают в колбах емкостью 250 мл, содержащие 50 мл ферментационной среды, в течение 24-30 ч при 25oC на качалке со скоростью вращения 150 об/мин, до получения плотности 109 клеток/мл.
Полученным посевным материалом засевают колбы емкостью 1000 мл, содержащие 500 мл ферментационной среды того же состава. Ферментацию проводят в течение 24 ч при 25oC на качалке со скоростью вращения 120 об/мин.
Последовательность процедур выделения и очистки α-N- ацетилгалактозаминидазы из биомассы бактерии и ее очистки традиционна.
α-N-ацетилгалактозаминидазная активность сосредоточена в биомассе бактерий, а не в культуральной среде. Навеску сырой биомассы суспендируют в 0,01 М фосфатном буфере, pH 7,2. Соотношение биомассы и буфера не превышает 0,5 мг на 1 мл. Суспензию озвучивают ультразвуком с частотой 22 кГц (при токе 0,4 А) 4-5 раз по 40 секунд с 10-20-секундным перерывом на ультразвуковом диспергаторе. Гомогенат центрифугируют 30-35 мин на центрифуге при 15000 об/мин.
Супернатант подвергают ионообменной хроматографии на колонке DEAE-Toyopearl 650 М фирмы "Toya Soda", Япония (15,5х2,0), уравновешенной 0,01 М фосфатным буфером, pH 7,2. Элюцию проводят линейным градиентом NaCl (0 - 0,5 М) 300/300 мл со скоростью 22 мл/час.
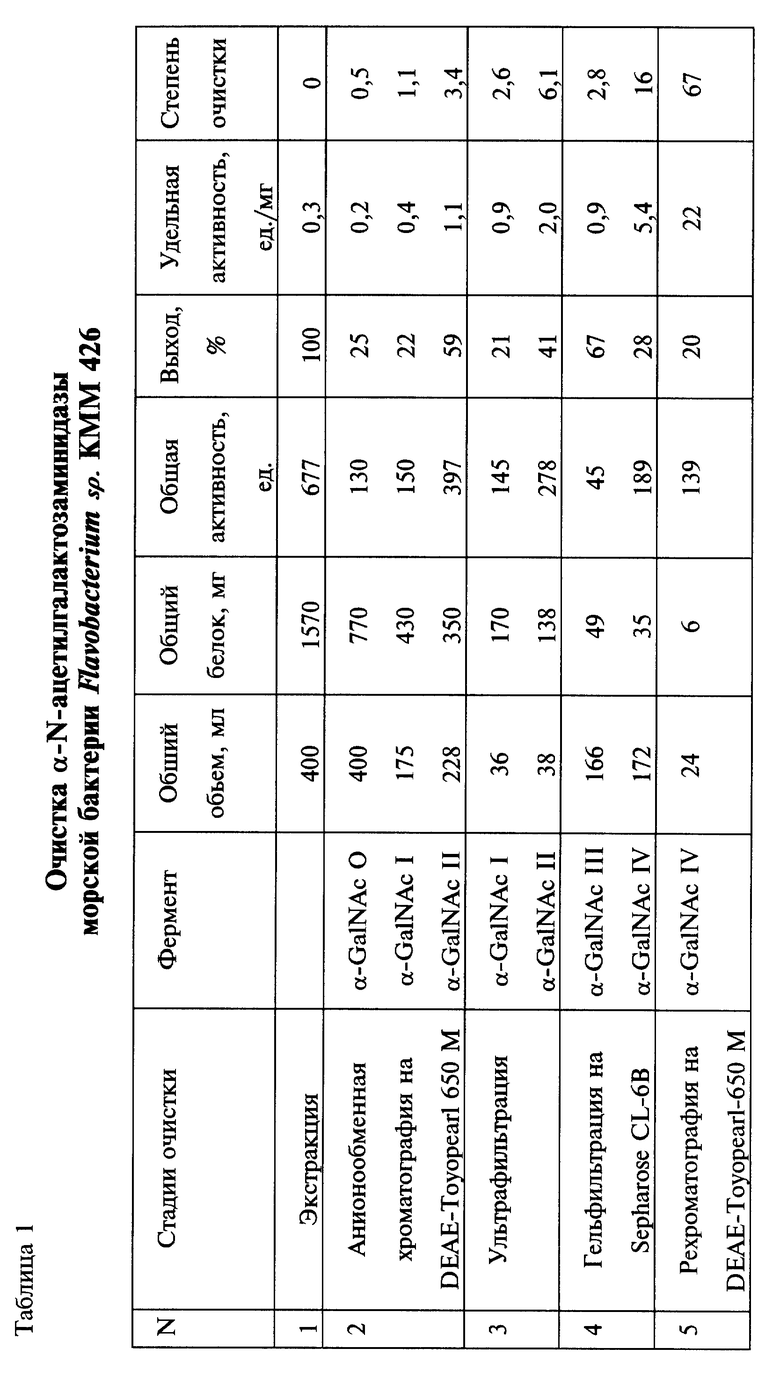
На чертеже изображена схема очистки и разделения α-N- ацетилгалактозаминидазной активностей Flavobacterium sp. КММ 426. В указанных условиях анионообменной хроматографии 24,7% α-N-ацетилгалактозаминидазной активности не сорбируется на анионообменнике (α-Ga1NAcO), сорбированная α-N- ацетилгалактозаминидазная активность элюируется двумя пиками: минорным (α-Ga1NAcI) и главным (α-Ga1NAcII). Только фракции, соответствующие пику II α-N- ацетилгалактозаминидазной активности, инактивируют групповую специфичность A(II) эритроцитов. Их объединяют и концентрируют ультрафильтрацией на мембране РМ-30 (Amicon, Англия) и наносят на колонку с сефарозой CL-6B фирмы "Pharmacia" (Швеция) (62х2,5 см), уравновешенную тем же буфером. Элюируя со скоростью 28 мл/час, получают дальнейшее разделение активности на два пика: более высокомолекулярный минорный (α-Ga1NAcIII) и последующий главный (α-Ga1NAcIV), молекулярная масса которого, как показала гельфильтрация на этом же носителе, но на аналитической колонке, составила 84 кДа. Из последних двух α-N-ацетилгалактозаминидаза IV активна по действию на A(II) эритроциты.
После гельфильтрации фракции, содержащие α-N- ацетилгалактозаминидазу IV, рехроматографируют на DEAE-Toyoperl 650 М в условиях, указанных выше. Рехроматография на DEAE- Toyoperl 650 М помогает отделить ряд белковых примесей.
Для дальнейших исследований берут фракции ферментного препарата, которые соответствуют центральной части пика активности при 0,15 М NaCl. Выход требуемой α-N- ацетилгалактозаминидазной активности составляет 20%, удельная активность увеличивается с 0,3 до 22 ед/мг белка (табл. 1).
Стандартную гидролитическую активность α-N- ацетилгалактозаминидазы (U) определяют следующим способом: к 50 мкл исследуемого раствора фермента добавляют 450 мкл раствора п-нитpoфeнил-N-aцeтил α-D-гaлaктoзaминидa производства фирмы "Sigma", США (1 мг/мл) в 0,1 М фосфатном буфере, pH 7,2, инкубируют при температуре 200oC. Реакцию останавливают через 15-60 минут, в зависимости от быстроты развития желтой окраски, добавлением 2,5 мл 1 М Na2CO3, и измеряют оптическую плотность раствора при 412 нм на СФ-26 (СССР). Количество выделившегося п-нитрофенола определяют из расчета: 23 мкг/мл соответствует 0,5 ед оптической плотности раствора. За единицу активности принимают количество фермента, которое катализирует образование одного мкМоля п-нитрофенола за 1 час в условиях определения.
Удельную активность α-N-ацетилгалактозаминидазы считают как отношение стандартных единиц на мг белка в единице объема (U/мг белка). Белок определяют по методу Лоури.
В результате применяемой схемы очистки (чертеж) получают препарат фермента, очищенный в 67 раз (табл.1) и не содержащий других гликаназ и гликозидаз.
Фермент имеет оптимум действия при pH 7,0-8,0, требуемый для проведения реакции трансформации эритроцитов человека группы крови A(II) в H(O) в щадящих эритроциты условиях. Это свойство дает существенное преимущество полученного фермента перед уже известным из печени курицы, имеющим оптимум действия при pH<4,5.
Фермент не выдерживает замораживания, но неограниченное время сохраняет активность при 4oC и в течение недели - при 20oC в присутствии 0,1% азида Na. Фермент термостабилен: сохраняет 100% активности по п-нитрофенил α-D-N-ацетилгалактозаминиду в течение 10-минутного прогревания при 50oC и pH 7,2.
Молекулярная масса фермента составляет 84 кДа по данным гельфильтрации на сефарозе CL-6B фирмы "Pharmacia" (Швеция).
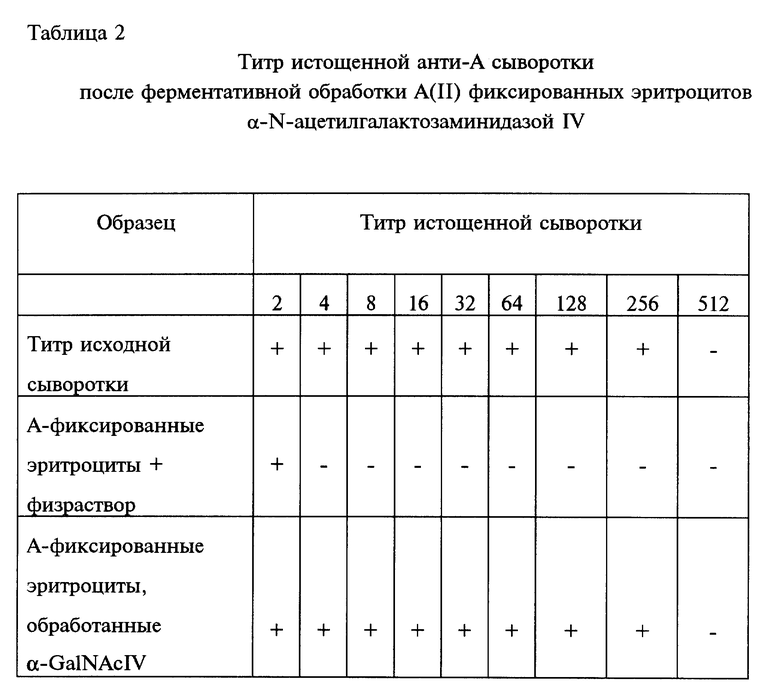
Из 3-х α-N-ацетилгалактозаминидаз, полученных из штамма бактерии Flavobacterium КММ 426 и испытанных в Гематологическом научном центре РАМН (Москва), а также в Институте органической химии РАН (Москва), только α-N- ацетилгалактозаминидаза IV проявила способность трансформировать эритроциты группы крови A(II) человека в эритроциты группы O(H) и инактивировать групповую специфичность вещества крови A (табл.2).
Нативные эритроциты, кровь и стандартные групповые сыворотки получены от станции переливания крови Гематологического научного центра РАМН. Моноклональные антитела (анти-A, анти-B, анти-H, анти-M, анти-N) - от фирмы "Гематолог" РАМН.
В длительных опытах по трансформации, когда велика вероятность гемолиза, использовались эритроциты, зафиксированные глутаровым альдегидом.
Эффективность фермента при действии на эритроциты устанавливают следующими процедурами. Хорошо отмытые зафиксированные эритроциты смешивают с раствором фермента и после 24 час инкубации с перемешиванием при 26oC 3 раза отмывают забуференным физраствором pH 7,3 и смешивают затем с соответствующими сыворотками. После 1 часа инкубации при комнатной температуре с легким перемешиванием производят определение агглютинирующей способности таких абсорбированных сывороток. Агглютинационные тесты осуществляют на 96-круглолуночных планшетах в серии двойных разведений нормальной и/или абсорбированной ("истощенной") сыворотки (растворов антител) с помощью нативных эритроцитов, предварительно отобранных из нескольких образцов донорской крови.
Фиксированные глутаровым альдегидом эритроциты полностью сохраняют структуру ABO-групповых антигенов и, соответственно, способны специфически адсорбировать антитела [8] . Поэтому, если фермент эффективно инактивирует A(II) антиген, т. е. переводит его в O(H)-антиген, характеризующий первую (нулевую) группу крови, то адсорбции анти-A антител не происходит (сыворотка не "истощается"), и титр агглютинации нативных эритроцитов соответствующей группы крови не будет отличаться от титра свежей (не "истощенной") сыворотки. Соответственно можно оценивать различную степень инактивации антигенов по изменению титра "истощенных" сывороток. В таблице 2 показаны титры "истощенной" сыворотки после обработки A(II) фиксированных эритроцитов α-N-ацетилгалактозаминидазой IV,
из Flavobacterium sp. KMM 426, которые свидетельствуют об эффективности действия этого препарата фермента на трансформацию эритроцитов группы крови A(II) человека.
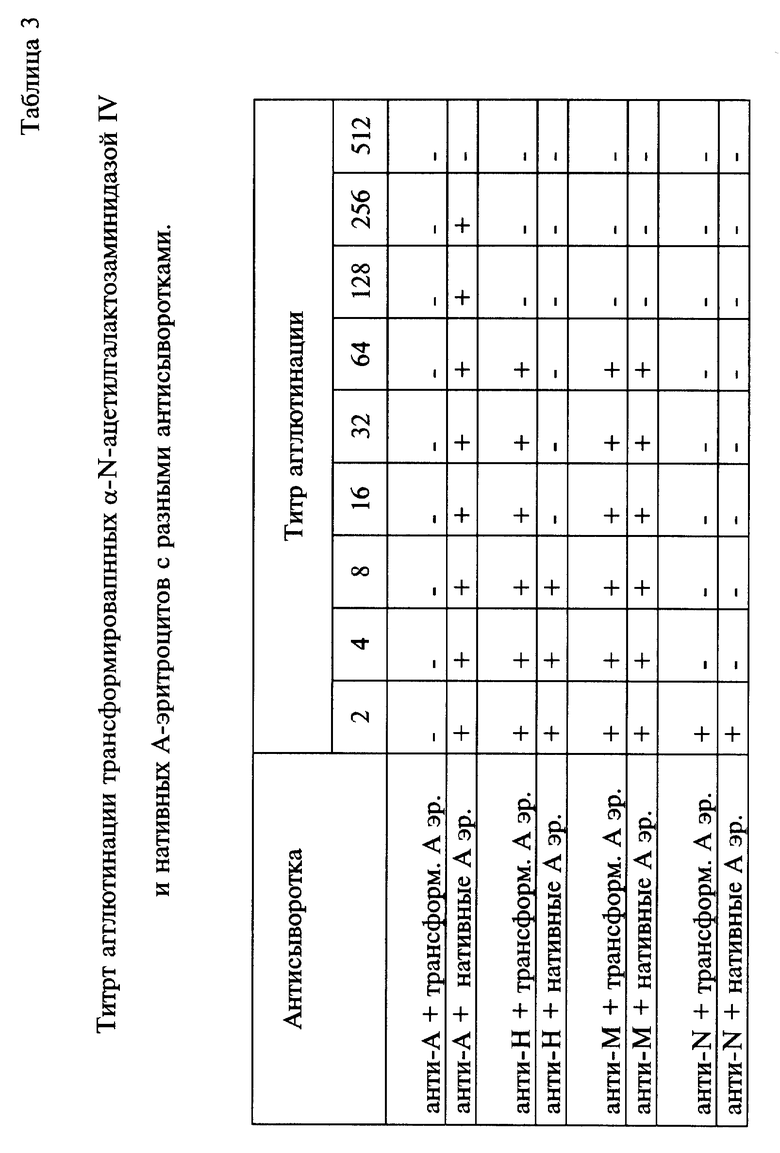
В таблице 3 показаны результаты иммунологического изучения нативных незафиксированных эритроцитов, обработанных α-N-ацетилгалактозаминидазой IV, показавшей свою эффективность на зафиксированных эритроцитах (табл. 2). Видно, что A(II)-антигены трансформированы в O(H)- антиген, т. к. нет агглютинации с анти-A сывороткой. Титр агглютинации с анти-H сывороткой закономерно немного увеличен за счет появления новых O(H)-антигенов вместо бывших до того A(II)-антигенов. Такая картина свидетельствует также об отсутствии в образцах фукозидазы, иначе H-антиген был бы инактивирован. Ферментативная обработка не меняет также титр агглютинации с анти-M или анти-N сыворотками, что может свидетельствовать об отсутствии сиалидаз в изученных образцах ферментов. Это очень важно с точки зрения приживляемости трансформированных эритроцитов при введении их в кровяное русло. α-N-ацетилгалактозаминидаза IV, прошедшая процедуру очистки, показанной на чертеже, не вызывает также неспецифической агрегации эритроцитов и их гемолиза, что говорит о достаточно высокой чистоте ферментного препарата.
Препарат α-N-ацетилгалактозаминидазы IV проявлял очень высокую активность в реакции ингибирования гемагглютинации с групповым веществом крови A (ГВК A+H), содержащем детерминанты, аналогичные A(II) эритроцитам.
Поставленная задача решена тем, что найден штамм морской бактерии - выдающийся продуцент фермента с уникальной способностью инактивировать групповую специфичность эритроцитов крови A(II), не требующий особых условий культивирования и дорогостоящих питательных сред, а также из биомассы этой бактерии получен препарат фермента, способный удовлетворить технологическим требованиям, предъявляемым к условиям обработки эритроцитов: высокотермостабильный и имеющий оптимум действия при pH 7,2.
Литература
1. Goldstein, J. , US Pat., 518990б 01.08.83, "Enzymatic conversion of certain sub-type A and AB erythrocytes."
2. Zevy G. N., Aminoff D. // J. Biol. Chem. 1980. V.255, P. 1737.
3. McDonald M.J., Bahl O.P. // Methods in Enzymol. N.Y.: Academ. Press Inc., 1972. P.737.
4. Kadowaki S., Ueda Т., Yamamoto K. et al // Agric. Biol. Chem. 1989.V. 53,N1. P.111.
5. Hoskins LC., Boulding E.T. Larson G. // Journ. Biol. Chem. 1997. V. 272, N12. P.7932.
6. Бакунина И.Ю., Иванова Е.П., Михайлов В.В., Недашковская О.М., Горшкова Н.М., Парфенова В.В. // Микробиология. 1994, Т.63, Вып.5, с.847.
7. Holmes В. , Owen R.J. and McMeekin Т. Genus Flavobacterium // In: Bergy's manual of systematic Bacteriology. 1984. Baltimor / Lond.: Williams and Wilkins. V.1, P.353-361.
8. Ковнер В. Я. , Кульман Р.А. и др. // Гематология и трнсфузиология. 1986. Т.31, С. 21-25.
Изобретение относится к биотехнологии, в частности к производству ферментов, имеющих значение в решении проблемы универсального донорства - возможности получения на местах универсальных по групповым свойствам эритроцитов для неотложной трансфузиологической помощи, α-N-ацетилгалактозаминидаза способна удалять α-1,3-связанные остатки N - ацетилгалактозамина из гликопротеинов групповых веществ А(II) крови с превращением последних в вещества группы О(Н). Штамм бактерий Flavobacterium sp. (ВКМ В-2137Д) выделен из морского грунта методом прямого высева. При культивировании в питательной среде, содержащей, г/л: бактопептон 5,0, глюкозу 1,0, К2HPO4 0,2, дрожжевой экстракт (Difco) 2,0, дистиллированную воду 250 мл и морскую воду 750 мл, рН 7,5, 25oC, в течение 24-30 ч, культура биосинтезирует α-N-ацетилгалактозаминидазу. Препарат α-N-ацетилгалактозаминидазы выделяют из биомассы высвобождением из клеток путем обработки ультразвуком с последующей очисткой фермента ионообменной хроматографией на DEAE - Toyoperl 650 -М, гельфильтрацией на сефарозе CL -6В и рехроматографией на DEAE - Toyoperl 650 М. Выход препарата α-N-ацетилгалактозаминидазы с удельной активностью 22 ед./мг белка составляет 20% от содержания ее в сыром экстракте. Фермент имеет оптимум действия при рН 7,2, сохраняет 100% активность при прогревании в течение 10 мин при 50°С, молекулярную массу 84 кДа. Фермент обладает уникальной способностью инактивировать групповую специфичность эритроцитов крови человека группы А(II). 3 табл., 1 ил.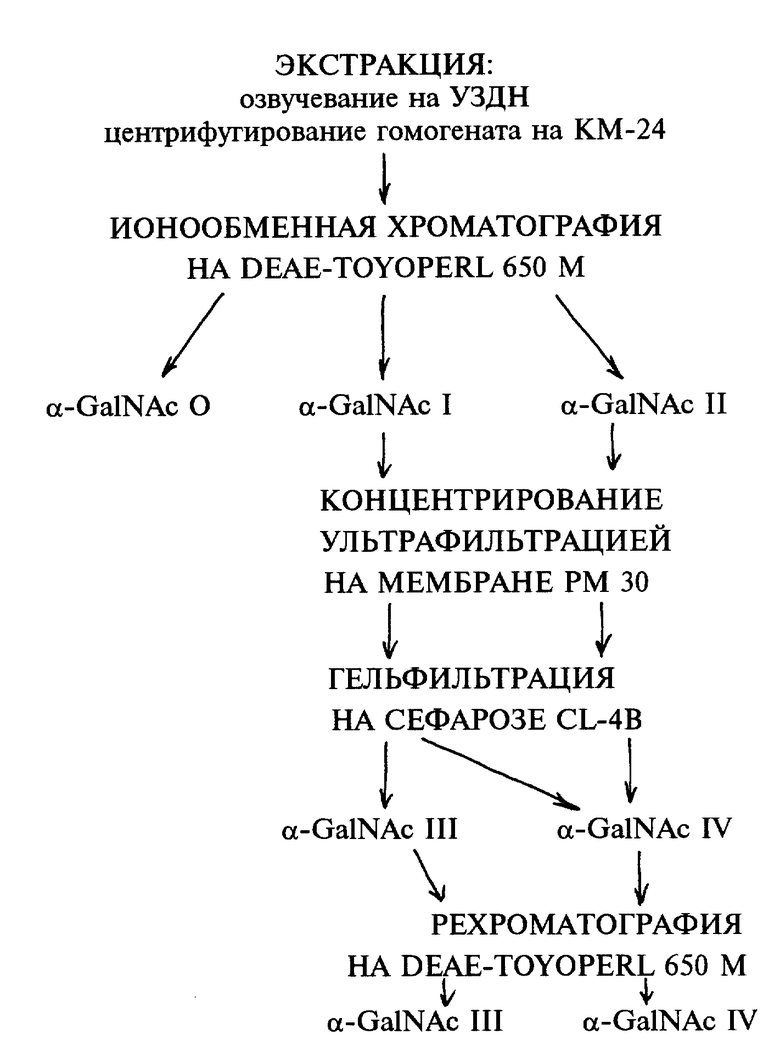
Штамм бактерий Flavobacterium sp. ВКМ В-2137Д - продуцент α-N-ацетилгалактозаминидазы.
| Hoskins L.C., Boulding E.T., Larson G | |||
| Journal Biol | |||
| Chem., 1997, v.272, N 12, p | |||
| Пневматический тормоз | 1926 |
|
SU7932A1 |
| Бакунина И.Ю | |||
| и др | |||
| Микробиология, 1994, т | |||
| Способ приготовления сернистого красителя защитного цвета | 1915 |
|
SU63A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Приспособление для усиления действия естественной вентиляции с применением фильтрующих тканей | 1925 |
|
SU847A1 |
| ШТАММ STREPTOMYCES KURSSANOVII - ПРОДУЦЕНТ ХИТИНАЗЫ И N-АЦЕТИЛ-D-ГЛЮКОЗАМИНИДАЗЫ | 1992 |
|
RU2061754C1 |
| US 5382524 A, 17.01.95 | |||
| US 5478738 A, 26.12.95 | |||
| ПРЕОБРАЗОВАТЕЛЬ ДЛЯ СОПРЯЖЕНИЯ УСТРОЙСТВА УПРАВЛЕНИЯ ВНЕШНИМИ ОБЪЕКТАМИ С КАНАЛОМ | 0 |
|
SU292158A1 |
| JP 01098485 A, 17.04.89 | |||
| JP 63276487 A, 14.11.88. | |||
Авторы
Даты
1999-11-20—Публикация
1998-06-17—Подача