Изобретение относится к области микробиологии и может быть использовано при изучении L-тpaнсфopмировaнных вариантов бактериальных клеток.
Известен способ определения изменчивости микроорганизмов, основанный на действии ультрафиолетовых лучей на односуточную культуру микроорганизмов в белковой среде ртутно-кварцевой лампой 4,0 а, спектр 5790-2300 A, продолжительность облучения 2-30 с (Надсон Г.А. Действие излучений на микроорганизмы и экспериментальный мутагенез /Избранные труды.- 1967.- Т.2 - С.151-157).
Ультрафиолетовое облучение в течение двух секунд вызывает появление первой фазы клеточных изменений. Цитоплазма возбуждена. Отмечаются выпячивание и образование цитоплазматических выростов. Вакуоли принимают неправильную конфигурацию и причудливые очертания и через некоторое время возвращаются к исходной форме. Происходит осаждение метахроматина, объем которого постепенно увеличивается. Ультрафиолетовые лучи в течение одной минуты угнетающе действуют на микробную клетку.
Однако этот способ не позволяет определить изменчивость микроорганизмов в динамике, т.к. лишенные оболочек клетки скучиваются или сливаются в грубозернистую, аморфную, постепенно разрушающуюся мертвую массу.
С целью получения более качественной картины динамики изменчивости микроорганизмов применяют ионизирующее воздействие в виде низкоэнергетического лазерного излучения, при энергетических экспозициях от 0,05 до 0,5 Дж/см, напряженность магнитного поля 60 мТл, время 60 с на культуру микроорганизмов в биологической среде с последующей фиксацией тушью или азур-зозином.
В качестве биологической среды используют перепелиные эмбрионы первых дней инкубации с целью сохранения осмотического давления при изменении формы клеток.
Общие признаки.
1. Ионизирующее воздействие.
3. Воздействие на микробную (культуру) клетку.
3. Воздействие в белковой среде.
4. Определение стадий изменчивости или фаз.
Отличительные признаки.
1. На микробную клетку воздействуют низкоэнергетическим лазерным излучением при энергетических экспозициях от 0,05 до 0,5 Дж/см, напряженность магнитного поля 60 мТл, время 60 с.
2. Фиксацию проводят тушью или азур-эозином.
3. В качестве биологической среды используют перепелиные эмбрионы первых дней инкубации.
Применение предлагаемого способа позволяет получить полную картину изменчивости микроорганизмов.
В клетках микроорганизмов энергия лазера преобразуется в энергию фотохимических процессов, электронных переходов и в тепловую энергию, что в конечном итоге приводит к сложной гамме морфофункциональных изменений в биологическом объекте.
Термический эффект является важным компонентом взаимодействия лазерного излучения с микробными клетками: при этом результаты взаимодействия определяются, с одной стороны, параметрами лазерного излучения, а с другой стороны способностью микробной клетки поглощать и отражать лазерное излучение и реактивностью микробных клеток, сопряженной с их теплоемкостью и теплопроводностью. Изменение клеток происходит на глазах у наблюдателя. При этом наблюдается быстрое движение клеток за счет влияния электромагнитных полей лазера и заряда поверхностей клеток.
Коринеформные бактерии, отличающиеся выраженным полиморфизмом, изменяют свою форму под влиянием низкоэнергетического лазерного излучения.
При действии теплового эффекта, когда энергетическая экспозиция составляет 0,4-0,5 Дж/см, отмечается сбрасывание клеточной оболочки микробактерий и появление " голых клеток". При освобождении клеток от оболочек один конец расширен, на другом сосредоточены зерна волютина. Стадия полиморфизма сменяется стадией агглютинации.
В этот период происходит склеивание клеток согласно распре деления зарядов их клеточных поверхностей. Характерной особенностью этой стадии является образование правильных геометрических форм. У микробактерий отмечают наличие жгутиков, колбовидных вздутий, гантелеобразную форму клеток. Стадия агглютинации заканчивается образованием вытянутых агглютинирующих форм, располагающихся в виде цепочки.
В стадии адсорбции появляются клетки сферической формы. При воздействии лазера микроорганизмы отражают излученный свет, в результате чего происходит образование энергетических колец вокруг живых клеток. Чем подвижнее клетки, тем больше энергетических колец появляется вокруг них.
В стадии адсорбции наблюдают процесс соединения различных форм клеток путем слияния клеточных слоев и цитоплазмы. При сближении L-трансформированных клеток происходит образование цитоплазматических мостиков, "воротничковой зоны", за счет складчатости цитоплазматической мембраны.
В стадии образования зернистых клеток появляются структуры, заполненные волютиновыми зернами адсорбированных клеток. При нарушении осмотического давления отмечают разрыв цитоплазматической мембраны и выход зернистых клеток. Свободные зернистые клетки при наличии биологической среды способны к L-трансформации, при добавлении стерильной дистиллированной воды наблюдают процесс реверсии к первоначальному виду.
При воздействии НЛИ на культуры коринеформных бактерий отмечают четыре стадии изменчивости (чертеж).
Первая стадия - полиморфизма проявляется при всех энергетических экспозициях и проходит за короткий период времени, при этом воздействие в дозе 0,05 Дж/см на микробную клетку оказывает более замедленный эффект, чем 0,5 Дж/см.
Стадию агглютинации можно наблюдать при энергетических экспозициях 0,3, 0,4, 0,5 Дж/см. При энергетических экспозициях 0,05 - 0,18 Дж/см агглютинация происходит с большой задержкой. Агглютинируюший эффект в лучшей степени проявляется при энергетических экспозициях 0,4-0,5 Дж/см.
Стадия адсорбции не прослеживается при энергетической экспозиции 0,05 Дж/см, что затрудняет работу исследователя. При энергетических экспозициях 0,18-0,3 Дж/см происходит задержка адсорбции, при 0,4-0,5 Дж/см прослеживаются все порядки стадии адсорбции.
Стадия образования зернистых клеток хорошо прослеживается при энергетических экспозициях 0,5 Дж/см, при экспозиции 0,4 Дж/см изменения происходят с некоторой задержкой. Таким образом, при энергетической экспозиции 0,5 Дж/см можно проследить динамику изменчивости актиномицетов.
После воздействия лазера на микробные клетки они приобретают более выраженную окраску. Это связано с активным усвоением красителей поверхностными структурами и цитоплазмой клеток, в результате чего их контуры и интенсивность окраски становятся четче по сравнению с обычными методами.
Окраску L-трансформированных вариантов клеток проводят тушью (отечественной) или азур-зозином (на глицерине), что дает возможность, не изменяя осмотического давления, сохранять шарообразную форму клеток.
В качестве биологической среды используют перепелиные эмбрионы первых дней инкубации с целью сохранения осмотического давления при изменении формы клеток. Перепелиные эмбрионы используются на биофабриках для получения культуры клеток, в микробиологических и вирусологических лабораториях. Это экологически чистый материал для изучения L-трансформированных вариантов клеток. Перепелки в птичниках не подвергаются вакцинациям, развитие эмбрионов происходит быстрее.
Таким образом, под влиянием низкоэнергетического лазерного излучения с использованием биологической среды более качественно прослеживается динамика изменчивости микроорганизмов, что в дальнейшем можно использовать для экспресс-диагностики инфекционных болезней.
Пример 1. Двухсуточную культуру коринебактерий вносят в биологическую среду на предметное стекло и смотрят под микроскопом. Изменения клеток в пределах первоначального размера отмечают в первые 7-15 мин, диаметр клетки 0,22+0,15 мкм, длина 0,44+0,2 мкм. При этом происходит быстрое движение клеток. Стадия полиморфизма переходит во вторую стадию агглютинации, которую отмечают через 30-40 мин для коринебактерий. Для этой стадии характерно полюсное соединение кокковых форм, образующих правильные геометрические фигуры диаметром 0,22+0,7 мкм, длиной 0,67+0,22 мкм. Для стадии адсорбции характерно образование клеток сферической формы, энергетических колец, "воротничковой зоны". Четвертая стадия образования зернистых клеток характеризуется появлением структур, заполненных волютиновыми зернами адсорбированных клеток.
Пример 2. При действии низкоэнергетического лазерного излучения на односуточную культуру диплококка в биологической среде визуально отмечали стадии агглютинации и адсорбции.
Способ основан на изменении формы клеток под влиянием ионизирующего излучения лазера в белковой среде с последующей фиксацией красителями (тушью или азур-эозином). Действие низкоэнергетического лазерного излучения изучали при энергетических экспозициях 0,05; 0,18; 0,3; 0,4; 0,5 Дж/см, время воздействия 60 с, напряженность магнитного поля 60 мТл. Исследование препаратов проводили на стеклах и в развивающихся перепелиных эмбрионах. После воздействия лазера микробные клетки приобретают более выраженную окраску. Способ позволяет более качественно оценить динамику изменчивости микроорганизмов. 1 ил.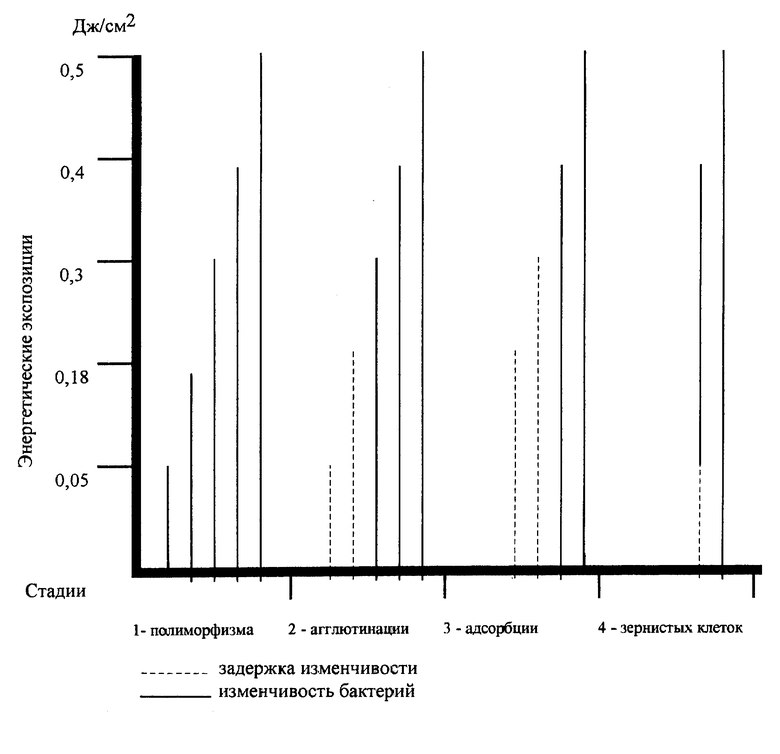
Способ определения динамики изменчивости микроорганизмов, основанный на ионизирующем воздействии на клетки микроорганизмов в белковой среде, отличающийся тем, что на клетку воздействуют низкоэнергетическим лазерным излучением при энергетических экспозициях 0,05 - 0,5 Дж/см, напряженность магнитного поля 60 мТл, время 60 с, фиксацию проводят тушью или азур-эозином, а в качестве биологической среды используют перепелиные эмбрионы.
| Надсон Г.А | |||
| Действие излучений на микроорганизмы и экспериментальный мутагенез | |||
| Избранные труды | |||
| Запальная свеча для двигателей | 1924 |
|
SU1967A1 |
| Способ определения жизнеспособности микроорганизмов | 1986 |
|
SU1458389A1 |
| Способ определения физиологического состояния бактериальных клеток ЕSснеRIснIа coLI в препарате | 1985 |
|
SU1328377A1 |
| Устройство для определения состояния микробной культуры | 1985 |
|
SU1322679A1 |
Авторы
Даты
1999-11-20—Публикация
1998-01-06—Подача