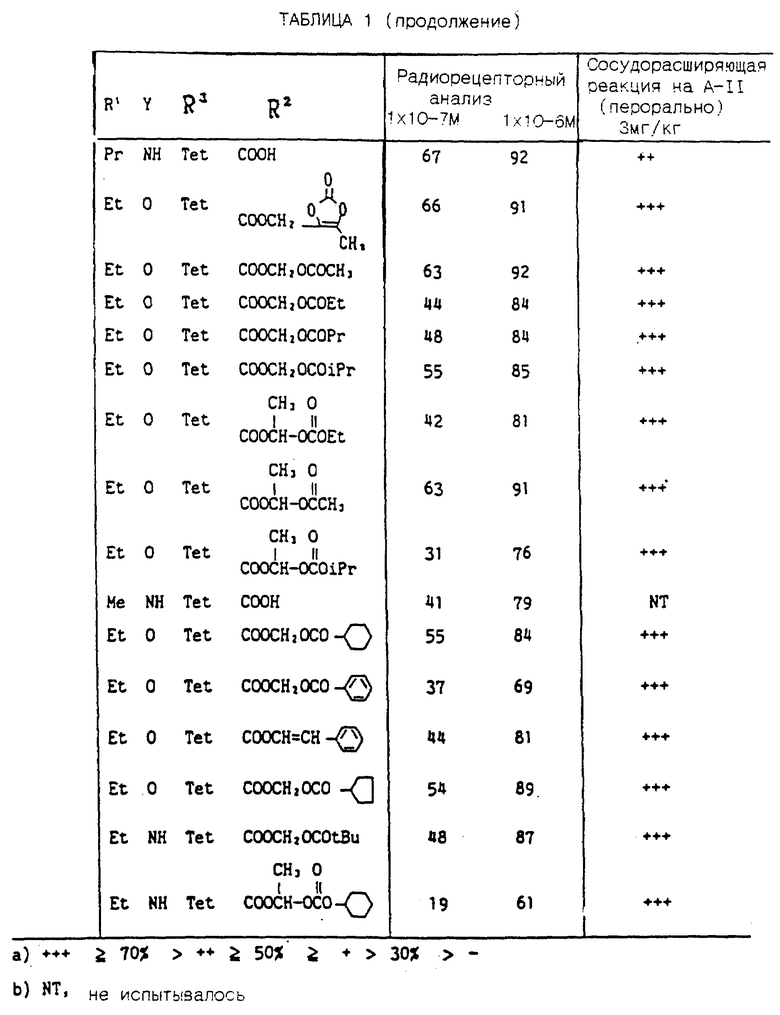
Предметом настоящего изобретения являются новые промежуточные соединения для производных бензимидазола, обладающих великолепными фармацевтическими свойствами.
В частности предметом настоящего изобретения являются эфиры N-(бифенилметил)аминобензойной кислоты общей формулы (V):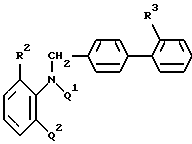
где R2 представляет низшую (C1-C4)алкоксикарбонильную группу,
R3 представляет низшую (C1-C4)алкоксикарбонильную группу или -CN,
Q2 представляет -NO2 или -NH2,
когда Q1 представляет H, или
Q2 означает -NO2, когда Q1 означает - COOR, где R означает низший (C1-C4)алкил, или соль этого соединения.
Соединения вышеприведенной формулы являются ценными промежуточными продуктами в синтезе производных бензимидазола общей формулы (I):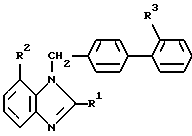
в котором R1 представляет необязательно замещенную алкильную группу, каждый из элементов R2 и R3 имеет значения, указанные выше, или их солей, которые обладают сильным антагонизмом в отношении ангиотензина II и гипотензивным действием, и является полезными в качестве терапевтических средств для лечения болезней, связанных с расстройством кровообращения, таких как гипертонические болезни, сердечно-сосудистые заболевания, кровоизлияние в мозг и т. д. В качестве одного из ранних исследований в этой области можно отметить производные имидазола, обладающие антагонизмом в отношении ангиотензина II, которые описывались в нерассмотренной публикации патентов Японии NN 71073/1981, 71074/1981, 92270/1982 и 157768/1983, в патенте США N 4355040 и в патенте США N 4340598. Далее улучшенные производные имидазола рассматриваются в Европейском патенте 0253310, Европейском патенте 0291969, Европейском патенте 0324377, в нерассмотренной публикации патентов Японии NN 23863/1988 и 117876/1989. А в Европейском патенте 0323841 и в не прошедшей экспертизу публикации патента Японии N 287071/1989 в качестве антагонистов ангиотензина II описываются производные пиррола, пиразола и триазола.
Кроме того в патенте США N 4880804 рассматриваются производные бензимидазола, обладающие антагонизмом в отношении рецепторов ангиотензина II и являющиеся эффективными при лечении крыс, страдающих почечной гипертензией, при внутривенном введении, например, соединения (A) представленные следующей формулой (A), имеющие гидроксиметильную, метоксильную, формильную, хлорную или карбоксильную группу в положениях 5 и/или 6. Однако, указывается, что большинство соединений (A) не обладает активностью при оральном введении, при этом только 6 - гидроксиметильные соединения и 6 - хлорсодержащие соединения являются эффективными при оральном введении (100 мг/кг или меньше). Однако, соединения, обладающие указанной выше активностью, являются неудовлетворительными для практического использования в качестве лекарственных средств.

В указанном патенте США специально отмеченные соединения, включающие вышеуказанные соединения (A), ограничены бензимидазолом, имеющим заместители в положениях 5 и/или 6 бензольного кольца, при этом в нем не рассматриваются производные бензимидазола, имеющие заместители в положении 4 или 7.
Авторы настоящего изобретения обнаружили, что определенные соединения, то есть 7 - замещенные производные бензимидазола, которые не были конкретно указаны в патенте США N 4880804, обладают сильным антагонизмом в отношении рецепторов ангиотензина II, а также при оральном введении проявляют неожиданно сильный антагонизм в отношении ангиотензина II и гепертензивное действие, которые не наблюдались у производных, замещенных в положениях 5 и/или 6. Авторы настоящего изобретения провели научно-исследовательскую работу для достижения целей настоящего изобретения.
В вышеуказанной общей формуле (I) и V определение "алкильная группа", включает низшие алкильные группы с прямой или разветвленной цепью, имеющие от 1 до 4 атомов углерода, такие как метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил.
Способ получения
Соединения настоящего изобретения общей формулы (V), можно получить в соответствии со схемой реакции 1, представленной ниже,
/в которой R2 и R3 имеют указанные выше значения, a W обозначает атом галогена/.
Вышеуказанная реакция соединения XI с соединением XII представляет алкилирование с использованием алкилирующего агента в органическом растворителе и в присутствии основания.
Эта реакция обычно выполняется в таком растворителе, как диметилформамид, диметилацетамид, диметилсульфоксид, ацетонитрил, ацетон или этилметилкетон, с использованием от 1 до 3 молей основания и от 1 до 3 молей алкилирующего агента.
В качестве основания используется, например, гидрид натрия, трет-бутоксид калия, карбонат калия или карбонат натрия.
Алкилирующий агент используется в форме замещенного галогенида (например, хлорида, бромида и йодида), но он может использоваться в форме сложного эфира замещенной сульфокислоты (например, метиловый эфир пара-толуолсульфокислоты).
Хотя условия реакции изменяются в зависимости от сочетания основания и алкилирующего агента, обычно эту реакцию выполняют при температурах от температуры охлаждения льдом до комнатной температуры в течение периода времени от 1 до 10 часов, после чего производят снятие защиты и взаимодействие с восстановителем (например, скелетный никелевый катализатор гидрирования, четыреххлористое олово, смесь железа и хлористоводородной кислоты, смесь гидразина и хлорида железа (3) и т.д.).
Сложный эфир карбаминовой кислоты (XI) получают с высоким выходом путем нагрева изоцианата (X):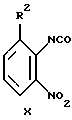
и трет-бутанола.
Соединения формулы (V), согласно изобретению, используют в качестве промежуточных при получении производных бензимидазола формулы I, в соответствии с Реакционной Схемой II, представленной ниже,
(в которой R1, R2 и R3 имеют указанные выше значения, а Y представляет иминоэфир, иминотиоэфир, карбоксид, амидин, цианогруппу и т.д.).
На схеме Реакции (II) представлена циклизация диаминосоединения (V) с различными соединениями в органическом растворителе с образованием соединения бензимидазола (1).
Вышеуказанные различные соединения включают карбоновую кислоту, альдегид, ортоэфир, иминоэфир и иминотиоэфир.
Эти реагенты обычно используются в количестве 1-10 молей в пересчете на 1 моль соединения (V), и эта реакция обычно протекает в органическом растворителе, но реагент может использоваться в двойном количестве по сравнению с растворителем.
Органические растворители, изменяющиеся в зависимости от используемого реагента, включают спирты (метанол, этанол и т.д.), целлозольвы (метилцеллозольв, этилцеллозольв и т. д. ), галогенированные углеводороды (хлороформ, метиленхлорид и т.д.), простые эфиры (диоксан, тетрагидрофуран и т.д.), ароматические углеводороды (бензол, толуол), ацетонитрил и диметилформамид наряду с другими веществами.
Для ускорения реакции в реакционную систему можно добавлять кислоту (хлористоводородная кислота, серная кислота, паратолуолсульфокислота и т.д.) или основание (триэтиламин, пиридин, метилат натрия, этилат натрия, карбонат калия и т.д.).
Хотя условия реакции изменяются в зависимости от используемых реагентов, эта реакция предпочтительно осуществляется при температурах от комнатной температуры до температуры кипения применяемого растворителя в течение периода времени от 1 до 10 часов.
Полученные таким образом соединения (1) и их соли являются менее токсичными, хорошо ингибируют сосудосуживающее и гипертензивное действие ангиотензина II, вызывают гипотензивный эффект у животных, в частности у млекопитающих (например, у человека, собаки, кролика, крысы и т.д.), поэтому они являются полезными в качестве терапевтических средств не только для лечения гипертензии, но и для лечения сердечно-сосудистых заболеваний, таких как сердечная недостаточность и кровоизлияние в мозг. Соединения (I) и их соли при использовании в качестве лекарственных средств, указанных выше, можно применять орально или неорально, в чистом виде или в таких дозированных формах, как порошки, гранулы, таблетки, капсулы, растворы для инъекций и т. д. , получаемых в результате смешения с соответствующими фармацевтически приемлемыми носителями, наполнителями или разбавителями.
Далее изобретение иллюстрируется экспериментальными примерами, которые не следует рассматривать, как ограничение настоящего изобретения.
Ниже приводятся следующие примеры сокращений, используемых в этом описании изобретения:
Me : метил, Et : этил, Pr : пропил, Bu : бутил. Pen : пентил, Tet : тетразолил, THF : тетрагидрофуран, DMF : диметилформамид, Ph : фенил, Ac : ацетил.
Пример 1
Метиловый эфир 3-амино-2-[(2'-цианобифенил-4-ил)метил] аминобензойной кислоты
Смесь этилового эфира 3-амино-2-[(2'-цианобифенил-4- ил)метил]аминобензойной кислоты (5 г) и NaH (60% масло, 1,62 г) в метаноле (50 мл) перемешивают при комнатной температуре в течение 24 часов. Реакционную смесь концентрируют до сухого состояния с образованием сиропа, который выливают в насыщенный водный раствор NaHCO3 (100 мл). Эту смесь экстрагируют хлороформом, а органический слой промывают H2O, сушили и выпаривают до сухого состояния, в результате чего получают кристаллический продукт.
Перекристаллизация из смеси этилацетата и гексана привела к образованию бесцветных кристаллов (3,9 г, 82%), температура плавления 106-108oC.
Спектр 1H-ЯМР (200 МГц, CDCl3) δ : 3,81 (3H, с), 3,97 (2H, широкий синглет), 4,23 (2H, с), 6,40 (1H, широкий синглет), 6,88-6,91 (2H, м), 7,34-7,55 (7H, м), 7,64 (1H, двойной триплет), 7,77 (1H, двойной дублет).
Инфракрасный спектр (KBr) см-1: 3410, 3350, 2225, 1695, 1485, 1470, 1290, 1200, 780, 760.
Пример 2
Метиловый эфир 2-(2-хлорэтил)-1-[(2'-цианобифенил-4-ил) метил]бензимидазол-7-карбоновой кислоты
К холодному раствору метилового эфира 3-амино-2-[(2'- цианобифенил-4-ил)метил] аминобензойной кислоты (0,5 г) в CH2Cl2 (5 мл) по каплям добавляют 3-хлорпропионилхлорид (0,15 мл). Реакционную смесь перемешивают при комнатной температуре в течение 30 минут, а затем концентрируют до сухого состояния с образованием остатка. Этот остаток растворяют в метаноле (5 мл), содержащем концентрированную HCl (0,5 мл), после чего этот раствор перемешивают при комнатной температуре в течение 16 часов. Реакционный раствор концентрируют до сухого состояния с образованием остатка, который растворяют в CH2Cl2-H2O. Водный слой делают основным, а затем экстрагируют. Органический слой промывают H2O, сушат и выпаривают до сухого состояния с образованием бледно-коричневого сиропа (0,7 г, 100%).
Спектр 1H-ЯМР (200 МГц, CDCl3) δ : 3,37 (2H, т), 3,74 (3H, с), 4,09 (2H, т), 5,87 (2H, с), 7,00 (2H, д), 7,29 (1H, т), 7,39-7,81 (7H, м), 7,97 (1H, двойной дублет).
Пример 3
Этил-2-[[(2'-цианобифенил)метил]амино]-3-нитробензоат
К раствору этил 2-трет-бутоксикарбониламино-3-нитробензоата (20 г) в тетрагидрофуране (50 мл) добавляют, при перемешивании и охлаждении льдом, гидрид натрия (60%-ная дисперсия в минеральном масле, 2,8 г).
Смесь перемешивают при комнатной температуре в течение 20 минут и затем к смеси добавляют 4-(2-цианофенил)бензилбромид (18 г) и йодид калия (360 мг), после чего в течение 10 часов кипятят с обратным холодильником. Растворитель выпаривают досуха и остаток распределяют между водой (250 мл) и эфиром (200 мл). Органический слой промывают водой, сушат и концентрируют, получая желтого цвета сироп. Сироп растворяют в смеси трифторуксусной кислоты (60 мл) с метиленхлоридом (40 мл) и раствор перемешивают в течение 1 часа при комнатной температуре. Реакционную смесь концентрируют досуха и к остатку добавляют диэтиловый эфир (200 мл) с получением кристаллов. Кристаллы собирают путем отфильтровывания, промывают эфиром, получая кристаллы бледно-желтого цвета (22,1 г; 85%); т.пл. = 118-119oC.
1H-ЯМР (90 МГц, CDCl3) δ : 1,37 (3H, т), 4,23 (с, 2H), 4,37 (к, 2H), 6,37 (1H, т), 7,33-7,83 (м, 9H), 7,97-8,20 (м, 2H).
ИК-спектр (вазелиновое масло) см-1: 3280, 2220, 1690, 1575, 1530, 1480, 1450, 1255, 1105, 755.
Пример 4
Этил 3-амино-2-[[(2'-цианобифенил-4-ил)метил]амино]бензоат
К раствору этил-2-[[(2'-цианобифенил-4-ил)метил]амино]-3- нитробензоата (10,4 г) в этаноле (50 мл) добавляют дигидрат дихлорида олова-(II) (28,1 г) и смесь перемешивают при 80oC в течение двух часов. Растворитель выпаривают досуха. К охлажденной льдом смеси остатка в этилацетате (300 мл) прикапывают 2 н. раствор NaOH (500 мл) при перемешивании. Водный слой экстрагируют этилацетатом (2 раза по 200 мл). Органические слои объединяют, промывают водой и сушат. Растворитель выпаривают досуха и остаток очищают с помощью колоночной хроматографии на силикагеле с получением кристаллов. Перекристаллизация из смеси этилацетат - гексан дает бесцветные кристаллы (7,3 г, 79%); т.пл. = 104-105oC.
1H-ЯМР (200 МГц, CDCl3) δ : 1,33 (т, 3H), 4,23 (с, 2H), 4,27 (к, 2H), 6,83-6,93 (2H, м), 7,35-7,55 (м, 7H), 7,64 (дт, 1H), 7,76 (дд).
ИК-спектр (KBr) см-1: 3445, 3350, 2220, 1680, 1470, 1280, 1240, 1185, 1160, 1070, 1050, 1020, 805, 750.
Пример 5
Этил 1-[(2'-цианобифенил-4-ил)метил]-2-этоксибензимидазол-7- карбоксилат
К раствору этил 3-амино-2-N-[(2'-цианобифенил-4-ил)метил]- аминобензоата (1,0 г) в этиловом эфире ортоугольной кислоты (5 мл) добавляют уксусную кислоту (0,2 г). Смесь перемешивают при 80oC в течение 1 часа. Реакционную смесь концентрируют и концентрат растворяют в этилацетате. Раствор промывают водным раствором гидрокарбоната натрия и водой. Растворитель выпаривают с получением кристаллов. Перекристаллизация из смеси этилацетат - бензол дает бесцветные кристаллы (0.79 г, 69%). Т.пл. = 131-132oC.
Элементный анализ для C26H23N3O3
рассчитано, %: C 73,39 H 5,45 N 9,88
найдено, %: C 73,36 H 5,42 N 9,83
1H-ЯМР (200 МГц, CDCl3) δ : 1,24 (т, 3H), 1,49 (т, 3H), 4,24 (к, 2H), 4,68 (к, 2H), 5,72 (с, 2H), 7,10 (д, 2H), 7,19 (т, 1H), 7,38-7,46 (м, 4H), 7,56-7,66 (м, 2H), 7,73-7,77 (м, 2H).
ИК-спектр (KBr) см-1: 2220, 1720, 1550, 1480, 1280, 1245, 1215, 1040, 760, 740.
Пример 6
Метил 2-[[(2'-цианобифенил)метил]амино]-3-нитробензоат
Смесь этил 2-[[(2'-цианобифенил)метил] амино] -3-нитробензоата (5 г) и гидрида натрия (60%-ная дисперсия в минеральном масле, 1,62 г) в метаноле (50 мл) перемешивают при комнатной температуре в течение одного дня. Реакционную смесь концентрируют и остаток выливают в насыщенный водный раствор гидрокарбоната натрия (100 мл), после чего экстрагируют хлороформом. Органический слой промывают водой, сушат и концентрируют досуха с получением кристаллов. Перекристаллизация из смеси этилацетата с гексаном дает бледно-желтого цвета кристаллы (3,98 г, 83%), т.пл. = 106-108oC.
1H-ЯМР (200 МГц, CDCl3) δ : 3,81 (с, 3H), 3,97 (ш.с, 3H), 4,23 (с, 2H), 6,40 (ш.с, 1H), 6,88-6,91 (м, 2H), 7,34-7,55 (м, 7H), 7,65 (дт, 1H, J = 1,2; 7,7 Гц), 7,77 (дд, 1H, J= 1,4; 8,0 гц).
ИК-спектр (KBr) см-1: 3410, 3350, 2225, 1695, 1485, 1470, 1290, 1200, 780, 760.
Пример 7
Метил [2-(2'-метоксикарбонилбифенил-4-ил)метиламино]-3- нитробензоат
К раствору метил 2-трет-бутоксикарбониламино-3-нитробензоата (1,84 г) в ацетонитриле (10 мл) добавляют раствор 4-(2'-метоксикарбонилбифенил-4-ил)метилбромида (1,9 г) в ацетонитриле (5 мл) и карбонат калия (0,86 г) и реакционную смесь кипятят с обратным холодильником в течение 20 часов. Реакционную смесь концентрируют досуха и полученный остаток экстрагируют этилацетатом и водой. Органический слой промывают водой, сушат и выпаривают. Остаток очищают путем колоночной хроматографии на силикагеле с получением сиропа бледно-желтого цвета. Сироп растворяют в этаноле (10 мл) и к раствору добавляют 20%-ный раствор хлороводорода в этаноле (4 мл). Реакционную смесь перемешивают при комнатной температуре в течение 22-х часов и концентрируют досуха. Остаток растворяют в этилацетате и раствор промывают насыщенным водным раствором гидрокарбоната натрия и водой, сушат и выпаривают с получением желтого цвета сиропа (1,39 г, 53%).
1H-ЯМР (200 МГц, CHCl3) δ : 3,61 (с, 3H), 3,89 (с, 3H), 4,21 (д, 2H), 6,72 (т, 1H), 7,30 (д, 4H), 7,36 (дд, 1H), 7,42 (дд, 1H), 7,53 (дд, 1H), 7,82 (дд, 1H), 8,00 (дд, 1H), 8,10 (дд, 1H).
Пример 8
Метил 3-амино-2-[(2'-метоксикарбонилбифенил-4-ил)метиламино]-бензоат
Целевое соединение получают в виде бледно-желтого цвета сиропа из метил 2-[(2'-метоксикарбонилбифенил-4-ил)метиламино] -3- нитробензоата по существу таким же образом, как описано в Рабочем примере 4.
Выход = 79%.
1H-ЯМР (200 МГц, CHCl3) δ : 3,63 (с, 3H), 3,80 (с, 3H), 3,97 (ш.с, 2H), 4,22 (д, 2H), 6,40 (ш.с, 1H), 6,82-6,92 (м, 2H), 7,23-7,44 (м, 7H), 7,53 (дт, 1H), 7,79-7,83 (м, 1H).
ИК-спектр (чистое вещество) см-1: 3450, 3360, 2970, 1730, 1700, 1470, 1460, 1450, 1440, 1290, 1250, 1200, 770, 750.
Пример 9
Метил 2-этокси-1-[(2'-метоксикарбонилбифенил-4-ил)метил] - бензимидазол-7-карбоксилат
Целевое соединение получают в виде бесцветных листочков из метил 3-амино-2-[(2'-метоксикарбонилбифенил-4-ил)метиламино] бензоата по существу таким же образом, как описано в примере 5.
Выход = 72%, Т.пл. = 112-113oC.
1H-ЯМР (200 МГц, CHCl3) δ : 1,50 (т, 3H), 3,55 (с, 3H), 3,77 (с, 3H), 4,68 (к, 2H), 5,65 (с, 2H), 6,99 (д, 2H), 7,17 (д, 2H), 7,17 (т, 1H), 7,31-7,55 (м, 4H), 7,73 (дд, 1H), 7,77 (дд, 1H).
ИК-спектр (чистое вещество) см-1: 1730, 1710, 1545, 1470, 1430, 1380, 1340, 1320, 1270, 1250, 1235, 1210, 1120, 1080, 1030, 750, 740, 710.
Пример 10
Метил 2-[[N-трет-бутоксикарбониламино-N-(2'-цианобифенил-4- ил)метил] амино]-3-нитробензоат
Раствор метил 2-трет-бутоксикарбониламино-3-нитробензоата (0,6 г), 2-(4-бромметилфенил)бензонитрила (0,54 г) и K2CO3 (0,28 г) в ацетонитриле (10 мл) кипятят с обратным холодильником в течение 4-х часов и концентрируют досуха. К полученному остатку добавляют воду и смесь экстрагируют этилацетатом. Экстракт промывают водой, сушат и выпаривают досуха. Остаток очищают путем колоночной хроматографии на силикагеле с получением кристаллов. Перекристаллизация из смеси этилацетата с гексаном дает бесцветные призмы (0,83 г, 85%). Т.пл. 153-154oC.
1H-ЯМР (200 МГц, CDCl3) δ : 1,35 (с, 9H), 3,70 (с, 3H), 4,63 (д, 1H), 4,80 (1H, д), 7,23-7,29 (м, 3H), 7,39-7,53 (м, 6H), 7,59-7,67 (м, 1H), 7,75 (дд, 1H), 7,93 (дд, 1H), 7,99 (дд, 1H), 8,05 (дд, 1H), 8,11 (дд, 1H).
ИК-спектр (KBr) см-1: 2220, 1700, 1530, 1390, 1360, 1315, 1290, 1160, 765.
Пример 11
Метил 2-[[(2'-цианобифенил-4-ил)метил]амино]-3-нитробензоат
Смесь метил 2-[[N-трет-бутоксикарбонил-N-(2'- цианобифенил-4-ил)метил] амино] -3-нитробензоата (0,49 г) в 20%-ном растворе хлороводорода в этаноле (3 мл) и этилацетате (3 мл) перемешивают при комнатной температуре в течение 1 часа. После выпаривания растворителя, к остатку добавляют метанол и насыщенный водный раствор гидрокарбоната натрия, получая кристаллы. Кристаллы собирают путем отфильтровывания и перекристаллизуют из смеси хлороформа с метанолом, получая кристаллы бледно-желтого цвета (0,3 г, 77%). Т.пл. = 140-141oC.
1H-ЯМР (200 МГц, ДМСО-d6) δ : 3,84 (с, 3H), 4,26 (м, 2H), 6,86 (т, 1H), 7,46 (д, 2H), 7,54-7,65 (м, 4H), 7,79 (д, 1H), 7,95 (дд), 8,05-8,11 (м, 2H), 8,67 (т, 1H).
Пример 12
Метил 3-амино-2-[[(2'-цианобифенил-4-ил)метил]амино]бензоат
Смесь метил 2-[[(2'-цианобифенил-4-ил)метил]амино]-3- нитробензоата (10 г), FeCl3•6H2O (0,1 г), активированного древесного угля (1 г) в смеси из метанола (100 мл) с ТГФ (50 мл) кипятят с обратным холодильником в течение 30 минут. К реакционной смеси прикапывают гидразингидрат (7,2 мл) и смесь затем кипятят с обратным холодильником в течение 14 часов. Нерастворимый материал удаляют из реакционной смеси путем отфильтровывания и фильтрат концентрируют досуха. К полученному в результате остатку добавляют водный раствор бикарбоната натрия и смесь экстрагируют этилацетатом. Экстракт промывают водой, сушат и выпаривают досуха. Остаток очищают путем колоночной хроматографии на силикагеле, получая кристаллы. Перекристаллизация из диизопропилового эфира дает бледно-желтого цвета игольчатые кристаллы (6,0 г, 64%), т.пл. = 110-111oC.
1H-ЯМР (200 МГц, CDCl3) δ : 3,81 (с, 3H), 3,97 (ш.с, 2H), 4,23 (д, 2H), 6,39 (т. 1H), 6,84-6,93 (м, 2H), 7,26-7,55 (м, 8H), 7,64 (дт, 1H), 7,77 (дд, 1H).
Пример 13
Этил 1-[(2'-цианобифенил-4-ил)метил]-2-этоксибензимидазол- 7-карбоксил
К раствору этил 2-хлор-1-[(2'-цианобифенил-4-ил)метил] бензимидазол-7-карбоксилата (1,0 г) в этаноле (30 мл) добавляют этилат натрия (0,17 г) и смесь кипятят с обратным холодильником в течение 1 часа. Реакционную смесь концентрируют досуха. Полученный в результате остаток растворяют в этилацетате и полученный раствор промывают водой и затем высушивают. После удаления растворителя остаток очищают путем колоночной хроматографии на силикагеле, получая целевое соединение в виде бесцветных кристаллов (0,37 г, 70%).
1H-ЯMP-cпeктp и ИК-спектр показывают, что продукт, полученный согласно этому примеру, полностью идентичен таковому, полученному в примере 5.
Пример 14
Этил 2-этокси-1-[[2'-(1H-тетразол-5-ил)бифенил-4- ил]метил]-бензимидазол-7-карбоксилат
Смесь этил 1-[(2'-цианобифенил-4-ил)метил]-2-этоксибензимидазол- 7-карбоксилата (0,7 г) с триметилазидом олова (0,7 г) в толуоле (15 мл) кипятят с обратным холодильником в течение 4-х дней. Реакционную смесь концентрируют досуха и к остатку добавляют метанол (20 мл) и 1 н. раствор HCl (10 мл). Смесь перемешивают при комнатной температуре в течение 30 минут и доводят до pH 3-4 с помощью 1 н. раствора NaOH. После удаления растворителя остаток распределяют между хлороформом и водой. Органический слой промывают водой и сушат, и растворитель выпаривают досуха с получением сиропа. Сироп очищают путем колоночной хроматографии на силикагеле с получением кристаллов. Перекристаллизация из смеси этилацетат - бензол приводит к бесцветным кристаллам (0,35 г, 45%), т.пл. = 158-159oC.
Элементный анализ для C26H24N6O3:
рассчитано, % : C 66,65 H 5,16 N 17,94
найдено, %: C 66,61 H 5,05 N 17,84
1H-ЯМР (200 МГц, CDCl3) δ : 1,09 (т, 3H), 1,43 (т, 3H), 4,02 (к, 2H), 4,30 (к, 2H), 5,57 (с, 2H), 6,71 (д, 2H), 6,83-6,96 (м, 4H), 7,27-7,31 (м., 1H), 7,40 (дд., 1H), 7,55-7,66 (2H, м), 8,04-8,09 (м., 1H).
ИК-спектр (KBr) см-1: 1720, 1605, 1540, 1470, 1430, 1250, 1040, 750.
Пример 15
Этиловый эфир 2-[(2'-цианобифенил-4-ил)метил]амино-3- нитробензойной кислоты
К раствору этилового эфира 2-трет-бутоксикарбониламино-3- нитробензойной кислоты (20 г) в тетрагидрофуране (50 мл) добавляют гидрид натрия (60% масло, 2,8 г), производя перемешивание в условиях охлаждения льдом. К этой смеси затем добавляют бромистый 4-(2-цианобифенил)метил (18 г) и йодистый калий (0,36 г) с последующим перемешиванием в течение 15 часов при комнатной температуре. Реакционную смесь нагревают с обратным холодильником в течение 4 часов. Растворитель отгоняют, а остаток экстрагируют водой (250 мл) и простым эфиром (200 мл). Органический слой концентрируют с образованием желтого масла, которое растворяют в смеси трифторуксусной кислоты (60 мл) и метиленхлорида (40 мл), и этот раствор перемешивают в течение одного часа при комнатной температуре. Реакционную смесь концентрируют до сухого состояния и к концентрату добавляют простой этиловый эфир (200 мл), в результате чего образовались кристаллы. Эти кристаллы собирают фильтрованием, промывают простым эфиром и сушат, что позволило получить бледно-желтые кристаллы (22,1 г, 85%), температура плавления 119-120oC.
Спектр 1H-ЯМР (90 МГц, CDCl3) δ : 1,37 (3H, т.), 4,23 (2H, с.), 4,37 (2H, кв), 6,37 (1H, т.), 7,33-7,83 (9H, м.), 7,97-8,20 (2H, м.).
Инфракрасный спектр (нуджол) см-1: 3280, 2220, 1690, 1575, 1530, 1480, 1450, 1255, 1125, 1105, 755.
Пример 16
Этиловый эфир 3-амино-2-[(2'-цианобифенил-4-ил)метил] амино-бензойной кислоты
К раствору этилового эфира 2-[(2'-цианобифенил-4-ил)метил] амино-3-нитробензойной кислоты (5,5 г) в тетрагидрофуране (50 мл) добавляют скелетный никелевый катализатор гидрирования (5 г). Каталитическое восстановление производят при комнатной температуре и атмосферном давлении. Катализатор отфильтровывают, а фильтрат концентрируют и с образованием желтого масла (5 г, количественное определение).
Спектр 1H-ЯМР (90 МГц, CDCl3•D2O): 1,30 (3H, т.), 4,23 (2H, с.), 4,27 (2H, кв.), 6,87-7,03 (2H, м.), 7,33-7,87 (9H, м.).
Инфракрасный спектр (чистый) см-1: 3435, 3350, 2980, 1690, 1615, 1465, 1365, 1280, 1240, 1215, 1190, 1065, 755.
Экспериментальный пример 1 (конечный продукт: соединение формулы I)
Ингибирование связывания ангиотензина-II с рецептором ангиотензина (Метод)
В эксперименте по ингибированию связывания ангиотензина-II (A-II) с A-II-рецептором руководствуются модификацией метода Douglas и др. (Endocrinology, 102, 685-696 (1978)). Мембранную фракцию A-II-рецептора готовят из бычьей коры надпочечника.
Производное бензимидазола формулы I (10-6 М или 10-7 М) и 125I-ангиотензин (125I-A-II) (1,85 kBq/50 мкл) добавляют к мембранной фракции рецептора и смесь инкубируют при комнатной температуре в течение 1 часа. Связанный с рецептором и свободный 125I-A-II разделяют через посредство фильтра (фильтр Whatman GF/B) и измеряют радиоактивность связанного с рецептором 125I-A-II.
Результаты представлены в таблице.
Экспериментальный пример 2 (конечный продукт: соединение формулы I)
Ингибирующий эффект соединения настоящего изобретения в отношении сосудосуживающего воздействия A-II
(Метод)
Используют Jcl: SD-крыс (в возрасте 9 недель, самцы). В предшествующий эксперименту день этим животным вставляют канюли в бедренную артерию и вену при анестезии с помощью пентобарбитала натрия. Животных не кормят, за исключением того, что дают свободный доступ к питьевой воде, до начала эксперимента. Точно в день проведения эксперимента артериальную канюлю соединяют с датчиком кровяного давления, и среднее кровяное давление регистрируют с помощью комбинированного метеорографа. До введения лекарственного средства, измеряют сосудосуживающее воздействие за счет внутривенного введения A-II (100 нг/кг) в качестве контроля. Лекарственные средства вводят орально, затем, в каждый момент измерения, внутривенно вводят A-II, и таким же образом измеряют сосудосуживающее воздействие. Путем сравнения сосудосуживающего воздействия до и после введения лекарственного средства, оценивают ингибирование, в процентах, за счет лекарственного средства индуцированного A-II сосудосуживающего воздействия.
Результаты представлены в таблице.


Предложены эфиры N-(бифенилметил)аминобензойкой кислоты общей формулы  где R2 представляет низшую (С1-С4)алкоксикарбонильную группу, R3 представляет низшую (С1-С4)алкоксикарбонильную группу или -CN, Q2 представляет -NO2 или -NH2, когда Q1 представляет Н, или Q2 означает -NO2, когда Q1 означает - COOR, где R означает низший (С1-С4) алкил, или соль этого соединения. Для получения указанных соединений соответствующий сложный эфир карбаминовой кислоты подвергают алкилированию алкилирующим агентом, включающим атом галогена, после чего при необходимости осуществляют снятие защитной группы с последующим необязательным восстановлением группы -NQ1 до NH-группы. Указанные соединения могут применяться в качестве промежуточных продуктов в синтезе производных бензимидазола, которые используют для получения лекарственных средств. 2 с. и 1 з.п. ф-лы, 1 табл.
где R2 представляет низшую (С1-С4)алкоксикарбонильную группу, R3 представляет низшую (С1-С4)алкоксикарбонильную группу или -CN, Q2 представляет -NO2 или -NH2, когда Q1 представляет Н, или Q2 означает -NO2, когда Q1 означает - COOR, где R означает низший (С1-С4) алкил, или соль этого соединения. Для получения указанных соединений соответствующий сложный эфир карбаминовой кислоты подвергают алкилированию алкилирующим агентом, включающим атом галогена, после чего при необходимости осуществляют снятие защитной группы с последующим необязательным восстановлением группы -NQ1 до NH-группы. Указанные соединения могут применяться в качестве промежуточных продуктов в синтезе производных бензимидазола, которые используют для получения лекарственных средств. 2 с. и 1 з.п. ф-лы, 1 табл.

где R2 представляет низшую (С1-С4)-алкоксикарбонильную группу;
R3 представляет низшую (С1-С4)-алкоксикарбонильную группу или - СN;
Q2 представляет - NО2 или - NН2, когда Q1 представляет Н, или Q2 означает - NО2, когда Q1 означает - СООR, где R означает низший (С1-С4)алкил,
или соль этого соединения.
где значения R2, R3, Q1, Q2 даны в п.1,
или их солей, отличающийся тем, что сложный эфир карбаминовой кислоты общей формулы
где R и R2 имеют значения, указанные в п.1, подвергают реакции алкилирования с алкилирующим агентом формулы
где W означает атом галогена;
R3 имеет значения, указанные в п.1,
после чего полученное соединение формулы
где значения R, R2 и R3 указаны выше,
необязательно подвергают реакции снятия защитной группы для получения соединения формулы
где значения R2 и R3 указаны выше,
с последующим, необязательным, восстановлением полученного соединения до соединения формулы
где значения R2 и R3 указаны выше.
| US 4880804 A, 1987 | |||
| УСТРОЙСТВО ДЛЯ ОТБОРА КЕРНА | 0 |
|
SU324377A1 |
| СПОСОБ РАЗЖИЖЕНИЯ ШЛАКОВ ПРИ ПЛАВКЕ В ИПДУКЦИОИИЫХ ПЕЧАХ | 0 |
|
SU363756A1 |
| US 4355040 A, 1982 | |||
| Кристаллизатор | 1988 |
|
SU1535566A1 |
| Гидроколонна | 1940 |
|
SU57873A1 |
| SU 110072 A, 1953 | |||
| 0 |
|
SU189444A1 | |
Авторы
Даты
2000-01-10—Публикация
1995-10-30—Подача