Областью данного изобретения являются аналоги полинуклеотидов, содержащие модифицированные сахара.
Предпосылки изобретения
Терапевтическое применение олигонуклеотидов является очень важной областью и описано, например, в (1) Zamecnik Р.С. and Stephenson M.L. Proc. Natl. Acad. Sci. U.S.A. (1978), 75, 280, 285; (2) Uhlmann E. and Peyman A. Chemical Reviews (1990), 90, 543-584; (3) Goodchild J. Bioconjugate chemistry (1990), 1, 165-187; и (4) Crooke S.T. and Lebleu B. "Antisense Research and Applications", CRC Press (1993). Специфическое связывание антисмысловых полинуклеотидов с представляющими интерес ДНК- или РНК-мишенями может вызывать потерю функций, связанных с ДНК или РНК, таких как репликация, транскрипция или трансляция, обеспечивая, таким образом, механизм контроля таких заболеваний, как рак и вирусная инфекция. Вследствие этого связывание антисмысловых олигонуклеотидов с мишенью может быть применено для изменения генной экспрессии во многих случаях, например для вмешательства в жизненные циклы вирусов или рост раковых клеток (Stein С.A., Cheng Y.C. Science (1993), 261, 1004-1012). Кроме этого, некоторые олигонуклеотиды хорошо связываются с белковыми мишенями, действуя таким образом как ингибиторы ферментов. Bock и др. описывают олигонуклеотиды, ингибирующие катализируемое тромбином человека образование фибриновых сгустков in vitro (Bock L.C., Griffin L. C. , Latham J.A., Vermaas E.H., Toole J.J. Nature (1992), 355, 564-566). Ecker и др. описывают различные олигонуклеотиды, ингибирующие симплекс вирус герпеса человека в количествах менее 1,0 мкмоля. Полинуклеотиды, обладающие свойствами ингибиторов ферментов, могут без труда быть выявлены с помощью комбинаторной технологии (Ecker D.J., Vickers T.A., Hanecak R., Driver V., Anderson К. Nucleic Acids Res. (1993), 21, 1853-1856).
Сообщалось, что олигонуклеотид, содержащий 5'-C-метил-разветвленный нуклеозид, показывает повышенную устойчивость к нуклеазам (Saha А.К. et al., poster in 206th ACS Meeting, Chicago, 1993). Сообщалось, что олигонуклеотид, содержащий 2'-O-метилнуклеозиды, также обладает улучшенной стабильностью в отношении действия нуклеаз и повышенным сродством к РНК (a. Inoue Н., Hayase Y. , Imura A., Iwai S., Miura K., Ohtsuka E. Nucleic Acids Res. (1987), 15, 6131; b. Shibahara S., Mukai S., Morisawa H., Nakashima H., Cobayashi S., Yamamoto N. Nucleic Acids Res. (1989), 17, 239). Сообщалось, что олигонуклеотид, содержащий 1'-замещенный нуклеозид, обладает некоторой устойчивостью к нуклеазам (Ono А., Dan А., Matsuda A. Bioconjugate Chemistry (1993), 4, 499-508).
Кроме наличия специфического сродства к комплементарной полинуклеотидной последовательности-мишени антисмысловые олигонуклеотиды хорошо удовлетворяют требованиям, необходимым для терапевтического применения, таким, например, как эффективность действия, биологическая доступность, низкая токсичность и низкая стоимость. Поскольку олигонуклеотиды, имеющие природный фосфодиэфирный остов, подвержены действию нуклеаз и с трудом проникают через клеточную мембрану, исследователи предприняли попытки осуществить его модификации, улучшающие устойчивость к действию нуклеаз и поглощение олигонуклеотидов клеткой. Главный недостаток аналогов олигонуклеотидов, используемых в качестве антисмысловых, заключается в том, что модифицированные межнуклеотидные связи исключают активацию ими РНКазы H, расщепляющей цепь РНК, с которой связан аналог олигонуклеотида. В связи с этим желательно получение таких полинуклеотидных аналогов, которые обладали бы повышенной устойчивостью к действию нуклеаз и клеточной поглощаемостью, сохраняя способность активировать РНКазу Н.
Краткое описание изобретения
Настоящее изобретение охватывает различные новые модифицированные по сахарной составляющей нуклеозиды и соответствующие модифицированные по сахарной составляющей олигонуклеотиды, обладающие свойствами, превосходящими свойства природных РНК- и ДНК-олигонуклеотидов при использовании их в качестве антисмысловых, в диагностике или для других целей.
Соединения по изобретению включают различные нуклеозиды, которые модифицировали таким образом, что они содержат замещения в положениях C1', C3', C4' или C5' сахарной составляющей нуклеозида.
Другой аспект данного изобретения заключается в получении олигонуклеотидов, содержащих один или более нуклеозид с модифицированной в соответствии с изобретением сахарной составляющей.
Другой аспект данного изобретения заключается в получении конъюгатов олигонуклеотидов, содержащих один или большее число нуклеозидов по изобретению с модифицированной сахарной составляющей.
Краткое описание рисунков
На фиг.1 изображены олигонуклеотиды по изобретению, в которых нуклеозидные заместители замещают положительно заряженной группировкой.
На фиг.2 изображена реакционная схема 1 для синтеза 3'-C-разветвленного тимидина.
На фиг.3 изображена реакционная схема 2 для синтеза 3'-C-разветвленного тимидина.
На фиг. 4 изображена реакционная схема 3 для синтеза 4'-C-разветвленного тимидина.
На фиг. 5 изображены дополнительные аспекты реакционной схемы 3 для синтеза 4'-C-разветвленного тимидина.
На фиг. 6 изображена реакционная схема 4 для синтеза 4'-C-разветвленного тимидина.
На фиг. 7 изображена реакционная схема 5 для синтеза 5'-C-разветвленного тимидина.
На фиг. 8 изображена реакционная схема 6 для синтеза 5'-C-разветвленного тимидина.
На фиг. 9 изображены дополнительные аспекты реакционной схемы 6 для синтеза 5'-C-разветвленного тимидина.
На фиг. 10 изображена реакционная схема 7 для синтеза 5'-C-разветвленного тимидина.
На фиг. 11 изображена реакционная схема 8 для синтеза 5'-C-разветвленного тимидина.
На фиг. 12 изображена схема, иллюстрирующая стереохимическое строение соединения 44 и других соединений.
На фиг. 13 изображена реакционная схема 9 для синтеза 1'-C-разветвленного тимидина.
На фиг. 14 изображена реакционная схема 10 для синтеза 1'-C-разветвленного тимидина.
Сокращения и определения
DMTr = 4,4'-диметокситритил
СЕРА = 2-цианоэтил-(N,N'-диизопропил)фосфорамидо
TBDMS = трет-бутилдиметилсилил
Ас = ацетил
TBDMSM = трет-бутилдиметилсилоксиметил
N3 = азидо
CF3CO = трифторацетил
Tf = трифторметансульфонил
THP = тетрагидропиранил
OTs = тозил
Используемый здесь термин "нуклеозид" означает соединение, содержащее пуриновое или пиримидиновое основание (или его производное), ковалентно связанное с 5-углеродным циклическим сахаром (фуранозой), например рибозой, 2'-дезоксирибозой и 2',3'-дидезоксирибозой. Термин "нуклеозид" применяется широко, включая модифицированные по сахарной составляющей нуклеозиды по изобретению.
Используемый здесь термин "полинуклеотид" означает полимеры, содержащие две или большее число нуклеозидных составляющих, в которых каждая нуклеозидная составляющая соединена с одной (в случае концевой) или двумя другими (в случае внутренней) нуклеозидными составляющими посредством межнуклеозидных связей, таких как фосфодиэфирные связи, пептидные связи, фосфонатные связи, фосфоротиоатные связи и им подобные. Примерами полинуклеотидов являются ДНК и РНК. Используемый здесь термин "полинуклеотид", если не оговорено особо, применяется широко, включая модифицированные по сахарной составляющей полинуклеотиды по изобретению.
Используемый здесь термин "олигонуклеотид" относится к относительно небольшим полинуклеотидам, например полинуклеотидам длиной от 2 до приблизительно 50 пар оснований; однако олигонуклеотид может быть и значительно длиннее.
Используемый здесь термин "гидроксилблокирующая группа" хорошо понятен специалистам в области органической химии. Примеры гидроксилблокирующих групп и других блокирующих групп могут быть найдены (среди прочих источников) в работе Greene and Wuts. "Protective Groups in Organic Synthesis", John Wiley & Sons, NY, NY (1991).
Используемые здесь термины "основание" и "нуклеозидное основание" относятся к гетероциклическим нуклеотидным основаниям природных нуклеиновых кислот, таким как аденин, цитозин, гипоксантин, урацил, тимин, гуанин, и их аналогам, включая неприродные основания, способным к образованию пар с природными основаниями. Подобные неприродные гетероциклические основания включают, но этим они не ограничиваются, аза- и деазапиримидиновые аналоги, аза- и деазапуриновые аналоги равно как и другие аналоги гетероциклических оснований, в которых один или несколько атомов углерода и азота пуринового или пиримидинового циклов замещены гетероатомами, например атомами кислорода, серы, селена, фосфора и им подобными.
Описание конкретных воплощений изобретения
Согласно данному изобретению предложены новые нуклеозиды и олигонуклеотиды, обладающие свойствами, делающими их пригодными для применения в антисмысловых, диагностических и других методах, использующих олигонуклеотиды. Соединения по изобретению включают различные нуклеозиды, модифицированные таким образом, что в них введены замещения в положениях C1', C3', C4' или C5' сахарной составляющей нуклеозида. Нуклеозиды по изобретению могут включать один или более заместителей, делающих нуклеозид пригодным для твердофазного синтеза или родственных методик синтеза, например рассматриваемые нуклеозиды могут находиться в форме фосфорамидитных производных, содержащих 5'-диметокситритильную или другие защитные группы. Согласно настоящему изобретению также предложены олигонуклеотиды, содержащие в составе нуклеиновой кислоты один или большее число нуклеозидов, модифицированных по сахарной составляющей в соответствии с данным изобретением.
Добавление соответствующего заместителя в положения C3' или C5' нуклеозида изменяет окружение фосфодиэфирной связи олигонуклеотидов, содержащих подобные модифицированные по сахарной составляющей нуклеозиды. Предпочтительным является использование в положениях C3' или C5' объемных заместителей, ингибирующих нежелательные взаимодействия с ферментами или их активными центрами. Такие C3'- и C5'-заместители должны делать фосфодиэфирную связь олигонуклеотидов недоступной для действия многих ферментов. В результате присутствия заместителей олигонуклеотиды, содержащие подобные C3'- или C5'-разветвленные нуклеозиды, могут быть более устойчивыми к действию нуклеаз по сравнению с ДНК и РНК. Заместители в C1' и C4' положениях нуклеозидов могут оказывать такое же благоприятное влияние, как заместители в положениях C3' и C5'. В тех воплощениях изобретения, в которых рассматриваемые олигонуклеотиды содержат положительно заряженные аминоалкильные производные сахарных составляющих, их общий отрицательный заряд при физиологических условиях уменьшен настолько, что двойная спираль, образованная с участием по меньшей мере одной нити подобного олигонуклеотида, может быть более стабильной по сравнению с соответствующим немодифицированным олигонуклеотидом (см. фиг.1). Таким образом, в тех воплощениях данного изобретения, которые включают аминоалкильные производные сахарных составляющих или похожие положительно заряженные производные, вследствие наличия положительного заряда может быть достигнуто улучшенное связывание при гибридизации рассматриваемых олигонуклеотидов с полинуклеотидной мишенью. Специалистам в данной области следует принимать во внимание, что изложенные выше предположения, являясь руководством для использования и создания дополнительных воплощений данного изобретения, не нуждаются в коррекции с целью применения или создания настоящего изобретения.
Одним воплощением данного изобретения являются нуклеозиды, модифицированные по сахарной составляющей, следующей формулы: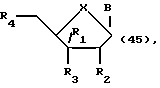
где R1 может быть алкилом, аралкилом, арилом, замещенным алкилом, замещенным аралкилом, замещенным арилом, в которых заместителями могут быть NO2, CN, N3, COOEt, ОН, SH, CONH2, CONHR, CONR2, COOH, OAC, NH2, NHAc, NMe2, CF3CONH, OR, SR, SO2CH3, CF3, F, Cl, Br, I, OTs, +NMe3, CH=CHR, C=CR, где R представляет собой алкил; R2 может быть H, ОН, алкокси-, арилоксигруппой; R3 может быть ОН, O-CEPA; R4 может быть ОН или гидроксилблокирующей группой; В представляет собой гетероциклическое нуклеозидное основание; X может быть О, S, NH или CH2.
Гетероциклическое нуклеозидное основание В модифицированных по сахарной составляющей нуклеозидов по изобретению, как представлено в формулах 45, 46, 47, 48, 49 и 50, может быть любым гетероциклическим нуклеозидным основанием как природным, так и неприродным. Так, гетероциклическими нуклеозидными основаниями, которые могут являться составляющими модифицированных в соответствии с настоящим изобретением по сахарной компоненте нуклеозидов, могут быть пурины (например, аденин, гуанин или ксантин), пиримидины (например, тимин, урацил, цитозин) и их гетероциклические аналоги и таутомеры. Подходящими гетероциклическими основаниями, которые могут служить в качестве составляющей нуклеозидных соединений по изобретению, являются те основания, которые могут быть введены в одну нить двунитевого полинуклеотида таким образом, чтобы имелась возможность поддерживать структурные взаимодействия пар оснований с природными основаниями комплементарной полинуклеотидной нити. Кроме этого, составляющая нуклеозидных соединений по изобретению, соответствующая основанию, соединена с сахарной составляющей в таком положении основания, при котором возможно поддержание, как обсуждалось выше, структурных взаимодействий между парами оснований.
Другое воплощение данного изобретения охватывает нуклеозиды формулы: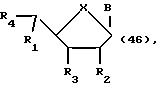
где R1 может быть алкилом, аралкилом, арилом, замещенным алкилом, замещенным аралкилом, замещенным арилом, в которых заместителями могут быть NO2, CN, N3, COOEt, ОН, SH, CONH2, CONHR, CONR2, COOH, OAC, NH2, NHAc, NMe2, CF3CONH, OR, SR, SO2Me, CF3, F, Cl, Br, I, OTs, +NMe3, CH=CHR, C=CR, где R представляет собой алкил; R2 может быть H, ОН, алкокси-, арилоксигруппой; R3 может быть ОН, O-TBDMS, O-CEPA; R4 может быть ОН, CHO или гидроксилблокирующей группой; В представляет собой гетероциклическое нуклеозидное основание; X может быть О, S, NH или CH2; где атом углерода, соединенный с обоими R1 и R4 заместителями, находится или в R или в S-конфигурации.
Другим воплощением данного изобретения являются нуклеозиды формулы: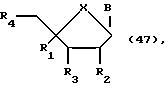
где R1 может быть алкилом, аралкилом, арилом, замещенным алкилом, замещенным аралкилом, замещенным арилом, в которых заместителями могут быть NO2, CN, N3, COOEt, ОН, SH, CONH2, CONHR, CONR2, COOH, OAC, NH2, NHAc, NMe2, CF3CONH, OR, SR, SO2Me, CF3, F, Cl, Br, I, OTs, +NME3, CH=CHR, C=CR, где R представляет собой алкил; R2 может быть H, ОН, алкокси-, арилоксигруппой; R3 может быть ОН, OTBDMS, O-CEPA; R4 может быть ОН или гидроксилблокирующей группой; В представляет собой гетероциклическое нуклеозидное основание; X может быть О, S, NH или CH2.
Другой аспект изобретения охватывает нуклеотиды формулы: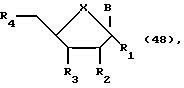
где R1 может быть алкилом, аралкилом, арилом, замещенным алкилом, замещенным аралкилом, замещенным арилом, в которых заместителями могут быть NO2, CN, N3, COOEt, ОН, SH, CONH2, CONHR, CONR2, COOH, OAC, NH2, NHAc, NMe2, CF3CONH, OR, SR, SO2Me, CF3, F, Cl, Br, I, OTs, +NMe3, CH=CHR, C=CR, где R представляет собой алкил; R2 может быть H, ОН, алкокси-, арилоксигруппой; R3 может быть ОН, O-MBn, O-CEPA; R4 может быть ОН или гидроксилблокирующей группой; В представляет собой гетероциклическое нуклеозидное основание; X может быть О, S, NH или CH2.
Еще один аспект данного изобретения охватывает различные эпоксипроизводные модифицированных по сахарной составляющей нуклеозидов по изобретению следующих формул: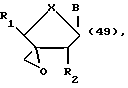
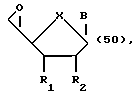
где R выбран из CH2OH, CH2ODMTr, CHO, COOH и COOEt; а X выбран из О и CH2. Эпоксиды могут находиться в любой из двух возможных стереохимических ориентаций.
Модифицированный по сахарной составляющей нуклеозид по изобретению может быть синтезирован в соответствии с примерами, приведенными в разделе "Примеры" настоящей заявки. Лицо с обычной квалификацией в области органической химии может, опираясь на приведенный здесь пример, синтезировать многочисленные соединения по изобретению, для которых не приведены подробные описания синтезов.
Олигонуклеотиды, содержащие нуклеозиды с модифицированными сахарными составляющими
Полинуклеотиды по изобретению содержат один или большее число нуклеозидов с модифицированной в соответствии с данным изобретением сахарной составляющей, в которых модифицированный нуклеозид соединен либо с другим модифицированным нуклеозидом, либо с немодифицированным нуклеозидом посредством межнуклеозидной связи. Строение модифицированных нуклеозидов, входящих в состав олигонуклеотидов по изобретению, охватывается формулами 45, 46, 47 и 48. Аналоги полинуклеотидов по изобретению не ограничиваются числом возможных нуклеозидных субъединиц индивидуального полинуклеотидного аналога, тем не менее в общем более удобно синтезировать короткие полинуклеотидные аналоги, например аналоги полинуклеотидов, содержащие менее 50 оснований.
Индивидуальные нуклеозиды по изобретению могут быть соединены друг с другом посредством межнуклеозидных связей таким образом, чтобы получались новые олигонуклеотиды с желаемой последовательностью нуклеозидных оснований. Межнуклеозидные связи могут быть связями между C3' и C5' или между C2' и C5'. Используемый здесь термин "межнуклеозидная связь" относится не только к фосфодиэфирной связи типа межнуклеозидной связи в ДНК (дезоксирибонуклеиновой кислоте) и РНК (рибонуклеиновой кислоте), но также ко множеству других связей, удовлетворяющих тем же структурным требованиям, что и фосфодиэфирные связи в ДНК и РНК. Примеры соединений с другими межнуклеозидными связями, пригодными для объединения олигонуклеотидов по изобретению, включают фосфоротиоаты, метилфосфонаты, фосфородитиоаты, борфосфонаты, селенфосфонаты, фосфорамидаты, ацетамидаты и им подобные. Описания синтеза и применения соединений с различными межнуклеозидными связями могут быть найдены среди прочего в следующих публикациях: патент США 5256775, международная публикация WO 93/24507, международная публикация WO 92/05186, патент США 5264562, международная публикация WO 92/02534, международная публикация WO 94/06811, международная публикация WO 93/17717, патент США 5212295, патент США 5292875, патент США 5218103, патент США 5166387, патент США 5151516, патент США 4814448, патент США 4814451, патент США 4096210, патент США 4094873, патент США 4092312, патент США 4016225, патент США 4007197 и т.п.
Полинуклеотиды по изобретению с желаемой последовательностью оснований могут быть без труда получены с помощью методик синтеза нуклеиновых кислот, хорошо известных специалистам средней квалификации в области органической химии. Предпочтительным при синтезе полинуклеотидов по изобретению является использование фосфорамидного способа с целью включения одного или более новых нуклеозидов по изобретению в полинуклеотидный аналог. Разветвленные заместители в положениях C3' или C5' нуклеозидов могут, в зависимости от их размеров, снижать скорость реакции присоединения. Вследствие этого для некоторых нуклеозидов с разветвленными заместителями большого объема может потребоваться увеличение времени проведения реакции присоединения в 10 или более раз. При необходимости для увеличения скорости реакции присоединения можно также использовать повторное связывание со свежими реагентами или проведение реакции с реагентами в более высоких концентрациях. По окончании синтеза олигонуклеотиды можно обрабатывать точно так же, как это делается для стандартных немодифицированных олигонуклеотидов, т.е. отщепить от нерастворимой подложки, используя 30% аммиак, провести снятие защитных групп при 55oC в течение 8 ч и очистить с помощью обращенно-фазовой ВЭЖХ.
Для проверки как чистоты олигонуклеотидов, так и факта включения в них желаемых нуклеозидов с модифицированной сахарной составляющей, очищенные олигонуклеотиды могут быть охарактеризованы путем анализа продуктов ферментативного расщепления, проведенного с использованием для расщепления олигонуклеотидов таких ферментов, как фосфодиэстераза змеиного яда и щелочная бактериальная фосфатаза. Продукты деградации затем могут быть проанализированы с помощью ВЭЖХ (или другой методики разделения) в сравнении с истинными нуклеозидными образцами. Структура очищенных олигонуклеотидов также может быть проверена с помощью масс-спектрометрии, с использованием такой методики, как электрораспыление.
Другим аспектом данного изобретения являются конъюгаты олигонуклеотидов с модифицированными сахарными составляющими, охватываемых изобретением. Амино-, гидрокси-, тио- или карбоксиалкилсодержащие линкеры могут быть присоединены в положениях C1', C3', C4' и C5' рассматриваемых нуклеозидов, обеспечивая таким образом сайт для конъюгации последних с представляющим интерес соединением. Линкеры в положениях C1' и C3' могут быть использованы для направления конъюгированного соединения в малые бороздки двунитевой молекулы нуклеиновой кислоты, в то время как линкеры, присоединенные в положение C4', - в большие бороздки. Линкеры, связанные с положением C5', можно использовать для направления конъюгированного соединения как в большие, так и в малые бороздки двунитевой молекулы нуклеиновой кислоты в зависимости от стереохимии линкера в данном положении. С использованием линкеров большое разнообразие функциональных соединений, таких как искусственные нуклеазы, сшивающие агенты, интеркалирующие соединения и репортерные молекулы, могут быть присоединены и размещены в желаемом месте.
Применимость и воздействие
В силу того, что олигонуклеотиды по изобретению способны проявлять значительную активность в отношении связывания с однонитевой и двунитевой нуклеиновой кислотой-мишенью с образованием дуплексов, триплексов и других форм стабильной ассоциации с природными полинуклеотидами и их структурными аналогами, данные олигонуклеотиды по изобретению могут быть применены в большинстве методик, использующих обычные олигонуклеотиды. Так, олигонуклеотиды по изобретению могут применяться, например, как полинуклеотидные гибридизационные зонды, праймеры для полимеразной цепной реакции (и схожих циклических амплификационных реакций), праймеры для секвенирования и т.д. Олигонуклеотиды по изобретению также могут быть использованы в диагностике и терапии заболеваний. Терапевтические применения олигонуклеотидов по изобретению включают специфическое ингибирование экспрессии генов (или ингибирование трансляции последовательностей РНК, кодирующих такие гены), связанных или с возникновением, или с поддержанием патологического состояния, за счет использования этих олигонуклеотидов в качестве антисмысловых. Олигонуклеотиды по изобретению могут применяться для осуществления антисмыслового ингибирования многочисленных генетических мишеней. Типичные гены или кодируемые теми генами РНК, которые могут быть мишенями для антисмыслового связывания олигонуклеотидов по изобретению, включают олигонуклеотиды, кодирующие ферменты, гормоны, белки крови, трансмембранные белки, молекулы адгезии (LFA-1, GPIIb/IIIa, ELAM-1, VACM-1, ICAM1, E-селектин и им подобные), молекулы рецепторов, включающие рецепторы цитокинов, цитокины (IL-1, IL-2, IL-3, IL-4, IL-6 и им подобные), онкогены, факторы роста и интерлейкины. Гены-мишени или соответствующие РНК могут быть связаны с любым из патологических состояний, таких как состояния, ассоциированные с воспалением, сердечно-сосудистыми заболеваниями, иммунными реакциями, раком, вирусными инфекциями, бактериальными инфекциями, дрожжевыми инфекциями, инфекциями-паразитами и им подобными.
Олигонуклеотиды по настоящему изобретению пригодны для терапевтического применения как in vivo, так и ex vivo. Показания на применение ex vivo включают обработку клеток, таких как клетки костного мозга или периферической крови, в таких состояниях, как лейкоз (хронический миелогенный лейкоз, острый лимфолейкоз) или вирусная инфекция. Гены-мишени или молекулы РНК, кодируемыми теми генами, которые могут служить мишенями для противораковых лекарств, включают онкогены, как, например, ras, k-ras, bcl-2, c-myb, bcr, c-myc, c-abl, или сверхэкспрессируемые последовательности типа mdm2, онкостатина М, IL-6 (саркома Капоши), HER-2 и транслокации, как, например, bcr-abl. Подходящими мишенями являются также последовательности вирусных генов или молекул РНК, ими кодируемых, как, например, гены полимеразы или обратной транскриптазы герпес-вирусов типа CMV, HSV-1, HSV-2, ретровирусов типа HTLV-1, HIV-1, HIV-2 или других ДНК- или РНК-содержащих вирусов, как, например, HBV, HPV, VZV, вирус гриппа, аденовирусы, флавивирусы, риновирусы и им подобные. Специфически связывающиеся олигонуклеотиды могут применяться в сочетании с другими терапевтическими средствами. Другие терапевтические применения олигонуклеотидов по изобретению включают: (1) модуляцию воспалительных ответов с помощью регуляции экспрессии таких генов, как IL-1 рецептор, IL-1, ICAM-1 или E-селектин, играющих роль в опосредовании воспаления и (2) модуляцию клеточной пролиферации в таких состояниях, как артериальная окклюзия (рестеноз) после пластической операции на сосудах, с помощью регуляции экспрессии (а) ростовых или митогенных факторов, как, например, немышечный миозин, myc, fox, PCNA, PDGF или FGF или других рецепторов, или (б) клеточных факторов пролиферации типа c-myb. Другие подходящие факторы пролиферации или сигнальные факторы трансдукции, как, например, TGFa, IL-6, gINF, протеинкиназа С, тирозинкиназы (например, p210, p190) могут служить мишенью при лечении псориаза и других состояний. Кроме этого, EGF-рецептор, TGFa или MHC аллели могут служить мишенью при лечении аутоиммунных заболеваний.
Олигонуклеотиды по изобретению также могут быть с успехом применены для замены обычных олигонуклеотидов во многих нетерапевтических методиках, таких как детектирование последовательностей нуклеиновых кислот методом гибридизации, полимеразная цепная реакция и им подобных. Эти нетерапевтические методики хорошо известны специалистам средней квалификации в области молекулярной биологии и могут быть найдены, например, в Sambrook et al. "Molecular Cloning Techniques", 2nd Edition, Clod Spring Harbor (1989).
Доставка олигонуклеотидов по изобретению в клетки может быть облегчена любым соответствующим способом, включающим использование трансфекции с фосфатом кальция, DMSO, глицерином или декстраном, электропорации или катионо-анионных и/или нейтральных липидных составов или липосом методами, описанными в литературе (Международные публикации NN WO 90/14074, WO 91/16024, WO 91/17424, патент США 4897355). Олигонуклеотиды могут быть введены в клетки с помощью комплексообразования с катионными липидами, такими как DOTMA (которые могут образовывать, а могут и не образовывать липосомы), а такие комплексы затем приводят в контакт с клетками. Соответствующие катионные липиды включают, но этим не ограничиваются, N-(2,3-ди(9-(Z)-октадеценилоксил))-проп-1-ил-N, N, N-триметиламмоний (DOTMA) и его соли, 1-O-олеил-2-O-олеил-3-диметиламинопропил -β- гидроксиэтиламмоний и его соли и 2,2-бис(олеилокси)-3-(триметиламмонио)пропан и его соли.
Усиленная доставка в клетки олигонуклеотидов по изобретению может также быть опосредована использованием (i) вирусов, таких как вирус Sendai (Bartzatt R. Biotechnol. Appl. Biochem. (1989), 11, 133-135) или аденовирус (Wagner E. et al. Proc. Natl. Acad. Sci. USA (1992), 89, 6099-6013); (ii) полиаминных или поликатионных конъюгатов с применением соединений типа полилизина, протамина или Na,N12-бис(этил)спермина (Wagner E. et al. Proc. Natl. Acad. Sci. USA (1991), 88, 4255-4259; Zenke M. et al. Proc. Natl. Acad. Sci. USA (1990), 87, 3655-3659; Chank В.К. et al. Biochem. Biophys. Res. Commun. (1988), 157, 264-270; патент США 5138045); (iii) липополиаминных комплексов с применением соединений типа липоспермина (Behr J.-P. et al. Proc. Natl. Acad. Sci. USA (1989), 86, 6982-6986; Loeffler J.P. et al. J. Neurochem. (1990), 54, 1812-1815); (iv) анионных, нейтральных или pH-чувствительных липидов с применением соединений, включающих анионные фосфолипиды типа фосфатидилглицерина, кардиолипина, фосфатидной кислоты или фосфатидилэтаноламина (Lee K.-D. et al. Biochem. Biophys. ACTA (1992), 1103, 185-197; Cheddar G. et al. Arch. Biochem. Biophys. (1992), 294, 188-192; Yoshimura Т. et al. Biochem. Int. (1990), 20, 697-706); (v) конъюгатов с соединениями типа трансферрина или биотина или (vi) конъюгатов с белками (включающими альбумин или антитела), гликопротеинами или полимерами (включающими полиэтиленгликоль), усиливающими фармакокинетические свойства рассматриваемых олигонуклеотидов. Используемый здесь термин "трансфекция" относится к любому методу, пригодному для доставки олигонуклеотидов в клетки. Любой реагент типа липида или любой агент типа вируса, который может быть использован при проведении трансфекции, называется здесь общим термином "усиливающий проницаемость агент". Доставка олигонуклеотидов в клетки может осуществляться посредством котрансфекции с другими нуклеиновыми кислотами, такими как (i) экспрессируемые фрагменты ДНК, кодирующие белок (белки) или фрагмент белка, или (ii) транслируемые РНК, кодирующие белок (белки) или фрагмент белка.
Олигонуклеотиды по изобретению могут таким образом быть введены в любой подходящий состав, усиливающий доставку олигонуклеотидов в клетки. Соответствующие этой цели фармацевтические составы включают также те составы, которые обычно применяются при доставке соединений в клетки или ткани путем местного введения. Такие соединения, как полиэтиленгликоль, пропиленгликоль, азон, ноноксонил-9, олеиновая кислота, DMSO, полиамины или липополиамины, могут быть использованы в составах для местного применения, содержащих олигонуклеотиды.
Синтез 3'-C-разветвленных нуклеозидов
Замещение гидроксильной группы в положении C3' нуклеозидов другими функциональными группами с сохранением водорода в положении C3' было описано, в частности, в De Clercq Е. Antiviral Res. (1989), 12, 1-20. О замещении водорода в положении C3' нуклеозидов другими функциональными группами сообщалось в Fedorov I.I., Kazmina Е.М., Novicov N.A., Gurskaya G.V., Bochkarev A.V., Jasko M. V. , Victorova L.S., Kuhkanova M.K., Balzarini J., De Clercq E. J. Med. Chem. (1992), 35, 4567-4575. Настоящее изобретение охватывает способы получения большого числа различных 3'-C-разветвленных нуклеозидов. Примеры способов получения 3'-C-разветвленных тимидинов представлены на реакционных схемах 1 и 2 (фиг.2 и 3, соответственно). Эти методики могут без труда быть адаптированы для синтеза других нуклеозидов по изобретению, включая воплощения изобретения, в которых нуклеозиды содержат основание, отличное от тимина. Соединение 4 было получено из тимидина в три стадии, как описано в Jorgensen P. N., Thrane Н., Wengel J. J. Am. Chem. Soc. (1994), 116, 2231. Обработка соединения 4 тозилхлоридом в пиридине позволила получить тозилат, соединение 5. Реакция соединения 5 с цианидом калия в DMF дала 3'-C-цианометилтимидиновое производное, соединение 6. Реакция соединения 5 с азидом натрия в DMF дала 3'-C-азидометилтимидиновое производное, соединение 7. Подобным же образом в реакциях соединения 5 с различными нуклеофильными реагентами может быть получен широкий круг разнообразных 3'-C-разветвленных производных тимидина, в которых 3'-C-гидроксильная группа остается в той же ориентации, что и в тимидине. Обработка соединения 6 2-цианоэтил-N,N-диизопропилхлорфосфорамидитом и диизопропилэтиламином в дихлорметане позволила получить фосфорамидит, соединение 8, являющееся строительным блоком в олигонуклеотидном синтезе. Подвергнутое такой же обработке соединение 7 дало соединение 9. Аналогичным образом посредством стандартных методик остальные 3'-разветвленные производные тимидина могут быть превращены в соответствующие фосфорамидиты (Eckstein F. "Oligonucleotide synthesis", Oxford University Press (1991)). Обработка соединения 5 гидридом натрия в THF позволила получить эпоксидное производное, соединение 10. Взаимодействие соединения 10 с алюмогидридом лития в THF позволило получить 3'-C-метилтимидиновое производное, соединение 11, которое переводили в фосфорамидит, соединение 12. Реакция соединения 10 с аммиаком в метаноле позволила получить 3'-C-аминометилтимидиновое производное, соединение 13, которое обрабатывали этилтиотрифторацетатом в THF, получая защищенное аминопроизводное, соединение 14. Соединение 14 переводили в фосфорамидит, соединение 15. Аналогично в результате взаимодействия соединения 10 с различными нуклеофильными реагентами может быть получен широкий круг разнообразных 3'-C-разветвленных производных тимидина, в которых 3'-C-гидроксильная группа остается в той же ориентации, что и в тимидине, так как нуклеофилы атакуют менее закрытый атом углерода эпоксидного кольца. Так, взаимодействие соединения 10 со спиртами в присутствии основания дает алкоксиметилтимидины. Для получения 3'-C-замещенных алкоксиметилтимидинов также могут быть использованы замещенные спирты. Заместители могут включать, но этим не ограничиваться, NO2, CN, COOEt и защищенные аминогруппы. Реакция соединения 10 с диолами позволяет получить 3'-C-гидроксиалкоксиметилтимидины, которые легко могут быть превращены в 3'-C-галоалкоксиметилтимидины. Реакция соединения 10 с нитрометаном дает 3'-C-нитроэтилтимидин. Восстановление 3'-C-нитроалкилтимидинов позволяет получить 3'-C-аминоалкилтимидины. Реакция соединения 10 с цианозамещенными органокадмиевыми реагентами дает 3'-C-цианоалкилтимидины. Реакция соединения 10 с этоксикарбонилалкилцинковыми реагентами позволяет получить 3'-C-этоксикарбонилалкилтимидины, которые легко гидролизуются в щелочных условиях до 3'-C-карбоксиалкилтимидинов.
В некоторых реакциях с участием литий органокупратных реагентов амидная группа тимидина может нуждаться в защите. Предпочтительным является использование в качестве защитной группы т-бутилдиметилсилоксиметила (TBDMSM), так как эта группа может быть легко снята после последующих превращений с помощью фторида тетрабутиламмония (TBAF). N-TBDMSM группа может быть введена в результате взаимодействия 3,5-биацилированного тимидина с т-бутилдиметилсилоксиметилхлоридом в пиридине.
N-TBDMSM тимидин подвергают похожей обработке, описанной выше для тимидина, с целью получения тозилата, промежуточного производного соединения 5, и эпоксида, промежуточного производного соединения 10, соответственно, которые оба могут быть использованы для получения 3'-C-алкилтимидинов и 3'-C-алкенилтимидинов реакцией с литиевыми реагентами. Гидроборирование или окислительное расщепление полученных 3′-C-(ω- алкенил)тимидинов дает гидроксиалкилтимидины, гидроксильная группа которых может быть превращена в разнообразные функциональные группы типа NH2, OR, SR, SH и X, где R представляет собой H или алкил, а X является F, Cl, Br, I, OTs.
Синтез 4'-C-разветвленных нуклеозидов
О ряде 4'-C-разветвленных нуклеозидов сообщалось в O-Yang С., Wu H.Y., Fraser-Smith Е.В., Walker К.А.М. Tetrahedron Letts (1992), 33, 37-40. Настоящее изобретение охватывает методики получения многих новых 4'-C-разветвленных нуклеозидов. Способ получения 4'-C-разветвленных тимидинов показан на Реакционных схемах 3, 4 и 5 (фиг.4, 5, 6 и 7, соответственно). Эти методики могут быть легко адаптированы для синтеза других нуклеозидов по изобретению, включая воплощения изобретения, в которых нуклеозиды содержат другое основание, нежели тимин. Соединение 16, полученное из тимидина, обрабатывали диметокситритилхлоридом, получая соединение 17. т-Бутилдиметилсилильную (TBDMS) группу соединения 17 удаляли обработкой TBAF, получая соединение 18, которое окисляли до альдегида, соединения 19, обработкой диметилсульфоксидом, DCC, трифторуксусной кислотой и пиридином. Соединение 19 было превращено в соединение 20, 4'-C-гидроксиметилтимидиновое производное, по методике, аналогичной описанным в O-Yang С., Wu H.Y., Fraser-Smith Е.В., Walker К.А.М. Tetrahedron Letts (1992), 33, 37-40 и Jones G.H., Taniguchi M., Tegg D., Moffatt J.G. J. Org. Chem. (1979), 44, 1309-1317. Диметокситритильную группу соединения 20 удаляли с помощью 80%-ной уксусной кислоты, получая соединение 21, 4'-C-гидроксиметилтимидин. Селективное бензоилирование соединения 21 с помощью бензоилангидрида позволяет получить соединение 22, 3'- и 5'-гидроксильные группы которого были защищены тетрагидропиранилом (THP) в реакции соединения 22 с дигидропираном в присутствии толуолсульфокислоты в дихлорметане. Полученное соединение 23 обрабатывали водным гидроксидом натрия, получая соединение 24, которое в результате реакции с метилиодидом в присутствии гидроксида натрия при 0oC дает 4'-C-метоксиметилтимидиновое производное, соединение 25. Удаление THP-защитных групп соединения 25 позволило получить соединение 26, 4'-C-метоксиметилтимидин. Для некоторых реакций предпочтительной является TBDMS-защитная группа, ввиду того, что использование THP приводит к образованию диастереомеров. Так, обработка соединения 22 трет-бутилдиметилхлорсиланом позволяет получить 3',5'-O-(бис-TBDMS)тимидиновое производное, соединение 27. Удаление бензоильной группы этилендиамином при 50oC позволило получить соединение 28, которое при взаимодействии с ангидридом трифторметансульфокислоты и пиридином в дихлорметане дает трифлат, соединение 29. Реакция соединения 29 с аммиаком в диоксане позволила получить 4'-C-аминометилтимидиновое производное, соединение 30. Реакция соединения 29 с азидом натрия в DMF позволила получить 4'-C-азидометилтимидиновое производное, соединение 31. Удаление TBDMS-защитных групп соединений 30 и 31 позволило получить соединения 32 и 33, 4'-C-аминометилтимидин и 4'-C-азидометилтимидин, соответственно. Аминогруппу соединения 33 защищали трифторацетильной группой, получая соединение 34. Реакция соединений 32 и 34 с диметокситритилхлоридом в пиридине позволила получить соединения 35 и 36, соответственно. Соединения 35 и 36 превращали в соответствующие фосфорамидиты, соединения 37 и 38, соответственно, путем обработки 2-цианоэтил-N,N-диизопропилхлорфосфорамидитом.
Реакции соединения 29 с реагентами Гриньяра позволяют получить 4'-C-алкилтимидины и 4'-C-алкенилтимидины. Гидроборирование или окислительное расщепление полученных 4′-C-(ω- алкенил)тимидинов дает гидроксиалкилтимидины, гидроксильная группа которых может быть превращена в разнообразные функциональные группы типа NH2, OR, SR, SH и X, где R представляет собой H или алкил, а X является F, Cl, Br, I, OTs. Реакции соединения 29 с цианоалкилкадмием позволяют получить 4'-C-цианоалкилтимидины. Реакции соединения 29 с этоксикарбонилалкилцинковыми реагентами позволяют получить 4'-C-этоксикарбонилалкилтимидины, которые могут быть гидролизованы до 4'-C-карбоксиалкилтимидинов. Реакции соединения 29 с алкоголятами натрия позволяют получить 4'-C-алкоксиметилтимидины. Для получения 4'-C-замещенных алкоксиметилтимидинов могут быть использованы замещенные спирты и фенолы. Заместителями могут быть NO2, CN, COOEt, OAc или защищенные аминогруппы. По окончании синтеза 4'-C-разветвленных тимидинов 5'-гидроксильные группы защищают диметокситритилом, а 3'-гидроксильные группы переводят в фосфорамидиты для олигонуклеотидного синтеза по стандартной методике (Eckstein F. "Oligonucleotide synthesis", Oxford University Press (1991)).
Синтез 5'-C-разветвленных нуклеозидов
Данное изобретение предусматривает способы получения большого числа 5'-C-разветвленных нуклеозидов. Примеры способов получения 5'-C-разветвленных тимидинов показаны на Реакционных схемах 6, 7 и 8 (фиг.8, 9 и 10, соответственно). Эти методики могут быть легко адаптированы для синтеза других нуклеозидов по изобретению, включая воплощения изобретения, в которых нуклеозиды содержат другое основание, нежели тимин. Соединение 42 готовили в три этапа по известной методике (O-Yang С., Wu H.Y., Fraser-Smith Е.В., Walker К. А.М. Tetrahedron Letts (1992), 33, 37-40). С другой стороны соединение 42 получали в реакции взаимодействия 80%-ной уксусной кислоты с соединением 41, 3',5'-O-(бис-трет-бутилдиметилсилил)тимидином, полученным в реакции тимидина с избытком трет-бутилдиметилхлорсилана и имидазола в пиридине. Реакция Виттига соединения 42 и илида фосфора, приготовленного из бромида метилтрифенилфосфония и гидрида натрия в DMSO, давала олефиновое производное, соединение 43. Эпоксидирование соединения 43 м-хлорпероксибензойной кислотой в дихлорметане позволяло получить 5'-(S)-эпоксидное производное, соединение 44, в качестве основного продукта и, как минорный продукт, 5'-(R)-эпоксидное производное. Стереохимические изображения соединения 44 и других соединений показаны на Схеме 1 (фиг. 12). Реакция соединения 44 с метанолом в присутствии карбоната натрия позволяла получить 5'-(S)-C-метоксиметилтимидин, соединение 45. Реакция соединения 44 с аммиаком в метаноле давала 5'-(S)-C-аминометилтимидин, который защищали трифторацетилом, получая соединение 46. Реакция соединения 44 с цианидом калия в DMF позволяла получить 5'-(S)-C-цианометилтимидин, соединение 47. 5'-Гидроксильные группы соединений 45-47 защищали диметокситритилом реакцией с диметокситритилхлоридом и трифторметансульфонатом серебра в пиридине, получая соединения 48-50, соответственно. TBDMS-группы соединений 48-50 удаляли с помощью TBAF в THF, получая соединения 51-53, соответственно. Соединения 51-53 переводили в соответствующие фосфорамидиты, соединения 54-56, соответственно. Реакция Гриньяра соединения 42 с бромидом аллилмагния давала смесь изомерных производных 5'-(R)-C-аллилтимидина и 5'-(S)-C-аллилтимидина, соединения 57 и 58, которые разделяют хроматографией на диоксиде кремния. TBDMS-группы соединений 57 и 58 удаляли обработкой TBAF в THF, получая 5'-(R)- и 5'-(S)-C-аллилтимидины, соединения 59 и 60, соответственно. Соединения 59 и 60 переводили в соответствующие фосфорамидиты, соединения 61 и 62, соответственно. Подобным же образом реакции соединения 42 с целым рядом реагентов Гриньяра позволяют получить различные 5'-(S или R)-C-алкилтимидины и 5'-(S или R)-C-алкенилтимидины. Гидроборирование или окислительное расщепление полученных 5′-C-(ω- алкенил)тимидинов дает гидроксиалкилтимидины, гидроксильная группа которых может быть превращена в разнообразные функциональные группы типа NH2, OR, SR, SH и X, где R представляет собой H или алкил, а X является F, Cl, Br, I, OTs.
Реакции соединения 29 с целым рядом нуклеофильных реагентов могут давать огромное разнообразие 5'-C-разветвленных тимидиновых производных. Так реакции соединения 44 со спиртами в присутствии основания дают 5'-C-алкоксиметилтимидины. Для получения 5'-C-замещенных алкоксиметилтимидинов также можно использовать замещенные спирты. Заместителями могут быть, но не ограничиваться ими, NO2, CN, COOEt и защищенные аминогруппы. Реакция соединения 44 с диолами позволяет получить 5'-C-гидроксиалкоксиметилтимидины, которые могут быть легко превращены в 5'-C-галоалкилтимидины. Реакция соединения 44 с нитрометаном дает 5'-C-нитроэтилтимидин. Восстановление 5'-C-нитроалкилтимидинов позволяет получить 5'-C-аминоалкилтимидины. Реакция соединения 44 с реагентами цианоалкилкадмия дает 5'-C-цианоалкилтимидины. Реакция соединения 44 с этоксикарбонилалкилцинковыми реагентами дает 5'-C-этоксикарбонилалкилтимидины, которые легко гидролизуются в щелочных условиях до 5'-C-карбоксиалкилтимидинов. Все превращения 5'-(S)-изомеров в равной степени касаются 5'-(R)-изомеров. И наконец, реакции 5'-C-разветвленных тимидинов с диметокситритилхлоридом и трифлатом серебра в пиридине дают 5'-O-DMTr-5'-C-разветвленные тимидины, которые переводят в соответствующие фосфорамидиты, соответственно по стандартной методике (Eckstein F. "Oligonucleotide synthesis", Oxford University Press (1991)).
Для определения конфигураций в C5'-положениях 5'-C-разветвленных тимидинов применяли преимущество NOE усиления пространственно близких протонов. Так как жесткая ориентация заместителей в положении C5' является существенной в NOE экспериментах, между положениями 3'-O- и 5'-O-тимидиновых производных вводили TIPDS-цикл (схема 8, фиг. 11), где 5'-протоны ориентированы или по направлению к 3'-протонам, или в направлении от 3'-протонов. Когда 3'-протоны насыщены, наличие или отсутствие NOE усиления 5'-протонов может легко наблюдаться (схема 1, фиг. 12). Для 5'-C-аллилтимидинов изомер, имеющий 4,8% NOE усиление, явно является 5'-(R)-изомером, а другой, не имеющий NOE усиления, является 5'-(S)-изомером. Без проведения рентгеноструктурного анализа прямое определение стереохимии 5'-эпоксигруппы является спорным. Однако превращение эпоксидов в продукты с открытым циклом не изменяет хиральности положения C5'. Если стереохимия одной пары таких продуктов с открытым циклом определена, то стереохимия эпоксидной пары также установлена. Так, подобно 5'-C-аллилтимидинам пара продуктов с открытым циклом, 5'-C-цианометилтимидинов, полученных из эпоксидов, была переведена в продукты с TIPDS-циклом. Когда 3'-протоны были насыщены, один изомер дал 6,3% NOE усиление. Ясно, что этот изомер является 5'-(R)-изомером, а другой является 5'-(S)-изомером.
Синтез 1'-C-разветвленных нуклеозидов
Имеются сообщения о различных 1'-C-разветвленных нуклеозидах (a. Uteza V. , Chen G-R., Tuoi J.L.Q., Descotes G., Fenet B., Grouiller A. Tetrahedron (1993), 49, 8579-8588; b. Azhayev A., Gouzaev A., Hovinen J., Azhayeva E., Lonnberg H. Tetrahedron Letts. (1993), 34, 6435-6438). Данное изобретение предусматривает способы получения большого числа 1'-C-разветвленных нуклеозидов. Примеры способов получения 1'-C-разветвленных тимидинов показаны на реакционных схемах 9 и 10 (фиг. 13 и 14, соответственно). Соединение 63 было получено в соответствии с известной методикой (Uteza V., Chen G-R., Tuoi J. L. Q. , Descotes G., Fenet В., Grouiller A. Tetrahedron (1993), 49, 8579-8588). Защита 5'-гидроксильной группы соединения 63 диметокситритилом дает соединение 64, обработка которого т-бутилдиметилхлорсиланом позволяет получить соединение 65. Обработка соединения 65 т-бутилдиметилсилоксиметилхлоридом позволяет получить соединение 66. Обработка соединения 66 триэтоксиалюмогидридом лития в эфире позволяет получить альдегид, соединение 67. Восстановление соединения 67 боргидридом натрия с последующей обработкой ангидридом трифторметансульфокислоты позволяет получить трифлат производное, соединение 68. Обработка соединения 68 широким кругом нуклеофильных реагентов позволяет получить ряд новых 1'-C-разветвленных тимидинов, соединений 69. Так, обработка соединения 68 цианидом, нитритом и азидом натрия позволяет получить соответствующие 1'-C-цианометил-, 1'-C-нитрометил- и 1'-C-азидометилтимидины, соответственно. Обработка соединения 68 нитрометаном позволяет получить 1'-C-нитроэтилтимидин. Обработка соединения 68 алкилсульфидами натрия позволяет получить 1'-C-алкилтиометилтимидин. Обработка соединения 68 алкоголятом натрия позволяет получить 1'-C-алкоксиметилтимидин. Обработка соединения 68 литиевыми органокупратными реагентами позволяет получить 1'-C-алкил- и 1'-C-алкенилтимидины. Замещенные алкил- или алкенилцинковые или кадмиевые реагенты могут быть использованы для получения 1'-C-замещенных алкил- и 1'-C-замещенных алкенилтимидинов. В качестве заместителей могут выступать COOEt, CN, NO2. Гидроборирование или окислительное расщепление полученных 3′-C-(ω- алкенил)тимидинов дает гидроксиалкилтимидины, гидроксильная группа которых может быть превращена в разнообразные функциональные группы типа NH2, OR, SR, SH и X, где R представляет собой H или алкил, а X является F, Cl, Br, I, OTs. Замещенные спирты и фенолы могут быть иcпользованы для получения 1'-C-алкоксиметил- и 1'-C-феноксиметилтимидинов. В качестве заместителей могут выступать NO2, CN, COOEt или ОАс. 1'-C-Нитроалкилтимидины могут быть восстановлены до соответствующих аминоалкилтимидинов. Соединения 69, обработанные TBAF дают незащищенные соединение 70, которые переводят в соответствующие фосфорамидиты, соединения 71.
Полностью защищенное п-метоксибензильной (MPM) группой соединение 63 дает соединение 72. Гидролиз соединения 72 в присутствии перекиси водорода и основания позволяет получить соединение 73, которое подвергают перегруппировке Хофмана, получая амин, который может быть переведен с помощью метилбромида в четвертичное аммониевое производное, соединение 74. Для замены триметиламина могут быть использованы разнообразные нуклеофилы. Обработка соединения 74 алкоголятом натрия позволяет получить 1'-C-алкокситимидины. Обработка соединения 74 алкилсульфидом натрия позволяет получить 1'-C-алкилтиотимидины. Нагреванием с бромидом натрия соединение 74 может быть переведено в 1'-C-бромтимидин, который в результате обработки азидом натрия, нитритом натрия или нитрометаном дает соответствующие 1'-C-замещенные тимидины. Обработанное церий-аммоний нитратом соединение 75 дает незащищенное соединение 76. 5'-Гидроксильную группу защищают диметокситритилом и полученные продукты, соединения 77, переводят в соответствующие фосфорамидиты, соединения 78.
Олигонуклеотиды, содержащие нуклеозиды с модифицированными сахарными составляющими
Недавно появились сообщения об олигонуклеотидах, содержащих нуклеозиды с модифицированными сахарными составляющими (A. Jorgensen P.N., Stein P.C., Wengel J. J. Am. Chem. Soc. (1994), 116, 2231; В. Fensholdt J., Thrane H., Wengel J. Tetrahedron Letts. (1995), 36, 2535; С. Thrane H., Fensholdt J., Regner M. , Wengel J. Tetrahedron Letts. (1995), 51, 10389; D. Saha А.К., Caulfield T. J. , Hobbs C., Upson D.A., Waychunas C., Yawman A.M. J. Org. Chem. (1995), 60, 788; E. Azhayev A., Gouzaev A., Hovinen J., Azhayeva E., Lonnberg H. Tetrahedron Letts. (1993), 34, 6435-6438; F. Ono A., Dan A., Matsuda A. Bioconjugate Chemistry (1993), 4, 499-508; G. Inoue H., Hayase Y. , Imura A. , Iwai S., Miuta K., Ohtsuka E. Nucleic Acids Res. (1987), 15, 6131; H. Lesnik E.A., Guinosso C.J., Kawasaki A.M., Sasmor H., Zounes M., Cummins L.L., Ecker D.J., Cook P.D. and Freier S.M. Biochemistry (1993), 32, 7832). Данное изобретение предусматривает целый ряд новых модифицированных по сахарной составляющей нуклеозидов, которые с помощью фосфорамидитной химии можно легко соединить в олигонуклеотиды. Такие модифицированные по сахарной составляющей олигонуклеотиды содержат по меньшей мере один модифицированный по сахарной составляющей нуклеозид по изобретению, они могут содержать множество модифицированных по сахарной составляющей нуклеозидов в своей последовательности или только лишь одни модифицированные по сахарной составляющей в соответствии с изобретением нуклеозиды. Модифицированные по сахарной составляющей олигонуклеотиды также могут включать и другие модификации, как, например, модификации остова, модификации оснований и любые другие модификации сахаров. Очевидно, что разветвленные заместители в положении C3' или C5' нуклеозидов будут уменьшать скорость присоединения, зависящую от размера заместителя. Ввиду этого для некоторых объемных заместителей разветвленных нуклеозидов время реакции присоединения увеличивалось. Так, для синтеза 5'-C-разветвленных олигонуклеотидов и 4'-C-разветвленных олигонуклеотидов использовали время присоединения порядка 2-5 минут. Для синтеза 3'-C-разветвленных олигонуклеотидов время реакции присоединения увеличивали до 45 минут (3 х 15 мин). При синтезе 3'-C-разветвленных олигонуклеотидов необходимы повторы реакции присоединения со свежей порцией реагентов, поскольку 3'-гидроксил является третичным. Структура очищенных олигонуклеотидов, содержащих модифицированную сахарную составляющую, проверяется с помощью анализа продуктов ферментативного расщепления.
Примеры
Описанное выше изобретение может быть лучше понято при рассмотрении последующих примеров. Следующие примеры предназначены для иллюстрации, но не для ограничения изобретения.
Пример 1
Получение 5'-O-(4,4'-диметокситритил)-3'-пара- тозилоксиметилтимидина
Раствор 5'-O-(4,4'-диметокситритил)-3'-гидроксиметилтимидина (2,12 г; 3,69 ммоль), полученного согласно известной методике (Jorgensen, P.N., Thrane, Н. , Wengel, J. J. Am. Chem. Soc. (1994), 116, 2231), пара-толуолсульфонилхлорида (1,76 г; 9,23 ммоля), DMAP (0,180 г, 1,48 ммоль) в безводном пиридине (13 мл) перемешивали при комнатной температуре в течение ночи. Реакционную смесь охлаждали до 0oC, разбавляли EtOAc (500 мл), промывали 10%-ным NaHCO3, высушивали над Na2SO4 и концентрировали. Неочищенный продукт очищали хроматографией на диоксиде кремния (5% CH3OH в CH2Cl2), получая 2,39 г (89%) 5'-O-(4,4'-диметокситритил)-3'-пара-тозилоксиметилтимидина в виде бесцветного порошка.
Пример 2
Получение 5'-O-(4,4'-диметокситритил)-3'-C-цианометилтимидина
Суспензию 5'-O-(4,4'-диметокситритил)-3'-пара- толуолсульфонилоксиметилтимидина (0,50 г; 0,686 ммоль) и цианида калия (0,134 г; 2,06 ммоль) в безводном DMF (7 мл) перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли EtOAc (60 мл) и промывали водой (3 х 75 мл), затем 10%-ным NaHCO3 (3 х 75 мл). Органический слой высушивали над Na2SO4, концентрировали и очищали хроматографией на диоксиде кремния (EtOAc-гексаны, 1: 1), получая 0,386 г (97%) 5'-O-(4,4'-диметокситритил)-3'-C-цианометилтимидина в виде бесцветного порошка.
Пример 3
Получение 5'-O-(4,4'-диметокситритил)-3'-C-азидометилтимидина
Суспензию 5'-O-(4,4'-диметокситритил)-3'-пара- толуолсульфонилоксиметилтимидина (0,40 г; 0,55 ммоль) и NaN3 (0,11 г; 1,65 ммоль) в безводном DMF (3 мл) нагревали при 50oC в течение 3 дней. Реакционную смесь охлаждали до комнатной температуры, разбавляли EtOAc (30 мл) и промывали водой (3 х 40 мл), затем 10%-ным NaHCO3 (3 х 40 мл). Органический слой высушивали над Na2SO4, концентрировали и очищали хроматографией на диоксиде кремния (EtOAc-гексаны, 1:1), получая 0,30 г (92%) 5'-O-(4,4'-диметокситритил)-3'-C-азидометилтимидина в виде бесцветного порошка.
Пример 4
Получение
3'-(2-цианоэтил-N,N-диизопропилфосфорамидита)
5'-O-(4,4'-диметокситритил)-3'-C-цианометилтимидина
К перемешиваемому раствору 5'-O-(4,4'-диметокситритил)-3'-C-цианометилтимидина (0,20 г; 0,344 ммоль) и диизопропилэтиламина (0,24 мл; 1,38 ммоль) в безводном дихлорметане (3 мл) добавляли при 0oC в атмосфере аргона по каплям раствор 2'-цианоэтил-N, N-диизопропилхлорфосфорамидита (170 мг; 0,715 ммоль) в дихлорметане. Полученную реакционную смесь перемешивали при комнатной температуре в течение 2 ч, охлаждали до 0oC, разбавляли холодным CH2Cl2 (20 мл) и промывали холодным NaHCO3 (3 х 15 мл). Органический слой высушивали над Na2SO4, концентрировали. Остаток очищали хроматографией на диоксиде кремния (Et3N-EtOAc-CH2Cl2, 5:50:45), получая 177 мг (66%) 3'-(2-цианоэтил-N, N-диизопропилфосфорамидита) 5'-O-(4,4'-диметокситритил)-3'-C-цианометилтимидина в виде пены.
Пример 5
Получение
3'-(2-цианоэтил-N,N-диизопропилфосфорамидита)
5'-O-(4,4'-диметокситритил)-3'-C-азидометилтимидина
К перемешиваемому раствору 5'-O-(4,4'-диметокситритил)-3'-C-азидометилтимидина (252 мг, 0,344 ммоль) и диизопропилэтиламина (0,44 мл, 2,51 ммоль) в безводном дихлорметане (3 мл) добавляли при 0oC в атмосфере аргона по каплям раствор 2'-цианоэтил-N, N-диизопропилхлорфосфорамидита (296 мг; 1,25 ммоль) в дихлорметане. Полученного реакционную смесь перемешивали при комнатной температуре в течение 2 ч, охлаждали до 0oC, разбавляли холодным CH2Cl2 (20 мл) и промывали холодным NaHCO3 (3 х 15 мл). Органический слой высушивали над Na2SO4, концентрировали. Остаток очищали хроматографией на диоксиде кремния (Et3N-EtOAc-CH2Cl2, 5:50:45), получая 128 мг (38%) 3'-(2-цианоэтил-N, N-диизопропилфосфорамидо)5'-O-(4,4'- диметокситритил)-3'-C-азидометилтимидина в виде пены.
Пример 6
Получение 5'-O-(4,4'-диметокситритил)-3'-C,O-метилентимидина
К суспензии NaH (60% в минеральном масле, 0,18 г; 7,5 ммоль) в безводном THF (18 мл) добавляли при 0oC в атмосфере аргона по каплям раствор 5'-O-(4,4'-диметокситритил)-3'-пара- толуолсульфонилоксиметилтимидина (1,5 г; 2,06 ммоль) в THF (10 мл). Полученную реакционную смесь перемешивали при комнатной температуре в течение 2 ч, охлаждали до 0oC и останавливали реакцию добавлением воды. Смесь разбавляли EtOAc (250 мл), промывали водой (2 х 200 мл), затем 10%-ным NaHCO3 (2 х 200 мл), высушивали над Na2SO4 и концентрировали. Остаток очищали хроматографией на диоксиде кремния (5% CH3ОН в CH2CL2), получая 0,97 г (85%) 5'-O-(4,4'-диметокситритил)-3'-C,O-метилентимидина в виде пены.
Пример 7
Получение
5'-O-(4,4'-диметокситритил)-3'-C-метилтимидина
К перемешиваемой суспензии алюмогидрида лития (58 мг; 1,53 ммоль) в безводном THF (10 мл) добавляли при 0oC в атмосфере аргона по каплям раствор 5'-O-(4,4'-диметокситритил)-3'-C, O-метилентимидина (385 мг; 0,692 ммоль) в THF (10 мл). Реакционную смесь перемешивали при 0oC в течение 1 ч и останавливали реакцию медленным добавлением 10%-ного NaHCO3. Полученную смесь разбавляли EtOAc (30 мл), промывали NaHCO3 (3 х 20 мл), высушивали над Na2SO4 и концентрировали. Остаток очищали хроматографией на диоксиде кремния (5% CH3ОН в CHCl3), получая 306 мг (79%) 5'-O-(4,4'-диметокситритил)-3'-C-метилтимидина в виде пены.
Пример 8
Получение
3'-(2-цианоэтил-N,N-диизопропилфосфорамидита)
5'-O-(4,4'-диметокситритил)-3'-C-метилтимидина
К перемешиваемому раствору 5'-O-(4,4'-диметокситритил)-3'-C-метилтимидина (98 мг; 0,17 ммоль) и диизопропилэтиламина (0,13 мл; 0,742 ммоля) в безводном дихлорметане (2 мл) при 0oC в атмосфере аргона добавляли по каплям раствор 2'-цианоэтил-N,N-диизопропилхлорфосфорамидита (85 мг; 0,36 ммоль) в дихлорметане. Полученную реакционную смесь перемешивали при комнатной температуре в течение 1 ч, охлаждали до 0oC, разбавляли холодным CH2Cl2 (20 мл) и промывали холодным NaHCO3 (3 х 15 мл). Органический слой высушивали над Na2SO4, концентрировали. Остаток очищали хроматографией на диоксиде кремния (Et3N-EtOAc: гексан, 5:50:45), получая 117 мг (88%) 3'-(2-цианоэтил-N,N-диизопропилфосфорамидита) 5'-O-(4,4'-диметокситритил)-3'-C-метилтимидина в виде пены.
Пример 9
Получение 5'-O-(4,4'-диметокситритил)-3'-C-аминометилтимидина
Насыщенный раствор аммиака в метаноле (9 мл) добавляли к раствору 5'-O-(4,4'-диметокситритил)-3'-C, O-метилентимидина (901 мг; 1,62 ммоль) в метаноле (3 мл) и полученный раствор оставляли при комнатной температуре на 3 дня. Избыток аммиака и метанола упаривали, а остаток очищали хроматографией (CH3OH-гексаны-CHCl3, 1: 1: 8), получая 414 мг (45%) 5'-O-(4,4'-диметокситритил)-3'-C-аминометилтимидина в виде бесцветного твердого вещества.
Пример 10
Получение 5'-O-(4,4'-диметокситритил)-3'-C- трифторацетамидометилтимидина
Раствор 5'-O-(4,4'-диметокситритил)-3'-C-аминометилтимидина (361 мг; 0,628 ммоль) и этилтиотрифторацетата (490 мг; 3,12 ммоль) в безводном THF (6 мл) перемешивали при комнатной температуре в течение 6 ч. Растворитель упаривали, а остаток очищали хроматографией на диоксиде кремния (5% CH3ОН в CH2Cl2), получая 411 мг (98%) 5'-O-(4,4'-диметокситритил)-3'-C- трифторацетамидометилтимидина в виде бесцветного порошка.
Пример 11
Получение
3'-(2-цианоэтил-N,N-диизопропилфосфорамидита)
5'-O-(4,4'-диметокситритил)-3'-C-трифторацетамидометилтимидина
К перемешиваемому раствору 5'-O-(4,4'-диметокситритил)-3'-C-метилтимидина (411 мг; 0,614 ммоль) и диизопропилэтиламина (0,64 мл; 3,65 ммоль) в безводном дихлорметане (6 мл) при 0oC в атмосфере аргона добавляли по каплям раствор 2'-цианоэтил-N,N-диизопропилхлорфосфорамидита (410 мг; 1,83 ммоль) в безводном дихлорметане. Полученную реакционную смесь перемешивали при комнатной температуре в течение 2 ч, охлаждали до 0oC, разбавляли холодным CH2Cl2 (30 мл) промывали холодным NaHCO3 (3 x 20 мл). Органический слой высушивали над Na2SO2 и концентрировали. Остаток очищали хроматографией на диоксиде кремния (Et3N-EtOAc-CHCl3, 5:30:65), получая 386 мг (72%) 3'-(2-цианоэтил-N, N-диизопропилфосфорамидита) 5'-O-(4,4'-диметокситритил)-3'-C-трифторацетамидометилтимидина в виде порошка.
Пример 12
Получение 3'-О-(4,4'-диметокситритил)-5'-формилтимидина
К перемешиваемому холодному раствору 3'-O-(4,4'-диметокситритил)тимидина (полученного из тимидина стандартными способами, 40,4 г; 0,072 моль) в безводном DMSO добавляли раствор DCC (45,86 г; 0,224 моль) в DMSO (180 мл). Полученный раствор перемешивали при 5oC в течение 5 мин, к смеси добавляли пиридин (2,94 г; 3,0 мл; 0,0371 моль) и после перемешивания еще в течение 5 мин добавляли по каплям раствор трифторуксусной кислоты (2,11 г; 1,43 мл; 0,0185 моль) в DMSO (2 мл). Полученную реакционную смесь перемешивали при 5oC в течение 10 мин и при комнатной температуре в течение 6 ч. К смеси при охлаждении добавляли по каплям воду (20 мл) и смесь перемешивали при комнатной температуре в течение 1 ч. Осадки отфильтровывали и промывали DMSO. Объединенные растворы DMSO при перемешивании выливали в крошеный лед (4 л). По истечении 1 ч осадки отфильтровывали и тщательно промывали водой. Осадок растворяли в метиленхлориде (500 мл), органический слой отделяли, высушивали (Na2SO4) и концентрировали. Неочищенный продукт очищали хроматографией на диоксиде кремния (3% метанола в метиленхлориде), получая 32,6 г (81%) 3'-O-(4,4'-диметокситритил)-5'-формилтимидина в виде бесцветного порошка.
Пример 13
Получение
3'-O-(4,4'-диметокситритил)-4'-C-гидроксиметилтимидина
К перемешиваемому раствору 3'-O-(4,4'-диметокситритил)-5'-формилтимидина (16,3 г; 30,07 ммоль) в диоксане (120 мл) при 0oC по каплям добавляли по очереди 36%-ный формальдегид (24 мл) и 2 н. NaOH (60 мл). Полученный раствор перемешивали при комнатной температуре в течение 6 ч. Реакционную смесь охлаждали до 0oC и к ней по каплям добавляли 10%-ную уксусную кислоту в воде до тех пор, пока значение pH не достигало 7,5. Смесь разбавляли этилацетатом (1 л), промывали 10 %-ным солевым раствором (500 мл, затем 2 х 300 мл), высушивали (Na2SO4) и концентрировали. Неочищенный продукт очищали хроматографией на диоксиде кремния (EtOAc-гексан, 3:1), получая 11,45 г (66,3%) 3'-O-(4,4'-диметокситритил)-4'-C-гидроксиметилтимидина в виде бесцветного порошка.
Пример 14
Получение 4'-C-гидроксиметилтимидина
Раствор 3'-O-(4,4'-диметокситритил)-4'-C-гидроксиметилтимидина (6,32 г; 11,0 ммоль) в 80%-ной уксусной кислоте в воде (50 мл) оставляли при комнатной температуре на 4 ч. Растворители удаляли при пониженном давлении и к остатку добавляли воду (200 мл). Получившуюся мутную смесь промывали эфиром (3 х 80 мл) и воду упаривали. Остаток растворяли в метаноле и толуоле и полученный раствор концентрировали. Этот процесс повторяли дважды. 4'-C-гидроксиметилтимидин (2,72 г; 91%) получали в виде пены.
Пример 15
Получение 4'-C-бензоилоксиметилтимидина
К перемешиваемому раствору 4'-C-гидроксиметилтимидина (3,72 г; 13,67 ммоль) в безводном пиридине (10 мл) при 0oC добавляли раствор бензангидрида (4,64 г; 51 ммоль) в пиридине (10 мл). Полученный раствор оставляли при 0oC на 1 ч, а затем при комнатной температуре на 20 ч. К раствору при 0oC добавляли воду (5 мл), пиридин упаривали и остаток очищали хроматографией на диоксиде кремния (7% этанола в хлороформе), получая 2,27 г (44%) 4'-C-бензоилоксиметилтимидина в виде бесцветного твердого вещества.
Пример 16
Получение
3',5'-O-(бис-тетрагидропиранил)-4'-C-гидроксиметилтимидина
К перемешиваемому раствору 4'-C-бензоилоксиметилтимидина (1,65 г; 4,39 ммоля) и пара-толуолсульфокислоты (50 мг) в безводном метиленхлориде (70 мл) при 0oC по каплям добавляли дигидропиран (1,84 г; 1,89 мл; 21,80 ммоль). Полученный раствор перемешивали при комнатной температуре в течение 2 ч. Затем при охлаждении добавляли 2 н. NaOH (20 мл), полученную смесь концентрировали для удаления метиленхлорида и добавляли диоксан (10 мл). Смесь перемешивали при комнатной температуре в течение 3 ч и экстрагировали метиленхлоридом (3 х 30 мл). Органической слой промывали водой (3 х 50 мл), высушивали (Na2SO4) и концентрировали. Остаток очищали фильтрацией через колонку с диоксидом кремния, получая 1,50 г (77,7%) 3',5'-O-(бис-тетрагидропиранил)-4'-C-гидроксиметилтимидина в виде пены.
Пример 17
Получение 4'-C-метоксиметилтимидина
К перемешиваемому раствору 3', 5'-O-(бис-тетрагидропиранил)-4'-C-гидроксиметилтимидина (660 мг; 1,5 ммоль) и гидрида натрия (60% в минеральном масле, 180 мг; 4,5 ммоль) в безводном THF (15 мл) при 0oC по каплям добавляли метилйодид (1,06 г; 0,46 мл). Полученный раствор перемешивали при 0oC в течение 1,5 ч. Затем к нему при 0oC по каплям добавляли воду (1 мл) и уксусную кислоту до тех пор, пока значение pH не достигало 7. Смесь разбавляли этилацетатом (50 мл), промывали водой (3 х 30 мл), высушивали (Na2SO4) и концентрировали. Остаток растворяли в кислотной смеси (5 мл THF, 10 мл CH3COOH и 5 мл воды), раствор оставляли при 50oC на 3 ч и растворители упаривали. Остаток растворяли в смеси метанол-толуол, концентрировали и повторяли эту процедуру еще один раз. Очистка с помощью хроматографии на диоксиде кремния (10% этанола в хлороформе) дала 271 мг (63%) 4'-C-метоксиметилтимидина в виде бесцветного твердого вещества.
Пример 18
Получение
5'-O-(4,4'-диметокситритил)-4'-C-метоксиметилтимидина
Раствор 4'-C-метоксиметилтимидина (173 мг; 0,6 ммоль) и диметокситритилхлорида (287 мг; 0,84 ммоль) в пиридине оставляли при комнатной температуре на 5 ч. Пиридин упаривали и остаток очищали хроматографией на диоксиде кремния (EtOAc-гексан, 2:1), получая 264 мг (74%) 5'-O-(4,4'-диметокситритил)-4'-C-метоксиметилтимидина в виде пены.
Пример 19
Получение
3'-(2-цианоэтил-N,N-диизопропилфосфорамидита)
5'-O-(4,4'-диметокситритил)-4'-C-метоксиметилтимидина
К перемешиваемому раствору 5'-O-(4,4'-диметокситритил)-4'-C-метоксиметилтимидина (200 мг; 0,34 ммоль) и диизопропилэтиламина (176 мг; 236 мкл; 1,36 ммоль) в безводном метиленхлориде (3 мл) при 0oC в атмосфере азота по каплям добавляли раствор 2-цианоэтил-N,N-диизопропилхлорфосфорамидита (161 мг; 152 мкл; 0,68 ммоль) в метиленхлориде (1 мл). Полученный раствор перемешивали при комнатной температуре в течение 30 мин, охлаждали до 0oC и разбавляли этилацетатом (30 мл). Смесь промывали 10%-ным NaHCO3 (3 х 20 мл), высушивали (Na2SO4) и концентрировали. Остаток очищали хроматографией на диоксиде кремния (Et3N-EtOAc-гeксан, 5:45:50), получая 190 мг (71%) 3'-(2-цианоэтил-N, N-диизопропилфосфорамидита) 5'-O-(4,4'-диметокситритил)-4'-C-метоксиметилтимидина в виде пены.
Пример 20
Получение
3',5'-(бис-трет-бутилдиметилсилил)-4'-C-гидроксиметилтимидина
К охлажденному перемешиваемому раствору 4'-C-бензоилметилтимидина (1,14 г; 3,03 ммоль) и имидазола (985 мг; 15,15 ммоль) в пиридине добавляли раствор трет-бутилдиметилхлорсилана (1,37 г, 9,09 ммоль) в пиридине. Реакционную смесь оставляли при 50oC на ночь, разбавляли этилацетатом (100 мл), промывали водой (3 х 50 мл), концентрировали. Остаток растворяли в этаноле (10 мл) и к раствору добавляли смесь этилендиамина и этанола (1:1, 20 мл). Раствор нагревали при 50oC в течение 2 дней. Этанол и этилендиамин упаривали при пониженном давлении и остаток растворяли в хлороформе (60 мл). Раствор промывали водой (3 х 40 мл), высушивали (Na2SO4) и концентрировали. Остаток очищали хроматографией на диоксиде кремния (EtOAc-гексан, 1:1), получая 780 мг (52%) 3',5'-(бис-трет-бутилдиметилсилил)-4'-C-гидроксиметилтимидина в виде твердого вещества белого цвета.
Пример 21
Получение
3',5'-(бис-трет-бутилдиметилсилил)-4'-C-аминометилтимидина
К перемешиваемому раствору 3', 5'-(бис-трет-бутилдиметилсилил)-4'-C-гидроксиметилтимидина (500 мг; 1,0 ммоль) и пиридина (0,4 мл) в безводном метиленхлориде (5 мл) при 0oC по каплям добавляли смесь ангидрида трифторметансульфокислоты (564 мг; 332 мкл; 2,0 ммоль) и пиридина (0,4 мл) в метиленхлориде (5 мл). Реакционную смесь перемешивали при 0oC в течение 30 мин и к ней добавляли 0,5 мл 10%-ного NaHCO3 при -10oC. Смесь разбавляли метиленхлоридом (20 мл), промывали охлажденным 10%-ным NaHCO3 (2 х 30 мл), высушивали (Na2SO4), концентрировали и сушили под вакуумом в течение 1 ч. Неочищенный продукт растворяли в диоксане (30 мл) и насыщали газообразным аммиаком. Раствор оставляли при комнатной температуре на ночь, после чего нагревали при 50oC в течение 2 дней. Избыток аммиака и диоксана упаривали и остаток очищали хроматографией на диоксиде кремния (1% метанола и 5% Et3N в CHCl3), получая 266 мг (53%) 3',5'-(бис-трет-бутилдиметилсилил)-4'-C-аминометилтимидина в виде твердого вещества белого цвета.
Пример 22
Получение
3',5'-(бис-трет-бутилдиметилсилил)-4'-C- трифторацетамидометилтимидина
Раствор 3',5'-(бис-трет-бутилдиметилсилил)-4'-C- аминометилтимидина (260 мг; 0,52 ммоль) и этилтиотрифторацетата (635 мг; 0,52 мл; 4,0 ммоль) в диоксане перемешивали при комнатной температуре в течение 5 ч. Растворитель упаривали и остаток очищали хроматографией на диоксиде кремния (5% метанола в хлороформе), получая 220 мг (71%) 3',5'-(бис-трет-бутилдиметилсилил)-4'-C-трифторацетамидометилтимидина в виде твердого вещества белого цвета.
Пример 23
Получение 4'-C-трифторацетамидометилтимидина
Раствор 3', 5'-(бис-трет-бутилдиметилсилил)-4'-C- трифторацетамидометилтимидина (215 мг; 0,36 ммоль) и TBAF (1,0 М в THF, нейтрализованный уксусной кислотой до pH 7,5; 0,72 мл) в THF (3 мл) оставляли при комнатной температуре на 20 ч. Растворитель упаривали и остаток очищали хроматографией на диоксиде кремния (10% метанола в хлороформе), получая 118 мг (89%) 4'-C-трифторацетамидометилтимидина в виде бесцветного твердого вещества.
Пример 24
Получение 5'-O-(4,4'-диметокситритил)-4'-C- трифторацетамидометилтимидина
Раствор 4'-C-трифторацетамидометилтимидина (110 мг; 0,3 ммоль) и диметокситритилхлорида (152 мг; 0,45 ммоль) в безводном пиридине (2 мл) оставляли при комнатной температуре на ночь. Пиридин упаривали и остаток очищали хроматографией на диоксиде кремния (EtOAc-гексан, 2:1), получая 122 мг (61%) 5'-O-(4,4'-диметокситритил)-4'-C-трифторацетамидометилтимидина в виде пены.
Пример 25
Получение
3'-(2-цианоэтил-N,N-диизопропилфосфорамидита)
5'-O-(4,4'-диметокситритил)-4'-C-трифторацетамидометилтимидина
К перемешиваемому раствору 5'-O-(4,4'-диметокситритил)-4'-C-трифторацетамидометилтимидина (110 мг; 0,165 ммоль) и диизопропилэтиламина (129 мг; 174 мкл; 1,0 ммоль) в безводном метиленхлориде (3 мл) при 0oC в атмосфере азота по каплям добавляли раствор 2-цианоэтил-N,N-диизопропилхлорфосфорамидита (78 мг; 74 мкл; 0,33 ммоль) в метиленхлориде (1 мл). Полученный раствор перемешивали при комнатной температуре в течение 30 мин, охлаждали до 0oC и разбавляли этилацетатом (20 мл). Смесь промывали 10%-ным NaHCO3 (3 х 15 мл), высушивали (Na2SO4) и концентрировали. Остаток очищали хроматографией на диоксиде кремния (Et3N-EtOAc-гексан, 5:45:50), получая 137 мг (86%) 3'-(2-цианоэтил-N, N-диизопропилфосфорамидита) 5'-O-(4,4'-диметокситритил)-4'-C-метоксиметилтимидина в виде пены.
Пример 26
Получение
3',5'-O-(бис-трет-бутилдиметилсилил)-4'-C-азидометилтимидина
К перемешиваемому раствору 3', 5'-(бис-трет-бутилдиметилсилил)-4'-C-гидроксиметилтимидина (0,95 г; 0,19 ммоль) и пиридина (0,1 мл) в безводном метиленхлориде (1 мл) при 0oC по каплям добавляли смесь ангидрида трифторметансульфокислоты (107 мг; 0,38 ммоль; 63 мкл) и пиридина (0,2 мл) в метиленхлориде (2,5 мл). Реакционную смесь перемешивали при 0oC в течение 30 мин, охлаждали до -10oC и добавляли 0,5 мл 10%-ного NaHCO3. Смесь разбавляли охлажденным метиленхлоридом (10 мл), промывали охлажденным 10%-ным NaHCO3 (2 х 10 мл), высушивали (Na2SO4), концентрировали и сушили под вакуумом в течение 10 мин. Неочищенный продукт растворяли в безводном DMF (1 мл) и добавляли азид натрия (50 мг). Смесь нагревали при 50oC в течение 14 ч, разбавляли этилацетатом (20 мл), промывали водой (5 х 10 мл), высушивали (Na2SO4) и концентрировали. Остаток очищали хроматографией на диоксиде кремния (10% этилацетата в метиленхлориде), получая 42 мг 3',5'-O-(бис-трет-бутилдиметилсилил)-4'-C-азидометилтимидина в виде пены.
Пример 27
Получение 4'-C-азидометилтимидина
Раствор 3', 5'-O-(бис-трет-бутилдиметилсилил)-4'-C- азидометилтимидина (25 мг) и TBAF (1,0 M в THF; 0,5 мл) в THF (1 мл) оставляли при комнатной температуре на 30 мин. Растворитель упаривали и остаток очищали хроматографией на диоксиде кремния (6% MeOH в CH2Cl2), получая 11 мг 4'-C-азидометилтимидина в виде бесцветного твердого вещества.
Пример 28
Получение
3'-O-трет-бутилдиметилсилил-5'-дезокси-5'-метилидентимидина
Суспензия гидрида натрия (60% в минеральном масле, 2,88 г; 72 ммоль) в безводном DMSO (100 мл) после перемешивания при 65oC в течение 1,5 ч в атмосфере азота превращалась в прозрачный раствор, который охлаждали до комнатной температуры и помещали в охлажденную перемешиваемую суспензию бромида метилтрифенилфосфония (27,0 г; 75,6 ммоль) в DMSO (20 мл) в атмосфере азота. Реакционную смесь перемешивали при комнатной температуре в течение 45 мин и при охлаждении добавляли раствор 3'-O-т-бутилдиметилсилил-5'-формилтимидина (8,50 г; 24 ммоль) в DMSO (40 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, разбавляли этилацетатом (2 л), промывали солевым раствором (5 х 800 мл), высушивали (Na2SO4), концентрировали. Неочищенный продукт очищали хроматографией на диоксиде кремния (EtOAc-гексан, 30: 70), получая 6,79 г (80,2 %) 3'-O-т-бутилдиметилсилил-5'-дезокси-5'-метилидентимидина в виде бесцветного твердого вещества, т.пл. 122o (перекристаллизация из этилацетата и гексана).
Пример 29
Получение
3'-O-трет-бутилдиметилсилил-5'-C,O-метилентимидина
Раствор 3'-O-трет-бутилдиметилсилил-5'-дезокси-5'- метилиндентимидина (6,26 г; 17,78 ммоль) и мета-хлорпероксибензойной кислоты (4,61 г; 26,68 ммоль) в метиленхлориде (160 мл) перемешивали при комнатной температуре в течение ночи, разбавляли метиленхлоридом (200 мл), промывали 10%-ным NaHCO3 (2 х 240 мл), а затем солевым раствором (160 мл), высушивали (Na2SO4) и концентрировали. Остаток хроматографировали на диоксиде кремния (EtOAc-гексан, 1: 2), получая нетронутый исходный материал (2,25 г; 35,9%), 3'-О-трет-бутилдиметилсилил-5'-(S)-C, O-метилентимидин (3,2 г; 76%) и 3'-О-трет-бутилдиметилсилил-5'-(R)-C,O-метилентимидин (0,365 г; 8%).
Пример 30
Получение
3'-O-трет-бутилдиметилсилил-5'-C-метоксиметилтимидина
Раствор 3'-О-трет-бутилдиметилсилил-5'-(R)-C,O-метилентимидина (1,84 г; 5 ммоль) и безводного карбоната калия (1,38 г; 10 ммоль) в метаноле перемешивали при комнатной температуре в течение 90 ч. Добавляли этилацетат (70 мл) и нейтрализовали смесь уксусной кислотой до pH 7. Растворители упаривали, а остаток растворяли в метиленхлориде (30 мл). Осадки отфильтровывали и раствор концентрировали. Остаток очищали хроматографией на диоксиде кремния (EtOAc-гексан, 1:1), получая 310 мг нетронутого исходного материала и 578 мг 3'-O-трет-бутилдиметилсилил-5'-C-метоксиметилтимидина в виде бесцветного твердого вещества.
Пример 31
Получение
3'-O-трет-бутилдиметилсилил-5'-C-трифторацетамидометилтимидина
Раствор 3'-O-трет-бутилдиметилсилил-5'-(R)-C,O-метилентимидина (0,84 г; 2,28 ммоль) в метаноле смешивали с насыщенным аммиаком раствором метанола (10 мл). Полученный раствор оставляли при комнатной температуре на 15 ч и затем упаривали избыток аммиака и метанола. Высушенный остаток растворяли в диоксане (10 мл) и добавляли этилтиотрифторацетат (1,80 г; 11,4 ммоль; 1,46 мл). Реакционную смесь перемешивали при комнатной температуре в течение 6 ч и затем упаривали растворитель. Остаток хроматографировали на диоксиде кремния (EtOAc-гексан, 1: 1), получая 895 мг (81,8%) 3'-O-трет-бутилдиметилсилил-5'-C-трифторацетамидометилтимидина в виде бесцветного твердого вещества.
Пример 32
Получение
3'-O-трет-бутилдиметилсилил-5'-(S)-C-цианометилтимидина
Смесь 3'-O-трет-бутилдиметилсилил-5'-(R)-C, O-метилентимидина (0,77 г; 2,09 ммоль) и цианида калия (520 мг; 8,0 ммоль) в DMF (10 мл) перемешивали при комнатной температуре в течение 40 ч, разбавляли этилацетатом (100 мл), промывали солевым раствором (5 х 60 мл), высушивали (Na2SO4) и концентрировали. Неочищенный продукт очищали хроматографией на диоксиде кремния (EtOAc-гексан, 1: 1), получая 3'-O-трет-бутилдиметилсилил-5'-(S)-C-цианометилтимидин (580 мг; 70%) в виде твердого вещества белого цвета.
Пример 33
Получение
3'-O-трет-бутилдиметилсилил-5'-(S)-C-азидометилтимидина
Смесь 3'-O-трет-бутилдиметилсилил-5'-(R)-С, O-метилентимидина (368 мг; 1,0 ммоль) и цианида калия (325 мг; 5,0 ммоль) в DMF (3 мл) нагревали при 50oC в течение 16 ч, разбавляли этилацетатом (60 мл), промывали солевым раствором (5 х 40 мл), высушивали (Na2SO4) и концентрировали. Неочищенный продукт очищали хроматографией на диоксиде кремния (EtOAc-гексан, 1:1), получая 3'-О-трет-бутилдиметилсилил-5'-(S)-C-цианометилтимидин (173 мг; 42%) в виде твердого вещества белого цвета.
Пример 34
Получение 3'-O-трет-бутилдиметилсилил-5'-C-аллилтимидинов
К суспензии безводного цианида, содержащего одновалентную медь, (7,57 г; 84,7 ммоль) в безводном THF при -5oC в атмосфере аргона по каплям добавляли бромид аллилмагния (2,0 М в THF; 46,6 мл; 93,2 ммоль). Взвесь перемешивали в течение 15 мин при -5oC и по каплям добавляли охлажденный раствор 3'-O-трет-бутилдиметилсилил-5'-формилтимидина (5,0 г; 14,12 ммоль) в THF (200 мл). Реакционную смесь перемешивали при комнатной температуре в течение 6 ч, реакцию останавливали добавлением при 0oC 10%-ного NaHCO3 (150 мл) и разбавляли смесь этилацетатом (200 мл). Органический слой промывали 10%-ным NaHCO3 (2 х 150 мл), высушивали (Na2SO4) и концентрировали, получая 5,18 г неочищенных 3'-O-трет-бутилдиметилсилил-5'-C-аллилтимидинов (содержащих 2 изомера 5'-(R) и 5'-(S)). Эти два изомера (в отношении приблизительно 1:1) были разделены хроматографией на диоксиде кремния в 15% EtOAc в CHCl3.
Пример 35
Получение
3'-O-трет-бутилдиметилсилил-5'-O-(4,4'-диметокситритил)-5'-(S)-C- метоксиметилтимидинов
Смесь 3'-O-трет-бутилдиметилсилил-5'-C-метоксиметилтимидина (258 мг; 0,645 ммоль), диметокситритилхлорида (1,09 г; 3,22 ммоль) и ангидрида трифторметансульфонового серебра (835 мг; 3,22 ммоль) в безводном пиридине (3 мл) нагревали при 50oC в течение 18 ч. Пиридин упаривали, а остаток хроматографировали на диоксиде кремния (EtOAc-гексан, 1:1), получая 372 мг (82%) 3'-O-т-бутилдиметилсилил-5'-O-(4,4'-диметокситритил)-5'-(S)-C- метоксиметилтимидина в виде твердого вещества белого цвета.
Подобным же образом были получены следующие соединения:
3'-O-трет-бутилдиметилсилил-5'-O-(4,4'-диметокситритил)-5'- (S)-C-цианометилтимидин был получен из 3'-O-трет-бутилдиметилсилил-5'-(S)-C-цианометилтимидина;
3'-O-трет-бутилдиметилсилил-5'-O-(4,4'-диметокситритил)-5'- (S)-C-азидометилтимидин был получен из 3'-O-трет-бутилдиметилсилил-5'-(S)-C-азидометилтимидина;
3'-O-трет-бутилдиметилсилил-5'-O-(4,4'-диметокситритил)- 5'-(S)-C-аллилтимидин был получен из 3'-O-трет-бутилдиметилсилил-5'-(S)-C-аллилтимидина;
3'-O-трет-бутилдиметилсилил-5'-O-(4,4'-диметокситритил)- 5'-(R)-C-аллилтимидин был получен из 3'-O-трет-бутилдиметилсилил-5'-(R)-C-аллилтимидина;
3'-O-трет-бутилдиметилсилил-5'-O-(4,4'-диметокситритил)- 5'-(S)-C-трифторацетамидометилтимидин был получен из 3'-O-трет-бутилдиметилсилил-5'-(S)-C-трифторацетамидометилтимидина;
3'-O-(трет-бутилдиметилсилил)-5-О-(4,4'-диметокситритил)- 5'(S)-C-этоксикарбонилметилтимидин был получен из 3'-O-(трет-бутилдиметилсилил)-5'(S)-C-этоксикарбонилметилтимидина.
Пример 36
Получение
5'-O-(4,4'-диметокситритил)-5'-(S)-C-метоксиметилтимидинов
Раствор 3'-O-трет-бутилдиметилсилил-5'-O-(4,4'-диметокситритил)- 5'-(S)-C-метоксиметилтимидина (825 мг; 1,17 ммоль) и TBAF (1,0 М в THF; 3,6 мл; 3,6 ммоль) в THF (15 мл) оставляли при комнатной температуре на 2 ч. THF упаривали и остаток хроматографировали на диоксиде кремния (EtOAc-гексан, 3: 2), получая 551 мг (80%) 5'-O-(4,4'-диметокситритил)-5'-(S)-C-метоксиметилтимидинов.
Подобным же образом были получены следующие соединения:
5'-O-(4,4'-диметокситритил)-5'-(S)-C-цианометилтимидин был получен из 3'-O-трет-бутилдиметилсилил-5'-O-(4,4'-диметокситритил)-5'-(S)- C-цианометилтимидина;
5'-O-(4,4'-диметокситритил)-5'-(S)-C-азидометилтимидин был получен из 3'-О-трет-бутилдиметилсилил-5'-O-(4,4'-диметокситритил)-5'-(S)- C-азидометилтимидина;
5'-O-(4,4'-диметокситритил)-5'-(S)-C-аллилтимидин был получен из 3'-O-трет-битилдиметилсилил-5'-O-(4,4'-диметокситритил)-5'-(S)-C- аллилтимидина;
5'-O-(4,4'-диметокситритил)-5'-(R)-C-аллилтимидин был получен из 3'-O-трет-битилдиметилсилил-5'-O-(4,4'-диметокситритил)-5'-(R)-C- аллилтимидина;
5'-O-(4,4'-диметокситритил)-5'-(S)-C-трифторацетамидометилтимидин был получен из 3'-O-трет-бутилдиметилсилил-5'-O-(4,4'-диметокситритил)-5'-(S)-C- трифторацетамидометилтимидина.
5'(S)-С-ацетоксиметил-5'-O-(4,4'-диметокситритил)тимидин был получен из 5'-(S)-C-ацетоксиметил-3'-O-(трет-бутилметилсилил)-5'-O-(4,4'- диметокситритил)тимидина.
5'(S)-C-азидоэтил-5'-O-(4,4'-диметокситритил)тимидин был получен из 5'(S)-C-азидоэтил-3'-O-(трет-бутилдиметилсилил)-5'-O-(4,4'- диметокситритил)тимидина.
5'(S)-C-ацетилтиопропил-5'-O-(4,4'-диметокситритил)тимидин был получен из 5'(S)-C-ацетилтиопропил-3'-O-трет-бутилдиметилсилил-5'-O-(4,4'- диметокситритил)тимидина.
Пример 37
Получение
3'-(2-цианоэтил-N,N-диизопропилфосфорамидитов)
5'-O-(4,4'-диметокситритил)-5'-(S)-C-метоксиметилтимидинов
К раствору 3'-O-трет-бутилдиметилсилил-5'-O-(4,4'-диметокситритил)-5'-(S)-C- метоксиметилтимидина (490 мг; 0,83 ммоль), диизопропилэтиламина (646 мг; 0,87 мл; 5,0 ммоль) в безводном дихлорметане (5 мл) при 0oC С в атмосфере азота по каплям добавляли раствор 2-цианоэтил-N,N-диизопропилхлорфосфорамидита (592 мг; 2,5 ммоль; 558 мкл) в дихлорметане (1 мл). Раствор перемешивали при комнатной температуре в течение 40 мин, охлаждали до 0oC, разбавляли дихлорметаном (60 мл), промывали холодным 5 %-ным NaHCO3 (3 х мл), высушивали (Na2SO4) и концентрировали. Остаток очищали хроматографией на диоксиде кремния (Et3N-EtOAc:гексан, 5:45:50), получая 584 мг (89%) 3'-(2-цианоэтил-N, N-диизопропилфосфорамидита) 5'-O-(4,4'-диметокситритил)-5'-(S)-C-метоксиметилтимидинов в виде пены.
Подобным же образом были получены следующие соединения:
3'-(2-цианоэтил-N, N-диизопропилфосфорамидит) 5'-O-(4,4'-диметокситритил)-5'-(S)-C-цианометилтимидина был получен из 5'-O-(4,4'-диметокситритил)-5'-(S)-C-цианометилтимидина;
3'-(2-цианоэтил-N, N-диизопропилфосфорамидит) 5'-O-(4,4'-диметокситритил)-5'-(S)-C-азидометилтимидина был получен из 5'-O-(4,4'-диметокситритил)-5'-(S)-C-азидометилтимидина;
3'-(2-цианоэтил-N, N-диизопропилфосфорамидит) 5'-O-(4,4'-диметокситритил)-5'-(S)-C-аллилтимидина был получен из 5'-O-(4,4'-диметокситритил)-5'-(S)-C-аллилтимидина;
3'-(2-цианоэтил-N, N-диизопропилфосфорамидит) 5'-O-(4,4'-диметокситритил)-5'-(R)-C-аллилтимидина был получен из 5'-O-(4,4'-диметокситритил)-5'-(R)-C-аллилтимидина;
3'-(2-цианоэтил-N, N-диизопропилфосфорамидит) 5'-O-(4,4'-диметокситритил)-5'-(S)-C-трифторацетамидометилтимидина был получен из 5'-O-(4,4'-диметокситритил)-5'-(S)-C-трифторацетамидометилтимидина.
3'-(2-цианоэтил-N, N-диизопропилфосфорамидит) 5'-(S)-C-ацетоксиметил-5'-O-(4,4'-диметокситритил)тимидина был получен из 5'(S)-C-ацетоксиметил-5'-O-(4,4'-диметокситритил)тимидина.
3'-(2-цианоэтил-N, N-диизопропилфосфорамидит) 5'-O-(4,4'-диметокситритил)-5'(S)-C-4-[4-(2,4-динитрофенил) имидазол-ацетамидо] метилтимидина был получен из 5'-O-(4,4'-диметокситритил)-5'(S)-C-[(2,4-динитрофенил)имидазол-4- ацетамидо]метилтимидина.
3'-(2-цианоэтил-N, N-диизопропил-фосфорамидит) 5'(R)-Сацетоксипропил-5'-O-(4,4'-диметокситритил)тимидина был получен из 5'-(R)-C-ацетоксипропил-5'-O-(4,4'-диметокситритил)тимидина.
3'-(2-цианоэтил-N, N-диизопропил-фосфорамидит) 5'(S)-Сацетилтиопропил-5'-O-(4,4'-диметокситритил)тимидина был получен из 5'-(S)-C-ацетилтиопропил-5'-O-(4,4'-диметокситритил)тимидина.
Пример 38
Получение
5'(S)-C-бромметил-3'-O-(трет-бутилдиметилсилил)тимидина
К перемешиваемому раствору 3'-O-(трет-бутилдиметилсилил)-5'-C,O-метилентимидина (1,53 г, 4,15 ммоль) в безводном THF (30 мл) при 0oC в атмосфере азота по каплям добавляли бромид метилмагния (1,4 М в толуол-THF, Aldrich, 8,9 мл, 12,45 ммоль) в течение 10 минут. Полученный раствор перемешивали при 0oC в течение 90 минут и по каплям добавляли 2 мл 5%-ного AcOH. Полученную смесь перемешивали в течение 10 минут при 0oC, разбавляли этилацетатом, промывали 5%-ным AcOH, водой, 5%-ным NaHCO3, высушивали (Na2SO4) и концентрировали, получая 1,73 г указанного в заголовке соединения.
Пример 39
Получение
5'-O-(4,4'-диметокситритил)-5'(S)-C-[(2,4-динитрофенил)имидазол- 4-ацетамидо]метилтимидина.
Раствор 5'-O-(4,4'-диметокситритил)-5'-(S)-C- трифторацетамидометилтимидина (160 мг, 0,24 ммоль) в метаноле (2 мл) и 30% NH4OH (2 мл) оставляли при комнатной температуре на ночь. Аммиак и растворители упаривали и остаток упаривали совместно с этанолом (2 х 3 мл). Высушенный неочищенный продукт растворяли в растворе сукцинимидного эфира 1-(2,4-динитрофенил)имидазол-4- уксусной кислоты (112 мг, 0,29 ммоль) в безводном THF (5 мл). Полученный раствор оставляли при комнатной температуре в течение 5 часов. THF упаривали и остаток хроматографировали на диоксиде кремния с 10% метанола в метиленхлориде, получая 149 мг указанного в заголовке соединения в виде желтого твердого вещества.
Пример 40
Получение
5'-(S)-C-бромметил-3'-O-(трет-бутилдиметилсилил)-5'-O-(4,4'- диметокситритил)тимидина
К смеси DMT-Cl (3,72 г, 11,0 ммоль) и трифлата серебра (2,83 г, 11,0 ммоль) в безводном пиридине (5 мл) добавляли раствор 5'(S)-C-бромметил-3'-O-(трет-бутилдиметилсилил)тимидина (1,64 г, 3,65 ммоль) в безводном пиридине (5 мл). Полученную реакционную смесь перемешивали при 45oC в течение 24 часов. Обычная обработка и хроматография на диоксиде кремния приводили к получению 1,92 г (70%) указанного в заголовке соединения в виде бесцветной пены.
Пример 41
Получение
5'(S)-C-ацетоксиметил-3'-O-(трет-бутилдиметилсилил)-5'-O-(4,4'- диметокситритил)тимидина 5'-(S)-C-бромметил-3'-O-(трет-бутилдиметилсилил)-5'-O-(4,4'- диметокситритил)тимидин (2,58 г, 3,44 ммоль) и безводный ацетат натрия (2,82 г, 34,4 ммоль) в безводном DMF (32 мл) перемешивали при 95-100oC в течение 4 суток. Смесь разбавляли этилацетатом, промывали водой пять раз, высушивали (Na2SO4) и концентрировали. Хроматография на диоксиде кремния (EtOAc-гексаны, 1:1) приводила к получению 1,52 г (60%) указанного в заголовке соединения в виде бесцветной пены.
Пример 42
Получение
5'(R)-C-гидроксипропил-5'-O-(4,4'-диметокситритил)-3'-O- (трет-бутилдиметилсилил)тимидина
К перемешиваемому раствору метилсульфида бора (2,0 М в THF, 6,15 мл, 12,31 ммоль) в безводном THF (4 мл) при 0oC в атмосфере аргона по каплям добавляли 5'-(R)-C-аллил-5'-O-(4,4'-диметокситритил)-3'-O-(трет- бутилдиметилсилил)тимидин (1,43 г, 2,05 ммоль) в безводном THF (12 мл). Полученную реакционную смесь перемешивали при 0oC в течение 3 часов, останавливали реакцию медленным добавлением 1 мл метанола с последующим добавлением метанола (23 мл), воды (23 мл) и пербората натрия (1,89 г, 12,31 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 2 часов, нерастворимое твердое вещество отфильтровывали и фильтрат концентрировали. Остаток растворяли в этилацетате, промывали солевым раствором три раза, высушивали (Na2SO4) и концентрировали. Хроматография на диоксиде кремния (EtOAc-гексаны, 1: 1) приводила к получению 0,82 г (56%) указанного в заголовке соединения в виде белой пены.
Пример 43
Получение
5'(R)-C-ацетоксипропил-3'-O-(трет-бутилдиметилсилил)-5'-O-(4,4'- диметокситритил)тимидина
Раствор 3'-O-(трет-бутилдиметилсилил)-5'-O-(4,4'-диметокситритил)- 5'(R)-C-гидроксипропилтимидина (326 мг, 0,455 ммоль) в уксусном ангидриде (0,5 мл) и пиридине (3,5 мл) оставляли при комнатной температуре в течение 2 часов, реакцию останавливали добавлением метанола (0,5 мл) и воды (0,5 мл), перемешивали при комнатной температуре в течение 1 часа, разбавляли этилацетатом, промывали 5%-ным NaHCO3 три раза, высушивали (Na2SO4) и концентрировали. Остаток растворяли в THF (3 мл) и добавляли TBAF (1,0 М, 1,3 мл). Раствор оставляли стоять при комнатной температуре в течение 10 минут, разбавляли этилацетатом, промывали 5%-ным NaHCO3 три раза, высушивали (Na2SO4), и концентрировали. В результате хроматографии на диоксиде кремния (EtOAc-гексаны, 3: 1) получали 237 мг (80,8%) указанного в заголовке соединения в виде бесцветной пены.
Пример 44
Получение
3'-O-(трет-бутилдиметилсилил)-5'(R,S)-C- этоксикарбонилметилтимидина
К смеси 3'-O-(трет-бутилдиметилсилил)-5'-C,O-дидегидротимидина (1,42 г, 4,0 ммоль) и порошка цинка (1,6 г, 24,0 ммоль) при 0oC в атмосфере азота порциями добавляли безводный бензол (50 мл) и этилбромацетат (3,36 г, 2,24 мл, 20,0 ммоль). Полученную смесь перемешивали при 55oC в течение 14 часов. Реакцию останавливали добавлением 10%-ного AcOH в воде при 0oC, разбавляли EtOAc, промывали 10%-ным AcOH, водой, затем 10%-ным NaHCO3, высушивали, концентрировали. Хроматографией на диоксиде кремния с EtOAc-гексанами (2:3) получали 1,22 г указанного в заголовке соединения (617 мг 5'(S)-изомера и 605 мг 5'(R)-изомера, оба в виде белого твердого вещества).
Пример 45
Получение
3'-O-(трет-бутилдиметилсилил)-5'-O-(4,4'-диметокситритил)- 5'(S)-C-гидроксиэтилтимидина
К перемешиваемой суспензии алюмогидрида лития (7,8 ммоль, 297 мг) в безводном THF (20 мл) при -10oC добавляли раствор 3'-O-(трет-бутилдиметилсилил)-5'-O-(4,4'-диметокситритил)- 5'(S)-C-этоксикарбонилметилтимидина (1,16 г, 1,56 ммоль) в THF (20 мл). Полученную смесь перемешивали при -5oC в течение 2 часов. Реакцию останавливали добавлением EtOAc и 10%-ного AcOH. Смесь разбавляли EtOAc, промывали солевым раствором три раза, высушивали и концентрировали. Хроматографией на диоксиде кремния с EtOAc-гексанами (1:1) получали 710 мл указанного в заголовке соединения в виде белого твердого вещества.
Пример 46
Получение
3'-O-(трет-бутилдиметилсилил)-5'-O-(4,4'-диметокситритил)-5' (S)-C-(пара-толуолсульфонилоксиэтил)тимидина
К перемешиваемому раствору 3'-O-(тpeт-бутилдимeтилcилил)-5'-O-(4,4'-диметокситритил)-5(S)-C- гидроксиэтилтимидина (0,82 ммоль, 580 мг) и DMAP (51 мг, 0,42 ммоль) в безводном пиридине (3 мл) добавляли раствор Ts-Cl (237 мг, 1,24 ммоль) в пиридине (2 мл). Полученную смесь перемешивали при комнатной температуре в течение 14 часов. Реакцию останавливали перемешиванием с 0,5 мл 10%-ного NaHCO3 при 0oC в течение 30 минут. Смесь разбавляли EtOAc, промывали солевым раствором три раза, высушивали и концентрировали, получая указанное в заголовке соединение в виде светло-желтой пены.
Пример 47
Получение
5'(S)-C-азидоэтил-3'-O-(трет-бутилдиметилсилил)-5'-O-(4,4'- диметокситритил)тимидина
Смесь 3'-O-(трет-бутилдиметилсилил)-5'-O-(4,4'-диметокситритил)- 5'(S)-C-пара-толуолсульфонилокси-этилтимидина (0,82 ммоль) и азида натрия (269 мг, 4,61 ммоль) в безводном DMF (5 мл) перемешивали при комнатной температуре в течение 24 часов. Смесь разбавляли EtOAc, промывали 5%-ным NaHCO3 три раза, солевым раствором три раза, высушивали и концентрировали, получая указанное в заголовке соединение в виде светло-желтой пены.
Пример 48
Получение
3'-O-(трет-бутилдиметилсилил)-5'(S)-C-(2,3-дигидроксипропил)- 5'-O-(4,4'-диметокситритил)тимидина
К смеси 5'(S)-C-аллил-3'-O-(трет-бутилдиметилсилил)-5'- O-(4,4'-диметокситритил)тимидина, N-метилморфолин-N-оксида (60% в воде, 0,24 мл, 1,38 ммоль), пиридина (0,28 мл) и воды (0,3 мл) в трет-бутаноле (5 мл) добавляли раствор 2,5% OsO4 в трет-бутаноле (55 мкл). Полученную смесь перемешивали в атмосфере азота при 70oC в течение 5 часов, охлаждали до комнатной температуры, разбавляли EtOAc, промывали солевым раствором три раза, высушивали и концентрировали. Хроматографией на диоксиде кремния с EtOAc-гексанами (2:1) получали 18 мг указанного в заголовке соединения (73 мг диастереомера I с более высоким значением Rf и 108 мг диастереоизомера II с более низким Rf) в виде белой пены.
Пример 49
Получение
3'-O-(трет-бутилдиметилсилил)-5'(S)-C-формилметил)-5'-O-(4,4'- диметокситритил)тимидина
К суспензии ацетата свинца (0,064 ммоль, 28,5 мг) в безводном бензоле (1 мл) при 0oC добавляли 3'-О-(трет-бутилдиметилсилил)5'(S)-C-(2,3-дигидроксипропил)-5'-O- (4,4-диметокситритил)тимидин (39 мг, 0,053 ммоль) в бензоле (1 мл). Полученную смесь перемешивали при комнатной температуре в течение 1,5 часов, охлаждали до 0oC, добавляли 10%-ный NaHCO3 (1,5 мл) и перемешивали в течение 5 минут. Слой бензола отделяли и водный слой экстрагировали EtOAc. Объединенный органический слой промывали 10%-ным NaHCO3, высушивали и концентрировали, получая указанное в заголовке соединение в виде бесцветной пены почти количественно.
Пример 50
Получение 3'-O-(трет-бутилдиметилсилил)-5'-O-(4,4'- диметокситритил)-5'(R)-C-формилэтилтимидина
К перемешиваемому раствору 3'-O-(трет-бутилдиметилсилил)-5'-O- (4,4'-диметокситритил)-5'(R)-C-гидроксипропилтимидина (500 мг, 0,625 ммоль) и DCC (390 мг, 1,87 ммоль) в безводном DMSO (5 мл) при 10oC в атмосфере аргона добавляли раствор пиридина и TFA (1,0 М пиридин и 0,5 М TFA, 0,63 мл) в безводном THF (12 мл). Полученную реакционную смесь перемешивали при комнатной температуре в течение ночи и добавляли 10%-ный NaHCO3 (0,5 мл). Смесь перемешивали при комнатной температуре в течение 2 часов, осадок отфильтровывали и промывали DMSO. Фильтрат разбавляли EtOAc, промывали 5%-ным NaHCO3, высушивали (Na2SO4) и концентрировали. Хроматографией на диоксиде кремния (EtOAc-гексаны 1:1) получали 406 мг указанного в заголовке соединения в виде бесцветной пены.
Пример 51
Получение 3'-O-трет-бутилдиметилсилил-5'-O-(4,4'-диметокситритил)- 5'(S)-C-метилсульфонилоксипропилтимидина
К перемешиваемому раствору 3'-O-(трет-бутилдиметилсилил)-5'-O- (4,4'-диметокситритил)-5'(S)-C-гидроксипропилтимидина (0,62 г, 0,86 ммоль) и DMAP (53 г, 0,43 ммоль) в пиридине (5 мл) при 0oC по каплям добавляли метансульфонилхлорид (0,20 мл, 2,60 ммоль). Полученную реакционную смесь перемешивали при комнатной температуре в течение 3 часов и затем реакцию останавливали при 0oC добавлением 1,0 мл 10%-ного NaHCO3. После перемешивания в течение 10 минут смесь разбавляли этилацетатом, дважды промывали 10%-ным NaHCO3, высушивали (Na2SO4) и концентрировали. Хроматографией на диоксиде кремния (Et0-Ас-гексаны 1: 1) получали 487 мг (71%) указанного в заголовке соединения в виде белой пены.
Пример 52
Получение 5'(S)-C-ацетилтиопропил-3'-O-(трет-бутилдиметилсилил)- 5'-O-(4,4'-диметокситритил)тимидина
К сухой смеси 3'-O-трет-бутилдиметилсилил-5'-O-(4,4- диметокситритил)-5'(S)-C-метил-сульфонилоксипропилтимидина (487 мг, 0,61 ммоль) и тиоацетата калия (700 мг, 6,1 ммоль) при 0oC добавляли DMF (безводный, 9,0 мл). Полученную реакционную смесь перемешивали при комнатной температуре в течение ночи, разбавляли этилацетатом, промывали солевым раствором пять раз, высушивали (Na2SO4) и концентрировали. Хроматографией на диоксиде кремния (EtOAc-гексаны 1:1) получали 468 мг (97%) указанного в заголовке соединения в виде белой пены.
Пример 53
Получение 5'(S)-C-ацетилтиопропил-3'-O-(трет-бутилдиметилсилил) тимидина
Раствор 5'(S)-C-ацетилтиопропил-3'-O-трет-бутилдиметилсилил-5'- O-(4,4'-диметокситритил)тимидина (600 мг, 0,77 ммоль) в 20 мл 80%-ного AcOH (20% воды) перемешивали при комнатной температуре в течение 30 минут и затем концентрировали для удаления большей части растворителей. Остаток растворяли в этилацетате, дважды промывали водой, 10%-ным NaHCO3, снова водой, высушивали (Na2SO4) и концентрировали. Остаток хроматографировали на диоксиде кремния (EtOAc-гексаны 1:1), получая 200 мг указанного в заголовке соединения в виде белой пены.
Пример 54
Получение
3'-O-(трет-бутилдиметилсилил)-5'(R,S)-C-нитрометилтимидина
Раствор 3'-O-трет-бутилдиметилсилил-5'-C, O-дидегидротимидина (650 мг, 1,83 ммоль), нитрометана (3,66 ммоля, 225 мг), триметиламина (5,5 ммоль, 555 мг) в безводном метиленхлориде (5 мл) оставляли стоять при комнатной температуре в течение 18 часов. Растворитель упаривали и остаток хроматографировали на диоксиде кремния (20% этилацетата в хлороформе), получая 491 мг указанного в заголовке соединения (405 мг диастереомера I с более высоким значением Rf и 85 мг диастереомера II с более низким Rf).
Пример 55
Получение 1'-циано-3'-трет-бутилдиметилсилил-5'-(4,4'- диметокситритил)тимидина
1'-циано-5'-(4,4'-диметокситритил)тимидин в безводном пиридине добавляли к перемешиваемому раствору трет-бутилдиметилхлорсилана (1,5 эквивалента) и имидазола (3,0 эквивалента) в безводном пиридине при температуре 0oC. Полученную реакционную смесь перемешивали при комнатной температуре в течение ночи. Пиридин упаривали, а остаток растворяли в этилацетате и промывали солевым раствором. Неочищенный продукт непосредственно используют в следующей реакции.
Пример 56
Получение 3'-т-бутилдиметилсилил-5'-диметокситритил-1'-формил-5-метоксибензилтимидина
3'-Трет-бутилдиметилсилил-1'-циано-5'- диметокситритил-5-(метоксибензил)тимидин (1,0 ммоль) в THF добавляют к перемешиваемому раствору триэтоксиалюмогидрида лития (2,0 ммоль) в THF при температуре -20oC в атмосфере азота. Реакционную смесь перемешивают при 5-10oC в течение 1 ч, реакцию останавливают водным раствором хлорида аммония. Смесь экстрагируют этилацетатом и неочищенный продукт хроматографируют на диоксиде кремния.
Пример 57
Получение 1'-амидо-3',5',5-трис(метоксибензил)тимидина
1'-амидо-3', 5',5-трис(метоксибензил)тимидин добавляют к перемешиваемому водному раствору 30%-ной перекиси водорода и карбоната натрия при 0oC. Реакционную смесь перемешивают при комнатной температуре в течение 2 ч, разбавляют водой, нейтрализуют разбавленной соляной кислотой, экстрагируют дихлорметаном. Неочищенный продукт очищают хроматографией.
Пример 58
Получение 1'-амино-3',5',5-трис(метоксибензил)тимидина
Методика получения аналогична описанной в литературе (Radhakrishna A.S., Parham М. Е. , Riggs R.M. and Loudon G.M. J. Org. Chem. (1979), 44, 1746). 1'-циано-3', 5', 5-трис(метоксибензил)тимидин (1 ммоль) в безводном THF добавляют к перемешиваемому раствору 1,1-бис(трифторацетоксийод) бензола (2,0 ммоль) в THF при 0oC. Реакционную смесь перемешивают при комнатной температуре в течение 5 ч, разбавляют дихлорметаном, промывают 5%-ным карбонатом натрия и солевым раствором. Неочищенный продукт очищают хроматографией.
Пример 59
Получение бромида триметил-3', 5', 5-трис(метоксибензил)тимидин-1'-ил аммония
1'-Амино-3', 5',5-трис(метоксибензил)тимидин добавляют к перемешиваемому раствору метилбромида (10 эквивалентов) в THF при 0oC С. Реакционную смесь перемешивают при температуре 50oC в течение ночи. Растворитель упаривают и неочищенный продукт очищают перекристаллизацией.
Пример 60
Получение 1'-бром-3',5',5-трис(метоксибензил)тимидина
Методика получения аналогична описанной в литературе (Deady L.M., Korytsky O. L. Tetrahedron Lett. (1979), 451). Бромид триметил-3',5',5-трис(метоксибензил)тимидин-1-ил аммония нагревают при 150oC в вакууме в течение ночи. Полученный продукт непосредственно используют в следующей реакции.
Пример 61
Получение 1'-этокси-3',5',5-трис(метоксибензил)тимидина
1'-Бром-3', 5', 5-трис(метоксибензил)тимидин в этаноле добавляют к перемешиваемому раствору этоксида натрия в этаноле при -10oC. Полученную реакционную смесь перемешивают при комнатной температуре в течение 1 ч, нейтрализуют разбавленным раствором соляной кислоты. Этанол упаривают и оставшуюся смесь экстрагируют этилацетатом. Неочищенный продукт очищают хроматографией, получая α и β диастереомеры.
Подобным же образом получают следующие соединения:
1'-(4-нитробутокси)-3',5',5-трис(метоксибензил)тимидин из 1'-бром-3',5', 5-трис(метоксибензил)тимидина и 4-нитробутанола-1;
1'-этилтио-3', 5', 5-трис(метоксибензил)тимидин из 1'-бром-3', 5', 5-трис(метоксибензил)тимидина и тиоэтоксида натрия.
Пример 62
Получение 1'-аминотимидина
Суспензию 1'-амино-3',5',5-трис(метоксибензил)тимидина и 10% палладия-на-угле в этаноле встряхивают в аппарате для гидрирования под давлением водорода 50 фунт-сила/кв.дюйм (345 кПа) в течение 24 ч. Твердый материал отфильтровывают и фильтрат концентрируют. Неочищенный продукт очищают перекристаллизацией.
Пример 63
Получение модифицированных по сахарной составляющей олигонуклеотидов
Данный пример иллюстрирует применение Соединения 55 (фиг. 8) для синтеза олигонуклеотида с последовательностью:
5'-d(ATC TCT CCG CTT CCT* TT* С)-3'
В этой последовательности А, С, G и Т представляют собой немодифицированные дезоксирибонуклеозиды, а Т представляет собой 5'-C-аминометилтимидин. Синтез олигонуклеотида из данного примера был осуществлен с помощью ДНК-синтезатора Synthesizer ABI 394. Все нуклеозиды вводятся с использованием фосфорамидитного метода. Включение dA, dC, dC, dG и Т осуществляют, применяя стандартные реагенты для синтеза ДНК и стандартную методику. Ввиду стерических препятствий, обусловленных наличием разветвленного заместителя в положении C5' тимидина, включение T* проводят, используя более продолжительный период времени (5 минут). После синтеза обработку синтезированного олигонуклеотида проводят по стандартной методике. Неочищенный олигонуклеотид очищали с помощью хроматографии с обращенной фазой на колонке C18 системы ВЭЖХ фирмы Beckman, используя TE-AA буфер (рН 7,0) и ацетонитрил в качестве подвижной фазы. Для очищенного олигонуклеотида были получены значения OD 62,4.
Подобным образом были синтезированы следующие олигонуклеотиды, модифицированные по сахарной составляющей:
5'-C-разветвленные модифицированные по сахарной составляющей олигонуклеотиды:
1. 5'-TTCCTGTCTGATGGCTTC-3'
2. 5'-XXCCTGTCTGATGGCTTC-3'
3. 5'-TTCCTGTCXGATGGCTTC-3'
4. 5'-ATCTCTCCGCTTCCTTTC-3'
5. 5'-ATCTCTCCGCTTCCTTXC-3'
6. 5'-ATCTCTCCGCTTCCTXXC-3'
7. 5'-ATCTCXCCGCTXCCTTTC-3'
8. 5'-ATCTCTCCGCTTCCTTYC-3'
9. 5'-ATCTCTCCGCTTCCTYYC-3'
10. 5'-ATCTCTCCGCTTCCYTYC-3'
11. 5'-AYCTCYCCGCTYCCTTYC-3'
12. 5'-ATCTCTCCGCTTCCTTZС-3'
13. 5'-ATCTCTCCGCTTCCTZZC-3'
14. 5'-ATCTCTCCGCTTCCZTZC-3'
15. 5'-ATCTCTCCGCTTCCTTVC-3'
16. 5'-ATCTCTCCGCTTCCTVVC-3'
17. 5'-ATCTCTCCGCTTCCVTVC-3'
18. 5'-ATCTCVCCGCVTCCTTTC-3'
19. 5'-AVCTCTCCGCTTCCTTTC-3'
20. 5'-ATCTCTCCGCTTCCTTWC-3'
21. 5'-ATCTCTCCGCTTCCTWWC-3'
22. 5'-ATCTCTCCGCTTCCWTWC-3'
23. 5'-ATCTCWCCGCWTCCTTTC-3'
24. 5'-AWCTCTCCGCTTCCTTTC-3'
X= 5'-(S)-C-метоксиметилтимидин, Y= 5'-(S)-C-аминометилтимидин, Z=5'-(S)-C-цианометилтимидин, V=5'-(S)-C-аллилтимидин и W=5-(R)-C-аллилтимидин.
4'-C-разветвленные модифицированные по сахарной составляющей олигонуклеотиды:
25. 5'-ATCTCTCCGCTTCCTTTC-3'
26. 5'-ATCTCTCCGCTTCCTTXC-3'
27. 5'-ATCTCTCCGCTTCCTXXC-3'
28. 5'-ATCTCTCCGCTTCCXTXC-3'
29. 5'-AXCTCTCCGCTTCCTTTC-3'
30. 5'-ATCTCXCCGCTXCCTTTC-3'
31. 5'-ATCTCTCCGCTTCCTTYC-3'
32. 5'-ATCTCTCCGCTTCCTYXC-3'
33. 5'-ATCTCTCCGCTTCCYTXC-3'
34. 5'-AYCTCTCCGCTTCCXTXC-3'
35. 5'-ATCTCYCCGCTYCCTTTC-3'
X=4'-C-метоксиметилтимидин, Y=4'-C-аминометилтимидин.
3'-C-разветвленные модифицированные по сахарной составляющей олигонуклеотиды:
36. 5'-ATCTCTCCGCTTCCTTTC-3'
37. 5'-ATCTCTCCGCTTCCTTXC-3'
38. 5'-ATCTCTCCGCTTCCTXXC-3'
39. 5'-ATCTCTCCGCTTCCXTXC-3'
40. 5'-ATCTCTCCGCXTCCTTTC-3'
41. 5'-AXCTCTCCGCTTCCTTTC-3'
42. 5'-ATCTCTCCGCTTCCTTYC-3'
43. 5'-ATCTCTCCGCTTCCTYYC-3'
44. 5'-ATCTCTCCGCYTCCTTTC-3'
45. 5'-AYCTCTCCGCTTCCXTXC-3'
46. 5'-ATCTCYCCGCTYCCTTTC-3'
47. 5'-ATCTCTCCGCTTCCTTZC-3'
48. 5'-ATCTCTCCGCTTCCTZZC-3'
49. 5'-ATCTCTCCGCTTCCZTZC-3'
X=3'-C-аминометилтиvидин, Y=3'-C-метилтимидин, Z=3'-C-цианометилтимидин.
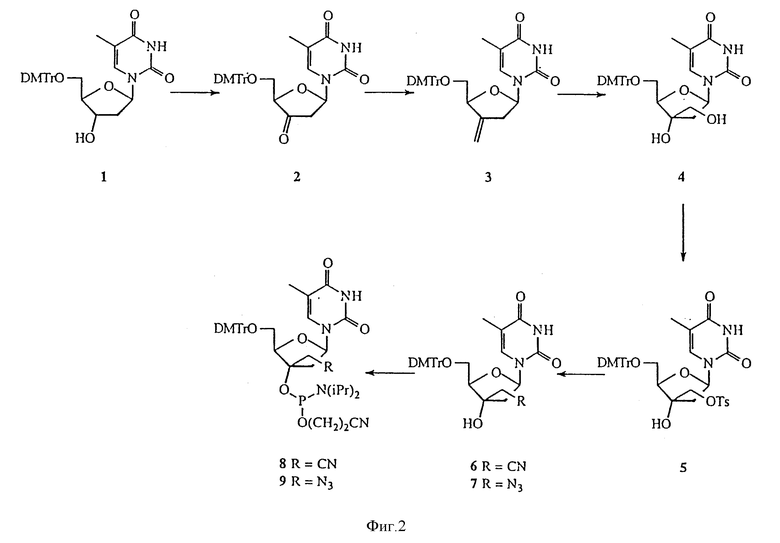
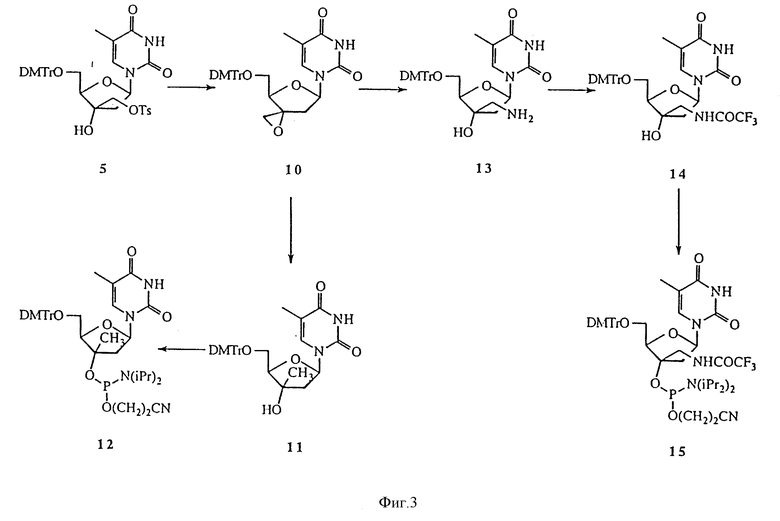
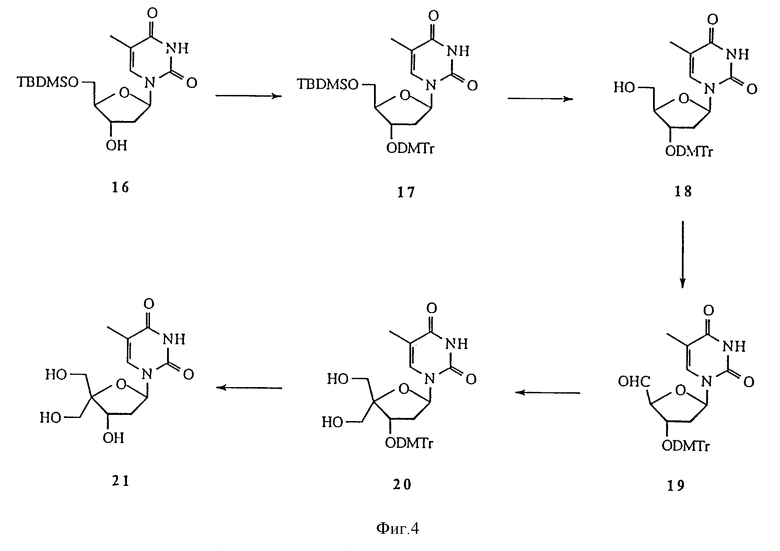
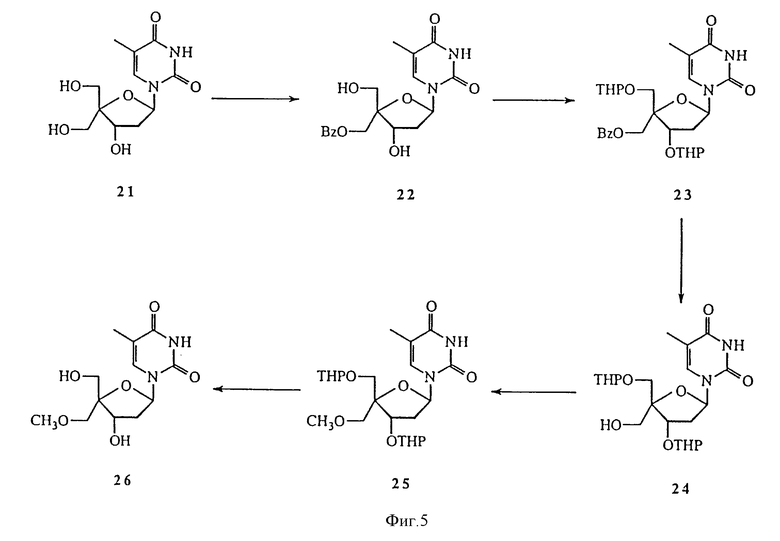
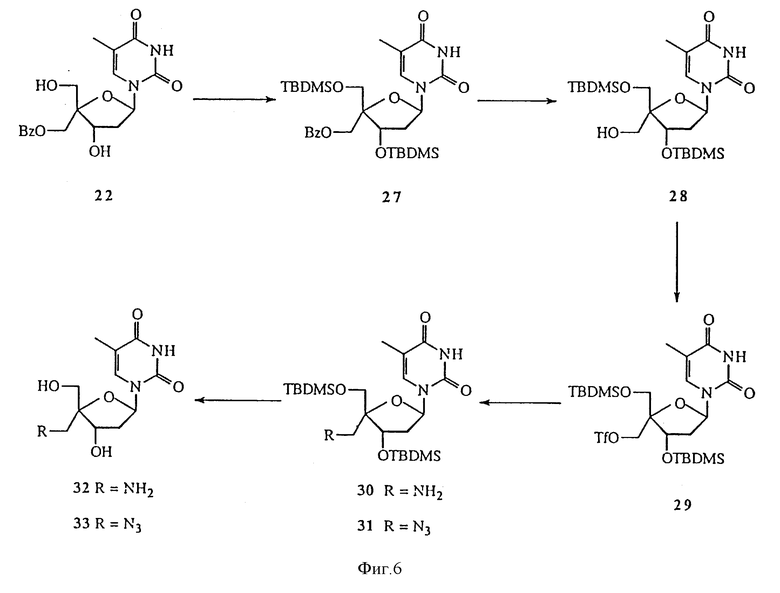
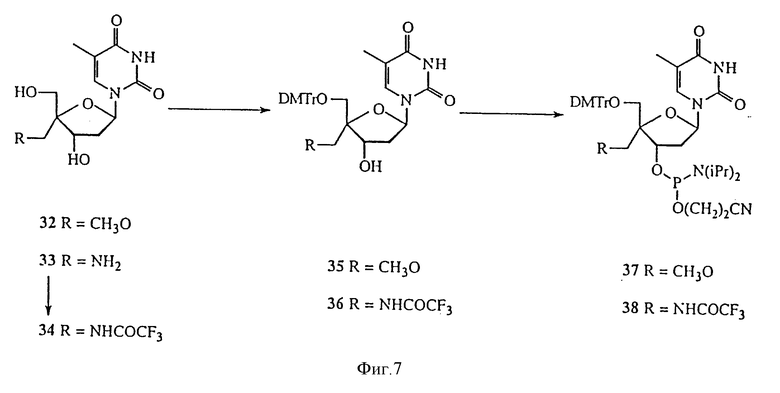
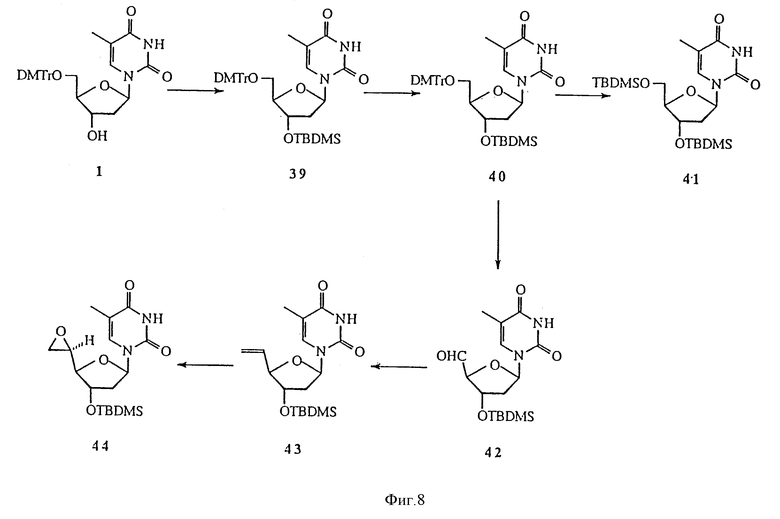
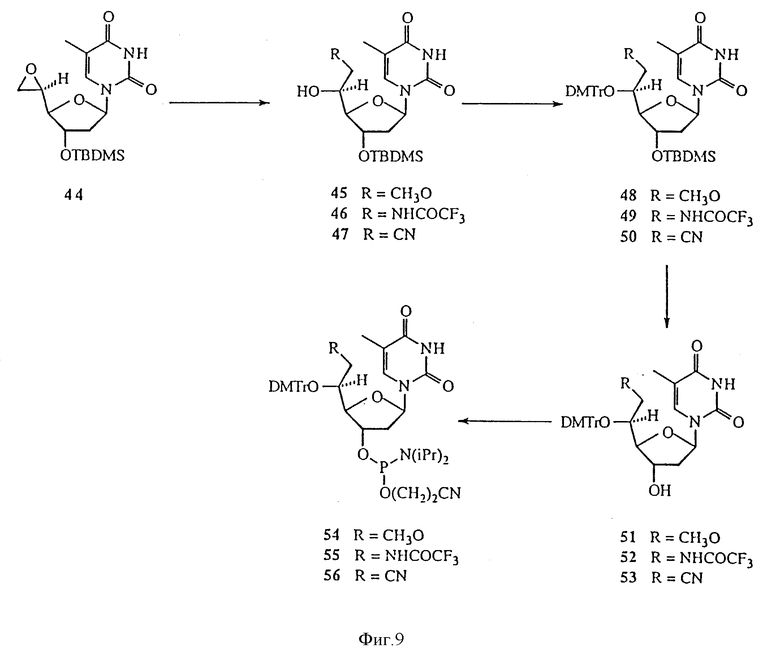
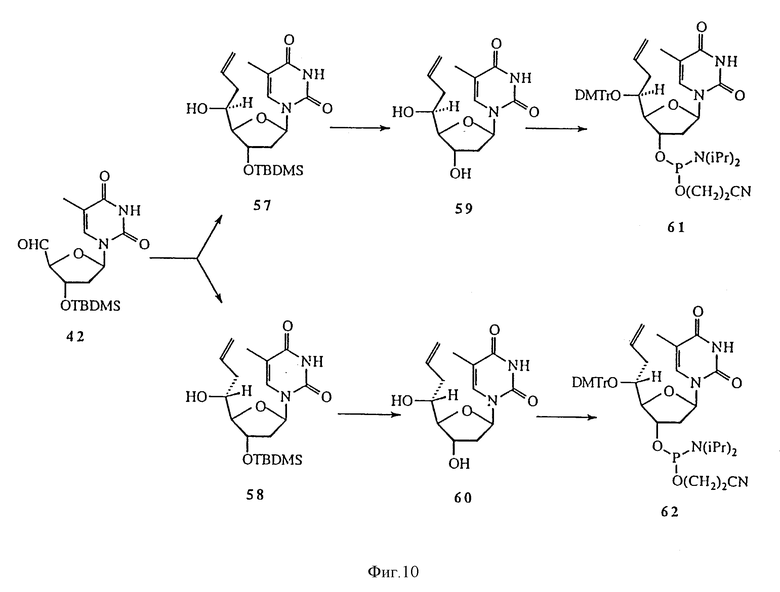
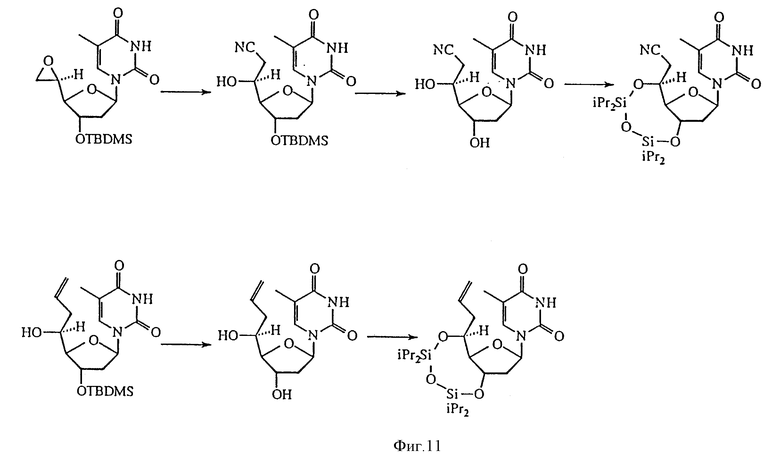
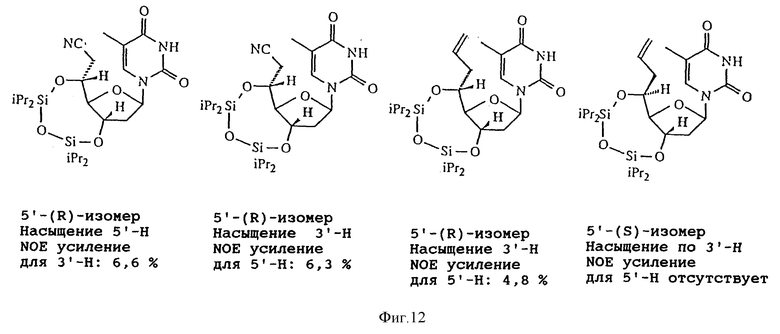

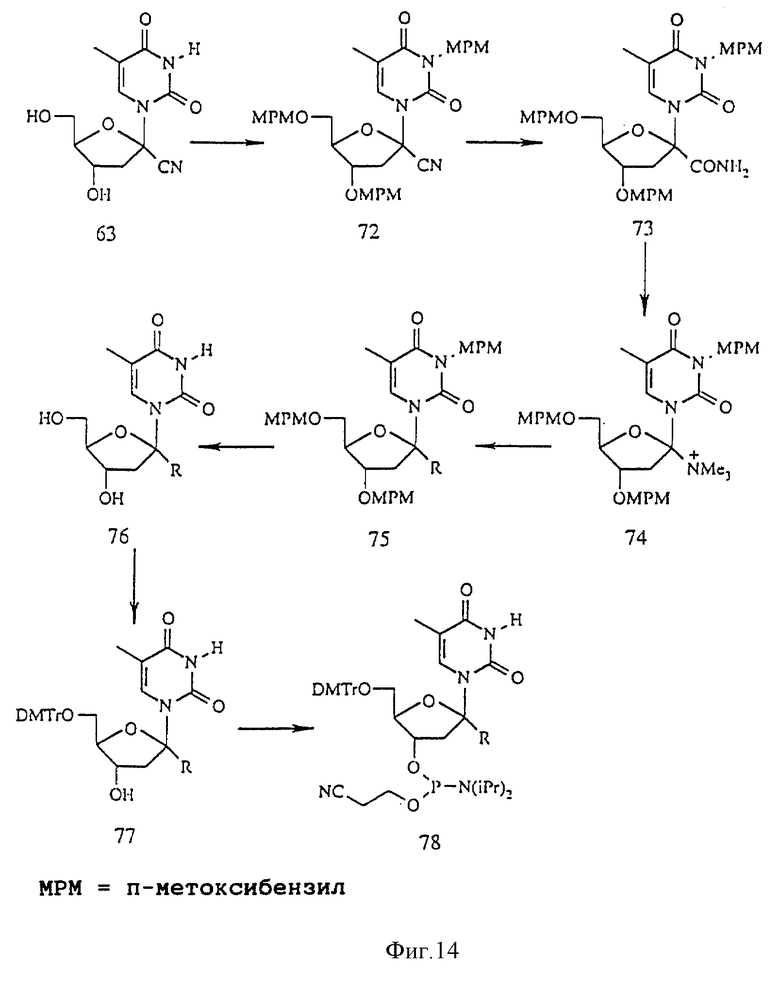
Описываются новые нуклеозиды с модифицированными сахарами общей формулы (I), где значения R'1, R1-R5, R'5, R'3, X, В указаны в п.1 формулы изобретения. Возможно применение данных олигонуклеотидов с модифицированной сахарной составляющей в качестве антисмысловых терапевтических средств, поскольку предполагается, что они обладают повышенной устойчивостью к нуклеазам и поглощением клетками, при этом сохраняя специфичность и сродство к последовательности нуклеиновых кислот-мишеней in vitro или in vivo. Описываются также олигонуклеотиды. 4 c. и 16 з.п. ф-лы, 14 ил.
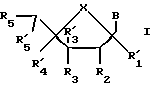
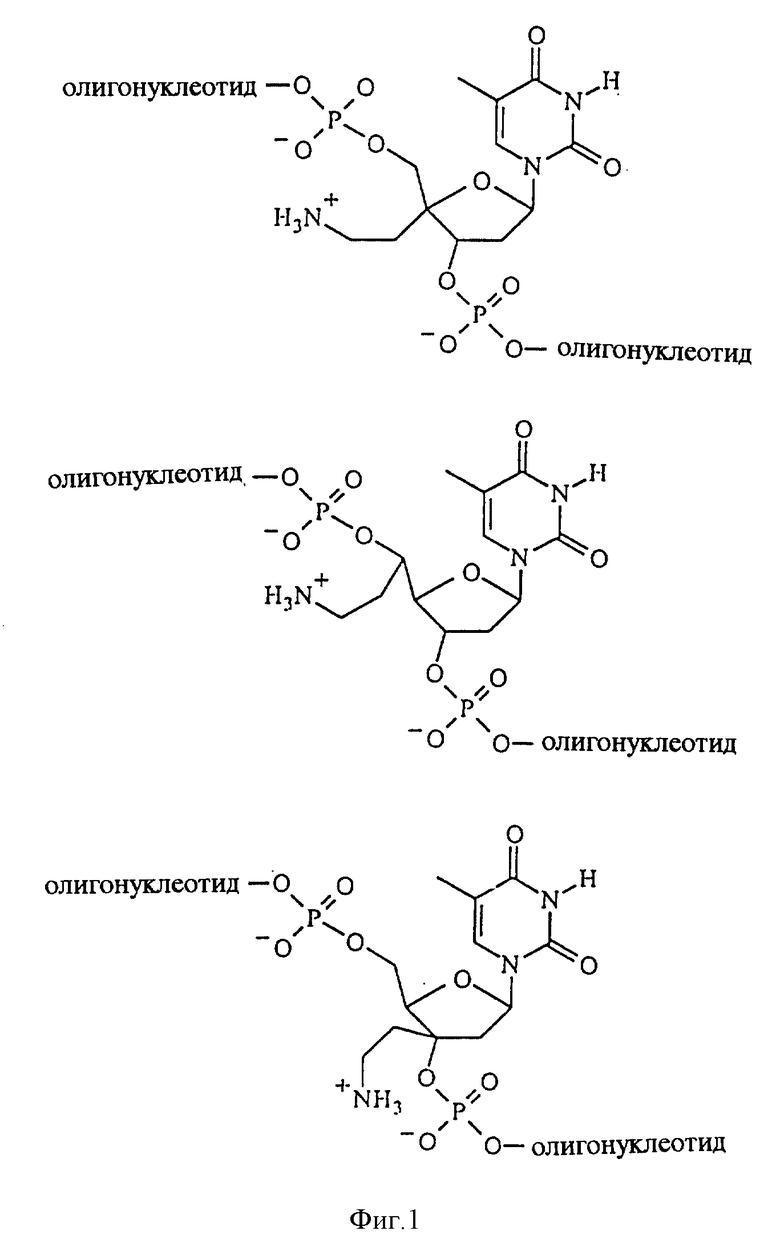
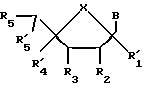
где В - нуклеозидное основание, такое, как тимин, любая арильная составляющая R'1, R'3, R'4 и R'5 представляет собой фенил, полицикл или гетероцикл;
R2 - Н, Х - S, O, СН2,
и, если
(I) R3 и R5 независимо выбраны из группы, состоящей из ОН, 2-цианоэтил-(N,N-диизопропил)фосфорамидитной или гидроксиблокирующей группы, то
(А) Х представляет S, СН2;
R'1, R'3, R'4 и R'5 независимо выбраны из группы, состоящей из Н, СN, N3, NО2, СF3, алкила С1-С10, при условии, что R'1, R'3, R'4 и R'5 не могут быть одновременно Н, а алкил может быть замещен одной из групп СN, NH2, ОН, Br, SO3R, СООR, где R - ацетил, СF3СО, тозил;
(Б) где Х представляет О;
R'1 выбирают из группы, состоящей из N3, NО2, СF3, алкила С1-С10, алкил может быть замещен одной из групп NО2, N3, СF3, Br;
R'3, R'4 и R'5 все являются Н;
(В) где Х представляет собой О;
R'3 выбран из группы, состоящей из СN, N3, замещенного алкила, где заместителем является СN, N3, NН2,
R'1, R'4 и R'5 все являются Н;
(II) где Х представляет О;
один из радикалов R3 и R5 представляет межнуклеотидную связь, а другой выбран из группы, состоящей из ОН, межнуклеотидной связи и гидроксиблокирующей группы, R' - обозначает Н, а два радикала из R'3, R'4 и R'5 обозначают Н, а третий модифицирован, как указано ниже:
(А) R'3 выбран из группы, состоящей из замещенного алкила С1-С10, аралкила C1-C10, арила, замещенного арила, а заместитель у алкила С1-С10 иной, чем ОН;
(Б) R'4 выбран из группы, состоящей из замещенного алкила С1-С10, аралкила С1-С10, арила, замещенного арила, радикала с высокой электроотрицательностью, СF3 или NО2 и заместитель у алкила С1-С10 и арила иной, чем ОН, NН2;
(В) когда R5 обозначает межнуклеотидную связь, R'5 выбран из группы, состоящей из замещенного алкила С1-С10, аралкила С1-С10, арила, замещенного арила и заместитель у алкила С1-С10 иной, чем NН2.
| Способ получения динуклеотидов | 1983 |
|
SU1404512A1 |
| US 5190969 A, 1993 | |||
| TETRAHEDRON LETTERS | |||
| Способ сопряжения брусьев в срубах | 1921 |
|
SU33A1 |
| TETRAHEDRON | |||
| Способ смешанной растительной и животной проклейки бумаги | 1922 |
|
SU49A1 |
Авторы
Даты
2000-02-27—Публикация
1995-11-02—Подача