Изобретение относится к области медицины, а именно к препаративной биохимии и фармацевтической промышленности и касается пептидов, обладающих иммуностимулирующей активностью, способа их получения, лекарственного препарата Спленопид, созданного на их основе, и его применения.
В настоящее время показана клиническая эффективность лечения инфекционных, гнойно-септических и онкогематологических заболеваний цитокинами, которые являются растворимыми факторами иммунокомпетентных клеток и представлены пептидами. Цитокины получают в чистом виде из природных источников сырья: тимуса и костного мозга млекопитающих, а также из клеток, стимулированных митогенами. В настоящее время широко известны цитокины, полученные химическим и рекомбинантным синтезом. Для повышения эффективности их применения проводятся попытки создания фармацевтических композиций, содержащие широкий набор синтетических цитокинов.
Что же касается селезенки млекопитающих, то известно, что перфузат селезенки свиньи обладает выраженной иммуностимулирующей активностью, обусловленной комплексом нативных цитокинов: интерлейкина-1, интерлейкина-2, интерферона-гамма, фактора некроза опухоли-альфа, гранулоцитарно-макрафагального колониестимулирующего фактора [1]. Однако попытки получения чистых биологически активных пептидов из селезенки довольно немногочисленны. Так, известен способ получения иммуностимулятора пептидной природы из селезенки млекопитающих [2]. Согласно этому способу селезенку свиньи или крупного рогатого скота промывают водой или ацетоном, измельчают, замораживают при -5oC, экстрагируют 3%-ной уксусной кислотой при pH 3,0-4,0 в присутствии хлористого цинка, центрифугируют, перемешивают с ацетоном, получают осадок, который растворяют в воде в присутствии уксусной кислоты с последующей фильтрацией и лиофилизацией. Однако полученный препарат содержит комплекс пептидов с неопределенным молекулярным весом, не обладает высокой стимулирующей активностью, а также содержит большое количество посторонних примесей.
Известна пептидсодержащая фракция, выделенная из селезенки свиньи или крупного рогатого скота, с молекулярной массой от 10000 до 140000 дальтон [3] . Указанная пептидсодержащая фракция содержит не только чистые белки, но и около 20-25 аминокислот. Что же касается способа ее получения, то он является аналитическим, поскольку для выделения фракции с указанной молекулярной массой необходимо разделение пептидсодержащей смеси с помощью хроматографии высокого давления. Способ заключается в промывании селезенки, ее измельчении, замораживании, экстрагировании фосфатным буфером, отделении осадка центрифугированием, ультрафильтрации надосадочной жидкости, сорбции на гельфосфате кальция и выделении указанной фракции жидкостной хроматографией высокого давления, ее стерилизующей фильтрации и лиофилизации.
Разработан способ получения и изучены некоторые свойства иммуномодулятора пептидной природы из селезенки свиньи с молекулярной массой пептидов от 700 до 15000 дальтон с последующей лиофилизацией продукта [4]. Полученный модулятор обладает высокой стимулирующей активностью, однако содержит также и примеси. Что же касается чистых пептидов, выделенных из селезенки, то известен пептид hil-2, выделенный из супернатанта клеток селезенки, стимулированных конконавалином А, который является разновидностью интерлейкина-2 и состоит из 140 аминокислот, обладая многими свойствами интерлейкина-2 [5], а также спленопептид, являющийся пентапептидом, с иммунологическими свойствами, подобными спленину [6]. Эти пептиды могут употребляться в нейтральной или солевой форме, могут включать небелковую часть, а также различные добавки, которые их делают пригодными для применения в виде инъекций, однако область их применения весьма ограничена. В то же самое время в литературе описано применение перфузатов ксеноселезенки для лечения больных с обширными гнойно-деструктивными заболеваниями легких и плевры с осложненным течением [7] , а также спленоперфузии для лечения таких аутоиммунных заболеваний, как системная красная волчанка, ревматоидный артрит и бронхиальная астма [8], при этом лечебный эффект обусловлен свойствами этого органа вырабатывать большое количество иммуномодулирующих веществ пептидной природы.
В связи с изложенным, задача изобретения заключается в поисках фракции пептидов, ответственных за активность, которой обладают перфузаты селезенки, выделении их в чистом виде с сохранением высокой иммуностимулирующей активности и низкой реактогенности, а также в создании препарата, представляющего фармацевтическую композицию, содержащую выделенные пептиды и фармакологически пригодный наполнитель, который позволяет получить препарат в лиофилизированной форме, пригодный к длительному хранению и парентеральному введению с минимальным аллергизирующим эффектом. Дополнительное применение препарата Спленопид показало высокую эффективность лечения тяжелых форм гнойно-септических и аутоиммунных заболеваний и позволило снизить количество применяемых глюкокортикостероидов.
Сущность изобретения заключается в получении пептидов из клеток ткани селезенки с молекулярной массой 400-50000 дальтон, полученных стимуляцией митогеном в процессе отмывки ткани селезенки, разрушением клеток диспергированной в воде, предварительно гомогенизированной ткани и ультрафильтрацией отделенного экстракта через фильтры с размером пор с границей раздела 50000 дальтон.
Способ получения пептидов, обладающих иммуностимулирующей активностью, включает стимуляцию клеток ткани селезенки млекопитающих митогеном одновременно с отмывкой органа разрушением клеток замораживанием-размораживанием ткани, диспергированной в дистиллированной воде после предварительной гомогенизации органа с последующей ультразвуковой обработкой, отделение экстракта и его ультрафильтрацию через капиллярные фильтры с размером пор с границей раздела 50000 дальтон.
Лекарственный препарат Спленопид, обладающий иммуностимулирующей активностью, представляет собой пептиды из клеток ткани селезенки с молекулярной массой 400-50000 дальтон, полученных стимуляцией митогеном в процессе отмывки ткани селезенки, разрушением клеток предварительно гомогенизированной ткани, диспергированной в дистиллированной воде, и ультрафильтрацией отдельного экстракта через фильтры с размером пор с границей раздела 50000 дальтон, взятые в количестве 10-15 мг белка в дозе, и физиологически пригодный наполнитель, в качестве которого может быть использован желатиноль с гентамицином. Препарат получают в лиофилизированной форме посредством лиофильного высушивания пептидов с наполнителем, включающего замораживание лиофилизата при -35oC и высушивания в течение 48 часов в сублимационной камере при -30o и вакууме 0,1 Тор.
Способ лечения гнойно-септических заболеваний включает на фоне комплексной терапии дополнительное внутримышечное введение больному лекарственного препарата Спленопид ежедневно, однократно в течение суток в количестве 5-20 мг белка в течение 3-10 дней.
Способ лечения аутоиммунных заболеваний включает дополнительное внутримышечное введение больному лекарственного препарата Спленопид ежедневно, однократно в течение суток в количестве 5-20 мг белка в течение 3-10 дней.
Изобретение реализуется следующим образом.
Стерильно забранную селезенку свиньи или крупного рогатого скота отмывают физиологическим раствором, содержащим митогенный стимулятор фитогемагглютинин или конконавалин А для митогенной стимуляции спленоцитов. Селезенку помещают в транспортный контейнер при температуре 4-6oC и доставляют в стерильный бокс, селезенку измельчают ножницами, а затем в гомогенизаторе, к гомогенату добавляют дистиллированную воду и разрушение клеток осуществляют повторным замораживанием-размораживанием с последующей обработкой ультразвуком. Затем массу центрифугируют или фильтруют через грубый фильтр и полученный таким образом экстракт подвергают ультрафильтрации через капиллярные фильтры с границей раздела 50000 дальтон. Ультрафильтрат представляет собой фракцию, содержащую пептиды, полипептиды и низкомолекулярные белки с молекулярной массой от 400 до 50000 дальтон. Для получения стабильного при хранении препарата Спленопид, обладающего иммуностимулирующей активностью, к ультрафильтрату добавляют официнальный желатиноль и раствор гентамицина, разливают во флаконы по 5 мл и подвергают лиофильному высушиванию при температуре замораживания -35oC, при этом температура в сублимационной камере составляет -30oC, уровень вакуума -0,1 Тор, время сублимации - 48 часов. Высушенный препарат герметично закрывают резиновой крышкой, завальцовывают алюминиевым колпачком и маркируют. Для проверки биологической активности содержимое флакона растворяют в дистиллированной воде и проверяют пролиферативную активность лимфоцитов, а также влияние препарата на течение аутоиммунного процесса у экспериментальных животных и на индуцированный экспериментальный сепсис и экспериментальную миелодепрессию. Далее проводят испытание препарата Спленопид в клинике при лечении тяжелых форм аутоиммунных (системная красная волчанка, ревматоидный артрит и т.д.) и гнойно-септических заболеваний.
При лечении тяжелых форм гнойно-септических и аутоиммунных заболеваний больному на фоне традиционного лечения вводят внутримышечно препарат Спленопид в количестве 5-20 мг белка в дозе ежедневно, однократно в течение суток 3-10 дней.
Примеры осуществления способа.
Пример 1. В цехе биопрепаратов мясокомбината осуществляют стерильный забор селезенок от годовалых свиней. Вес трех селезенок составляет 995 г. Каждую селезенку отмывают 1 л 0,9%-ного раствора хлористого натрия с добавлением 30-40 мг фитогемагглютинина. Селезенку в стерильном полиэтиленовом пакете помещают и транспортный контейнер (температура +4-6oC), доставляют в стерильный бокс лаборатории. Препарат получают путем грубого измельчения ткани селезенки ножницами с последующим более тонким измельчением гомогенизатором, добавляют 1600 мл дистиллированной воды. Последующее разрушение клеточной массы осуществляют 3-кратным замораживанием-размораживанием с последующей ультразвуковой деструкцией (22 кГц по 60 сек). Далее массу центрифугируют при температуре +4-6oC в течение 30 минут при 3000 об/мин. Надосадочную жидкость собирают в емкости для последующей фильтрации с помощью капиллярных полисульфоновых фильтров с границей раздела 50000 дальтон. На выходе получают 1 л ультрафильтрата с молекулярной массой 400-50000 дальтон. В качестве наполнителя и стабилизатора перед сублимацией на 1000 мл ультрафильтрата добавляют 166±3,0 мл официнального желатиноля и 1,2±0,1 мл 4%-ного официнального раствора гентамицина. Смесь разливают во флаконы емкостью 10 мл (из нейтрального стекла) по 5 мл. В 5 мл содержится 8-10 мл общего белка (определение по Лоури). Далее проводят сублимационное высушивание ультрафильтрата на аппарате LZ-45 (Чехия). Режим лиофилизации имеет следующие параметры: температура замораживания ультрафильтрата - 35oC, температура в сублимационной камере - 30oC, уровень вакуума в сублимационной камере - 0,1 Тор. Время сублимации 48 часов. Высушенный препарат герметично закрывают крышкой и завальцовывают алюминиевым колпачком и маркируют. Препарат представляет пористую массу светло-желтого цвета, хорошо растворимую в воде и в 0,9%-ном растворе хлористого натрия. Влажность препарата 5%, количество белка 8-10 мг. При посеве 2-х флаконов препарат стерилен, нетоксичен, апирогенен, стабилен при хранении при +4-6oC в течение 2-х лет, pH препарата при растворении в воде составляет 7,0-8,5.
Препарат оказывал специфическое иммуностимулирущее действие, выявленное по усилению пролиферативной активности лимфоцитов.
Специфические и неспецифические примеси. Осуществляют контроль на отсутствие пептидов с молекулярной массой более 50000 дальтон. Для этого содержимое одного флакона растворяют в 5 мл 10%-ного раствора муравьиной кислоты в воде и 0,4 мл раствора вводят в стеклянную хроматографическую колонку 1х60, заполненную сефадексом G-50 (Fine Pharmacia, Швеция). Образец хроматографируют при скорости потока 0,15 мл/мин. Регистрацию производят по УФ-поглощению при длине волны 280 нм. Предварительно определяют на хроматографе область выхода свободного объема колонки. Для этого колонку калибруют, нанося на нее смесь 0,2 мл 0,05%-ного раствора голубого декстрана и 0,2 мл 0,01%-ного раствора цианкобаламина в 10%-ной муравьиной кислоте. Область выхода на хроматограмме голубого декстрана соответствует свободному объему колонки.
На хроматограмме образца препарата не должно быть пиков УФ-поглощающего материала в области выхода свободного объема.
Пример 2. Аналогичным способом выделяют биологически активную фракцию пептидов из ткани селезенки крупного рогатого скота, за исключением того, что отмывание ткани осуществляют с добавлением конкавалина А, а неразрушенные и полуразрушенные клетки удаляются фильтрацией через грубые матерчатые фильтры. И на 1 кг селезенки получают 1 л ультрафильтрата.
Определение пролиферативной активности лимфоцитов. Получение лимфоцитарной суспензии: кровь, взятую из локтевой вены, переносят в стерильные пробирки с 2,7%-ным р-ром Na-ЭДТА (pH 7,4) из расчета 1 мл на 10 мл крови. Тщательно перемешивают с антикоагулянтом для предотвращения свертывания.
- Полученную кровь разводят HEPES-буфером (без ионов Ca и Mg) в соотношении 1:3.
- В центрифужную пробирку наливают 3 мл р-ра фикол-верографина (плотность - 1,077 г/см). С помощью пастеровской пипетки 8 мл разведенной крови осторожно наслаивают по стенке пробирки на раствор фикол-верографина, закрывают стерильной резиновой пробкой и центрифугируют в горизонтальном роторе при 400 G в течение 30 минут.
- После центрифугирования из белесоватого кольца, образовавшегося на границе смеси фикол-верографина и разведенной крови, пастеровской пипеткой отбирают взвесь мононуклеарных клеток (лимфоциты и моноциты) и подсчитывают их число (P) по формуле: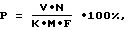
где K - количество разделяемой крови, M - количество лейкоцитов в 1 мл крови, F - доля лимфоцитов, V - объем взвеси лимфоцитов после разделения крови в мл, N - концентрация лимфоцитов в 1 мл взвеси.
Выход лимфоцитов, составляющий не менее 70 - 90%, считается удовлетворительным. - Концентрацию выделенных лимфоцитов в стерильных условиях доводят до 5•10 в 6 степени клеток/мл среды RPMJ 1640, содержащей 10% (человеческой) сыворотки IV(AB) группы или телячьей; 12 мМ HEPES, 300 мкг/мл глутамина, по 100 мкг/мл каждого антибиотика и препарат Спленопид в концентрациях от 0,00012 до 0,12 мг белка/мл и закрывают стерильными пробками.
- Автоматическими пипетками клеточную суспензию разливают по 20 мкл в лунки 96-луночного планшета для иммунологических реакций. В лунки контрольных культур для оценки спонтанной пролиферативной активности лимфоцитов добавляют по 20 мкл среды RPMI 1640, в лунки контрольных культур для оценки индуцированной митогенами пролиферативной активности лимфоцитов помимо 20 мкл среды RPMI 1640 вносят 20 мкл раствора митогена (фитогемагглютинина). В опытные лунки к 20 мкл среды RPVJ 1640 добавляют по 20 мкл разных концентраций препарата. Каждый вариант культуры занимает по 3 лунки.
- Культуры на 72 часа помещают в термостат при 37oC во влажную атмосферу, содержащую 5% CO. За 4 часа до конца культивирования в каждую лунку вносят 20 мкл р-ра H-тимидина с уд. активностью 10 мкKu/мл без стерильности.
- После окончания культивирования каждую среду автоматической пипеткой (лучше с помощью автоматического сборника клеток Harvester) тщательно ресуспендируют и переносят на стекловолоконные фильтры, высушивают и каждый участок фильтра с пробой из отдельной лунки переносят во флакон с 2 мл сцинтилляционной жидкости (1 кг толуола, 4 PPO и 061 г - POPOP).
- Подсчет включения H-тимидина производят на сцинтилляционном счетчике (импульсы за минуту), вычисляется средняя величина включения в 3 контрольных - без митогена (спонтанная пролиферация - СП) и в 3-х с митогеном (индуцированная пролиферация - ИП), а также пролиферация при воздействии разных концентраций препарата культур лимфоцитов; Пролиферативная активность выражается "индексом стимуляции" - ИС, вычисляемом по формуле: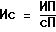
В норме ИС - 50-60%.
В низких дозах препарат должен стимулировать пролиферативную активность лимфоцитов, в высоких дозах - угнетать ее.
Пример 3. Влияния препарата Спленопид на течение аутоиммунного процесса.
Влияние препарата Спленопид изучают на инбредных мышах-самках NZB 10-месячного возраста с активной экспериментальной красной волчанкой, сопровождающейся тяжелым люпус-нефритом. Опытным мышам вводят внутривенно препарат в дозе 0,2 мг на животное. Препарат вводят 2 раза в неделю в течение 2-х месяцев, начиная с 10-месячного возраста (всего 16 инъекций). Контрольным животным вводят физиологичекий раствор в том же объеме. Кровь для исследования анти-ДНК-антител и ЦИК берут из ретробульбарного сплетения до начала введения препарата, в возрасте 11 месяцев (8 инъекций) и в 13 месяцев (через 1 месяц после завершения курса введения препарата). Содержание антител к нативной ДНК определяют с помощью радиоизотопной техники и стандартных наборов Kit фирмы "Amersham" (Великобритания). ЦИК выявляют методом 3%-ной ПЭГ-преципитации на лазерном нефелометре фирмы "Haechat-Bechring" (Германия) и распечатывают на компьютере "Hewlett-Packard-85" (США). Отложения иммунных комплексов в почках исследуют в гистологических срезах флюоресцирующей сыворотки против иммуноглобулинов мышей, меченной изотиоцианатом флоюресцеина (НИИ эпидемиологии и микробиологии им. Н.Ф.Гамалеи РАМН). Площадь, занимаемую отложениями иммунных комплексов (ИК) в сосудистом клубочке почки оценивают по 5-балльной системе. Проводят контроль выживаемости мышей и определяют содержание белка в суточных порциях мочи по Лоури. Достоверность результатов оценивают по критерию t-Стьюдента. Результаты проведенных исследований представлены в таблице 1.
Из этой таблицы видно, что под влиянием препарата происходит достоверное снижение анти-ДНК антител и ЦИК в сыворотке крови, снижалось содержание иммунных комплексов в клубочках почек, а также концентрация белка в суточных порциях мочи. Установлено также, что средняя продолжительность жизни мышей и количество выживших животных к 13-месячному возрасту было более чем в 3 раза выше в опытной группе.
Таким образом, введение препарата Спленопид мышам NZB с ярко выраженным волчаночным процессом способно снизить активность аутоиммунного процесса.
Пример 4. Влияние препарата на течение экспериментального сепсиса. Воздействие на септический процесс препарата из ткани селезенки изучают в экспериментах на белых беспородных мышах. Экспериментальный сепсис вызывают внутривенным введением животным однодневной живой культуры Staph. aureus штамм "Wood-46" в дозе 0,2 мл с концентрацией 1 млрд. клеток в 1 мл. Сепсис развивался на 3 сутки с ЛД-50. После заражения животных разделяли на 2 группы (по 30 животных в каждой). В I группе на 3, 4, 5 сутки после заражения внутривенно вводят по 0,2 мл физиологического раствора. Во II группе в те же сроки вводили по 0,2 мл препарата Спленопид.
Результаты исследования показали, что введение препарата в указанной дозе приводило к выживанию 71% зараженных мышей, в то время как в контроле выживаемость мышей составила 38%.
Для изучения механизмов повышения резистентности мышей к септическому процессу было изучено изменение физиологических характеристик лейкоцитов (фагоцитоз, люминол-зависимая хемилюминесценция, NST-тест) под влиянием препарата селезенки. Установлено, что под влиянием препарата увеличиваются абсолютный фагоцитарный показатель лейкоцитов приблизительно на 100% (опыт - 90692±5231; контроль - 45920±2145, p<0,05); захват микробов лейкоцитами (число Райта) на 92% (контроль 8,5±0,05, опыт - 16,3±1,2, p<0,05) и процент переваривания микробов на 55%.
Под влиянием препарата селезенки хемилюминесценция лейкоцитов in vitro увеличивалась в 2,5 раза (опыт 3722253+856712; контроль 1507456+242052, а NST-реакция лейкоцитов в 2 раза (опыт 386+11,2; контроль 194+9,5). Таким образом введение препарата повышает противоинфекционную защиту у животных с экспериментальным сепсисом.
Пример 5. Влияние препарата Спленопид на экспериментальную миэлодепрессию.
Исследование проведено на 2-х группах белых беспородных крысах-самцах с циклофосфановой миэлодепрессией:
1 группа - контроль с введением циклофосфана;
2 группа - опыт с введением циклофосфана и препарата Спленопид. Миэлодепрессию вызывают внутрибрюшинным введением циклофосфана в дозе 50 мг/кг веса один раз в день в течение 2 суток. Количество лейкоцитов падало более чем в 5 раз, лимфоцитов примерно в 6 раз, нейтрофилов на 1/3 от исходного уровня (таблица 2). Препарат селезенки вводят внутрибрюшинно в дозе 1,6 мг белка/кг один раз в сутки в течение 3 дней. Кровь для исследования берут из хвостовой вены. Число лейкоцитов, эритроцитов и тромбоцитов определяют стандартными методами. У опытных крыс после введения препарата (таблица 2) происходило увеличение лейкоцитов с 1,8+0,6 в контроле до 4,4+0,4 на 10/л. Палочкоядерных лейкоцитов с 0,86+0,03 в контроле до 1,29+0,04 на 10/л, лимфоцитов с 1,2+0,04 в контроле до 3,1+0,03 на 10/л и моноцитов с 0,03+0,001 в контроле до 0,11+0,001 на 10/л. К 5-ым суткам благоприятное влияние препарата на изучаемые показатели было еще более выраженным; к 14 суткам - в опытной группе не отличались от исхода, в то время как в контрольной группе они были все еще ниже нормы (таблица 2).
Таким образом, проведенные эксперименты свидетельствуют о том, что препарат Спленопид обладает выраженным иммунокоррегирующим действием при различных патологиях, связанных с нарушением функций иммунной системы. Установлено, что препарат Спленопид, полученный по разработанной нами технологии, стимулирует метаболическую и функциональную активность лейкоцитов периферической крови, способствует выведению аутоиммунных комплексов из организма, при системной красной волчанке что, очевидно, связано с повышением активности фагоцитирующих клеток. Вероятно, эти механизмы играют важную роль и в реализации лечебного действия препарата при экспериментально вызванных патологических состояниях - сепсисе, системной красной волчанке и фармакологической миелодепрессии.
Примеры клинического применения.
Пример N 1. Больной П., 27 лет. Переведен в хирургическое отделение ГКБ N 67 21.04.89 г. Диагноз: Перитониальный сепсис, катаболическая фаза септикопиемии. Болен с 20.03.89 г. 5.04.89 г. была произведена операция по поводу острого аппендицита. Через 11 дней развился гнойный перитонит. Больной вял, адинамичен, кожные покровы бледные, цианоз губ, акроцианоз тахипноэ до 34 в минуту. Сердечные тоны глухие, тахикардия до 120 в мин, АД 115/80 мм рт.ст., на ЭКГ признаки гипоксии миокарда, печень на 2,5 см выступает из-под реберной дуги, край печени болезненный. Брюшная стенка напряжена, симптом Щеткина-Блюберга положительный. В моче белок 0,99 г/л, лейкоцитов 2-3 в поле зрения. В крови лейкоцитоз 14,5•109/л с нейтрофильным сдвигом влево, п/я нейтрофилы - 25%, с/я - 55%, эозинофилы - 1%, лимфоциты - 12%, моноциты - 7%. Гематокрит - 33%, СОЭ - 3 мм/ч, ЛИИ - 7,1%. Реакция HCT лейкоцитов - 115 ед. плотности. Фагоцитоз: ФИ - 65, фагоцитарное число - 3,7. Процент переваривания - 31. Температура колебалась от 37,5oC (утром) до 39,5oC (вечером). Больной ранее подвергался интенсивному лечению: массивная доза антибиотиков; переливание крови и плазмы; детоксикационная терапия. Несмотря на лечение, септикопиемия прогрессировала. В связи с этим на фоне интенсивной терапии было проведено лечение препаратом Спленопид. Препарат вводили внутримышечно в дозе 20 мл, 1 раз в день, в течение 4 дней. На фоне общего тяжелого состояния положительная динамика появилась на 2-й день после первого введения Спленопида. Больной активнее вступал в контакт, улучшилось общее состояние, появился аппетит, слизистые покровы стали более розовыми, уменьшился цианоз губ, температура тела снизилась до величин: 36,5oC (утром) до 37,5oC (вечером). Частота пульса 75 в мин., АД - 120/70 мм рт. ст., тоны сердца ясные. Симптом Блюмберга стал отрицательным. Печень несколько уменьшилась до 1,5 см. Количество белка в моче снизилось - 0,33 г/л. Количество лейкоцитов - 11,4•109/л, п/я - 15%, с/я - 55%, эозинофилы - 1%, лимфоциты - 20%, моноциты - 9%, ЛИИ - 4,2%, СОЭ - 25 мм/ч, Hct - 45%, HCT - 159. Фагоцитарный индекс - 72, фагоцитарное число - 6,4, процент переваривания - 46.
Через 3 дня после окончания курса лечения препаратом состояние больного улучшилось. Биохимические и иммунологические показатели нормализовались. Выздоровление наступило через 3 недели.
Пример N 2. Больная К. , 32 лет. Поступила в институт пульмонологии 5.10.89 г. Диагноз: инфекционно-аллергическая бронхиальная астма, тяжелая форма. Приступы удушья бывают по 10-20 раз в сутки. Болезнь протекает с очень короткими периодами ремиссии (не более месяца). Лечили с помощью бронхолитиков (биротек при приступе удушья) и стероидные гормоны от 2 до 5 мг в сутки. После проведения терапии препарата БАВ отмечено: сначала значительное уменьшение тяжести и частоты приступов удушья, а затем и полное их исчезновение. Количество принимаемых бронхолитиков значительно уменьшилось: больная профилактически использовала 1-2 дозы в день. Прием стероидных гормонов постепенно прекратили совсем. Содержание ЦИК в плазме крови достоверно снизилось в 1,8 раза после первой инъекции препарата Спленопид и оставалось на этом уровне до выписки больной. Концентрация IgE уменьшилась к 10 дню после применения препарата в 2,2 раза по сравнению с исходной величиной. Фагоцитоз увеличился в 2 раза. Исследования до лечения больной БАВ T-клеточного иммунитета с использованием моноклональных антител показало снижение суммарного количества T-лимфоцитов и дисбаланс субпопуляций T-лимфоцитов. После лечения БАВС (3 внутримышечных введения через день по 10 мл) наблюдалось повышение общего числа T-лимфоцитов (с 46,4% до 70,1%), T-хелперов с 36,2% до 43,6%), T-супрессоров (с 16,3% до 20,3%).
В течение 1,5 лет после лечения препаратом приступов удушья у больной не наблюдалось. Предвестники наступающего приступа легко купировались 1 дозой биротека.
Пример N 3. Больная С., 38 лет. Поступила в клинику института Ревматологии 6.12.89 г. Диагноз: Ревматоидный артрит (РА), активность III. Жалобы на боли в суставах - коленных, правом тазобедренном, голеностопном, в мелких суставах кистей. Выраженная утренняя скованность суставов. Снижение силы сжатия в кистях. Припухлость суставов. Лечение - кортикостероидная терапия, эффективность от лечения гемособции была не удовлетворительная, в связи с чем был проведен курс лечения путем внутримышечного введения 1 раз в сут и в течение 10-х дней по 15 мл препарата Спленопид.
После введения препарата наблюдалась существенная положительная динамика (табл. 3). Самым ранним положительным симптомом явилось значительное уменьшение болей в суставах, что отмечалось уже на 2-й день после введения БАВ. Через неделю после второй процедуры утренняя скованность снизилась на 37%, остальные показатели суставного синдрома изменились недостоверно. Существенная положительная динамика суставного синдрома с достоверными изменениями показателей произошла к концу первого месяца после применения препарата - уменьшились длительность утренней скованности, число воспаленных и болезненных суставов, отмечалось значительное снижение болей в суставах и суставного индекса Ричи. Сила сжатия кистей и окружность проксимальных межфаланговых суставов не изменилась. В течение года наблюдения прогрессирования суставного синдрома не наблюдалось.
Представляет интерес влияние препарата на внесуставные проявления заболевания. Через месяц после проведения лечения БАВ у 3 больных исчезли ревматоидные узелки, у 2 уменьшились проявления нейропатии и у 3 - дигитального артрита. Клиническая эффективность БАВ подтверждалась снижением воспалительной активности по результатам лабораторных показателей (табл. 4).
Наблюдалось достоверное снижение СОЭ, фибриногена, альфа-2 и гамма-глобулинов. Достигнуто существенное снижение ревматоидного фактора, уменьшалась концентрация циркулирующих иммунных комплексов. Активность заболевания снизилась до I-II степени. При исследовании показателей фагоцитоза (табл. 5) наблюдалось резкое возрастание HCT-теста, процента фагоцитоза и фагоцитарного числа сразу после введения, свидетельствующее о стимулирующем влиянии препарата на фагоцитарную активность полиморфно-ядерных лейкоцитов у больных РА. Исследования T-клеточного иммунитета показали снижение в исходе по сравнению с контрольной группой общего числа T-лимфоцитов (CD1+) преимущественно за счет субпопуляции супрессоров/киллеров (CD8+). Иммунорегуляторный индекс был резко повышен за счет снижения субпопуляции CD8+ при неизмененном количестве CD4+. После введения препарата происходило возрастание содержания супрессоров/киллеров, иммунорегуляторный индекс приблизился к нормальным величинам. Следовательно, влияние Спленопида на T-лимфоциты при их сниженном количестве можно определить как иммуностимулирующее.
Таким образом, экспериментальные и клинические исследования показали высокую эффективность препарата Спленопид и широкий спектр его иммуностимулирующей активности, направленной на различные звенья гуморального и клеточного иммунитета и приводящего к успешному лечению патологий с их нарушениями. Стабильность препарата Спленопид при длительном хранении, а также высокая степень очистки, обусловившая отсутствие побочных реакций при его применении, простота способа изготовления, его экономичность и доступность сырья создает перспективы для широкого внедрения препарата в клиническую практику.
Литература
1. Николаев С. Д. и др. Теоретические и экспериментальные предпосылки использования перфузатов ксеноселезенки в клинической практике. Экспериментальные и клинические аспекты ксеноспленотерапии, Ижевск: Экспертиза, 1977, с.17-23.
2. SU 1152801, 1985.
3. RU 2033796, 30.04.95.
4. Цыпин А.Б., Онищенко Н.А,, Мануйлов Б.М. и др. Разработка, получение и некоторые свойства нового иммуномодулятора пептидной природы на ткани селезенки. Ж. Иммунология, 1995, N 7, с.33-36.
5. ERO 21997, 29.04.87.
6. WO 445581, 11.09.91.
7. Методические рекомендации. Применение перфузата ксеноселезенки в лечении больных с обширным гнойно-деструктивными заболеваниями легких и плевры с осложненным течением, Новосибирск, 1992.
8. Цыпин А. Б. , Ведерникова Л.А. Спленоперфузия в комплексном лечении тяжелых форм системной красной волчанки, ревматоидного артрита и бронхиальной астмы. В об.: Проблемы трансплантологии и искусственных органов, М., 1994, с.131-140.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИММУНОМОДУЛИРУЮЩЕЕ СРЕДСТВО | 1988 |
|
RU2027434C1 |
| СПОСОБ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ИММУНОЗАВИСИМЫХ ОСЛОЖНЕНИЙ У КАРДИОХИРУРГИЧЕСКИХ БОЛЬНЫХ В ПОСЛЕОПЕРАЦИОННОМ ПЕРИОДЕ | 2006 |
|
RU2326679C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННОГО ПРЕПАРАТА ИММУНОМОДУЛЯТОРА ДЛЯ ЛЕЧЕНИЯ ТЯЖЕЛЫХ ФОРМ ГНОЙНО-СЕПТИЧЕСКИХ И АУТОИММУННЫХ ЗАБОЛЕВАНИЙ | 2012 |
|
RU2491944C1 |
| Способ лечения больных с печеночной недостаточностью | 1991 |
|
SU1813453A1 |
| Способ выбора донора при аллотрансплантации почки | 1989 |
|
SU1725124A1 |
| Способ иммунокоррекции при аутоиммунном процессе | 1986 |
|
SU1454471A1 |
| ПЕПТИДСОДЕРЖАЩАЯ ФРАКЦИЯ ИЗ СЕЛЕЗЕНКИ МЛЕКОПИТАЮЩИХ, ОБЛАДАЮЩАЯ ИММУНОСТИМУЛИРУЮЩЕЙ АКТИВНОСТЬЮ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1993 |
|
RU2033796C1 |
| Способ лечения сепсиса | 1985 |
|
SU1461419A1 |
| ИММУНОМОДУЛИРУЮЩИЙ ПРЕПАРАТ "БЕТАЛЕЙКИН" | 1998 |
|
RU2128706C1 |
| ТРАНСУМБИЛИКАЛЬНЫЙ ИНТРАПОРТАЛЬНЫЙ КАТЕТЕР ДЛИТЕЛЬНОГО ПРИМЕНЕНИЯ | 1993 |
|
RU2071791C1 |





Изобретение относится к медицине, а именно к препаративной биохимии, фармацевтической промышленности и биотехнологии и касается пептидов, обладающих иммуностимулирующей активностью, способа их получения, лекарственного препарата Спленопида, созданного на основе этих пептидов, и его применения. Сущность изобретения заключается в получении пептидов с мол. м. от 400 до 50000 Да из ткани селезенки посредством митогенной стимуляции клеток ткани селезенки в процессе ее отмывки, гомогенизации органа, диспергированием в дистиллированной воде и разрушением клеток замораживанием-размораживанием и ультразвуковой обработкой, отделением экстракта и его ультрафильтрации через фильтры с размером пор с границей раздела 50000 Да. При добавлении к выделенным пептидам наполнителя препарат получают в лиофилизированной форме, стабильной при хранении в течение двух лет. Изобретение обеспечивает высокую эффективность применения препарата при лечении тяжелых форм гнойно-септических и аутоиммунных заболеваний. 4 с. и 3 з.п.ф-лы, 5 табл.
| Поточная линия для изготовления декоративных плит | 1972 |
|
SU445581A1 |
| Применение перфузата ксеноселезенки в лечении больных с обширными гнойно-деструктивными заболеваниями легких и плевры с осложненным течением: Методические рекомендации | |||
| - Новосибирск, 1992 | |||
| RU 95110155 А1, 20.06.97 | |||
| БИОЛОГИЧЕСКИ АКТИВНОЕ СРЕДСТВО, СПОСОБ ЕГО ПОЛУЧЕНИЯ, ПРЕПАРАТ, СОДЕРЖАЩИЙ УКАЗАННОЕ СРЕДСТВО, И СПОСОБ ИСПОЛЬЗОВАНИЯ ПРЕПАРАТА | 1992 |
|
RU2041715C1 |
| КАТАЛИЗАТОР ПОЛИМЕРИЗАЦИИ ПРОПИЛЕНА, КАТАЛИТИЧЕСКАЯ СИСТЕМА И СПОСОБ ПОЛУЧЕНИЯ ПОЛИПРОПИЛЕНА | 1991 |
|
RU2074864C1 |
Авторы
Даты
2000-07-10—Публикация
1998-04-08—Подача