Данное изобретение относится к новым соединениям. Соединения по настоящему изобретению ингибируют действие фермента липоксигеназы и могут использоваться при лечении или облегчении воспалительных заболеваний, аллергии и сердечно-сосудистых заболеваний у млекопитающих. Данное изобретение относится также к фармацевтическим композициям, содержащим такие соединения.
Предпосылки изобретения
Арахидоновая кислота известна как биологический предшественник нескольких групп биологически активных эндогенных метаболитов. Первой стадией в метаболизме арахидоновой кислоты является ее высвобождение из фосфолипидов мембраны посредством действия фосфолипазы A2. Арахидоновая кислота затем метаболизируется либо циклооксигеназой с получением простагландинов, включая простациклин и тромобоксаны, либо оксигеназой с получением гидропероксидных жирных кислот, которые могут быть в дальнейшем преобразованы в лейкотриены.
Лейкотриены являются исключительно сильнодействующими веществами, которые вызывают широкое разнообразие биологических эффектов, часто в диапазоне концентраций от наномолярных до пикомолярных. Пептидолейкотриены (LTC4, LTD4, LTE4) являются важными бронхорасширяющими и сосудорасширяющими средствами, а также вызывают высвобождение из сосудов плазмы путем повышения проницаемости капилляров. LTB4 является сильнодействующим средством химиотаксиса, усиливающим приток лейкоцитов и вызывающим их последующую дегрануляцию на участке воспаления. Патофизиологическая роль лейкотриенов показана на ряде болезненных состояний человека, включая астму и родственные заболевания обструкции дыхательных путей, аллергический ринит, ревматоидный артрит и подагру, псориаз и атопический дерматит, респираторный синдром истощения у взрослых (РСИВ), воспалительные заболевания кишечника (например, болезнь Крона), эндотоксиновый бактериально-токсический шок, атеросклероз и сердечно-сосудистые заболевания (например, поражение миокарда, вызванное ишемией) и гломелулярный нефрит. Любой агент, который ингибирует действие липоксигеназ, как ожидается, будет иметь значительную терапевтическую ценность для лечения острых и хронических воспалительных состояний.
В качестве обзора по ингибиторам липоксигеназы смотри Н. Masamune and L. S. Melvin, Sr. : Annual Reports in Medicinal Chemistry, 1989, 24, pp 71-80 (Academic). Более недавние дополнительные примеры ингибиторов липоксигеназы описаны в ЕР 0462830 A2, ЕР 0505122 A1 и ЕР 0540165 A1.
Краткое описание изобретения
Настоящее изобретение относится к новым химическим соединениям следующей формулы I
или его фармацевтически приемлемые соли, где
Ar1 означает имидазолил, пиразолил, 1,2,3-триазолил, 1,2,4-триазолил, которые связаны с X1 посредством кольцевого атома азота и которые могут быть необязательно замещены одним или двумя C1-4алкилами;
X1 означает прямую связь или C1-4-алкилен;
Ar2 означает фенилен, необязательно замещенный одним или двумя атомами галогена;
X2 означает -A-X- или -X-A, где A означает прямую связь или C1-4алкилен и X означает окси или тио;
Ar3 означает фенилен, необязательно замещенный одним или двумя заместителями, выбранными из галогена или циано;
R1 и R2 вместе образуют группу формулы -D1-Z-D2-, которая вместе с атомом углерода, к которому она присоединена, образует кольцо, имеющее 3-8 атомов, где D1 и D2 означают C1-4алкилен, и Z означает прямую связь, окси или винилен, D1 и D2 могут быть замещены C1-3алкилом; и
Y означает CONR3R4, CN, C(R3)=N-OR4, COOR3 или COR3, где R3 и R4 означают, каждый, H или C1-4алкил.
Предпочтительная группа соединений по настоящему изобретению состоит из соединений формулы I, где Ar2 представляет 1,4-фенилен, и Ar3 представляет 1,3-фенилен или 5-фтор-1,3-фенилен. В этой предпочтительной группе особенно предпочтительными соединениями являются:
(1) такие соединения, в которых Ar1 является 2-алкилимидазолилом; X1 представляет прямую связь и Y представляет CONH2; и
(2) такие соединения, в которых Ar1 является пирролилом; X1 представляет CH2 и Y представляет CONH2.
Эти соединения могут использоваться при лечении или смягчении воспалительных заболеваний, аллергии и сердечно-сосудистых заболеваний у млекопитающих и в качестве активного ингредиента в фармацевтических композициях для лечения таких состояний.
Предпочтительными индивидуальными соединениями по настоящему изобретению являются следующие:
4-[5-фтор-3-[4-(2-метилимидазол-1-ил)бензилокси] фенил] - 3,4,5,6-тетрагидро-2Н-пиран-4-карбоксамид;
4-[3-[4-(2-метилимидазол-1-ил)фенилтио] фенил] -3,4,5,6- тетрагидро-2Н-пиран-4-карбоксамид;
4-[3-[4-(пиррол-1-илметил)фенилтио] фенил] -3,4,5,6-тетрагидро- 2Н-пиран-4-карбоксамид;
(2SR, 4RS)-2-метил-4-[3-[4-(2-метилимидазол-1-ил)фенилтио] - фенил] -3,4,5,6-тетрагидро-2Н-пиран-4-карбоксамид; и 4-метоксииминометил-4-[3-[4-(2-метилимидазол-1-ил)фенилтио]- фенил]-3,4,5,6-тетрагидро-2Н-пиран.
Подробное описание изобретения
Соединение формулы I или его фармацевтически приемлемая соль могут быть получены различными способами. Например, соединение формулы I получают в соответствии с реакциями, приведенными на Схеме 1. Если не указано другого, Ar1, X1, Ar2, X2, Ar3, R1, R2 и Y в реакционных схемах и в обсуждении, которое следует далее, определены выше.

При одном осуществлении, как показано на Схеме 1, соединение формулы II (или формулы V), где Q является замещаемой группой, присоединяется к соединениям формулы III (или формулы IV), предпочтительно, в присутствии подходящего основания. Подходящей замещаемой группой Q является, например, галоген или сульфонилоксигруппа, например, фтор, хлор, бром, йод, трифторметансульфонилокси, метансульфонилокси или п-толуолсульфонилоксигруппа, все они легко удаляются обычными способами. Предпочтительным основанием для реакции присоединения является, например, гидроксид щелочного или щелочноземельного металла, алкоксид, карбонат или гидрид, такие как гидроксид натрия, гидроксид калия, метоксид натрия, этоксид натрия, трет-бутоксид калия, карбонат натрия, карбонат калия, гидрид натрия или гидрид калия, или амин, такой как триэтиламин, диизопропилэтиламин или диметиламино-пиридин. Предпочтительные реакционно-инертные растворители включают, например, ацетон, ацетонитрил, дихлорметан, N,N- диметилацетамид, N,N-диметилформамид, диметилсульфоксид, диоксан или тетрагидрофуран. Температуры реакции предпочтительно находятся в диапазоне от комнатной температуры до температуры кипения растворителя, но, если необходимо, можно применять более низкую или более высокую температуру. Время реакции составляет обычно от нескольких часов до нескольких дней. Реакцию удобно проводить в присутствии подходящего катализатора, например, тетракис(трифенилфосфин)палладий, хлорид бис(трифенилфосфин)палладия(II), оксид меди, йодид меди, бромид меди или хлорид меди.
Альтернативно, соединение формулы II (или формулы V), где Q является гидроксильной группой, и A является C1-C4 алкиленом, например, метиленом, присоединяют к соединению формулы III (или формулы IV) в условиях реакции типа реакции Мицунобу. Подходящими конденсирующими реагентами являются, например, диэтилазодикарбоксилат и трифенилфосфин, и предпочтительные реакционно-инертные растворители включают дихлорметан, тетрагидрофуран и толуол. Температура реакции, предпочтительно, находится в диапазоне от 0oC до комнатной температуры, но, если необходимо, можно применять более низкую или более высокую температуру. Время реакции составляет обычно от нескольких минут до несколько часов.

При другом осуществлении (Схема 2), соединение формулы II (или формулы V), где Q является замещаемой группой, связывают с соединением формулы VI (или формулы VII), где R5, R6 и R7 являются, независимо, подходящим алкилом, таким как C1-4 алкил, или арилом, таким как фенильная группа, и М является кремнием или оловом (IV), предпочтительно, кремнием, предпочтительно, в присутствии соответствующего основания. Подходящей замещаемой группой Q является, например, галоген или сульфонилоксигруппа, например, фтор, хлор, бром, йод, трифторметансульфонилокси, метансульфонилокси или п-толуолсульфонилоксигруппа, все они легко удаляются обычными способами. Подходящей -MR6R6R7 группой является, например, триметилсилил, триизопропилсилил, трет-бутилдиметилсилил или трет-бутилдифенилсилильная группа, предпочтительно, триизопропилсилил или трибутилстаннил, все легко удаляются обычными способами. Предпочтительным основанием для реакции присоединения является, например, алкоксид щелочного и щелочноземельного металла или галогенид, такие как этоксид натрия, трет-бутоксид натрия, трет-бутоксид калия, фторид натрия, фторид калия или фторид цезия, или четвертичная соль аммония, такая как тетрабутиламмонийфторид. Предпочтительные реакционно-инертные растворители включают, например, этанол, ацетонитрил, толуол, N,N-диметилацетамид, N-метил-2-пирролидон, N, N-диметилформамид, диметилсульфоксид, диоксан или тетрагидрофуран. Температуры реакции предпочтительно находятся в диапазоне от комнатной температуры до температуры кипения растворителя, но, если необходимо, можно применять более низкую или более высокую температуру. Время реакции обычно составляет от нескольких минут до нескольких дней. Реакцию удобно проводить в присутствии подходящего катализатора, например, тетракис(трифенилфосфин)палладия, хлорид бис(трифенилфосфин)палладия(II) или тому подобное (например, смотри Tetrahedron Lett., 1994, 3225-3226).
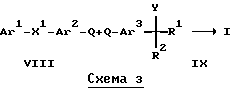
Альтернативно, при другом осуществлении, соединение формулы I, где X является тио, может быть получено, как показано на Схеме 3. Таким образом, соединение формулы VIII присоединяют к соединению формулы IX, где Q является замещаемой группой, в присутствии тиомочевины и подходящего катализатора, например, тетракис(трифенилфосфина)палладия, или катализатора на основе никеля (0), получаемого in situ, например, из хлорида бис(триэтилфосфин)никеля(II), и подходящего восстанавливающего агента, такого как, например, цианоборгидрид натрия или тому подобное (Chem. Lett. 1986, 1379-1380). Подходящей замещаемой группой Q является, например, галоген или сульфонилоксигруппа, например, фтор, хлор, бром, йод, трифторметансульфонилокси, метансульфонилокси или п-толуолсульфонилоксигруппа, все они легко удаляются обычными способами. Предпочтительные реакционно-инертные растворители включают, например, этанол, ацетонитрил, толуол, N,N-диметилацетамид, N-метил-2-пирролидон, N,N-диметилформамид, диметилсульфоксид, диоксан или тетрагидрофуран. Температуры реакции, предпочтительно, находятся в диапазоне от комнатной температуры до температуры кипения растворителя, но, если необходимо, можно применять более низкую или более высокую температуру. Время реакции составляет обычно от нескольких минут до нескольких дней.
Для получения этих соединений формулы I, где X является сульфинильной или сульфонильной группой, соединение формулы I, где X является тио, может быть окислено обычными способами. Подходящим окисляющим агентом является, например, перекись водорода, надкислота, такая как м-хлорнадоксибензойная кислота или надоксиуксусная кислота, надоксисульфат щелочного металла, такой как пероксимоносульфат калия или тому подобное. Предпочтительные реакционно-инертные растворители включают, например, ацетон, дихлорметан, хлороформ, тетрагидрофуран или воду. Температуры реакции предпочтительно находятся в диапазоне от 0oC до от комнатной температуры, но если необходимо, можно применять более низкую или более высокую температуру. Время реакции составляет обычно от нескольких минут до нескольких часов.
Исходные продукты формул II, III, IV, V, VI, VII, VIII и IX могут быть легко получены обычными способами, известными специалистам в данной области. Получение таких исходных материалов описано в прилагаемых неограничивающих примерах, которые приведены только для целей иллюстрации. Альтернативно, необходимые исходные продукты могут быть получены с помощью способов или их модификаций, аналогичных способам, описанным ниже.
Продукты, которые приведены в вышеуказанных общих синтезах и иллюстрируются здесь в экспериментальных примерах, могут быть выделены стандартными методами, и очистку можно осуществить с помощью обычных средств, известных специалистам в данной области, таких как дистилляция, перекристаллизация и хроматографические методы.
Соединения по настоящему изобретению, которые содержат один или несколько асимметричных центров, способны существовать в различных стереоизомерных формах. Все такие индивидуальные формы и их смеси включены в объем настоящего изобретения. Различные изомеры могут быть получены с помощью стандартных способов. Например, рацемические смеси могут быть разделены на индивидуальные энантиомеры с помощью стандартных приемов разделения. Индивидуальные диастереомеры могут быть получены с тереоселективным синтезом или путем разделения смесей с помощью фракционной кристаллизации или хроматографических методов.
Большинство соединений по настоящему изобретению способны образовывать аддитивные соли неорганических или органических кислот. Фармацевтически приемлемые соли дополнения кислот новых соединений по настоящему изобретению легко получают путем взаимодействия указанного соединения с выбранной минеральной или органической кислотой в среде водного растворителя, в подходящем органическом растворителе, таком как, например, метанол, этанол, ацетон или диэтиловый эфир или их смесь. Желаемая твердая соль может затем быть получена путем осаждения или осторожного выпаривания растворителя.
Кислоты, которые используются для получения фармацевтически приемлемых солей дополнения кислот указанных выше соединений по настоящему изобретению, представляют собой такие кислоты, которые образуют нетоксичные соли кислот, такие соли как гидрохлорид, гидробромид, гидройодид, нитрат, сульфат или ацетат, фумарат, тартрат, сукцинат, малеат, глюконат, сахарат, бензоат, метансульфонат, бензолсульфонат, п-толуолсульфонат и памоат (то есть, 1,1'метилен-бис-(2-гидрокси-3-нафтоат)).
Соединения по настоящему изобретению, которые имеют также кислотные группы, способны образовывать соли оснований с различными фармацевтически приемлемыми катионами. Примеры таких солей включают соли щелочных металлов или щелочноземельных металлов, и, в частности, соли натрия и калия. Все эти соли получают обычными способами. Химические основания, которые используют в качестве реагентов для получения фармацевтически приемлемых солей оснований настоящего изобретения, представляют собой такие основания, которые образуют нетоксичные основные соли. Эти конкретные нетоксичные основные соли включают соли, полученные с такими фармацевтически приемлемыми катионами, как натрий, калий, кальций и магний и тому подобное. Эти соли легко могут быть получены путем обработки указанных выше соединений водным раствором, содержащим желаемый фармацевтически приемлемый катион, а затем выпаривания полученного раствора досуха, предпочтительно, при пониженном давлении. Альтернативно, они также могут быть получены путем смешивания растворов кислотных соединений в низших спиртах и желаемого алкоксида щелочного металла, а затем выпаривания полученного раствора досуха тем же способом, что и выше. В любом случае, предпочтительно используются стехиометрические количества реагентов в порядке обеспечения полноты реакции и максимального получения выходов желаемого конечного продукта.
Соединения по настоящему изобретению ингибируют активность фермента 5-липоксигеназы. Это ингибирование может быть продемонстрировано in vitro в исследованиях с использованием резидентных клеток брюшной полости крыс (RPC) (Japanese Journal of Inflammation: 1987, 7, 145-150) и цельной гепаринизированной крови человека (HWB) (Br. J. of Pharmacol.: 1990, 99, 113-118), оба из которых определяют воздействие указанных соединений на метаболизм арахидоновой кислоты. Все последующие примеры, исследованные в рассмотренных выше исследованиях, как показано, обладают эффективностью при ингибировании активности липоксигеназы. Некоторые предпочтительные соединения показывают низкие значения IC50 в диапазоне от 0,01 до 1 мкМ по отношению к липоксигеназной активности.
Способность соединений по настоящему изобретению ингибировать фермент липоксигеназу делает их полезными для подавления симптомов, вызванных эндогенными метаболитами, происходящими от арахидоновой кислоты в субъекте-млекопитающем, в частности, в субъекте-человеке. По этой причине соединения представляют собой ценность при профилактике или лечении таких болезненных состояний, при которых аккумуляция метаболитов арахидоновой кислоты является обуславливающим фактором, например, аллергической бронхиальной астмы, заболеваний кожи, ревматоидного артрита и остеоартрита.
В частности, соединения по настоящему изобретению и их фармацевтически приемлемые соли могут быть использованы при лечении и облегчении воспалительных заболеваний у субъекта-человека.
Для лечения различных состояний, описанных выше, соединения и их фармацевтически приемлемые соли могут вводиться субъекту-человеку либо сами по себе, либо, предпочтительно, в сочетании с фармацевтически приемлемыми носителями или разбавителями в составе фармацевтической композиции в соответствии со стандартной фармацевтической практикой. Соединения могут вводиться перорально или вводиться парентерально обычным способом.
Когда соединения вводятся субъекту-человеку для профилактики или лечения воспалительного заболевания, диапазон дозы для перорального введения будет составлять от около 0,1 до 10 мг/кг веса тела субъекта, подлежащего лечению, в день, предпочтительно от около 0,1 до 4 мг/кг в день в одной или в разделенных дозах. Если желаемым является парентеральное введение, тогда эффективная доза будет составлять от около 0,05 до 5 мг/кг веса тела субъекта, подлежащего лечению, в день. В некоторых случаях может быть необходимым использовать дозировки вне этих пределов, поскольку дозировки будут обязательно изменяться в соответствии с возрастом, весом и реакцией индивидуального пациента, а также с тяжестью симптомов у пациента и эффективностью конкретного соединения, которое вводят.
При пероральном введении соединения настоящего изобретения и их фармацевтически приемлемые соли могут вводиться, например, в виде таблеток, порошков, лепешек, сиропов или капсул, или в виде водного раствора или суспензии. В случае таблеток для перорального введения, носители, которые обычно используют, включают лактозу и кукурузный крахмал. Обычно добавляют дополнительно смазывающие агенты, такие как стеарат магния. В случае капсул, используемыми разбавителями являются лактоза и высушенный кукурузный крахмал. Когда для перорального введения требуются водные суспензии, активный ингредиент объединяют с эмульгаторами и суспенгаторами. Если желательно, могут быть добавлены некоторые подслащивающие и/или ароматизирующие агенты. Для внутримышечного, внутрибрюшинного, подкожного и внутривенного использования обычно приготавливают стерильные растворы активного ингредиента и может быть соответствующим образом установлен pH растворов, в частности, с помощью буфера. Для внутривенного использования должна контролироваться общая концентрация растворимого вещества, чтобы сделать препарат изотоническим.
Кроме того, особенно для лечения астмы, соединения формулы I настоящего изобретения могут вводиться субъекту-человеку путем ингаляции. Для этой цели их вводят в виде аэрозоля или аэрогеля в соответствии со стандартной практикой.
Примеры
Настоящее изобретение иллюстрируют с помощью следующих примеров. Однако, необходимо учесть, что изобретение не ограничивается конкретными деталями этих примеров. Спектры протонного ядерного магнитного резонанса (ЯМР) измеряют при 270 МГц, если не указано другого, и положение пиков выражены в миллионных долях (м.д.) в сторону уменьшения поля по отношению к тетраметилсилану. Формы пиков обозначены следующим образом: с - синглет, д - дублет, т - триплет, м - мультиплет и ушир. - уширенный.
Пример 1
1-[3-Фтор-5-[4-(2-метилимидазол-1-ил)бензилокси] фенил]- циклопентан-1-карбоксамид
A. Этил 1-(3-бензилокси-5-фторфенил)циклопентан-1-карбоксилат
Указанное в заглавии соединение получают из этил 3-бензилокси-5-фторфенилацетата в соответствии с получением этил 4-(3-бензилокси-5-фторфенил)-3,4,5,6-тетрагидро-2Н- пиран-4-карбоксилата, за исключением того, что 1,4-дибромбутан замещают на бис-(2-хлорэтил)эфир.
1H ЯМР (CDCl3) δ: 7,49-7,28 (5H, м), 6,81-6,75 (1H, м), 6,69 (1H, ддд, J= 9,9, 2,2, 2,2 Гц), 6,56 (1H, ддд, J=10, 2,2, 2,2 Гц), 5,02 (2H, с), 4,07 (2H, кв, J=7,0 Гц), 2,67-2,52 (2H, м), 1,91-1,60 (6H, м), 1,16 (3H, т, J=7,0 Гц).
B. Этил 1-(5-фтор-3-гидроксифенил)циклопентан-1-карбоксилат
Указанное в заглавии соединение получают из этил 1-(3- бензилокси-5-фторфенил)циклопентан-1-карбоксилата в соответствии с получением этил 4-(5-фтор-3-гидроксифенил)-3,4,5,6-тетрагидро-2H-пиран- 4-карбоксилата.
1H ЯМР (CDCl3) δ: 6,68-6,58 (2H, м) , 6,48 (1H, ддд, J=10, 2,2, 2,2 Гц), 4,12 (2H, кв, J=7,0 Гц), 2,47-2,31 (2H, м), 1,73-1,33 (6H, м), 1,19 (3H, т, J=7,0 Гц).
C. Этил 1-[5-фтор-3-[4-(2-метилимидазол-1-ил)бензилокси]- фенил]циклопентан-1-карбоксилат (Предлагаемое Соединение)
Указанное в заглавии соединение получают из 1-(5-фтор-3-гидроксифенил) циклопентан-1-карбоксилата в соответствии с получением этил 4-[5-фтор-3-[4-(2-метилимидазол-1-ил)бензилокси] фенил]-3,4,5,6-тетрагидро-2H-пиран-4-карбоксилата
Пример 2.
1H ЯМР (CDCl3): δ: 7,55 (2H, д, J=8,4 Гц), 7,33 (2H, д, J=8,4 Гц), 7,04 (1H, д, J= 1,5 Гц), 7,01 (1H, д, J=1,5 Гц), 6,80- 6,78 (1H, м), 6,73 (1H, ддд, J= 9,5, 2,2, 2,2 Гц), 6,58 (1H, ддд, J=10, 2,2, 2,2 Гц), 5,08 (2H, с), 4,09 (2H, кв, J=7,0 Гц), 2,64-2,55 (2H, м), 2,38 (3H, с), 1,93-1,68 (6H, м), 1,17 (3H, т, J=7,0 Гц).
D. 1-[5-Фтор-3-[4-(2-метилимидазол-1-ил)бензилокси] фенил] - циклопентан-1-карбоксамид
Желаемое соединение получают из этил 1-[3-фтор-5-[4-(2-метилимидазол-1-ил)бензилокси] фенил] циклопентан-1 -карбоксилата в соответствии с получением 4-[5-фтор-3-[4-(2-метил-имидазол-1-ил) бензилокси] фенил] - 3,4,5,6-тетрагидро-2H-пиран-4-карбоксамида (Пример 5).
1H ЯМР (CDCl3) δ: 7,56 (2H, д, J=8,1 Гц), 7,34 (2H, д, J=8,1 Гц), 7,04 (1H, с), 7,02 (1H, с), 6,93 (1H, дд, J-2,2, 2,2 Гц), 6,78 (1H, ддд, J=2,2, 2,2, 9,5 Гц), 6,65 (1H, ддд, J=2,2, 2,2, 9,5 Гц), 6,11 (2H, ушир. с), 5,12 (2H, с), 2,52-2,40 (2H, м), 2,38 (3H, с), 2,13-1,82 (6H, м).
Пример 2
Этил 4-[5-фтор-3-[4-(2-метилимидазол-1-ил)бензилокси] фенил]- 3,4,5,6-тетрагидро-2H-пиран-4-карбоксилат
A. Этил 4-(2-бензилокси-1-ил)бензоат
Смесь 2-метилимидазола (50 г, 0,6 моль), этил 4-фторбензоата (100 г, 0,6 моль) и карбоната калия (415 г, 3 моль) в сухом ДМСО нагревают при 120oC в течение 66 часов в атмосфере азота. После охлаждения до комнатной температуры, реакционную смесь выливают в воду (1 л), охлажденную льдом, и экстрагируют Et2O (750 мл х 2). Органическую фазу промывают водой (500 мл) и солевым раствором (500 мл), сушат над MgSO4 и выпаривают. Остаточный твердый продукт перекристаллизуют из этилацетата-гексана с получением указанного в заголовке соединения (47 г, 33%) в виде желтых иголок.
1H ЯМР (CDCl3) δ: 8,22-8,12 (м, 2H), 7,43-7,33 (м, 2H), 7,10-6,99 (м, 2H), 4,42 (кв, J=7,0 Гц, 2H), 1,43 (т, J=7,0 Гц, 3H).
B. 4-(2-метилимидазол-1-ил)бензиловый спирт
К раствору этил 4-(2-метилимидазол-1-ил)бензоата (46 г, 0,2 моль) в сухом CH2Cl2 (1 л), охлажденному до -75oC, в атмосфере азота в течение 30 минут осторожно добавляют диизобутилгидридалюминия (540 мл, 0,93 М в гексане), и затем смеси дают медленно нагреться до температуры окружающей среды. После перемешивания в течение 5 часов реакционную смесь охлаждают на ледяной бане и добавляют осторожно метанол (30 мл). Затем добавляют 30% водный раствор соли Рошеля (500 мл) и смесь перемешивают при температуре окружающей среды в течение 16 часов. Нерастворимый продукт (по существу, целевой продукт) удаляют путем фильтрования, и органическую фазу отделяют и промывают водой (500 мл), сушат (MgSO4) и выпаривают. Полученные в результате объединенные твердые продукты перекристаллизовывают из этанола (300 мл) с получением указанного в заглавии соединения (35,6 г, 95%) в виде белых иголок.
1H ЯМР (ДМСО-d6) δ: 7,50-7,33 (4H, м), 7,25 (1H, д, J=1,1 Гц), 6,90 (1H, д, J=1,1 Гц), 5,33 (1H, т, J=6,0 Гц), 4,56 (2H, д, J=6,0 Гц), 2,27 (3H, с).
C. Гидрохлорид 4-(2-метилимидазол-1-ил)бензилхлорида
4-(2-метилимидазол-1-ил)бензиловый спирт (1,28 г, 6,8 ммоль) в SOCl2 (5 мл) перемешивают при температуре окружающей среды в течение 30 минут и затем удаляют летучие продукты при пониженном давлении. Полученный в результате сырой продукт промывают минимальным количеством сухого Et2O и сушат в вакууме с получением указанного в заглавии соединения (1,65 г, количеств.) в виде белого твердого продукта.
1H ЯМР (ДМСО-d6) δ: 7,91 (1H, д, J=1,84 Гц), 7,79 (1H, д, J=1,84 Гц), 7,72 (2H, д, J=8,80 Гц), 7,66 (2H, д, J=8,80 Гц), 4,89 (2H, с), 2,56 (3H, с).
D. Диэтил 3-бензилокси-5-фторфенилмалонат
К перемешиваемому раствору диэтилмалоната (110,2 г, 688 ммоль) в диоксане (1 л) при 0oC в атмосфере азота добавляют гидрид натрия (27,5 г, 688 ммоль, 60% дисперсия в минеральном масле). После перемешивания при 0oC в течение 20 мин и при комнатной температуре в течение 80 мин добавляют бромид меди (98,7 г, 688 ммоль) и раствор 3-бензилокси-5-фторфенилбромида (J. Med, Chem. , 1992, 35, 2600) (96,7 г, 344 ммоль) в диоксане (100 мл) и полученную в результате суспензию нагревают с обратным холодильником при перемешивании в течение 4,5 часов. Реакцию гасят путем добавления 6 н хлористого водорода (120 мл) при 0oC, разбавляют водой (1 л) и экстрагируют н-гексаном (3 х 700 мл). Объединенные экстракты промывают водой (2 х 500 мл), насыщенным раствором бикарбоната натрия (500 мл), водой (500 мл) и солевым раствором (500 мл), сушат (сульфат магния) и концентрируют при пониженном давлении с получением 147,5 г сырого продукта в виде жидкости янтарного цвета. Очистку выполняют с помощью колоночной хроматографии (силикагель, 1,7 кг; этилацетат в н-гексане, возрастающее отношение этилацетата от 5% до 20%) с получением 60/8 г смеси указанного в заглавии соединения и диэтилмалоната в отношении 1:1 в виде бесцветной жидкости. Выход указанного в заглавии соединения составляет 34%.
1H ЯМР (CDCl3) δ: 7,46-7,31 (5H, М), 6,85-6,81 (1H, М), 6,76 (1H, ддд, J= 1,82, 2,20, 9,16 Гц), 6,66 (1H, ддд, J=2,20, 2,56, 10,62 Гц), 5,04 (2H, с), 4,54 (1H, с), 4,30-4,16 (4H, м), 1,32-1,22 (6H, м).
Е. Этил 3-бензилокси-5-фторфенилацетат
Указанную выше смесь смеси диэтил 3-бензилокси-5-фторфенилмалоната и диэтилмалоната (например, 1:1,2, 1,0 г), ДМСО (10 мл), воды (0,1 мл) и LiCl (346 мг) помещают в 50 мл круглодонную колбу с магнитной мешалкой и снабженную холодильником. Смесь нагревают с обратным холодильником в течение 5 час. Смесь выливают в воду (50 мл) и все экстрагируют н-гексаном (2 х 50 мл). Объединенные органические экстракты промывают водой (50 мл), солевым раствором (50 мл) и сушат над Na2SO4. Удаление растворителя дает 283 мг (57%) этил 3-бензилокси-5-фторфенилацетата в виде желтого масла.
1H ЯМР (CDCl3) δ: 7,50-7,30 (5H, м), 6,77-6,50 (3H, м), 5,02 (2H, с), 4,16 (2H, кв, J=7,3 Гц), 3,56 (2H, с), 1,26 (3H, т, J=7,3 Гц).
F. Этил 4-[3-(бензилокси)-5-фторфенил]-3,4,5,6-тетрагидро-2H- пиран-4-карбоксилат
К перемешиваемому раствору этил 3-(бензилокси)-5-фторфенилацетата (17,5 г, 61 ммоль) и 15-краун-5 (1,32 г, 6 ммоль) в ДМФ (300 мл) при комнатной температуре по частям добавляют гидрид натрия (5,37 г, 134 ммоль, 60% дисперсия в минеральном масле). После перемешивания при комнатной температуре в течение 25 мин добавляют йодид натрия (1,32 г, 6 ммоль) и бис(2-хлорэтил)эфир (9,14 г, 61 ммоль). Через 1 день смесь разбавляют 0,5 н соляной кислотой (500 мл) и экстрагируют эфиром (3 х 500 мл). Объединенные экстракты промывают водой (500 мл), насыщенным раствором бикарбоната натрия (500 мл), водой (500 мл) и солевым раствором (500 мл), сушат (сульфат магния) и концентрируют при пониженном давлении с получением 26,15 г сырого продукта в виде желтой жидкости. Колоночная хроматография (силикагель, 1 кг; 20% этилацетат в н-гексане) дает указанное в заглавии соединение в виде бесцветной жидкости. (12,7 г, 58%).
1H ЯМР (CDCl3) δ: 7,45-7,31 (5H, м), 6,81-6,78 (1H, м), 6,70 (1H, ддд, J= 1,83, 2,20, 10,25 Гц), 6,59 (1H, ддд, J=2,20, 2,20, 10,25 Гц), 5,03 (2H, с), 4,14 (2H, кв, J=6,96 Гц), 3,92 (2H, ддд, J=3,29, 4,03, 11,72 Гц), 3,54 (2H, ддд, J= 2,20, 11,35, 11,72 Гц), 2,50-2,40 (2H, м), 1,92 (2H, ддд, J-4,03, 11,35, 13,55 Гц), 1,19 (3H, т, J=6,96 Гц).
G. Этил 4-(5-фтор-3-гидроксифенил)-3,4,5,6-тетрагидро-2H- пиран-4-карбоксилат
Смесь 4-[3-(бензилокси)-5-фторфенил)-3,4,5,6-тетрагидро-2H-пиран-4-карбоксилата (2,70 г, 7,5 ммоль) и 10% палладия на активированном угле (0,27 г) в этаноле (100 мл) перемешивают в атмосфере водорода в течение 3,25 час. Катализатор удаляют путем фильтрования и выпаривание фильтрата дает указанное в заглавии соединение в виде бесцветной жидкости (2,01 г, количественный выход).
1H ЯМР (CDCl3) δ: 6,72-6,62 (2H, м), 6,47 (1H, ддд, J=2,20, 2,20, 10,25 Гц), 5,40 (1H, ушир. с), 4,17 (2H, кв, J= 6,96 Гц), 3,98-3,89 (2H, м), 3,61-3,49 (2H, м), 2,50-2,41 (2H, м), 2,00-1,86 (2H, м), 1,24 (3H, т, J=6,96 Гц).
H. Этил 4-[5-фтор-3-[4-(2-метилимидазол-1-ил)бензилокси] - фенил] -3,4,5,6-тетрагидро-2H-пиран-4-карбоксилат
Перемешиваемую смесь этил 4-(5-фтор-3-гидроксифенил)-3,4,5,6-тетрагидро-2H-пиран-4-карбоксилата (2,01 г, 7,5 ммоль), гидрохлорида 4-(2-метилимидазол-1-ил)бензилхлорида (1,82 г, 7,5 ммоль) и карбоната калия (5,18 г, 37,5 ммоль) в ДМФ (30 мл) нагревают при 100oC в течение 1,33 час. После охлаждения до комнатной температуры смесь разбавляют смесью этилацетата и толуола (2: 1, 200 мл) и промывают водой (4 х 100 мл) и солевым раствором (100 мл), сушат (сульфат магния) и концентрируют с получением 3,38 г сырого продукта в виде янтарного твердого продукта. Перекристаллизация из смеси изопропилового эфира (25 мл) и этилацетата (2 мл) дает указанное в заглавии соединение (2,22 г, 68%) .
1H ЯМР (CDCl3) δ: 7,55 (2H, д, J=8,43 Гц), 7,34 (2H, д, J=8,43 Гц), 7,04 (1H, д, J=1,50 Гц), 7,01 (1H, д, J=1,0 Гц), 6,82 (1H, дд, J=2,20, 2,20 Гц), 6,75 (1H, ддд, J=2,20, 2,20, 10,26 Гц), 6,62 (1H, ддд, J=2,20, 2,20, 10,26 Гц), 5,09 (2H, с), 4,16 (2H, кв, J=7,33 Гц), 3,98-3,88 (2H, м), 3,60-3,50 (2H, м), 2,51-2,42 (2H, м), 2,38 (3H, с), 2,01-1,86 (2H, м), 1,21 (3H, т, J= 7,33 Гц).
Пример 3
4-Ацетил-4-[5-фтор-3-[4-(2-метилимидазол-1-ил)бензилокси] -фенил] - 3,4,5,6-тетрагидро-2H-пиран
A. 4-[3-(Бензилокси)-5-фторфенил]-4-гидроксиметил-3,4,5,6- тетрагидро-2H-пиран
К перемешиваемому раствору этил 4-[3-(бензилокси)-5-фторфенил] -3,4,5,6-тетрагидро-2H-пиран-4- карбоксилата (1,54 г, 4,23 ммоль) в эфире (150 мл) добавляют литийалюминийгидрид (0,16 г, 4,3 ммоль) тремя частями. Полученную суспензию перемешивают при комнатной температуре в атмосфере азота в течение 20 мин. Избыток гидрида уничтожают путем добавления насыщенного водного раствора сульфата натрия. Смесь разбавляют 10% водным раствором серной кислоты (100 мл), и органический слой отделяют. Эфирный слой промывают водой (100 мл), насыщенным водным раствором бикарбоната натрия (100 мл) и солевым раствором (100 мл), сушат (сульфат магния) и концентрируют досуха с получением указанного в заглавии соединения в виде белого твердого продукта (1,28 г, 94%).
1H ЯМР (CDCl3) δ: 7,44-7,33 (5H, м), 6,78-6,58 (3H, м), 5,05 (2H, с), 3,84-3,73 (2H, м), 3,62-3,48 (4H, м), 2,13-2,00 (2H, м), 1,95-1,82 (2H, м), 1,09 (1H, т, J=6,96 Гц).
B. 4-[3-(Бензилокси)-5-фторфенил]-4-формил-3,4,5,6-тетрагидро-2H-пиран
Тетра-н-пропиламмоний перрутенат (70 мг, 0,2 ммоль) добавляют за один раз к перемешиваемой смеси 4-[3-(бензилокси)-5-фторфенил]-4-гидроксиметил-3,4,5,6-тетрагидро- 2H-пирана (1,28 г, 4,0 ммоль), N-метилморфолин-N-оксида (0,70 г, 6,0 ммоль) и порошкообразного 3  молекулярного сита (2,0 г) при комнатной температуре в атмосфере азота. Через 20 мин добавляют тетра-н-пропиламмонийперрутенат (30 мг, 0,085 ммоль) и N-метилморфолин-N-оксид (0,30 г, 2,6 ммоль), и перемешивание продолжают в течение 30 мин. Смесь подвергают хроматографии (силикагель, 110 г; 25% этилацетат в н-гексане) с получением указанного в заглавии соединения в виде бесцветной жидкости (1,08 г, 86%).
молекулярного сита (2,0 г) при комнатной температуре в атмосфере азота. Через 20 мин добавляют тетра-н-пропиламмонийперрутенат (30 мг, 0,085 ммоль) и N-метилморфолин-N-оксид (0,30 г, 2,6 ммоль), и перемешивание продолжают в течение 30 мин. Смесь подвергают хроматографии (силикагель, 110 г; 25% этилацетат в н-гексане) с получением указанного в заглавии соединения в виде бесцветной жидкости (1,08 г, 86%).
1H ЯМР (CDCl3) δ: 9,38 (1H, с), 7,44-7,32 (5H, м), 6,70-6,58 (3H, м), 5,03 (2H, с), 3,89 (2H, ддд, J=4,03, 4,03, 12,09 Гц), 3,62-3,51 (2H, м), 2,38-2,28 (2H, м), 2,09-1,97 (2H, м).
C. 4-[3-(Бензилокси)-5-фторфенил]-4-(1-гидроксиэтил)-3,4,5,6- тетрагидро-2H-пиран
К перемешиваемому раствору 4-[3-(бензилокси)-5-фторфенил] -4-формил-3,4,5,6-тетрагидро-2H-пирана (1,08 г, 3,4 ммоль) в ТГФ (16 мл) при комнатной температуре в атмосфере азота добавляют по каплям О,96М раствор метилмагнийбромида (5,3 мл, 5,1 ммоль). Смесь перемешивают в течение ночи, разбавляют насыщенным водным раствором хлорида аммония (40 мл) и экстрагируют дихлорметаном (2 х 40 мл). Объединенные органические слои промывают водой (40 мл) и солевым раствором (40 мл), сушат (сульфат магния) и концентрируют досуха. Очистка с помощью колоночной хроматографии (силикагель, 150 г; этилацетат в н-гексане в качестве элюента с увеличением количества этилацетата от 40% до 60%) дает указанное в заглавии соединение в виде бесцветной жидкости (0,71 г, 63%).
1H ЯМР (CDCl3) δ: 7,47-7,32 (5H, м), 6,73-6,70 (1H, м), 6,67-6,60 (2H, м), 5,05 (2H, с), 3,85-3,75 (2H, м), 3,64 (1H, дт, J=6,96, 6,96 Гц), 3,47-3,27 (2H, м), 2,28-2,20 (1H, м), 2,06-2,00 (1H, м), 1,93-1,78 (2H, м), 1,11 (1H, д, J=6,96 Гц), 0,90 (3H, д, J=6,96 Гц).
D. 4-(5-Фтор-З-гидроксифенил)-4-(1-гидроксиэтил)-3,4,5,6- тетрагидро-2H-пиран
Указанное в заглавии соединение получают по способу, описанному в примере 2G с получением 4-[5-фтор-3-гидрокси-фенил]-3,4,5,6-тетрагидро-2H-пиран-4-карбоксилата, используя 4-(1-гидроксифенил)-4-[3-(бензилокси)-5-фторфенил]-3,4,5,6- тетрагидро-2H-пиран.
1H ЯМР (ДМСО-d6) δ: 9,70 (1H, ушир. с), 6,60-6,52 (2H, м), 6,40 (1H, ддд, J=2,20, 2,20, 10,63 Гц), 4,62 (1H, ушир. д, J=4,76 Гц), 3,77-3,61 (2H, м), 3,54-3,41 (1H, м), 3,30-3,12 (2H, м), 2,11-2,00 (1H, м), 1,95-1,72 (3H, м), 0,70 (3H, д, J=6,23 Гц).
Е. 4-Ацетил-4-(З-фтор-5-гидроксифенил)-3,4,5,6-тетрагидро-2H-пиран
Указанное в заглавии соединение получают по способу, описанному в примере 3B с получением 4-[3-(бензилокси)-5-фторфенил]-4-формил-3,4,5,6-тетрагидро-2H-пирана, используя 4-(5-фтор-3-гидроксифенил)-4-(1-гидроксиэтил)-3,4,5,6- тетрагидро-2H-пиран.
1H ЯМР (CDCl3) δ: 6,61 (1H, д, J=1,84, 2,20, 9,90 Гц), 6,65-6,47 (2H, м), 5,90 (1H, ушир. с), 3,85 (2H, ддд, J=4,40, 4,40, 12,09 Гц), 3,59 (2H, ддд, J= 2,20, 9,42, 12,09 Гц), 2,40-2,29 (2H, м), 2,19-2,18 (2H, м), 1,97 (3H, с).
F. 4-Ацетил-4-[5-фтор-3-[4-(2-метилимидазол-1-ил)бензилокси] - фенил]-3,4,5,6-тетрагидро-2H-пиран
Указанное в заглавии соединение получают по способу, описанному в примере 2H с получением этил 4-[5-фтор-3-[4-(2-метилимидазол-1-ил) бензилокси] фенил] -3,4,5,6-тетрагидро-2H-пиран-4-карбоксилата, используя 4-(5-фтор-3-гидроксифенил)-4-(1-гидроксиэтил)-3,4,5,6- тетрагидро-2H-пиран вместо этил 4-(5-фтор-3-гидроксифенил)-3,4,5,6-тетрагидро-2H-пиран-4-карбоксилата.
1H ЯМР (CDCl3) δ: 7,54 (2H, д, J=8,43 Гц), 7,34 (2H, д, J=8,43 Гц), 7,05 (1H, д, J= 1,47 Гц), 7,02 (1H, д, J=1,47 Гц), 6,72-6,61 (3H, м), 5,08 (2H, с), 3,84 (2H, ддд, J=4,40, 4,40, 12,09 Гц), 3,58 (2H, ддд, J=2,57, 9,52, 12,09 Гц), 2,38 (3H, с), 2,41-2,31 (2H, м), 2,20 (2H, ддд, J=4,40, 9,52, 14,29 Гц), 1,95 (3H, с).
Пример 4
4-[5-фтор-3-[4-(2-метилимидазол-1-ил)бензилокси]фенил]- 3,4,5,6-тетрагидро-2H-пиран-4-карбоновая кислота
Перемешиваемую смесь этил 4-[5-фтор-3-[4-(2-метилимидазол-1-ил) бензилокси]фенил]-3,4,5,6-тетрагидро-2H-пиран- 4-карбоксилата (Пример 3) (1,10 г, 25 ммоль), водный раствор гидроксида лития (0,13 г, 30 ммоль, 5 мл), метанола (15 мл) и ТГФ (15 мл) нагревают с обратным холодильником в течение 24 час. Реакционную смесь нейтрализуют 1н соляной кислотой. Летучие продукты удаляют путем выпаривания при пониженном давлении. Остаток суспендируют в смеси воды (20 мл) и фосфатного буфера (pH 7,5 мл) и нагревают с обратным холодильником в течение 30 мин. После охлаждения до 0oC твердые продукты собирают путем фильтрования, промывают водой и затем эфиром и сушат до постоянного веса в вакууме при 80oC в течение 14 час с получением указанного в заглавии соединения в виде белых твердых продуктов (0,98 г, 96%).
1H ЯМР (ДМСО-d6) δ: 7,62 (2H, д, J=8,43 Гц), 7,48 (2H, д, J=8,43 Гц), 7,30 (1H, д, J=1,10 Гц), 6,92 (1H, д, J=1,10 Гц), 6,90-6,76 (3H, м), 5,19 (2H, с), 3,84-3,75 (2H, м), 3,50-3,40 (2H, м), 2,36-2,27 (2H, м), 2,29 (3H, с), 1,88-1,75 (2H, м).
Пример 5
4-[5-Фтор-3-[4-(2-метилимидазол-1-ил)бензилокси]фенил]- 3,4,5,6-тетрагидро-2H-пиран-4-карбоксамид
К перемешиваемой суспензии 4-[5-фтор-3-[4-(2-метил-имидазол-1-ил) бензилокси] фенил] -3,4,5,6-тетрагидро-2H-пиран- 4-карбоновой кислоты (616 мг, 1,5 ммоль) в дихлорметане (20 мл) при 0oC в атмосфере азота добавляют оксалилхлорид (419 мг, 3,3 ммоль). Полученную суспензию перемешивают при 0oC в течение 30 мин и затем при комнатной температуре в течение 1 час. Полученную белую суспензию концентрируют досуха и остаток добавляют к перемешиваемому водному раствору аммиака (26%, 20 мл). После перемешивания при комнатной температуре в течение 70 мин твердые продукты собирают путем фильтрования, промывают водой и сушат до постоянного веса в вакууме при 80oC в течение ночи с получением указанного в заглавии соединения (337 мг, 54%).
1H ЯМР (ДМСО-d6) δ: 7, 61 (2H, д, J=8,43 Гц), 7,48 (2H, д, J=8,43 Гц), 7,30 (1H, д, J=1,08 Гц), 7,24 (1H, ушир. с), 7,08 (1H, ушир. с), 6,92 (1H, д, J=1,08 Гц), 6,89-6,82 (2H, м), 6,80-6,75 (1H, м), 5,18 (2H, с), 3,66-3,57 (2H, м), 3,51-3,40 (2H, м), 2,44-2,35 (2H, м), 2,29 (3H, с), 1,84-1,72 (2H, м).
Пример 6
N, N-Диметил-4-[5-фтор-3-[4-(2-метилимидазол-1-ил)бензилокси] - фенил]-3,4,5, 6-тетрагидро-2H-пиран-4-карбоксамид
К перемешиваемой суспензии 4-[5-фтор-3-[4-(2-метилимидазол-1-ил) бензилокси] фенил] -3,4,5,6-тетрагидро-2H-пиран- 4-карбоновой кислоты (100 мг, 0,24 ммоль), гидрохлорида диметиламина (98 мг, 1,2 ммоль) и триэтиламина (253 мг, 2,5 ммоль) в ТГФ (50 мл) при 0oC добавляют диэтилцианофосфат (44 мг, 0,27 ммоль). Через 10 мин реакционную смесь разбавляют водой (50 ил) и экстрагируют этилацетатом (50 мл). Экстракт промывают водой (50 мл) и солевым раствором (50 мл), сушат над сульфатом магния и концентрируют. Очистку остатка выполняют с помощью колоночной хроматографии (силикагель, 50 г; градиент полярности элюента от дихлорметана до 5% метанола в дихлорметане) с получением 117 мг сырого продукта в виде бесцветной пены. Перекристаллизация из смеси изопропиловый эфир-этилацетат (1:1) дает указанное в заглавии соединение (51 мг, 50%).
1H ЯМР (CDCl3) δ: 7,54 (2H, д, J=8,43 Гц), 7,33 (2H, д, J=8,43 Гц), 7,04 (1H, д, J= 1,10 Гц), 7,01 (1H, д, J=1,10 Гц), 6,69-6,58 (3H, м), 5,08 (2H, с), 3,93-3,85 (2H, м), 3,83-3,72 (2H, м), 2,67 (6H, ушир. с), 2,38 (3H, с), 2,28-2,19 (2H, м), 2,05-1,92 (2H, м).
Пример 7
4-Циано-4-[3-[4-(2-метилимидазол-1-ил)бензилокси] фенил] - 3,4,5,6-тетрагидро-2H-пиран
A. 4-Циано-4-(3-метоксифенил)-3,4,5,6-тетрагидро-2H-пиран
Указанное в заглавии соединение получают по способу, описанному в примере 2F, за исключением того, что (3-метоксифенил)ацетонитрил используют вместо этил 4-[3-(бензилокси)-5-фторфенил] -3,4,5,6-тетрагидро-2H-пиран-4- карбоксилата.
1H ЯМР (CDCl3) δ: 7,34 (1H, дд, J=8,1, 8,1 Гц), 7,02-6,98, (2H, м), 6,93-6,84 (1H, м), 4,19-3,75 (4H, м), 3,84 (3H, с), 2,22-1,98 (4H, м).
B. Циано-4-(3-гидроксифенил)-3,4,5,6-тетрагидро-2H-пиран
Указанное в заглавии соединение получают по способу, описанному в примере 20B, за исключением того, что 4-циано-4-(3-метоксифенил)-3,4,5,6-тетрагидро-2H-пиран используют вместо 1-(3-фтор-5-метоксифенил)циклопент-3-ен-1-карбоксилата.
1H ЯМР (CDCl3) δ: 7,36-7,21 (1H, м), 7,10-6,95 (2H, м), 6,89-6,77 (1H, м), 5,79 (1H, с), 4,21-4,03 (2H, м), 4,00-3,80 (2H, м), 2,25-1,95 (4H, м).
C. 4-Циано-4-[3-[4-(2-метилимидазол-1-ил)бензилокси] фенил] - 3,4,5,6-тетрагидро-2H-пиран
4-Циано-4-(3-гидроксифенил)-3,4,5,6-тетрагидро-2H-пиран взаимодействует с 4-(2-метилимидазол-1-ил)бензилхлоридом с
получением указанного в заглавии соединения с выходом 38% в виде бесцветных иголок по способу, описанному в примере 2H.
1H ЯМР (CDCl3) δ: 7,57 (2H, д, J=8,4 Гц), 7,42-7,29 (3H, м), 7,19-6,93 (5H, м), 5,15 (2H, с), 4,16-3,81 (4H, м), 2,38 (3H, с), 2,22-2,00 (4H, м).
ИК (КВr): n 1610, 1585, 1519, 1489, 1416, 1391 см-1. Т. Пл. 153-154oC.
Пример 8
4-[3-[4-(2-Метилимидазол-1-ил)фенилтио] фенил] -3,4,5,6- тетрагидро-2H-пиран-4-карбоксамид
A. 4-(2-Метилимидазол-1-ил)фенилйодид
К перемешиваемому раствору 2-метилимидазола (13,6 г, 165 ммоль) в ДМФ (500 мл) по частям добавляют гидрид натрия (6,60 г, 165 ммоль, 60% дисперсия в минеральном масле). Полученную белую суспензию перемешивают при комнатной температуре в течение 30 мин, добавляют 4-фторйодбензол (33,3 г, 150 ммоль), и смесь нагревают при 100oC. Через 16 час объем ДМФ удаляют путем выпаривания. Остаток затем распределяют между смесью этилацетат-толуол (2:1, 500 мл) и водой (250 мл). Органический слой отделяют и промывают водой (250 мл). Продукт экстрагируют 10% водным раствором хлористого водорода (2 х 200 мл) и объединенные водные экстракты нейтрализуют 30% водным раствором гидроксида калия. Полученную суспензию экстрагируют смесью этилацетат-толуол (2:1, 3 х 250 мл), солевым раствором (250 мл), сушат (сульфат магния) и концентрируют досуха. Остаток перекристаллизовывают из толуола с получением указанного в заглавии соединения в виде не совсем белых твердых продуктов (21,9 г, 51%).
1H ЯМР (CDCl3) δ: 7,65-7,61 (2H, м), 7,32-7,26 (2H, м), 7,33 (1H, д, J= 1,47 Гц), 6,98 (1H, д, J=1,47 Гц), 2,83 (3H, с).
B. Этил 4-(3-бромфенил)-3,4,5,6-тетрагидро-2H-пиран-4-карбоксилат
К перемешиваемому раствору этил 3-бромфенилацетата (Guenther, О. et al, Chem. Ber. , 1967, 100, 425) (41,3 г, 170 ммоль) и 15-краун-5 (3,74 г, 17 ммоль) в ДМФ (1 л) при комнатной температуре по частям добавляют гидрид натрия (14,8 г, 370 ммоль, 60% дисперсия в минеральном масле). После перемешивания при комнатной температуре в течение 40 мин добавляют йодид натрия (25,5 г, 170 ммоль) и бис(2-хлорэтил) эфир (30,4 г, 210 ммоль). Через 10,5 час объем ДМФ удаляют при пониженном давлении. Остаток обрабатывают смесью этилацетата и толуола (1:1, 500 мл) и промывают 0,5 н соляной кислотой (500 мл). Водный слой экстрагируют смесью этилацетат-толуол (1:1, 2 х 500 мл), и объединенные экстракты промывают водой (250 мл), насыщенным раствором бикарбоната натрия (250 мл), водой (2 х 250 мл) и солевым раствором (250 мл), сушат (сульфат магния) и концентрируют при пониженном давлении с получением 56,8 г сырого продукта в виде оранжевой жидкости. Очистка с помощью колоночной хроматографии (силикагель, 700 г; 15%, а затем 20% этилацетата в н-гексане) дает указанное в заглавии соединение в виде желтой жидкости (36,5 г, 69%).
1H ЯМР (CDCl3) δ: 7/52 (1H, дд, J=1,83, 1,83 Гц), 7,40 (1H, ддд, J=1,83, 1,83, 7,70 Гц), 7,31 (1H, ддд, J=1,83, 1,83, 8,06 Гц), 7,22 (1H, дд, J=7,70, 8,06 Гц), 4,16 (2H, кв, J=7,33 Гц), 3,94 (2H, ддд, J=3,29, 4,03, 11,73 Гц), 3,56 (2H, ддд, J=2,20, 11,73, 13,56 Гц), 2,50 (2H, ддд, J=2,20, 3,29, 11,36 Гц), 1,94 (2H, ддд, J=4,03, 11,36, 13,56 Гц), 1,20 (3H, т, J=7,3 Гц).
C. 4-(3-Бромфенил)-3,4,5,6-тетрагидро-2H-пиран-4-карбоновая кислота
Перемешиваемую смесь этил 4-(3-бромфенил)-3,4,5,6-тетрагидро- 2H-пиран-4-карбоксилата (36,5 г, 117 ммоль), водного раствора гидроксида лития (6,14 г, 146 ммоль, 50 мл), метанола (150 мл) и ТГФ (150 мл) нагревают с обратным холодильником в течение 1 дня. Реакционную смесь распределяют между эфиром (100 мл) и 10% водным раствором гидроксида калия (300 мл). Эфирный слой отделяют, экстрагируют 10% водным раствором гидроксида калия (2 • 100 мл) и удаляют. Объединенные водные экстракты подкисляют концентрированной соляной кислотой, и полученный в результате белый осадок собирают путем фильтрования, промывают водой и сушат до постоянного веса в вакууме при 80oC с получением указанного в заглавии соединения в виде белого твердого продукта (26,4 г, 79%).
1H ЯМР (CDCl3) δ: 7,55 (1H, дд, J=1,83, 1,83 Гц), 7,43 (1H, ддд, J=1,46, 1,83, 8,06 Гц), 7,35 (1H, ддд, J=1,46, 1,83, 8,06 Гц), 7,24 (1H, дд, J=8,06, 8,06 Гц), 3,94 (2H, ддд, J=3,67, 4,03, 12,09 Гц), 3,62 (2H, ддд, J=1,83, 11,72, 12,09 Гц), 2,50 (2H, м), 1,97 (2H, ддд, J=4,03, 11,72 13,92 Гц).
D. Метил 4-(3-метилсульфинилфенил)-3,4,5,6-тетрагидро-2H-пиран- 4-карбоксилат
К перемешиваемому раствору 4-(3-бромфенил)-3,4,5,6-тетрагидро- 2H-пиран-4-карбоновой кислоты (19,1 г, 67 ммоль) в ТГФ (650 мл) при -78oC в атмосфере азота добавляют н-бутиллитий (1,60 М в растворе н-гексана, 100 мл, 160 ммоль). Через 45 мин медленно добавляют раствор диметилдисульфида (8,84 г, 94 ммоль) в ТГФ (50 мл) в течение 30 минут и смесь перемешивают при -78oC в течение дополнительных 70 мин, а затем в течение 3 час при температуре окружающей среды. К полученной в результате суспензии добавляют 2н соляную кислоту (500 мл) и слои разделяют. Водный слой экстрагируют этилацетатом (2 х 250 мл), и объединенные органические слои промывают водой (94 х 100 мл) и солевым раствором (100 мл), сушат (сульфат магния) и концентрируют досуха.
Остаток (21,5 г) растворяют в метаноле (100 мл), и добавляют 10% метаноловый раствор хлористого водорода (100 мл), и смесь нагревают с обратным холодильником при перемешивании в течение 13 час. Добавляют другую часть 10% метанольного раствора хлористого водорода (100 мл), и нагревание продолжают в течение следующих 7 часов. Летучие вещества удаляют путем выпаривания и остаток растворяют в этилацетате (500 мл) и промывают водой (2 х 250 мл), насыщенным водным раствором бикарбоната натрия (250 мл), водой (250 мл) и солевым раствором (250 мл). Водные органические слои объединяют и экстрагируют этилацетатом (2 х 250 мл). Объединенные органические слои сушат (сульфат магния) и концентрируют досуха.
Этот продукт (17,9 г) растворяют в метаноле (200 мл) и охлаждают до 0oC. Добавляют раствор перйодата натрия (16,0 г, 75 ммоль) в воде (200 мл) и полученную суспензию перемешивают при 0oC в течение 1 час. Реакционную смесь разбавляют водой (500 мл) и экстрагируют дихлорметаном (200 мл) и 10% метанолом в дихлорметане (3 • 200). Объединенные экстракты промывают солевым раствором (200 мл), сушат (сульфат магния) и концентрируют досуха. Очистка с помощью колоночной хроматографии (силикагель, 700 г; этилацетат) дает указанное в заглавии соединение в виде бесцветной жидкости (12,2 г, 64%), которая затвердевает при стоянии.
1H ЯМР (CDCl3) δ: 7,71-7,68 (1H, м), 7,55-7,50 (3H, м), 4,02-3,92 (2H, м), 3,69 (3H, с), 3,62-3,50 (2H, м), 2,73 (3H, с), 2,62-2,52 (2H м), 2,06-1,59 (2H, м).
E. Метил 4-(3-меркаптофенил)-3,4,5,6-тетрагидро-2H-пиран-4- карбоксилат
Метил 4-(3-метилсульфинилфенил)-3,4,5,6-тетрагидро-2H-пиран-4- карбоксилат (12,2 г, 43 ммоль) растворяют в трифторуксусном ангидриде (50 мл) и нагревают с обратным холодильником в течение 30 мин. Летучие продукты удаляют выпариванием и остаток растворяют в метиловом спирте (100 мл). Через 5 мин добавляют триэтиламин (100 мл), и смесь концентрируют досуха. Остаток растворяют в этилацетате (500 мл), промывают насыщенным водным раствором хлорида аммония (200 мл) и солевым раствором (200 мл), сушат (сульфат магния) и концентрируют досуха с получением указанного в заглавии сырого соединения в виде матово-черной жидкости, которую используют как таковую без дальнейшей очистки.
1H ЯМР (CDCl3) δ: 7,30-7,13 (3H, м), 4,90-3,90 (2H, м), 3,68 (3H, с), 3,64-3,48 (2H, м), 2,58-2,48 (2H м), 2,04-1,93 (2H, м).
F. Этил 4-[3-[4-(2-метилимидазол-1-ил)фенилтио] фенил]-3,4,5,6- тетрагидро-2H-пиран-4-карбоксилат (Предлагаемое соединение)
Раствор метил 4-(3-меркаптофенил)-3,4,5,6-тетрагидро-2H-пиран-4- карбоксилата (1,04 г, 3,5 ммоль), 4-(2-метилимидазол-1-ил)фенилйодида (0,89 г, 3,5 ммоль), трет-бутоксида натрия (673 мг, 7 ммоль) и тетракис(трифенилфосфин)палладия (162 мг, 0,14 ммоль) в сухом этаноле (20 мл) нагревают с обратным холодильником при перемешивании в течение ночи. Летучие продукты удаляют путем выпаривания и остаток распределяют между этилацетатом (100 мл) и водой (100 мл). Водный слой экстрагируют этилацетатом (100 мл). Объединенные органические слои промывают солевым раствором (100 мл), сушат (сульфат магния) и концентрируют досуха с получением 1,09 г сырого продукта в виде коричневой жидкости. Очистка с помощью колоночной хроматографии (силикагель, 50 г; метанол в дихлорметане, увеличивающееся отношение метанола от 0% до 4%) дает указанное в заглавии соединение (0,90 г).
1H ЯМР (CDCl3) δ: 7,51-6,98 (10H, м), 4,15 (2H, д, J=6,96 Гц), 3,98-3,88 (2H, м), 3,61-3,50 (3H м), 2,55-2,45 (2H, м), 2,37 (3H, с), 2,01-1,90 (2H, м), 1,18 (3H, т, J=6,96 Гц).
G. 4-[3-[4-(2-Метилимидазол-1-ил)фенилтио] фенил]-3,4,5,6- тетрагидро-2H-пиран-4-карбоновая кислота (Предлагаемое соединение)
К раствору этил 4-[3-[4-(2-Метилимидазол-1-ил)фенилтио] -фенил] - 3,4,5,6-тетрагидро-2H-пиран-4-карбоксилата, полученного как указано выше, в смеси тетрагидрофурана (20 мл) и метанола (20 мл) добавляют водный раствор гидрохлорида лития (0,42 г, 10 ммоль), и смесь нагревают с обратным холодильником при перемешивании в течение 11 час. Летучие продукты затем удаляют при пониженном давлении. Остаток распределяют между эфиром (100 мл) и водой (100 мл), и эфирный слой экстрагируют 1н водным раствором гидроксида калия (2 • 50 мл). Объединенные водные слои нейтрализуют 1н водным раствором хлористого водорода и насыщенным водным раствором бикарбоната натрия. Осадки собирают с помощью фильтрования, промывают водой и сушат в вакууме при 80oC с получением указанного в заглавии соединения (488 мг, 35% из метил 4-(3-метилсульфинилфенил)-3,4,5,6-тетрагидро-2H-пиран- 4-карбоксилата).
1H ЯМР (CDCl3) δ: 7,49-7,37 (7H, м), 7,34-7,29 (1H, м), 7,30 (1H, д, J= 1,10 Гц), 6,91 (1H, д, J=1,10 Гц), 3,90-3,78 (2H, м), 3,49-3,36 (2H м), 2,38-2,28 (2H, м), 2,28 (3H, с), 1,88-1,76 (2H, м).
H. 4-[3-[4-(2-Метилимидазол-1-ил)фенилтио] фенил]-3,4,5,6- тетрагидро-2H-пиран-4-карбоксамид
К перемешиваемой суспензии 4-[3-[4-(2-Метилимидазол-1-ил) фенилтио]фенил] -3,4,5,6-тетрагидро-2H-пиран-4-карбоновой кислоты (217 мг, 0,55 ммоль) при 0oC добавляют оксалилхлорид (254 мг, 2,0 ммоль). Полученный в результате раствор перемешивают при 0oC в течение 30 мин, а затем при комнатной температуре в течение 20 мин. Летучие продукты затем удаляют выпариванием. Остаток добавляют к перемешиваемому водному раствору аммиака (30 мл) и перемешивают в течение 1 час. После охлаждения до 0oC осадки собирают путем фильтрования, промывают водой и сушат до постоянного веса в вакууме при 80oC с получением указанного в заглавии соединения (207 мг, 96%).
1H ЯМР (ДМСО-d6) δ: 7,49-7,26 (10H, м), 7,10 (1H, ушир. с), 6,90 (1H, д, J=1,10 Гц), 3,78-3,68 (2H м), 3,52-3,40 (2H м), 2,46-2,36 (2H, м), 2,28 (3H, с), 1,86-1,64 (2H, м).
Пример 9
4-[3-[4-(Пиррол-1-илметил)фенилтио] фенил] -3,4,5,6-тетрагидро- 2H-пиран-4-карбоксамид
A. Этил 4-[3-[4-(пиррол-1-илметил)фенилтио]фенил]-3,4,5,6- тетрагидро-2H-пиран-4-карбоксилат (Предлагаемое Соединение)
Указанное в заглавии соединение получают по способу, описанному в примере 8F с получением этил 4-[3-[4-(2-метилимидазол-1- ил)фенилтио]фенил]-3,4,5,6-тетрагидро-2H-пиран-4-карбоксилата, используя 4-(пиррол-1-илметил)фенилйодид (ЕР 488602 А1) вместо 4-(2-метилимидазол-1-ил)фенилйодида.
1H ЯМР (CDCl3) δ: 7,38-7,34 (1H, м), 7,28-7,18 (5H, м), 7,04 (2H, д, J= 8,43 Гц), 6,68 (2H, т, J=2,20 Гц), 6,19 (2H, т, J=2,20 Гц), 5,05 (2H, с), 4,12 (2H, кв, J=7,33 Гц), 3,96- 3,86 (2H, м), 3,59-3,49 (2H м), 2,50-2,42 (2H, м), 1,99-1,85 (2H, м), 1,16 (3H, т, J=7,33 Гц).
B. 4-[3-[4-(Пиррол-1-илметил)фенилтио]фенил]-3,4,5,6-тетрагидро- 2H-пиран-4-карбоновая кислота (Предлагаемое Соединение)
Указанное в заглавии соединение получают по способу, описанному в примере 8G с получением 4-[3-[4-(2-метилимидазол-1-ил)фенилтио] - фенил]-3,4,5,6-тетрагидро-2H-пиран-4-карбоновой кислоты, используя этил 4-[3-[4-(пиррол-1-илметил)фенилтио]фенил]-3,4,5,6-тетрагидро-2H- пиран-4-карбоксилат вместо этил 4-[3-[4-(2-метилимидазол-1-ил)- фенилтио]фенил]-3,4,5,6-тетрагидро-2H-пиран-4-карбоксилата.
1H ЯМР (CDCl3) δ: 7,40-7,37 (1H, м), 7,32-7,25 (4H, м), 7,23-7,16 (1H, м), 7,04 (2H, д, J=8,43 Гц), 6,68 (2H, т, J=2,20 Гц), 6,19 (2H, т, J=2,20 Гц), 5,05 (2H, с), 3,96-3,87 (2H, м), 3,66-3,55 (2H м), 2,51-2,41 (2H, м), 2,00-1,88 (2H, м).
C. 4-[3-[4-(Пиррол-1-илметил)фенилтио] фенил] -3,4,5,6-тетрагидро- 2H-пиран-4-карбоксамид
Суспензию 4-[3-[4-(пиррол-1-илметил)фенилтио] фенил]-3,4,5,6- тетрагидро-2H-пиран-4-карбоновой кислоты (0,36 г, 0,93 ммоль), бикарбоната аммония (0,44 г, 5,58 ммоль) и 2-этокси-1-этоксикарбонил- 1,2-дигидрохинолина (0,28 г, 1,12 ммоль) в дихлорметане (20 мл) перемешивают при комнатной температуре в течение ночи. Бикарбонат аммония и 2-этокси-1-этоксикарбонил-1,2-дигидрохинолин добавляют до тех пор, пока кислота не израсходуется. Реакционную смесь разбавляют дихлорметаном (50 мл) и промывают водой (950 мл). Органический экстракт промывают холодной 1н соляной кислотой (50 мл) и насыщенным водным раствором бикарбоната натрия (5 мл), водой (50 мл) и солевым раствором (50 мл), сушат (сульфат магния) и концентрируют досуха. Перекристаллизация остатка из этилацетата дает указанное в заглавии соединение (198 мг, 54%).
1H ЯМР (ДМСО-d6) δ: 7,38-7,25 (6H, м), 7,18-7,03 (4H, м), 7,80 (2H, т, J= 2,20 Гц), 6,02 (2H, т, J= 2,20 Гц), 5,09 (2H, с), 3,77-3,66 (2H, м), 3,50-3,38 (2H м), 2,42-2,32 (2H, м), 1,82-1,68 (2H, м).
Пример 10
N-Метил-4-[5-фтор-3-[4-(2-метилимидазол-1-ил)бензилокси] -фенил] - 3,4,5,6-тетрагидро-2H-пиран-4-карбоксамид
Указанное в заглавии соединение получают по способу, описанному в примере 5, за исключением того, что водный раствор метиламина (40%) используют вместо водного раствора аммиака. Избыток метиламина удаляют при пониженном давлении, остаток разбавляют водой (100 мл) и экстрагируют дихлорметаном (2 х 100 мл). Объединенные экстракты сушат (сульфат магния) и концентрируют. Остаток перекристаллизовывают из этилацетата с получением указанного в заглавии соединения в виде мелкодисперсных белых твердых продуктов.
1H ЯМР (ДМСО-d6) δ: 7,69 (1H, ушир. с), 7,61 (2H, д, J=8,43 Гц), 7,47 (2H, д, J= 8,43 Гц), 7,29 (1H, д, J=1,10 Гц), 6,91 (1H, т, J=1,10 Гц), 6,90-6,80 (2H, м), 6,79-6,70 (1H, м), 5,17 (2H, с), 3,75-3,65 (2H, м), 3,48-3,36 (2H м), 2,55 (3H, с), 2,41-2,31 (2H, м), 2,29 (3H, с), 1,90-1,77 (2H, м).
Пример 11
4-[5-Фтор-3-[4-(2-метилимидазол-1-ил)бензилокси] фенил] -3,4,5,6-тетрагидро-2H-пиран-4-тиокарбоксамид
К перемешиваемому раствору 4-[5-фтор-3-[4-(2-метилимидазол-1- ил)бензилокси]фенил]-3,4,5,6-тетрагидро-2H-пиран-4-карбоксамида (Пример 5) в ТГФ (10 мл) добавляют пентасульфид фосфора (236 мг, 0,53 ммоль) и бикарбонат натрия (176 мг, 2,1 ммоль). Полученную смесь нагревают при 40oC в течение 4 час. Смесь концентрируют в вакууме. К остатку добавляют воду (100 мл), и смесь экстрагируют дихлорметаном (2 х 100 мл). Объединенные органические экстракты сушат над сульфатом натрия и концентрируют в вакууме. Остаток очищают на хроматографической колонке (LiChropprep-NH2), а затем п-ТСХ, элюируя дихлорметаном-метанолом (10:1) с получением 38 мг указанного в заглавии соединения в виде белых твердых продуктов.
1H ЯМР (CDCl3) δ: 7,67-7,49 (3H, м), 7,39-7,29 (2H, м), 7,03 (1H, д, J= 1,47 Гц), 7,01 (1H, д, J=1,46 Гц), 6,98-6,62 (4H, м), 5,09 (2H, с), 3,95-3,80 (2H м), 3,70-3,54 (2H, м), 2,70- 2,55 (2H, м), 2,37 (3H, с), 2,30-2,14 (2H, м).
ИК (KBr) ν: 1620, 1590, 1520, 1420, 1140 см-1
т. пл.: 167-170oC.
Пример 12
4-[3-[4-(2-Метилимидазол-1-илметил)фенилтио] фенил] -3,4,5,6- тетрагидро-2H-пиран-4-карбоксамид
A. 4-[(2-Метилимидазол-1-ил)метил]фенил]фенилйодид
Смесь 2-метилимидазола (0,66 г, 8,0 ммоль), 4-йодбензилбромида (J. Am. Chem. Soc. , 1949, 71, 3360) (2,38 г, 8,0 ммоль) и карбоната калия (2,21 г, 16 ммоль) в ацетонитриле (100 мл) перемешивают при нагревании с обратным холодильником в течение 15 час. После охлаждения остатки отфильтровывают и фильтрат концентрируют досуха. Остаток распределяют между эфиром (100 мл) и водой (100 мл). Эфирный слой отделяют, промывают солевым раствором (100 мл), сушат (сульфат магния) и концентрируют. Очистка с помощью колоночной хроматографии (силикагель, 50 г; метанол в дихлорметане, увеличивающееся отношение метанола от 0% до 5%) дает указанное в заглавии соединение (1,05 г, 44%).
1H ЯМР (CDCl3) δ: 7,67 (2H, д, J=8,42 Гц), 6,96 (1H, д, J=1,10 Гц), 6,82 (1H, д, J=1,10 Гц), 6,79 (2H, д, J=8,42 Гц), 4,99 (2H, с), 2,32 (3H, с).
B. Этил 4-[3-[4-(2-метилимидазол-1-ил)метил]фенилтио]фенил]- 3,4,5,6-тетрагидро-2H-пиран-4-карбоксилат (Предлагаемое Соединение)
Указанное в заглавии соединение получают по способу, описанному в примере 8F с получением этил 4-[3-[4-(2-метилимидазол-1-ил)- фенилтио]фенил]-3,4,5,6-тетрагидро-2H-пиран-4-карбоксилата, используя 4-[(2-метилимидазол-1-ил)метил]фенилйодид вместо 4-(2-метилимидазол-1-ил)фенилйодида.
1H ЯМР (CDCl3) δ: 7,40-6,82 (10H, м), 5,27 (2H, с), 4,13 (2H, кв, J=6,96 Гц), 3,96-3,86 (2H, м), 3,61-3,47 (2H, м), 2,52-2,42 (2H, м), 2,33 (3H, м), 1,99-1,87 (2H, м), 1,25 (3H, т, J=6,96 Гц).
C. 4-[3-[4-(2-Метилимидазол-1-илметил]фенилтио]фенил]-3,4,5,6- тетрагидро-2H-пиран-4-карбоновая кислота (Предлагаемое Соединение)
Указанное в заглавии соединение получают по способу, описанному в примере 8G с получением 4-[3-[4-(2-метилимидазол-1-ил)фенилтио] - фенил] -3,4,5,6-тетрагидро-2H-пиран-4-карбоновой кислоты, используя этил 4-[3-[4-(2-метилимидазол-1-ил)метил] фенилтио] фенил]-3,4,5,6- тетрагидро-2H-пиран-4-карбоксилат вместо этил 4-[3-[4-(2- метилимидазол-1-ил)фенилтио]фенил]-3,4,5,6-тетрагидро-2H-пиран-4- карбоксилата.
1H ЯМР (CDCl3) δ: 7,56-7,52 (1H, м), 7,45-7,40 (1H, м), 7,36-7,23 (2H, м), 7,19 (2H, д, J=8,42 Гц), 6,95 (1H, д, J=1,46 Гц), 6,91 (2H, д, J=8,42 Гц), 6,79 (1H, д, J=1,46 Гц), 4,98 (2H, с), 3,96-3,86 (2H, м), 3,74-3,62 (2H, м), 2,57-2,47 (2H, м), 2,31 (3H, с), 1,97-1,83 (2H, м).
D. 4-[3-[4-(2-Метилимидазол-1-илметил)фенилтио]фенил]-3,4,5,6- тетрагидро-2H-пиран-4-карбоксамид
Указанное в заглавии соединение получают по способу, описанному в примере 9C с получением 4-[3-[4-(пиррол-1-ил)-метил]фенилтио]- фенил]-3,4,5,6-тетрагидро-2H-пиран-4-карбоксамида, используя 4-[3-[4-(2-метилимидазол-1-илметил)фенилтио] фенил] -3,4,5,6- тетрагидро-2H-пиран-4-карбоновую кислоту вместо 4-[3-[4-(пиррол- 1-илметил)фенилтио] фенил]-3,4,5,6-тетрагидро-2H-пиран-4-карбоновой кислоты.
1H ЯМР (CDCl3) δ: 7,39-7,36 (1H, м), 7,37-7,19 (5H, м), 6,99 (2H, д, J= 8,79 Гц), 6,96 (1H, д, J=1,47 Гц), 6,85 (1H, д, J=1,47 Гц), 5,20 (2H, ушир. с), 5,04 (2H, с), 3,82-3,72 (4H, м), 2,34 (3H, с), 2,35-2,29 (2H, м), 2,01-1,97 (2H, м).
Пример 13
1-[5-Фтор-3-[4-(2-метилимидазол-1-ил)бензилокси] фенил]- циклогексан-1-карбоксамид
A. Этил 1-(3-бензилокси-5-фторфенил)циклогексан-1-карбоксилат
Указанное в заглавии соединение получают из этил 3-бензилокси-5-фторфенилацетата по способу, описанному в примере 2F, за исключением того, что 1,5-дибромпентан используют вместо бис(2-хлорэтил)эфира.
1H ЯМР (CDCl3) δ: 7,48-7,27 (5H, м), 6,84-6,80 (1H, м), 6,73 (1H, ддд, J= 10, 2,2, 2,2 Гц), 6,56 (1H, ддд, J=10, 2,2, 2,2 Гц), 5,02 (2H, с), 4,11 (2H, кв, J=7,0 Гц), 2,49-2,32 (2H, м), 1,77-1,35 (8H, м), 1,18 (3H, т, J=7,0 Гц).
B. Этил 1-(5-фтор-3-гидроксифенил)циклогексан-1-карбоксилат
Указанное в заглавии соединение получают из этил 1-(3-бензилокси-5-фторфенил)циклогексан-1-карбоксилата по способу, описанному в примере 2G.
1H ЯМР (CDCl3) δ: 6,72-6,63 (2H, м), 6,47 (1H, ддд, J=2,2, 2,2, 10 Гц) , 4,13 (2H, кв, J=7,0 Гц), 2,48-2,33 (2H, м), 1,75-1,35 (8H, м), 1,20 (3H, т, J=7,0 Гц).
C. Этил 1-[5-фтор-З-[4-(2-метилимидазол-1-ил)бензилокси]- фенил]циклогексан-1-карбоксилат (Предлагаемое Соединение)
Указанное в заглавии соединение получают из этил 1-(5-фтор-3-гидроксифенил)циклогексан-1-карбоксилата по способу, описанному в примере 2H.
1H ЯМР (CDCl3) δ: 7,55 (2H, д, J=8,4 Гц), 7,33 (2H, д, J=8,4 Гц), 7,04 (1H, д, J=1,5 Гц), 7,01 (1H, д, J=1,5 Гц), 6,86-6,83 (1H, м), 6,76 (1H, ддд, J= 2,2, 2,2, 9,7 Гц), 6,58 (1H, ддд, J=2,2, 2,2, 10 Гц), 5,08 (2H, с), 4,12 (2H, кв, J= 7,0 Гц), 2,49-2,38 (2H, м), 2,38 (3H, с), 1,79-1,58 (6H, м), 1,53-1,32 (2H, м), 1,19 (3H, т, J=7,0 Гц).
D. 1-[5-Фтор-3-[4-(2-метилимидазол-1-ил)бензилокси] фенил] - циклогексан-1-карбоксамид
Желаемое соединение получают из этил 1-[3-фтор-5-[4-(2- метилимидазол-1-ил)бензилокси] фенил] циклогексан-1-карбоксилата по способу, описанному в примере 5.
1H ЯМР (CDCl3) δ: 7,53 (2H, д, J=8,1 Гц), 7,22 (2H, д, J=8,1 Гц), 7,08 (1H, с), 6,96 (1H, с), 6,95 (1H, м), 6,83 (1H, ддд, J=2,2, 2,2, 9,5 Гц), 6,56 (1H, ддд, J= 2,2, 2,2, 9,5 Гц), 6,10 (2H, ушир. с), 5,11 (2H, с), 2,60-2,35 (2H, м), 2,33 (3H, с), 1,79-1,50 (8H, м).
Пример 14
1-[5-Фтор-3-[4-(2-метилимидазол-1-ил)бензилокси] фенил] - циклопент-3-ен-1-карбоксамид
A. Метил 5-фтор-3-метоксифенилацетат
К перемешиваемой смеси метил 5-фтор-3-гидрокси-фенилацетата (3,3 г, 15,7 ммоль) и карбоната калия (1,82 г, 50 ммоль) в ДМФ (30 мл) при комнатной температуре добавляют метилйодид (1,82 г, 50 ммоль) и реакционную смесь перемешивают в течение ночи. Затем смесь разбавляют водой (50 мл) и экстрагируют эфиром. Объединенные экстракты промывают водой и солевым раствором, сушат (MgSO4) и концентрируют в вакууме. Остаток очищают с помощью колоночной хроматографии (SiO2, 150 г; гексан/этилацетат (10/1)), получая 5-фтор-3-метокси-фенилацетат в виде бесцветного масла.
1H ЯМР (CDCl3) δ: 6,64-6,57 (2H, м), 6,53 (1H, ддд, J=2,2, 2,2, 11 Гц), 3,79 (3H, с), 3,71 (3H, с), 3,57 (2H, с).
B. Метил 1-(3-фтор-3-метоксифенил)циклопент-3-ен-карбоксилат
К перемешиваемому раствору 5-фтор-3-метоксифенилацетата (708 мг, 3,6 ммоль) в ТГФ (10 мл) добавляют 1 M раствор трет-бутоксида калия в ТГФ (4,0 мл, 4,0 ммоль) при -30oC в течение 0,25 час. После перемешивания в течение 1 ч при той же температуре добавляют по каплям раствор цис-1,4-дихлорбут-2-ена (526 мг, 4,0 ммоль) в ТГФ (2 мл) и реакционную смесь нагревают до комнатной температуры в течение 2 часового периода. Реакционную смесь охлаждают до -30oC и добавляют 1,0 M раствор трет-бутоксида калия в ТГФ (4,0 мл, 4,0 ммоль), и смесь перемешивают в течение ночи при комнатной температуре. Реакцию гасят путем добавления насыщенного водного раствора хлорида аммония и экстрагируют этилацетатом. Объединенные экстракты промывают солевым раствором, сушат над MgSO4 и концентрируют в вакууме. Очистка с помощью колоночной хроматографии (SiO2, 150 г; гексан/этилацетат (20/1)) дает 495 мг (55%) метил 1-(5-фтор-3-метоксифенил)циклопент-3-ен-карбоксилата в виде бесцветного масла.
1H ЯМР (CDCl3) δ: 6,67-6,60 (2H, м), 6,49 (1H, ддд, J=11, 2,2, 2,2 Гц), 5,75 (2H, с), 3,78 (3H, с), 3,66 (3H, с), 3,36 (2H, д, J=15 Гц), 2,72 (2H, д, J=15 Гц).
C. Метил 1-(5-фтор-3-гидроксифенил)циклопент-3-ен-1-карбоксилат
К перемешиваемому раствору 1-(5-фтор-3-метоксифенил)циклопент-3- ен-1-карбоксилата (495 мг, 2,0 ммоль) в сухом дихлорметане (10 мл) добавляют 1,0 М раствор трибромида бора в дихлорметане (10 мл, 10 ммоль) при -78oC, и смесь перемешивают в течение 1 час при той же температуре. Реакцию гасят путем добавления воды (20 мл), и полученную смесь подкисляют 1,0 н водным раствором соляной кислоты и экстрагируют этилацетатом. Органическую фазу промывают солевым раствором, сушат и концентрируют при пониженном давлении. Остаток растворяют в смеси метанола (5 мл) и толуола (15 мл), и добавляют 2,0 М раствор триметилсилилдиазометана в гексане (2 мл, 4 ммоль) при перемешивании при температуре окружающей среды. Через 0,5 час реакционную смесь распределяют между этилацетатом и водой, органическую фазу отделяют, и водную фазу экстрагируют этилацетатом. Объединенную органическую фазу промывают солевым раствором, сушат над MgSO4 и концентрируют в вакууме. Полученное в результате масло очищают с помощью колоночной хроматографии (SiO2, 150 г; гексан/этилацетат (4/1)) с получением 407 мг (87%) белых кристаллов метил 1-(5-фтор-3-гидроксифенил)циклопент-3-ен-1-карбоксилата.
1H ЯМР (CDCl3) δ: 6,64-6,57 (2H, м), 6,46 (1H, ддд, J=9,2, 2,2, 2,2 Гц), 5,75 (2H, с), 5,68 (1H, ушир. с), 3,67 (3H, с), 3,35 (2H, д, J=15 Гц), 2,71 (2H, д, J=15 Гц).
D. 1-[5-Фтор-3-[4-(2-метилимидазол-1-ил)бензилокси] фенил]- циклопент-3-ен-1-карбоксамид
Метил 1-(5-фтор-3-гидроксифенил)циклопент-3-ен-1-карбоксилат преобразуют в указанное в заглавии соединение, как описано с получением 4-[5-фтор-3-[4-(2-метилимидазол-1-ил)- бензилокси] фенил]-3,4,5,6-тетрагидро-2H-пиран-4-карбоксамид (Пример 5).
1H ЯМР (ДМСО-d6) δ: 7,62 (2H, д, J=8,4 Гц), 7,48 (2H, д, J=8,4 Гц), 7,30 (1H, д, J=2,2 Гц), 6,92 (1H, д, J=2,2 Гц), 6,92-6,83 (1H, м), 6,79-6,75 (1H, м), 6,46-6,67 (1H, м), 5,76 (2H, с), 5,18 (2H, с), 3,27 (2H, д, J=15 Гц), 2,62 (2H, д, J=15 Гц), 2,30 (3H, с).
Пример 15
4-[3-[4-(2-Метилимидазол-1-ил)бензилокси] фенил] -3,4,5,6- тетрагидро-2H-пиран-4-карбоксамид
A. 4-(3-Бензилоксифенил)-3,4,5,6-тетрагидро-2H-пиран-4- карбоновая кислота
Указанное в заглавии соединение получают по способу, описанному в примере 4, за исключением того, что этил 4-(3-бензилоксифенил)- 3,4,5,6-тетрагидро-2H-пиран-4-карбоксилат (ЕР 462830 A2) используют вместо этил 4-[5-фтор-3-[4-(2-метилимидазол-1-ил)бензилокси] фенил] - 3,4,5,6-тетрагидро-2H-пиран-4-карбоксилата.
1H ЯМР (CDCl3) δ: 7,68-7,22 (6H, м), 7,22-7,01 (2H, м), 6,95-6,82 (1H, м), 5,09 (2H, с), 4,10-3,80 (2H, м), 3,80-3,41 (2H, м), 2,70-2,25 (2H, м), 2,19-1,75 (2H, м).
B. 4-(3-Бензилоксифенил)-3,4,5,6-тетрагидро-2H-пиран-4- карбоксамид
Указанное в заглавии соединение получают по способу, описанному в примере 5, за исключением того, что 4-(3-бензилоксифенил)-3,4,5,6- тетрагидро-2H-пиран-4-карбоновую кислоту используют вместо 4-[5-фтор-3-[4-(2-метилимидазол-1- ил)бензилокси]фенил]-3,4,5,6-тетрагидро-2H-пиран-4-карбононовой кислоты.
1H ЯМР (CDCl3) δ: 7,52-7,30 (6H, м), 7,04-6,99 (2H, м), 6,98-6,88 (1H, м), 5,19 (2H, ушир. с), 5,07 (2H, с), 3,91-3,74 (4H, м), 2,43-2,31 (2H, м), 2,19-2,02 (2H, м).
C. 4-(3-Гидроксифенил)-3,4,5,6-тетрагидро-2H-пиран-4-карбоксамид
Указанное в заглавии соединение получают по способу, описанному в примере 2G, за исключением того, что 4-(3-бензилоксифенил)-3,4,5,6- тетрагидро-2H-пиран-4-карбоксамид используют вместо этил 4-(3- бензилокси-5-фторфенил)-3,4,5,6-тетрагидро-2H-пиран-4-карбоксилата.
1H ЯМР (CDCl3) δ: 9,40 (1H, ушир. с), 7,11 (1H, т, J= 8,1 Гц), 6,97 (1H, с), 6,78 (1H, д, J= 7,7 Гц), 6,62 (1H, д, J=8,4 Гц), 3,68-3,82 (2H, м), 3,58-3,40 (2H, м), 2,44-2,27 (2H, м), 0,82-0,68 (2H, м).
D. 4-[3-[4-(2-метилимидазол-1-ил)бензилокси] фенил] -3,4,5,6- тетрагидро-2H-пиран-4-карбоксамид
4-(3-Гидроксифенил)-3,4,5,6-тетрагидро-2H-пиран-4-карбоксамид взаимодействует с гидрохлоридом 4-(2-метилимидазол-1-ил)бензилхлорида по способу, описанному в примере 2H, с получением указанного в заглавии соединения.
т.пл.: 183,0-186,0oC
1H ЯМР (CDCl3) δ: 7,60-7,57 (2H, м), 7,41-7,32 (3H, м), 7,09-7,00 (4H, м), 6,98-6,91 (1H, м), 5,36-5,22 (2H, ушир. с), 5,13 (2H, с), 3,89-3,76 (4H, м), 2,44-2,33 (5H, м), 2,19-2,02 (2H, м).
ИК (КВr) ν: 3400, 3200, 2900, 1680, 1520, 1420, 1380, 1310, 1250, 1170, 1100 см-1
Пример 16
1-[3-[4-(2-Метилимидазол-1-ил)бензилокси] фенил] циклопентан-1- карбоксамид
A. Этил 1-[3-бензилоксифенил]циклопентан-1-карбоксилат
Указанное в заглавии соединение получают по способу, описанному в примере 2F, за исключением того, что 1,4-дибромбутан используют вместо бис(2-хлорэтил)эфир, и 3- бензилоксифенилацетат используют вместо этил 3-(бензилокси)-5-фторфенилацетата.
1H ЯМР (CDCl3) δ: 7,52-7,30 (5H, м), 7,30-7,20 (1H, м), 7,09-6,94 (2H, м), 6,91-6,82 (1H, м), 5,05 (2H, с), 4,06 (2H, кв, J=7,0 Гц), 2,72-2,56 (2H, м), 1,99-1,83 (2H, м), 1,82-1,64 (4H, м), 1,15 (3H, т, J=7,0 Гц).
B. 1-[3-Бензилоксифенил]циклопентан-1-карбоновая кислота
Указанное в заглавии соединение получают по способу, описанному в примере 4, за исключением того, что 1-[3-бензилоксифенил]циклопентан-1-карбоксилат используют вместо этил 4-[5-фтор-3-[4-(2-Метилимидазол-1-ил)бензилокси]фенил]- 3,4,5,6-тетрагидро-2H-пиран-4-карбоксилата.
1H ЯМР (CDCl3) δ: 7,56-7,21 (6H, м), 7,09-7,00 (2H, м), 6,88 (1H, м), 5,03 (2H, с), 2,71-2,53 (2H, м), 2,00-1,88 (2H, м), 1,87-1,66 (4H, м).
C. 1-[3-Бензилоксифенил]циклопентан-1-карбоксамид
Указанное в заглавии соединение получают по способу, описанному в примере 5, за исключением того, что 1-[3-бензилоксифенил] циклопентан-1-карбоновую кислоту используют вместо 4-[5-фтор-3-[4-(2-метилимидазол-1-ил)бензилокси] фенил]-3,4,5,6-тетрагидро-2H-пиран-4-карбоновой кислоты.
1H ЯМР (CDCl3) δ: 7,50-7,22 (6H, м), 6,92 (2H, с), 6,88 (1H, м), 5,48-5,10 (2H, ушир. с), 5,04 (2H, с), 2,52-2,36 (2H, м), 2,12-1,95 (2H, м), 1,92-1,55 (4H, м).
D. 1-[3-Гидроксифенил] циклопентан-1-карбоксамид
Указанное в заглавии соединение получают по способу, описанному в примере 2G, за исключением того, что 1-[3-бензилоксифенил]циклопентан-1-карбоксамид используют вместо этил 4-(3-бензилокси-5-фторфенил)-3,4,5,6-тетрагидро-2H-пиран-4-карбоксилата.
1H ЯМР (CDCl3) δ: 9,84 (1H, ушир. с), 7,59 (1H, т, J=7,7 Гц), 7,45 (1H, с), 7,30 (1H, с), 7,10 (1H, д, J=8,4 Гц), 3,06-2,88 (4H, м), 2,30-2,00 (4H, м).
Е. 1-[3-[4-(2-метилимидазол-1-ил)бензилокси] фенил]- циклопентан-1-карбоксамид
1-(3-Гидролксифенил)циклопентан-1-карбоксамид взаимодействует с гидрохлоридом 4-(2-метилимидазол-1-ил)бензилхлорида по способу, описанному в примере 2H, с получением указанного в заглавии соединения. т.пл.: 163,0-164,0oC
1H ЯМР (CDCl3) δ: 7,56 (2H, д, J=8,0 Гц), 7,50-7,31 (3H, м), 7,18-6,99 (4H, м), 6, 97-6,88 (1H, м), 5,45-5,20 (2H, ушир. с), 5,11 (2H, с), 2,60-2,30 (2H, м), 2,38 (3H, с), 2,19-1,60 (6H, м).
ИК (KBr) ν: 3400, 3200, 2950, 1670, 1610, 1580, 1520, 1420, 1370, 1310, 1290, 1260, 1060 см-1.
Пример 17
Гидрохлорид 4-[5-Фтор-3-[4-(2-метилимидазол-1-ил)бензилокси] - фенил]-3,4,5,6-тетрагидро-2H-пиран-4-карбоксамида
4-[5-Фтор-З-[4-(2-метилимидазол-1-ил)бензилокси] фенил]- тетрагидро-2H-пиран-4-карбоксамид (39 мг, 0,1 ммоль) растворяют в 10% смеси хлористого водорода и метанола(2 мл). После перемешивания в течение 10 мин летучие продукты удаляют путем выпаривания, и полученный в результате остаток перекристаллизовывают из этанола с получением указанного в заглавии соединения (24 мг, 57%) в виде белых твердых продуктов.
1H ЯМР (ДМСО-d6) δ: 7,87 (1H, с), 7,87-7,63 (5H, м), 7,25 (1H, с), 7,08 (1H, с), 6,88-6,74 (3H, м), 5,23 (2H, с), 3,80-3,66 (2H, м), 3,60-3,42 (2H, м), 2,54 (3H, с), 2,50-2,33 (2H, м), 1,88-1,69 (2H, м).
Пример 18
Гидрохлорид 4-[3-[4-(2-метилимидазол-1-ил)фенил] тиофенил] - 3,4,5,6-тетрагидро-2H-пиран-4-карбоксамида
Используют такой же способ, как описан в примере 17, за исключением того, что 4-[3-[4-(2-метилимидазол-1-ил)фенил]-тиофенил]-3,4,5,6-тетрагидро- 2H-пиран-4-карбоксамид используют вместо 4-[5-фтор 3-[4-(2-метилимидазол-1-ил)бензилокси]фенил]-3,4,5,6-тетрагидро- 2H-пиран-4-карбоксамида.
т.пл.: 216-222oC (разложение)
1H ЯМР (ДМСО-d6) δ: 7,86 (1H, д, J=2,20 Гц), 7,75 (1H, д, J=2,20 Гц), 7,59 (1H, д, J=8,79 Гц), 7,53-7,50 (1H, м), 7,49- 7,33 (3H, м), 7,41 (1H, д, J= 8,79 Гц), 7,32 (1H, ушир. с), 7,10 (1H, ушир. с), 3,78-3,69 (2H, м), 3,51-3,43 (2H, м), 2,51 (3H, с), 2,48-2,37 (2H, м), 1,88-1,74 (2H, м).
Пример 19
Гемифумарат 4-[3-[4-(2-метилимидазол-1-ил)фенилтио]фенил]- 3,4,5,6-тетрагидро-2H-пиран-4-карбоксамида
4-[3-[4-(2-метилимидазол-1-ил)фенилтио]фенил]-3,4,5,6- тетрагидро-2H-пиран-4-карбоксамид (39 мг, 0,1 ммоль) и фумаровую кислоту (12 мг, 0, 1 ммоль) растворяют в метаноле (3 мл). После перемешивания в течение 10 мин летучие вещества удаляют путем выпаривания, и полученный в результате остаток перекристаллизовывают из 2-пропанола с получением указанного в заглавии соединения (40 мг, 78%) в виде белых твердых продуктов.
т.пл.: 183,5-184,9oC
1H ЯМР (ДМСО-d3) δ: 7,48-7,34 (7H, м), 7,32-7,25 (3H, м), 7,08 (1H, с), 6,93 (1H, с), 6,63-6,61 (1H, м), 3,79-3,64 (2H, м), 3,55-3,37 (2H, м), 2,45-2,36 (2H, м), 2,28 (3H, с), 1,84-1,72 (2H, м).
ИК (KBr) ν: 3400, 3200, 2950, 1670, 1610, 1580, 1520, 1420, 1370, 1310, 1290, 1260, 1060 см-1.
Пример 20
1-[3-[4-(2-метилимидазол-1-ил)бензилокси]фенил]циклобутан-1- карбоксамид
A. 1-Циано-1-(3-метоксифенил)циклобутан
К раствору (3-метоксифенил)ацетонитрила (3,0 г, 20,0 ммоль) в ДМСО (120 мл) добавляют 3 капли 15-краун-5 и гидрид натрия (60% вес/вес дисперсия в минеральном масле, 1,6 г) при комнатной температуре, и реакционную смесь перемешивают в течение 30 мин. Добавляют йодид натрия (3,6 г, 24 ммоль) и 1,3-дибромпропан (8,0 г, 40 ммоль), и смесь перемешивают в течение ночи. Добавляют 2 н HCl (50 мл), и смесь экстрагируют эфиром (100 мл х 2). Объединенные экстракты промывают водой (100 мл х 2) и солевым раствором (100 мл), сушат (MgSO4) и концентрируют в вакууме. Остаток очищают с помощью колоночной хроматографии (SiO2, 300 г; гексан/этилацетат (20,1)) с получением 2,10 г (56%) указанного в заглавии соединения в виде бесцветного масла.
1H ЯМР (CDCl3) δ: 7,32 (1H, дд, J=13,9, 5,9 Гц), 7,00 (1H, м), 6,93 (1H, J= 2,2, 2,2 Гц), 6,85 (1H, дд, J=8,1, 2,6 Гц), 3,85 (3H, с), 2,90-2,77 (2H, м), 2,71-2,58 (2H, м), 2,54-2,31 (1H, м), 2,18-2,00 (1H, м).
B. 1-Циано-1-(3-гидроксифенил)циклобутан
К перемешиваемому раствору 1-циано-1-(3-метоксифенил)-циклобутана (1,93 г, 10 ммоль) в сухом дихлорметане (50 мл) добавляют 1,0 М раствор трибромида бора в дихлорметане (22 мл, 22 ммоль) при 0oC, и смесь перемешивают в течение 30 мин при той же температуре, затем в течение ночи при комнатной температуре. Реакцию гасят путем добавления воды (100 мл) и экстрагируют дихлорметаном (50 мл х 2). Органическую фазу промывают солевым раствором (50 мл), сушат (MgSO4) и концентрируют в вакууме. С получением 1,70 г (100%) указанного в заглавии соединения в виде прозрачного коричневого масла.
1H ЯМР (CDCl3) δ: 7,29 (1H, д, J=1,8 Гц), 6,98 (1H, м), 6,83 (1H, м), 6,78 (1H, ушир. с), 2,91-2,78 (2H, м), 2,78-2,53 (2H, м), 2,52-2,33 (1H, м), 2,20-1,99 (1H, м).
C. 1-Циано-1-[3-[4-(2-метилимидазол-1-ил)бензилокси] фенил]- циклобутан (Предлагаемое Соединение)
Смесь 1-циано-1-(3-гидроксифенил)циклобутана (1,76 г, 10 ммоль), 4-(2-метилимидазол-1-ил) гидрохлорида бензилхлорида (2,10 г, 10 ммоль) и карбоната калия (6,90 г, 50 ммоль) в ДМФ (80 мл) перемешивают вместе при 80oC в течение 3 час. Добавляют воду (200 мл) и смесь экстрагируют этиацетатом/бензолом (2,1, 100 мл х 2), промывают водой (100 мл х 2), солевым раствором (100 мл), сушат (MgSO4) и концентрируют в вакууме. Остаток очищают с помощью колоночной хроматографии (SiO2, 150 г; дихлорметан, метанол (20,1)) с получением 2,90 г (84%) указанного в заглавии соединения в виде прозрачного желтого масла.
1H ЯМР (CDCl3) δ: 7,60 (2H, д, J=8,2 Гц), 7,44-7,30 (3H, м), 7,13-6,88 (5H, м), 5,18 (2H, с), 2,93-2,78 (2H, м), 2,73-2,58 (2H, м), 2,52-2,30 (4H, м), 2,20-2,00 (1H, м).
D. 1-[3-[4-(2-метилимидазол-1-ил)бензилокси]фенил]циклобутан- 1-карбоксамид
К раствору 1-циано-1-[3-[4-(2-метилимидазол-1-ил)-бензилокси] фенил]циклобутана (2,90 г, 8,4 ммоль) в ДМСО (5 мл), охлажденному до 0oC, добавляют 30% H2O2 (2,0 мл) и карбонат калия (0,4 г). Смеси дают нагреться до комнатной температуры и перемешивают в течение ночи, затем перемешивают в течение 6 час при 60oC. Добавляют воду (100 мл), и смесь экстрагируют этилацетатом (100 мл х 3). Объединенные органические слои экстрагируют 2 н HCl (100 мл х 2), и водный слой промывают этилацетатом (100 мл х 3). Водный кислотный слой подщелачивают до pH 9 5 н. NaOH (150 мл) и экстрагируют этилацетатом (100 мл х 3). Объединенные органические экстракты промывают водой (100 мл), солевым раствором (100 мл), сушат (MgSO4) и концентрируют в вакууме с получением сырого продукта в виде белого твердого продукта. Перекристаллизация из этилацетата дает 2,13 г (70%) указанного в заглавии соединения в виде белого твердого продукта.
1H ЯМР (CDCl3) δ: 7,56 (2H, д, J=8,4 Гц), 7,36-7,29 (3H, м), 7,08-6,87 (5H, м), 5,20 (2H, ушир. с), 5,12 (2H, с), 2,91-2,78 (2H, м), 2,56-2,42 (2H, м), 2,38 (3H, с), 2,28-2,10 (1H, м), 1,98-1,82 (1H, м).
Пример 21
1-[3-[4-(2-метилимидазол-1-ил)бензилокси] фенил]циклопентан-1- карбоксамид
Указанное в заглавии соединение получают по способу, описанному для 1-[3-[4-(2-метилимидазол-1-ил)бензилокси] - фенил]циклобутан-1-карбоксамида за исключением того, что 1,2- дибромэтан используют вместо 1,3-дибромпропана (Пример 20).
1H ЯМР (CDCl3) δ: 7,56 (2H, д, J=8,4 Гц), 7,37-7,28 (3H, м), 7,12-7,07 (2H, м), 7,04 (1H, д, J=1,5 Гц), 7,01 (1H, д, J=1,5 Гц), 6,95 (1H, ддд, J= 8,1, 1,8, 0,7 Гц), 5,80 (1H, ушир. с), 5,42 (1H, ушир. с), 2,38 (3H, с), 1,68-1,56 (2H, м), 1,17- 1,06 (2H, м).
Пример 22
4-[5-Фтор-3-[2-фтор-4-(2-метилимидазол-1-ил)бензилокси] - фенил] -3,4,5,6-тетрагидро-2H-пиран-4-карбоксамид
A. 4-[3-(Бензилокси)-5-фторфенил] -3,4,5,6-тетрагидро-2H- пиран-4-карбоновая кислота
Указанное в заглавии соединение получают по способу, описанному в примере 4, за исключением того, что этил 4-[3-(бензилокси)-5-фторфенил]-3,4,5,6-тетрагидро-2H-пиран-4-карбоксилат используют вместо этил 4-[5-фтор-3-[4-(2- метилимидазол-1-ил)бензилокси] фенил] -3,4,5,6-тетрагидро-2H- пиран-4-карбоксилата.
1H ЯМР (CDCl3) δ: 7,49-7,29 (5H, м), 6,87-6,80 (1H, м), 6,74 (1H, ддд, J= 1,8, 2,2, 9,9 Гц), 6,62 (1H, д, J=2,2, 2,2, 10,3 Гц), 5,02 (2H, с), 4,00-3,85 (2H, м), 3,70-3,50 (2H, м), 2,52-2,38 (2H, м), 2,04-1,85 (2H, м).
B. 4-[3-(Бензилокси)-5-фторфенил] -3,4,5,6-тетрагидро-2H- пиран-4-карбоксамид
Указанное в заглавии соединение получают по способу, описанному в примере 5, за исключением того, что 4-[3-(бензилокси)-5-фторфенил]-3,4,5,б-тетрагидро-2H-пиран-4- карбоновую кислоту используют вместо 4-[5-фтор-3-[4-(2- метилимидазол-1-ил)бензилокси] фенил]-3,4,5,6-тетрагидро-2H- пиран-4-карбоновой кислоты.
1H ЯМР (CDCl3) δ: 7,48-7,31 (5H, м), 6,82-6,76 (1H, м), 6,71 (1H, ддд, J= 1,8, 1,8, 9,9 Гц), 6,65 (1H, д, J=2,2, 2,2, 10,3 Гц), 5,23 (2H, ушир. с), 5,04 (2H, с), 3,85-3,70 (4H, м), 2,40-2,26 (2H, м), 2,10-1,95 (2H, м).
C. 4-[5-Фтор-3-гидроксифенил]-3,4,5,6-тетрагидро-2H-пиран-4- карбоксамид
Указанное в заглавии соединение получают по способу, описанному в примере 2G, за исключением того, что 4- [5-фтор- 3-(бензилокси)фенил]-3,4,5,6-тетрагидро-2H-пиран-4-карбоксамид используют вместо этил 4-(5-фтор-3-бензилоксифенил)-3,4,5,6-тетрагидро-2H-пиран-4-карбоксилата.
1H ЯМР (CDCl3) δ: 9,32 (1H, ушир. с), 6,75-6,45 (3H, м), 6,13 (1H, ушир. с), 5,83 (1H, ушир. с), 3,90-3,58 (4H, м), 2,47- 2,30 (2H, м), 2,10-1,90 (2H, м).
D. 4-[5-Фтор-3-[2-фтор-4-(2-метилимидазол-1-ил)бензилокси] - фенил] -3,4,5,6-тетрагидро-2H-пиран-4-карбоксамид
4-(5-Фтор-3-гидроксифенил)-3,4,5,6-тетрагидро-2H-пиран- 4-карбоксамид взаимодействует с гидрохлоридом 2-фтор-4-(2- метилимидазол-1-ил)бензилхлорида по способу, описанному в примере 2H, с получением указанного в заглавии соединения с выходом 41% в виде белого порошка.
1H ЯМР (CDCl3) δ: 7,63 (1H, дд, J=7,7, 8,1 Гц), 7,20-6,98 (4H, м), 6,89-6,60 (3H, м), 5,41 (2H, ушир. с), 5,14 (2H, с), 3,90-3,70 (4H, м), 2,46-2,28 (5H, м), 2,14-1,98 (2H, м).
ИК (KBr) ν: 3310, 3165, 1687, 1619, 1590, 1519, 1456, 1415.
Пример 23
4-[2,5-Дифтор-3-[4-(2-метилимидазол-1-ил)бензилокси] фенил]- 3,4,5,6-тетрагидро-2H-пиран-4-карбоксамид
A. О-трет-Бутилдиметилсилил-2,5-дифторфенол
К перемешиваемому раствору 2,5-дифторфенола (15,1 г, 116 ммоль) в ДМФ (100 мл) добавляют гидрид натрия (60% вес/вес дисперсия в минеральном масле; 5,13 г, 139 ммоль) с охлаждением на льду. После перемешивания в течение 30 мин добавляют трет-бутилдиметилсилил хлорид (17,5 г, 0,116 ммоль), и перемешивание продолжают в течение дополнительного 1 час. Смесь выливают в воду (200 мл) и экстрагируют эфиром (300 мл). Экстракт промывают солевым раствором (200 мл), сушат (сульфат магния) и растворитель удаляют путем выпаривания с получением 26,65 г (94%) указанного в заглавии соединения в виде бесцветного масла.
1H ЯМР (CDCl3) δ: 7,05-6,91 (1H, м), 6,70-6,52 (2H, м), 1,00 (9H, с), 0,201 (3H, с), 0,197 (3H, с).
B. 3-трет-Бутилдиметилсилилокси-2,5-дифторбензальдегид
1,0 М раствор втор-Buli (21,5 мл, 21,5 ммоль) добавляют по каплям к перемешиваемому раствору O-трет-бутилдиметил- силил-2,5-дифторфенола (5,0 г, 20 ммоль) в ТГФ (20 мл) при -78oC. Через 0,5 час добавляют по каплям ДМФ (1,9 мл, 24,6 ммоль), при этом поддерживают температуру -70oC. По истечении 30 мин смеси дают нагреться до комнатной температуры за 30 мин. К смеси прибавляют 3 н HCl (30 мл), и перемешивание продолжают в течение 30 минут. Смесь экстрагируют эфиром (100 мл), и экстракт промывают водой (100 мл), солевым раствором (100 мл), сушат (сульфат натрия) и выпаривают. Колоночная хроматография (силикагель) остатка при элюировании с н-гексаном дает 3,56 г (64%) указанного в заглавии соединения в виде бесцветного масла.
1H ЯМР (CDCl3) δ: 10,31 (1H, д, J=2,93 Гц), 7,12 (1H, ддд, J=3,3, 4,4, 7,7 Гц), 6,89 (1H, ддд, J=3,3, 7,0, 9,2 Гц), 1,02 (9H, с), 0,245 (3H, с), 0,240 (3H, с).
C. 2,5-Дифтор-3-метоксибензальдегид
Фторид калия (7,79 г, 134 ммоль) и йодметан (4,98 мл, 80 ммоль) добавляют к перемешиваемому раствору 3-трет-бутилди- метилсилилокси-2,5-дифторбензальдегида (19,45 г, 67 ммоль) в ДМФ (100 мл) при комнатной температуре. Через 5 час смесь выливают в воду (100 мл) и экстрагируют этилацетатом (200 мл). Экстракт промывают водой (100 мл), солевым раствором (100 мл), сушат (сульфат магния) и выпаривают. Остаток очищают с помощью колоночной хроматографии (силикагель), элюируя этилацетатом/н-гексаном (1/10) с получением 8,58 г (74%) указанного в заглавии соединения в виде белого твердого продукта.
1H ЯМР (CDCl3) δ: 10,35 (1H, д, J=2,93 Гц), 7,08 (1H, ддд, J=2,9, 4,0, 7,3 Гц), 6,94 (1H, ддд, J=2,9, 6,6, 9,5 Гц), 3,94 (3H, с).
D. 2,5-Дифтор-3-метоксибензиловый спирт
Боргидрид натрия (2/83 г, 74,7 ммоль) добавляют к перемешиваемому раствору 2,5-дифтор-3-метоксибензальдегида (8,57 г, 49,8 ммоль) в этаноле (100 мл) при комнатной температуре. Через 30 мин смесь концентрируют, остаток разбавляют эфиром (300 мл) и последовательно промывают водой (200 мл), 10% лимонной кислотой (200 мл), водой (200 мл, солевым раствором (200 мл) и сушат над сульфатом магния.
Удаление растворителя дает 8,26 г (95%) указанного в заглавии соединения в виде белого твердого продукта.
1H ЯМР (CDCl3) δ: 6,80-6,69 (2H, м), 4,74 (2H, с), 3,86 (3H, с), 2,14 (1H, ушир. с).
Е. 2,5-Дифтор-3-метоксифенилацетонитрил
К перемешиваемому раствору 2,5-дифтор-3-метоксибензилового спирта (8,26 г, 47,4 ммоль) в дихлорметане (100 мл) добавляют п-толуолсульфонилхлорид (9,95 г, 52,2 ммоль) и триэтиламин (7,30 мл, 52,2 ммоль) при комнатной температуре. Через 3,5 час смесь выливают в воду (200 мл) и экстрагируют эфиром (200 мл). Экстракт промывают солевым раствором (200 мл), сушат (сульфат магния) и выпаривают. К остатку добавляют ДМСО (200 мл) и цианид натрия (3,48 г, 71 ммоль). Полученную смесь перемешивают в течение 2 час, а затем выливают в воду (200 мл) и экстрагируют эфиром (300 мл). Экстракт промывают водой (100 мл), солевым раствором (100 мл) и сушат над сульфатом магния. Удаление растворителя дает 5,91 г (63%) указанного в заглавии соединения в виде красного масла.
1H ЯМР (CDCl3 δ: 6,80-6,65 (2H, м), 3,89 (3H, с), 3,76 (2H, д, J=0,74 Гц).
F. Метил 2,5-фтор-3-метоксифенилацетат
К перемешиваемому раствору 2,5-дифтор-3-метоксифенилацетонитрила (5,92 г, 30 ммоль) в этиленгликоле (150 мл) добавляют гидроксид калия (85%; 3,0 г, 45 ммоль). Смесь нагревают при 120oC в течение 1 час, а затем смесь выливают в воду (100 мл) и промывают эфиром (100 мл). Водный слой подкисляют 6 н HCl (10 мл) и экстрагируют эфиром (200 мл). Экстракт промывают водой (50 мл), солевым раствором (50 мл), сушат (сульфат магния) и выпаривают. Оставшийся твердый продукт растворяют в метаноле (200 мл), и к раствору добавляют конц. серную кислоту (2 мл). Полученную смесь нагревают с обратным холодильником в течение 1 час, охлаждают и концентрируют в вакууме. Остаток растворяют в эфире (100 мл), промывают водой (100 мл), насыщенным водным раствором гидрокарбоната натрия (100 мл), солевым раствором (100 мл) и сушат над сульфатом магния. Удаление растворителя дает 3,80 г (59%) указанного в заглавии соединения.
1H ЯМР (CDCl3) δ: 6,70-6,50 (2H, м), 3,87 (3H, с), 3,72 (3H, с), 3,65 (2H, д, J=1,84 Гц).
G. Метил 4-(2,5-дифтор-3-метоксифенил)-3,4,5,6-тетрагидропиран-4-карбоксилат
Указанное в заглавии соединение получают по способу, описанному в примере 2F, за исключением того, что метил 2,5-дифтор-3-метоксифенилацетат используют вместо этил 3-бензилокси-5-фторфенилацетата.
1H ЯМР (CDCl3) δ: 6,71-6,59 (2H, м), 3,93-3,73 (4H, м), 3,86 (3H, с), 3,75 (3H, с), 2,45-2,32 (2H, м), 2,14-1,96 (2H, м).
H. Метил 4-(2,5-дифтор-3-гидроксифенил)-3,4,5,6-тетрагидропиран-4-карбоксилат
Указанное в заглавии соединение получают по способу, описанному в примере 14C, за исключением того, что метил 4-(2,5-дифтор-3-метоксифенил)-3,4,5,6-тетрагидро-2H-пиран-4- карбоксилат используют вместо метил 1-(3-фтор-5-гидрокси)- циклопент-3-ен-карбоксилата.
1H ЯМР (CDCl3) δ: 6,80-6,50 (2H, м), 3,96-3,68 (7H, м), 2,49-2,32 (2H, м), 2,16-1,95 (2H, м).
I. Метил 4-[2,5-дифтор-3-[4-(2-метилимидазол-1-ил)бензил- окси]фенил]-3,4,5,6-тетрагидро-2H-пиран-4-карбоксилат (Предлагаемое Соединение)
Метил 4-(2,5-дифтор-3-гидроксифенил)-3,4,5,6-тетрагидро- пиран-4-карбоксилат взаимодействует с гидрохлоридом 4-(2- метилимидазол-1-ил)бензилхлорида по способу, описанному в примере 2H, с получением указанного в заглавии соединения с выходом 49% в виде желтого масла.
1H ЯМР (CDCl3) δ: 7,37 (2H, д, J=8,43 Гц), 7,34 (2H, д, J=8,43 Гц), 7,05 (1H, д, J=1,5 Гц), 7,01 (1H, д, J=1,5 Гц), 6,90-6,45 (2H, м), 5,13 (2H, с), 3,95-3,62 (7H, м), 2,50-2,30 (5H, м), 2,16-1,94 (2H, м).
J. 4-[2,5-Дифтор-3-[4-(2-метилимидазол-1-ил)бензилокси] - фенил] -3,4,5,6-тетрагидро-2H-пиран-4-карбоксамид
Указанное в заглавии соединение получают по способу, описанному в примере 4 и в примере 5, за исключением того, что метил 4-[2,5-дифтор-3-[4-(2-метилимидазол-1-ил)бензилокси] фенил] -3,4,5,6- тетрагидро-2H-пиран-4-карбоксилат используют вместо этил 4-[5-фтор-З-[4-(2-метилимидазол-1-ил)- бензилокси]фенил]-3,4,5,6-тетрагидро-2H-пиран-4-карбоксилата.
1H ЯМР (CDCL3) δ: 7,56 (2H, д, J=8,43 Гц), 7,34 (2H, д, J=8,4 Гц), 7,04 (1H, д, J= 1,1 Гц), 7,01 (1H, д, J=1,5 Гц), 6,82-6,69 (2H, м), 5,40 (2H, ушир. с), 5,15 (2H, с), 4,00-3,70 (4H, м), 2,50-2,30 (5H, м), 2,22-2,02 (2H, м).
Пример 24
4-[3-[4-(2-Метилимидазол-1-ил)фенилсульфонил] фенил] -3,4,5,6- тетрагидро-2H-пиран-4-карбоксамид
Смесь 4-[3-[4-(2-метилимидазол-1-ил)фенилтио]фенил]-3,4,5,6-тетрагидро- 2H-пиран-4-карбоксамида (пример 8, 1,62 г, 4,00 ммоль) и перекиси водорода (30% в воде, 5,0 мл) в уксусной кислоте (12 мл) перемешивают при комнатной температуре в течение 12 час, затем нагревают при температуре дефлегмации в течение 2 час. Реакционную смесь затем выливают в насыщенный водный раствор NaHCO3 (50 мл) и экстрагируют этилацетатом (300 мл х 2). Объединенные органические экстракты промывают солевым раствором (100 мл), сушат (MgSO4) и концентрируют в вакууме с получением 1,68 г (колич.) указанного в заглавии соединения в виде бледно-желтого твердого продукта.
1H ЯМР (CDCl3) δ: 8,10-8,01 (3H, м), 7,88 (1H, д, J=7,7 Гц), 7,68 (1H, д, J= 7,0 Гц), 7,57 (1H, дд, J=7,0, 7,0 Гц), 7,47 (2H, д, J=8,8 Гц), 7,05 (1H, д, J= 1,5 Гц), 7,01 (1H, д, J=1,5 Гц), 5,42 (2H, ушир. с), 3,91-3,70 (4H, м), 2,39 (3H, с), 2,48-2,38 (2H, м), 2,12-1,99 (2H, м).
Пример 25
4-Циано-4-[5-фтор-3-[4-(2-метилимидазол-1-ил)фенилтио] фенил]- 3,4,5,6-тетрагидро-2H-пиран
A. 4-Циано-4-(3,5-дифторфенил)-3,4,5,6-тетрагидро-2H-пиран
К раствору 3,5-дифторфенилацетонитрила (24,2 г, 0,158 моль) в ДМСО (240 мл) по частям добавляют гидрид натрия (60% вес/вес дисперсия в минеральном масле, 13,3 г, 0,332 моль) за 10 минут. Реакционную смесь перемешивают в течение 40 мин при комнатной температуре, и затем медленно добавляют бис(2-хлорэтил)эфир (24,9 г, 0,174 моль), и перемешивание продолжают в течение дополнительного 1 час. Реакционную смесь выливают в воду (500 мл), и смесь экстрагируют смесью этилацетат-толуол (2:1 объем/объем, 400 мл х 3). Объединенные экстракты промывают 2 н водным раствором HCl (300 мл), водой (300 мл) и солевым раствором (300 мл), сушат (MgSO4) и концентрируют до 100 мл. Осажденные твердые продукты собирают и промывают холодным Et2O (50 мл) с получением 26,3 г (71%) указанного в заглавии соединения в виде беловатых твердых продуктов.
1H ЯМР (CDCl3) δ: 7,15-7,00 (2H, м), 6,89-6,78 (1H, м), 4,20-4,05 (2H, м), 3,98-3,80 (2H, м), 2,20-1,96 (4H, м).
B. 4-Циано-4-(5-фтор-3-метилтиофенил)-3,4,5,6-тетрагидро-2H-пиран
Метантиол барботируют через перемешиваемую суспензию гидрида натрия (65% вес/вес дисперсия в минеральном масле, 273 мг, 7,4 ммоль) в ДМФ (10 мл) до тех пор, пока не получат прозрачный раствор. Добавляют 4-циано-4-(3,5-дифторфенил)-3,4,5,6-тетрагидро-2H-пиран (1,65 г, 7,4 ммоль) и полученную смесь нагревают при 100oC в течение 22 час, охлаждают и выливают в воду (100 мл). Смесь экстрагируют Et2O (100 мл), и экстракт промывают водой (100 мл), солевым раствором (100 мл) и сушат (MgSO4). Удаление растворителя дает 1,87 г (колич. ) указанного в заглавии соединения в виде желтовато-коричневого масла.
1H ЯМР (CDCl3) δ: 7,20-7,12 (1H, м), 6,96-6,85 (2H, м), 4,16-4,04 (2H, м), 3,79-3,81 (2H, м), 2,51 (3H, с), 2,20-1,98 (4H, м).
C. 4-Циано-4-(5-фтор-3-метилсульфинилфенил)-3,4,5,6-тетрагидро-2H-пиран
Указанное в заглавии соединение получают по способу, описанному в примере 8D, за исключением того, что 4-циано-4- (5-фтор-3-метилтиофенил)-3,4,5,6-тетрагидро-2H-пиран используют вместо 4-Циано-4-(3-метилтиофенил)-3,4,5,6-тетрагидро-2H-пирана.
1H ЯМР (CDCl3) δ: 7,60-7,54 (1H, м), 7,41-7,30 (2H, м), 4,20-4,15 (2H, м), 3,98-3,81 (2H, м), 2,78 (3H, с), 2,25-2,01 (4H, м).
D. 4-Циано-4-(5-фтор-3-меркаптофенил)-3,4,5,6-тетрагидро-2H-пиран
Указанное в заглавии соединение получают по способу, описанному в примере 8Е, за исключением того, что 4-циано-4- (5-фтор-3-метилсульфинилфенил)-3,4,5,6-тетрагидро-2H-пиран используют вместо 4-Циано-4-(3-метилсульфинилфенил)-3,4,5,6- тетрагидро-2H-пирана.
1H ЯМР (CDCl3) δ: 7,46-6,89 (3H, м), 4,18-4,00 (2H, м), 3,96-3,78 (2H, м), 2,20-1,92 (4H, м).
Е. 4-Циано-4-[5-фтор-3-[4-(2-метилимидазол-1-ил)фенилтио] - фенил] -3,4,5,6-тетрагидро-2H-пиран
Указанное в заглавии соединение получают по способу, описанному в примере 8F, за исключением того, что 4-циано-4- (5-фтор-3-меркаптофенил)-3,4,5,6-тетрагидро-2H-пиран используют вместо 4-циано-4-(3-меркаптофенил)-3,4,5,6-тетрагидро-2H-пирана.
1H ЯМР (CDCl3) δ: 7,75-6,89 (9H, м), 4,15-4,04 (2H, м), 3,96-3,81 (2H, м), 2,40 (3H, с), 2,18-1,98 (4H, м).
Пример 26
4-[5-Фтор-3-[4-(2-метилимидазол-1-ил)фенилтио] фенил] -3,4,5,6- тетрагидро-2H-пиран-4-карбоксамид
К раствору 4-циано-4-[5-фтор-3-[4-(2-метилимидазол-1-ил) фенилтио]фенил] -3,4,5,6-тетрагидро-2H-пирана (пример 25, 1,71 г, 4,36 ммоль) в трет-бутаноле (20 мл) добавляют порошкообразный гидроксид калия (85%, 860 мг, 13 ммоль). Полученную смесь нагревают при температуре дефлегмации в течение 4 час, охлаждают и концентрируют в вакууме. Добавляют воду (50 мл), а осадки собирают путем фильтрования и промывают 50 мл этилацетата. После сушки в вакууме, получают 560 мг (31%) указанного в заглавии соединения в виде желтого порошка.
1H ЯМР (CDCl3) δ: 7,50 (4H, с), 7,32 (2H, с), 7,21 (1H, с), 7,20-6,98 (3H, м), 6,92 (1H, с), 3,80-3,62 (2H, м), 3,52-3,26 (2H, м), 2,47-2,20 (5H, м), 1,88-1,67 (2H, м).
Пример 27
4-циано-4-[5-фтор-3-[4-(2-метил-1H-пиррол-1-ил)фенилтио] - фенил] -3,4,5,6-тетрагидро-2H-пиран
A. 4-(2-Метилпиррол-1-ил)фенилйодид
Указанное в заглавии соединение получают из 2-метилпиррола (J. Org. Chera. 1956, 21, 918) по способу получения, аналогичному способу получения 4-(пиррол-1-илметил)фенилйодида (ЕР 488602 A1).
1H ЯМР (CDCl3) δ: 7,75 (2H, д, J=8,5 Гц), 7,04 (2H, д, J=8,5 Гц), 6,72 (1H, д, J=1,8 Гц), 6,19 (1H, д, J=1,8 Гц), 6,04 (1H, с), 2,20 (3H, с).
B. 4-Циано-4- [5-фтор-3-[4-(2-метил-1H-пиррол-1-ил)фенилтио]- фенил]-3,4,5,6-тетрагидро-2H-пиран
Указанное в заглавии соединение получают по способу, описанному в примере 25Е, за исключением того, что 4-(2- метилпиррол-1-ил)фенилйодид используют вместо 4-(2-метилимидазол-1-ил) фенилйодида.
1H ЯМР (CDCl3) δ: 7,50 (2H, д, J=8,8 Гц), 7,33 (2H, д, J=8,8 Гц), 7,05-6,99 (1H, м), 6,95-6,87 (2H, м), 6,79-6,77 (1H, м), 6,23-6,20 (1H, м), 5,30 (1H, с), 4,11-4,05 (4H, м), 3,93-3,82 (4H, м), 2,25 (3H, с).
Пример 28
4-[5-Фтор-3-[4-(2-метил-1H-пиррол-1-ил)фенилтио] фенил] - 3,4,5,6-тетрагидро-2H-пиран-4-карбоксамид
Указанное в заглавии соединение получают по способу, описанному в примере 26, за исключением того, что 4-циано-4 - [5-фтор-3-[4-(2-метил-1H-пиррол-1-ил)фенилтио] фенил] -3,4,5,6- тетрагидро-2H-пиран используют вместо 4-Циано-4-[5-фтор-3-[4- (2-метилимидазол-1-ил)фенилтио] фенил]-3,4,5,6-тетрагидро-2H- пирана.
1H ЯМР (ДМСО-d6) δ: 7,47 (4H, дд, J=17,7, 8,4 Гц), 7,30 (1H, с), 7,18-6,96 (4H, м), 6,88 (1H, т, J=2,8 Гц), 6,12-6,08 (1H, м), 5,99 (1H, с), 3,73-3,68 (2H, м), 3,48-3,29 (2H, м), 2,39-2,33 (2H, м), 2,19 (3H, с), 1,71-1,72 (2H, м).
Пример 29
(2SR, 4RS)-4-Циано-2-метил-4-[3-[4-(2-метилимидазол-1-ил)- фенилтио]фенил]-3,4,5,6-тетрагидро-2H-пиран
и
(2SR, 4SR)-4-Циано-2-метил-4-[3-[4-(2-метилимидазол-1-ил)- фенилтио]фенил]-3,4,5,6-тетрагидро-2H-пиран
A. 1-Йод-2-(2-йодэтокси)пропан
Смесь 2-[2-(п-толуолсульфонилокси)этокси] пропил п-толуолсульфоната (J. Chem. Soc. , Perkin trains. I 1979, 1029) (5,7 г, 13 ммоль) и йодида натрия (12 г, 80 ммоль) в ацетоне (100 мл) нагревают при температуре дефлегмации в течение 24 час. Смесь охлаждают, концентрируют в вакууме и добавляют воду (200 мл). Смесь экстрагируют Et2O (300 мл), промывают солевым раствором (200 мл) и сушат (MgSO4). Удаление растворителя дает 4,3 г (95%) указанного в заглавии соединения в виде желтого масла.
1H ЯМР (CDCl3) δ: 3,87-3,42 (3H, м), 3,32-3,10 (4H, м), 1,30 (3H, д, J= 5,9 Гц).
B. (2SR,4RS)-4-Циано-4-(3-йодфенил)-2-метил-3,4,5,6-тетрагидро- 2H-пиран и (2SR,4SR)-4-циано-4-(3-йодфенил)-2-метил-3,4,5,6-тетрагидро-2H-пиран
Указанное в заглавии соединение получают по способу, описанному в примере 25A, за исключением того, что 3-йодфенилацетонитрил и 1-иод-2-(2-йодэтокси)пропан используют вместо 3,5-дифторфенилацетонитрила и бис-(2-хлорэтил)эфира. Диастереомеры отделяют с помощью колоночной хроматографии на силикагеле с получением 1,46 г (38%) менее полярного изомера, (2SR,4RS)-4-циано-4-(3-йодфенил)-2-метил-З, 4,5,6-тетрагидро-2H-пирана; и 1,31 г (34%) более полярного изомера, (2SR, 4SR)- 4-циано-4-(3-йодфенил)-2-метил-3,4,5,6-тетрагидро-2H-пирана.
(2SR,4RS)-4-циано-4-(3-йодфенил)-2-метил-3,4,5,6-тетрагидро-2H -пиран:
1H-ЯМР (CDCl3) δ: 7,80 (1H, ушир. с), 7,74-7,64 (1H, м), 7,52-7,39 (1H, м), 7,16 (1H, дд, J= 7,9 7,9 Гц), 4,20-4,08 (1H, м), 4,03-3,84 (2H, м), 2,16-1,97 (3H, м), 1,69 (1H, дд, J=13,6, 11,0 Гц), 1,28 (3H, д, J=6,2 Гц).
(2SR,4SR)-4-циано-4-(3-йодфенил)-2-метил-З,4,5,6-тетрагидро- 2H-пиран:
1H-ЯМР (CDCl3) δ: 7,90-7,40 (2H, м), 7,67-7,40 (1H, м), 7,32-7,12 (1H, м), 4,06-3,88 (1H, м), 3,69-3,42 (2H, м), 2,62-2,30 (3H, м), 2,32-2,00 (1H, м), 1,25 (3H, д, J=6,2 Гц).
C. (2SR,4RS)-4-Циано-2-метил-4-(3-триизопропилсилилтиофенил)- 3,4,5,6-тетрагидро-2H-пиран
К перемешиваемому раствору триизопропилсилантиола (Tetrahedron Lett. 1994, 35, 3221) (684 мг, 3,6 ммоль) в толуоле (5 мл) добавляют гидрид натрия (60% масляная дисперсия, 144 мг, 3,6 ммоль) в атмосфере азота. После перемешивания в течение 15 мин полученный раствор добавляют к смеси (2SR,4RS)-4-циано-4-(З-йодфенил-2-метил)-3,4,5,6-тетрагидро-2H-пирана (1,07 г, 3,27 ммоль) и тетракис(трифенилфосфин) палладия (0) (114 мг, 0,1 ммоль) в толуоле (20 мл), и смесь нагревают при 80oC в течение 1 час. Полученную смесь охлаждают, выливают в воду (50 мл) и экстрагируют Et2O (100 мл). Органический экстракт промывают водой (50 мл), солевым раствором (50 мл), сушат (MgSO4) и концентрируют. Очистка с помощью колоночной хроматографии на силикагеле с элюированием этилацетатом-гексаном (1: 9), дает 1,23 г (96 %) указанного в заглавии соединения в виде красного масла.
1H-ЯМР (CDCl3) δ: 7,80-7,25 (4H, м), 3,97-3,82 (1H, м), 3,60-3,40 (2H, м), 2,56-2,38 (3H, м), 2,15-2,00 (1H, м), 1,36-1,00 (24H, м).
D. (2SR,4SR)-4-Циано-2-метил-4-(3-триизопропилсилилтиофенил)- 3,4,5,6-тетрагидро-2H-пиран
Указанное в заглавии соединение получают по способу, описанному выше, за исключением того, что (2SR,4SR)-4-циано- 4-(3-йодфенил)-2-метил-3,4,5,6-тетрагидро-2H-пиран используют вместо (2SR,4RS)-4-циано-4-(3-йодфенил)-2-метил-З,4,5,6- тетрагидро-2H-пирана.
1H-ЯМР (CDCl3) δ: 7,80-7,20 (4H, м), 4,19-3,85 (3H, м), 2,12-1,95 (3H, м), 1,77-1,60 (1H, м), 1,37-1,00 (24H, м).
Е. (2SR, 4RS)-4-Циано-2-метил-4-[3-[4-(2-метилимидазол-1-ил)- фенилтио] фенил]-3,4,5,6-тетрагидро-2H-пиран (Заявляемое Соединение)
К перемешиваемому раствору 4-(2-метилимидазол-1-ил)- фенилйодида (1,21 г, 3,1 ммоль) и (2SR, 4RS)-4-циано-2-метил- 4-(3-триизопропилсилилтиофенил)-3,4,5,6-тетрагидро-2H-пирана (795 мг, 2/8 ммоль) в этаноле (20 мл) добавляют тетракис-(трифенилфосфин)палладий (0) (215 мг, 0,2 ммоль) и трет-бутоксид калия (383 мг, 3,4 ммоль) в атмосфере азота. Полученную смесь нагревают при температуре дефлегмации в течение 15,5 час, затем охлаждают и концентрируют в вакууме. Остаток разбавляют этилацетатом (100 мл) и промывают водой (2 х 100 мл), солевым раствором (100 мл) и сушат (MgSO4), и концентрируют. Очистка с помощью колоночной хроматографии на силикагеле с элюированием дихлорметаном-метанолом (25:1) дает 1,01 г (93%) указанного в заглавии соединения в виде желтой смолы.
1H-ЯМР (CDCl3) δ: 7,75-7,20 (8H, м), 7,03 (1H, д, J=1,5 Гц), 7,00 (1H, д, J=1,1 Гц), 3,97-3,84 (1H, м), 3,60-3,40 (2H, м), 2,52-2,30 (6H, м), 2,08 (1H, дд, J=14,2, 10,6 Гц), 1,22 (3H, д, J=6,2 Гц).
F. (2SR, 4RS)-4-Циано-2-метил-4-[3-[4-(2-метилимидазол-1-ил)- фенилтио] фенил]-3,4,5,6-тетрагидро-2H-пиран (Заявляемое Соединение)
Указанное в заглавии соединение получают по способу, описанному выше, за исключением того, что (2SR,4SR)-4-циано-2-метил-4- (3-триизопропилсилилтиофенил)-3,4,5,6-тетрагидро-2H-пиран используют вместо (2SR,4RS)-4-циано-2-метил-4-(3- триизопропилсилилтиофенил)-3,4,5,6-тетрагидро-2H-пирана.
1H-ЯМР (CDCl3) δ: 7,44-7,18 (8H, м), 7,03 (1H, д, J=1,5 Гц), 7,00 (1H, д, J=1,5 Гц), 4,20-3,85 (3H, м), 2,37 (3H, с), 2,15-1,98 (3H, м), 1,82-1,64 (1H, м), 1,27 (3H, д, J=6,2 Гц).
Пример 30
(2SR, 4RS)-2-Метил-4-[3-[4-(2-метилимидазол-1-ил)фенилтио] - фенил] -3,4,5,6-тетрагидро-2H-пиран-4-карбоксамид
Указанное в заглавии соединение получают по способу, описанному в примере 26, за исключением того, что (2SR,4RS)-4-циано-2-метил-4- [3-[4-(2-метилимидазол-1-ил) фенилтио]- фенил]-3,4,5,6-тетрагидро-2H-пиран используют вместо 4-циано- 4-[5-фтор-3-[4-(2-метилимидазол-1-ил)фенилтио] фенил] -3,4,5,6- тетрагидро-2H-пирана.
1H ЯМР (CDCl3) δ: 7,50-7,20 (8H, м), 7,04 (1H, д, J=1,1 Гц), 6,99 (1H, д, J= 1,5 Гц), 5,18 (2H, ушир. с), 3,98-3,84 (1H, м), 3,55-3,30 (3H, м), 2,40-2,18 (5H, м), 1,99 (1H, дд, J=13,9, 11,4 Гц), 1,18 (3H, д, J=5,9 Гц).
Пример 31
(2SR, 4SR)-2-Метил-4-[3-[4-(2-метилимидазол-1-ил)фенилтио] - фенил] -3,4,5,6-тетрагидро-2H-пиран-4-карбоксамид
Указанное в заглавии соединение получают по способу, описанному в примере 26, за исключением того, что (2SR,4SR)- 4-циано-2-метил-4-[3-[4-(2-метилимидазол-1-ил)фенилтио] - фенил]-3,4,5,6-тетрагидро-2H-пиран используют вместо 4-циано- 4-[5-фтор-3-[4-(2-метилимидазол-1-ил)фенилтио] фенил] -3,4,5,6- тетрагидро-2H-пирана.
1H-ЯМР (CDCl3) δ: 7,53-7,18 (8H, м), 7,02 (1H, д, J=1,5 Гц), 6,99 (1H, д, J= 1,1 Гц), 5,37 (2H, ушир. с), 4,07-3,95 (1H, м), 3,87-3,70 (3H, м), 2,48-2,25 (5H, м), 1,92 (1H, ддд, J=12,8, 12,8, 4,8 Гц), 1,24 (3H, д, J=6,2 Гц).
Пример 32
Хиральное разделение (2SR,4RS)-2-метил-4-[3-[4- (2-метилимидазол-1-ил) фенилтио]фенил]-3,4,5,6-тетрагидро-2H-пиран-4- карбоксамид (пример 30)
(2SR, 4RS)-2-Метил-4-[3-[4-(2-метилимидазол-1-ил)фенилтио] фенил] -3,4,5,6-тетрагидро-2H-пиран-4-карбоксамид (пример 30, 100 мг) разделяют с помощью колоночной хроматографии с хиральным сорбентом (колонка: Daicel Chemical Industries LTD; CHIRALPAK AS 2 x 25 см, элюент: гексан/этанол (объем/объем, 8/2, скорость потока: 6 мл/мин, температура: 40oC) с получением 38 мг (+) энантиомера (1-ая фракция, (+) [α]D +21oC, CO,1, метанол)) и 44 г (-)энантиомера (2-ая фракция).
Пример 33
4-Циано-4-[3-[4-(1,2,4, -триазол-4-ил)фенил] тиофенил] -3,4,5,6- тетрагидро-2H-пиран
A. 4-Циано-4-(3-йодфенил)-3,4,5,6-тетрагидро-2H-пиран
Смесь 3-йодфенилацетонитрила (2,43 г, 10 ммоль), бис(2-хлорэтил)эфира (1,57 г, 11 ммоль), гексадецилтрибутилфосфонийбромида (250 мг, 0,5 ммоль) и 50% водного раствора гидроксида натрия (20 мл) энергично перемешивают в течение 1 час при комнатной температуре. Смесь нейтрализуют 6 н водной HCl, переносят к разделительной печи и экстрагируют этилацетатом (50 мл х 3). Объединенные экстракты промывают 2 н водным раствором HCl (50 мл), водой (50 мл) и солевым раствором (50 мл), сушат (MgSO4) и концентрируют в вакууме. Остаток сырых твердых продуктов собирают и промывают холодным Et2O (30 мл) с получением 2,38 г (76%) указанного в заглавии соединения в виде белых твердых продуктов
1H-ЯМР (CDCl3) δ: 7,83-7,80 (1H, м), 7,73-7,67 (1H, м), 7,50-7,44 (1H, м), 7,16 (1H, дд, J= 8,1, 7,7 Гц), 4,14-4,02 (2H, м), 3,98-3,81 (2H, м), 2,20-1,99 (2H, м).
B. 4-Циано-4-(3-триизопропилсилилтиофенил)-3,4,5,6-тетрагидро- 2H-пиран
Указанное в заглавии соединение получают по способу, описанному в примере 29C с получением (2SR,4RS)-4-циано-2-метил-4- (3-триизопропилсилилтиофенил)-3,4,5,6-тетрагидро-2H-пирана, используя 4-Циано-4-(3-йодфенил)-3,4,5,6-тетрагидро-2H-пиран вместо (2SR, 4RS)-4-Циано-4-(3-йодфенил)-2-метил-3,4,5,6-тетрагидро-2H-пирана.
1H-ЯМР (CDCl3) δ: 7,62 (1H, т, J=1,5 Гц), 7,48 (1H, дт, J=7,0, 1,5 Гц), 7,34 (1H, дт, J= 7,0, 1,5 Гц), 7,28 (1H, т, J=7,0 Гц), 4,13-4,02 (2H, м), 3,96-3,83 (2H, м), 2,18-1,97 (4H, м), 1,33-1,16 (3H, м), 1,07 (18H, д, J=6,6 Гц).
C. 4-Циано-4-[3-[4-(1,2,4-триазол-4-ил)фенил] тиофенил]- 3,4,5,6-тетрагидро-2H-пиран.
Указанное в заглавии соединение получают по способу, описанному в примере 29Е с получением (2SR,4RS)-4-циано-2- метил-4-[3-[4-(2-метилимидазол-1-ил)фенилтио] фенил] -3,4,5,6- тетрагидро-2H-пирана, используя 4-(триазол-4-ил)фенилйодид и 4-циано-4-(3-триизопропилсилилтиофенил)-3,4,5,6-тетрагидро-2H-пиран вместо 4-(2-метилимидазол-1-ил)фенилйодида и (2SR,4RS)-4-циано-2-метил-4-(3-триизопропилсилилтиофенил)- 3,4,5,6-тетрагидро-2H-пирана, соответственно.
MS (EI): m/z 362 (M+)
Получение требуемого 4-(триазол-4-ил)фенилйодида описано ниже.
Диметилформазин дигидрохлорид (J. Chem. Soc. (C) 1967. 1664) (5,38 г, 25 ммоль), п-йоданилин (5,48 г, 25 ммоль) и п-толуолсульфоновую кислоту (0,2 г, 1,1 ммоль) в толуоле (50 мл) нагревают с обратным холодильником в течение 3,5 час. Летучие продукты удаляют при пониженном давлении, и остаток очищают с помощью колоночной хроматографии (SiO2, 300 г; от 0 до 4% этанола в дихлорметане) и перекристаллизации из смеси этанола (10 мл) и дихлорметана (50 мл) с получением 2,63 г (39%) требуемого соединения в виде иголок.
1H-ЯМР (CDCl3) δ: 8,45 (2H, с), 7,89 (2H, д, J=8,8 Гц), 7,16 (2H, д, J= 8,8 Гц).
Пример 34
4-[3-[4-(1,2,4, -Триазол-4-ил)фенил] тиофенил] -3,4,5,6-тетрагидро- 2H-пиран-4-карбоксамид
Указанное в заглавии соединение получают по способу, описанному в примере 26, за исключением того, что 4-циано-4- [3-[4-(1,2,4-триазол-4-ил)фенил] тиофенил] -3,4,5,6-тетрагидро-2H-пиран используют вместо 4-циано-4-[5-фтор-3-[4-(2-метилимидазол-1-ил) фенилтио] фенил]-3,4,5,6-тетрагидро-2H-пирана.
1H-ЯМР (ДМСО-d6) δ: 9,12 (2H, с), 7,71 (2H, д, J=8,8 Гц), 7,48-7,36 (5H, м), 7,28 (1H, ушир. с), 7,26-7,21 (1H, м), 7,08 (1H, ушир. с), 3,78-3,68 (2H, м), 3,51-3,40 (2H, м), 2,47-2,37 (2H, м), 1,86-1,73 (2H, м).
Пример 35
4-циано-4-[3-[4-(3,5-диметилпиразол-1-ил)фенилтио] фенил] -3,4,5,6- тетрагидро-2H-пиран
A. 4-(3,5-диметилпиразол-1-ил)фенилйодид
Указанное в заглавии соединение получают по способу, описанному в примере 8A, за исключением того, что 3,5-диметилпиразол используют вместо 2-метилимидазола.
1H-ЯМР (CDCl3) δ: 7,76 (2H, дд, J=6,6, 2,2 Гц), 7,19 (2H, дд, J=6,6, 2,2 Гц), 6,00 (1H, с), 2,30 (3H, д, J=0,7 Гц), 2,28 (3H, с).
B. 4-Циано-4-[3-[4-(3,5-диметилпиразол-1-ил)фенилтио]фенил]- 3,4,5,6-тетрагидро-2H-пиран
Указанное в заглавии соединение получают по способу, описанному в примере 29Е с получением (2SR,4RS)-4-циано-2- метил-4-[3-[4-(2-метилимидазол-1-ил)фенилтио] фенил] -3,4,5,6- тетрагидро-2H-пирана, используя 4-(3,5-диметилпиразол-1-ил)фенилйодид и 4-циано-4-(3-триизопропилсилилтиофенил)-3,4,5,6-тетрагидро-2H-пиран вместо 4-(2-метилимидазол-1-ил)фенилйодида и (2SR, 4RS)-4-циано-2-метил-4-(3-триизопропилсилилтиофенил) -3,4,5,6-тетрагидро-2H-пирана, соответственно.
1H-ЯМР (CDCl3) δ: 7,71-7,23 (8H, м), 6,01 (1H, с), 4,11-4,05 (2H, м), 3,94-3,83 (2H, м), 2,33 (3H, с), 2,29 (3H, с), 2,14-2,00 (4H, м).
Пример 36
4-[3-[4-[3,5-диметилпиразол-1-ил)фенилтио] фенил] -3,4,5,6- тетрагидро-2H-пиран-4-карбоксамид
Указанное в заглавии соединение получают по способу, описанному в примере 26, за исключением того, что 4-циано-4- [3-[4-[3,5-диметилпиразол-1-ил)фенилтио] фенил]-3,4,5,6-тетрагидро- 2H-пиран используют вместо 4-циано-4-[5-фтор-3-[4-(2- метилимидазол-1-ил)фенилтио] фенил]-3,4,5,6-тетрагидро-2H-пирана.
1H-ЯМР (ДМСО-d6) δ: 7,51-7,21 (9H, м), 7,07 (1H, с), 6,07 (1H, с), 3,78-3,67 (2H, м), 3,52-3,38 (2H, м), 2,42-2,37 (2H, м), 2,30 (3H, с), 2,16 (3H, с), 1,83-1,71 (2H, м).
Пример 37
4-Циано-4-[3-[4-(2-метилимидазол-1-ил)фенокси] фенил] -3,4,5,6-тетрагидро-2H-пиран
A. 4-Циано-4-(3-метоксифенил)-3,4,5,6-тетрагидро-2H-пиран
Указанное в заглавии соединение получают по способу, описанному в примере 25A, за исключением того, что 3-метоксифенилацетонитрил используют вместо 3-йодфенилацетонитрила (80%).
1H-ЯМР (CDCl3) δ: 7,34 (1H, т, J=8 Гц), 7,09-7,02 (2H, м), 6,88 (1H, ддд, J= 8,3, 1,5 Гц), 4,11-4,06 (2H, м), 3,95-3,84 (2H, м), 3,84 (3H, с), 2,15-2,04 (4H, м).
B. 4-Циано-4-(3-гидроксифенил)-3,4,5,6-тетрагидро-2H-пиран
К дихлорметановому раствору (80 мл) 4-циано-4-(3-метоксифенил)- 3,4,5,6-тетрагидро-2H-пирана (2,32 г, 10,35 ммоль), охлажденному до 0oC, добавляют по каплям трибромид бора (3,15 мл, 33,3 ммоль) в течение 10 мин. Ледяную баню удаляют и реакционную смесь перемешивают при температуре окружающей среды в течение 19 час, а затем с обратным холодильником в течение 4 час. Реакционную смесь охлаждают и выливают в воду (150 мл). Органический слой отделяют, и водный слой экстрагируют этилацетатом (50 мл х 3). Объединенные органические экстракты промывают солевым раствором (50 мл), сушат (MgSO4) и концентрируют в вакууме. Сырой продукт кристаллизуют из изопропилового эфира с получением указанного в заглавии соединения в виде беловатых твердых веществ (1,43 г, 66%).
1H-ЯМР (CDCl3) δ: 7,29 (1H, т, J=8 Гц), 7,04 (1H, дд, J=8,2 Гц), 6,98 (1H, дд, J=4,2 Гц), 6,83 (1H, дд, J=8,4 Гц), 5,14 (1H, ушир. с), 4,09 (2H, дд, J=10,2 Гц), 3,90 (2H, дт, J=12,2 Гц), 2,14-2,01 (4H, м).
C. 4-Циано-4-[3-[4-(2-метилимидазол-1-ил)фенокси]фенил]- 3,4,5,6-тетрагидро-2H-пиран
Смесь 4-(2-метилимидазол-1-ил)фенилйодида (1,28 г, 4,5 ммоль), 4-циано-(3-гидроксифенил)-3,4,5,6-тетрагидро-2H-пирана (1,20 г, 5,9 ммоль) и К2CO3 (4,15 г, 30 ммоль) в пиридине (50 мл) нагревают при 130oC, добавляют оксид меди (636 мг, 8,0 ммоль) и реакционную смесь нагревают с обратным холодильником в течение 2 дней. Реакционную смесь охлаждают и фильтруют через слой Целита, и твердые продукты промывают этилацетатом (100 мл). Фильтрат концентрируют в вакууме, и полученный остаток разбавляют водой (100 мл) и экстрагируют этилацетатом (50 мл х 3). Объединенные органические экстракты промывают 1 н водным раствором NaOH, водой (100 мл) и солевым раствором (100 мл), сушат (Na2SO4) и концентрируют в вакууме. Остаток очищают с помощью колоночной хроматографии {LiChroprer NH2 (Merck), 100 г; элюируют гексаном/этилацетатом (1/1)} с получением 620 мг (38%) указанного в заглавии соединения в виде желтого масла.
1H-ЯМР (CDCl3) δ: 7,44 (1H, дд, J=8,1, 7,7 Гц), 7,33-7,21 (4H, м), 7,12-6,98 (5H, м), 4,15-4,04 (2H, м), 3,99-3,82 (2H, м), 2,37 (3H, с), 2,22-2,00 (4H, м).
Пример 38
4-[3-[4-(2-Метилимидазол-1-ил)фенокси] фенил] -3,4,5,6- тетрагидро-2H-пиран-4-карбоксамид
Указанное в заглавии соединение получают по способу, описанному в примере 26, за исключением того, что 4-циано-4- [3-[4-(2-метилимидазол-1-ил)фенокси] фенил]-3,4,5,6-тетрагидро-2H-пиран используют вместо 4-циано-4-[5-фтор-3-[4-(2-метилимидазол-1-ил) фенилтио]фенил]-3,4,5,6-тетрагидро-2H-пирана.
1H-ЯМР (CDCl3) δ: 7,40 (1H, дд, J=8,1, 7,7 Гц), 7,29-7,13 (4H, м), 7,09-6,95 (5H, м), 5,32 (2H, ушир. с), 3,89-3,70 (4H, м), 2,43-2,32 (2H, м), 2,40 (3H, с), 2,16-2,02 (2H, м).
Пример 39
4-Метоксииминометил-4-[3-[4-(2-метилимидазол-1-ил)фенилтио] - фенил] -3,4,5,6-тетрагидро-2H-пиран
A. 4-(3-Йодфенил)-3,4,5,6-тетрагидро-2H-пиран-4-карбальдегид
К перемешиваемому раствору 4-циано-4-(3-йодфенил)-3,4,5,6-тетрагидро-2H-пирана (3,3 г, 10,5 ммоль) в сухом дихлорметане (15 мл) добавляют по каплям раствор DIBAL (10,7 мл, 10,5 ммоль) при -78oC в атмосфере аргона. После завершения добавления смесь перемешивают в течение 3 час при той же температуре. К реакционной смеси осторожно добавляют 1 мл этанола, затем добавляют 10 мл 1н водного раствора HCl, и смесь перемешивают в течение 0,5 час. Водную смесь экстрагируют дихлорметаном (20 мл х 3), и объединенные органические слои промывают водой (50 мл) и солевым раствором (50 мл). Экстракт сушат (MgSO4) и концентрируют в вакууме. Хроматографическая очистка остатка { SiO2, 150 г; элюируют гексаном/этилацетатом (5,1)} дает 2,61 г (79%) желаемого продукта в виде бесцветного масла.
1H-ЯМР (CDC13) δ: 9,40 (1H, с), 7,65 (1H, ддд, J=7,7, 1,8, 1,1 Гц), 7,62 (1H, дд, J=1,8, 1,5 Гц), 7,26 (1H, ддд, J=8,1, 1,5, 1,1 Гц), 7,13 (1H, дд, J= 8,1, 7,7 Гц), 3,95-3,82 (2H, м), 3,61-3,49 (2H, м), 2,43-2,28 (2H, м), 2,12-1,99 (2H, м).
В. 4-(3-Йодфенил)-4-метоксииминометил-3,4,5,6-тетрагидро-2H- пиран
4-(3-Йодфенил)-3,4,5,6-тетрагидро-2H-пиран-4-карбальдегид (1,5 г, 4,7 ммоль) и гидрохлорид O-метилгидроксиламина (1,0 г, 12 ммоль) растворяют в смеси метанола (8 мл) и пиридина (2 мл), и вместе перемешивают в течение ночи при температуре окружающей среды. Реакционную смесь концентрируют в вакууме, и полученный остаток разбавляют 1н водным раствором HCl (50 мл) и экстрагируют дихлорметаном (20 мл х 3). Объединенные органические слои промывают водой (50 мл) и солевым раствором (50 мл), сушат (MgSO4) и концентрируют в вакууме. Остаток очищают с помощью колоночной хроматографии { SiO2 100 г; элюируют гексаном/этилацетатом (5/1)} с получением 1,35 г (83%) желаемого продукта в виде светлого желтого масла.
1H-ЯМР (CDCl3) δ: 7,64 (1H, дд, J=1,8, 1,8 Гц), 7,59 (1H, ддд, J=7,7, 1,8, 1,1, Гц), 7,34 (1H, с), 7,30 (1H, ддд, J=8,1, 1,8, 1,1 Гц), 7,09 (1H, дд, J=8,1, 7,7 Гц), 3,88 (3H, с), 3,87-3,72 (4H, м), 2,21-2,02 (4H, м).
C. 4-[3-[4-(2-Метилимидазол-1-ил)фенилтио] фенил] -4-метокси- иминометил-3,4,5,6-тетрагидро-2H-пиран
30-мл двугорлая колба снабжена пробкой, входом для азота и бруском магнитной мешалки. Колбу загружают цианборгидридом натрия (13 мг, 0,2 ммоль) и промывают азотом (этот процесс повторяют дважды). Затем добавляют хлорид бис(триэтилфосфин)-никеля (II) (41 мг, 0,1 ммоль), 4-(3-йодфенил)-4-метоксииминометил-3,4,5,6-тетрагидро-2H-пиран (1,2 г, 2,6 ммоль) и тиомочевину (286 мг, 3,8 ммоль), и колбу промывают азотом три раза. Добавляют N,N-диметилформамид (2 мл), и полученную смесь нагревают при 60oC в течение 4 час. После охлаждения до комнатной температуры добавляют оксид кальция (210 мг, 3,8 ммоль) и ДМФ (4 мл). Полученную смесь перемешивают при комнатной температуре в атмосфере азота в течение 1,5 час, а затем добавляют смесь 4-(2-метилимидазол-1-ил)фенилйодида (780 мг, 2,8 ммоль), хлорида бис(триэтилфосфин)никеля (II) (41 мг, 0,1 ммоль) и цианборгидрида натрия (13 мг, 0,2 ммоль). Полученную красную смесь нагревают при 60oC в атмосфере азота в течение 4 час и затем охлаждают до комнатной температуры. Полученную смесь глубокого красного цвета распределяют между водой (50 мл) и дихлорметаном (50 мл) и отделяют органическую фазу. Водную фазу экстрагируют дихлорметаном (20 мл х 2). Объединенные экстракты промывают водой (50 мл) и солевым раствором (50 мл), сушат (MgSO4) и концентрируют в вакууме. Остаток очищают с помощью колоночной хроматографии на силикагеле {LiChroprer NH2 (Merck), 50 г; элюируют этилацетатом} с получением 388 мг (37%) желаемого соединения в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 7,48-7,16 (9H, м), 7,02 (1H, д, J=1,1 Гц), 6,98 (1H, д, J=1,1 Гц), 3,90-3,69 (4H, м), 3,85 (3H, с), 2,36 (3H, с), 2,22-2,01 (4H, м).
Пример 40
Метил 4-[3-[4-(2-метилимидазол-1-ил)фенилтио] фенил]-3,4,5,6- тетрагидро-2H-пиран-4-карбоксилат
4-[3-[4-(2-метилимидазол-1-ил)фенилтио]фенил]-3,4,5,6-тетрагидро- 2H-пиран-4-карбоксамид (1,0 г, 2,5 ммоль) растворяют в большом избытке смеси HCl-метанол (10 мл) и раствор нагревают с обратным холодильником в течение ночи. Летучие продукты удаляют выпариванием при пониженном давлении, остаток распределяют между 0,5н водной NaOH (50 мл) и этилацетатом (50 мл), и органическую фазу отделяют. Водную фазу экстрагируют этилацетатом (20 мл х 2). Объединенные экстракты промывают водой (50 мл) и солевым раствором (50 мл), сушат (MgSO4) и концентрируют в вакууме с получением 360 мг (35%) указанного в заглавии соединения.
1H-ЯМР (CDCl3) δ: 7,47-7,18 (8H, м), 7,07-6,60 (2H, м), 4,00-3,87 (2H, м), 3,68 (3H, с), 3,60-3,49 (2H, м), 2,55-2,44 (2H, м), 2,35 (3H, с), 2,00-1,83 (2H, м).
Пример 41
4-[3-[4-(2-метилимидазол-1-ил)фенилтио] фенил] -3,4,5,6- тетрагидро-2H-пиран-4-карбальдегид
A. [4-[3-[4-(2-метилимидазол-1-ил)фенилтио]фенил]-3,4,5,6- тетрагидро-2H-пиран-4-ил]метанол
К перемешиваемому раствору метил 4-[3-[4-(2-метилимидазол-1-ил) фенилтио] фенил] -3,4,5,6-тетрагидро-2H-пиран-4- карбоксилата (359 мг, 0,9 ммоль) при 0oC добавляют LAH (80 мг, 2,0 ммоль). После завершения добавления смеси позволяют нагреться до комнатной температуры. К реакционной смеси осторожно добавляют воду (1 мл) и полученные твердые продукты растворяют в 1н водном растворе HCl, и водный раствор подщелачивают 1н водным раствором NaOH. Водную смесь экстрагируют этилацетатом (30 мл х 3), и объединенные экстракты промывают водой (50 мл) и солевым раствором (50 мл), сушат (MgSO4) и концентрируют в вакууме. Остаток очищают с помощью колоночной хроматографии на силикагеле {LiChroprer NH2 (Merck), 20 г; элюируют этилацетатом} с получением 231 мг (69%) желаемого соединения в виде белых твердых продуктов.
1H-ЯМР (CDCl3) δ: 7,45-7,29 (6H, м), 7,20 (2H, д, J=8,8 Гц), 7,01 (1H, д, J= 1,5 Гц), 6,98 (1H, д, J=1,5 Гц), 3,86-3,70 (2H, м), 3,64 (2H, с), 3,62-3,48 (2H, м), 2,35 (3H, с), 2,18-2,05 (2H, м), 2,00-1,87 (2H, м), 1,67 (1H, ушир. с).
В. 4-[3-[4-(2-Метилимидазол-1-ил)фенилтио] фенил]-3,4,5,6- тетрагидро-2H-пиран-4-карбальдегид
Раствор [4-[3-[4-(2-метилимидазол-1-ил)фенилтио] фенил]-3,4,5,6- тетрагидро-2H-пиран-4-ил] метанола (230 мг, 0,6 ммоль) в дихлорметане (5 мл) добавляют по каплям к реагенту Сверна [1,2 ммоль, 2 экв, полученного путем добавления раствора ДМСО (143 мг) в дихлорметане (5 мл) к раствору оксалилхлорида (155 мг, 1,2 ммоль) в дихлорметане (10 мл) при -78oC] при -78oC в атмосфере аргона. Реакционную смесь перемешивают в течение 0,5 час при -78oC, а затем ей дают нагреться до -20oC в течение 2 час. К реакционной смеси добавляют триэтиламин (1 мл), и полученный раствор перемешивают в течение 0,5 час при 0oC. Смесь распределяют между насыщенным водным раствором NH4Cl (50 мл) и этилацетатом (50 мл), органическую фазу отделяют, и водную фазу экстрагируют этилацетатом (20 мл х 2). Объединенные органические экстракты промывают водой (50 мл) и солевым раствором (50 мл), сушат (MgSO4) и концентрируют в вакууме. Оставшееся масло очищают с помощью колоночной хроматографии {SiO2 100 г; элюируют дихлорметаном/этанолом (20/1)} с получением 178 мг (77%) указанного в заглавии соединения в виде белых твердых продуктов.
1H-ЯМР (CDCl3) δ: 9,43 (1H, с), 7,46-7,31 (5H, м), 7,27-7,18 (3H, м), 7,03 (1H, д, J=1,5 Гц), 6,99 (1H, д, J=1,5 Гц), 3,97-3,83 (2H, м), 3,65-3,51 (2H, м), 2,45-2,28 (2H, м), 2,37 (3H, с), 2,15-1,98 (2H, м).
Пример 42
4-Гидроксииминометил-4-[3-[4-(2-метилимидазол-1-ил)фенилтио] - фенил]-3,4,5,6-тетрагидро-2H-пиран
4-[3-[4-(2-метилимидазол-1-ил)фенилтио] фенил] -3,4,5,6-тетрагидро- 2H-пиран-4-карбальдегид (178 мг, 0,47 ммоль) и гидроксиламингидрохлорид (210 мг, 3 ммоль) растворяют в смеси метанола (4 мл) и пиридина (1 мл), и реакционную смесь перемешивают при температуре окружающей среды в течение 5 часов. Летучие продукты удаляют в вакууме, и полученный остаток разбавляют 0,1 н водным раствором NaOH (20 мл) и экстрагируют этилацетатом (30 мл х 3). Объединенные органические слои промывают водой (50 мл) и солевым раствором (50 мл), сушат (MgSO4) и концентрируют в вакууме. Оставшиеся твердые продукты перекристаллизовывают из этилацетата с получением 130 мг (70%) указанного в заглавии соединения в виде белых твердых продуктов.
1H ЯМР (ДМСО-d6) δ: 10,80 (1H, с), 7,48-7,25 (10H, м), 6,91 (1H, с), 3,73-3,51 (4H, м), 2,28 (3H, с), 2,22-2,10 (2H, м), 2,01-1,88 (2H, м).
Пример 43
4-Циано-4-[5-фтор-3-[4-(2-метилпиррол-1-илметил)фенилтио] - фенил] -3,4,5,6-тетрагидро-2H-пиран
A. 4-(2-метилпиррол-1-илметил)фенилйодид
Указанное в заглавии соединение получают из 2-метилпиррола (J. Org. Chem. 1956, 21, 918. ) аналогично способу получения 4-(пиррол-1-илметил)фенилйодида (ЕР 488602 A1).
1H ЯМР (CDCl3) δ: 7,62 (2H, д, J=8,4 Гц), 6,72 (2H, д, J=8,4 Гц), 6,61-6,59 (1H, м), 6,12-6,10 (1H, м), 5,94-5,92 (1H, м), 4,96 (2H, с), 2,11 (3H, д, J=0,7 Гц).
В. 4-Циано-4-[5-фтор-3-[4-(2-метилпиррол-1-илметил)фенилтио] - фенил]-3,4,5,6-тетрагидро-2H-пиран
Указанное в заглавии соединение получают по способу, описанному в примере 25Е, за исключением того, что 4-(2-метилпиррол-1-илметил)фенилйодид используют вместо 4-(2- метилимидазол-1-ил)фенилйодида.
1H-ЯМР (CDCl3) δ: 7,39 (2H, д, J=8,1 Гц), 7,14 (1H, с), 7,00 (2H, д, J= 8,1 Гц), 7,00-6,95 (1H, м), 6,78 (1H, д, J=8,8 Гц), 6,64 (1H, т, J=2,2 Гц), 6,12-6,10 (1H, м), 5,95 (1H, ушир. с), 5,05 (2H, с), 4,10-4,04 (2H, м), 3,91-3,81 (2H, м), 2,14 (3H, с), 2,05-1,99 (4H, м).
Пример 44
4-[5-Фтор-3-[4-(2-метилпиррол-1-илметил)фенилтио]фенил]- 3,4,5,6-тетрагидро-2H-пиран-4-карбоксамид
Указанное в заглавии соединение получают по способу, описанному в примере 26, за исключением того, что 4-циано-4- [5-фтор-З-[4-(2-метилпиррол-1-илметил)фенилтио] фенил] - 3,4,5,6-тетрагидро-2H-пиран используют вместо 4-циано-4-[5-фтор-3-[4-(2-метилимидазол-1-ил)фенилтио]фенил]-3,4,5,6- тетрагидро-2H-пирана.
1H ЯМР (ДМСО-d6) δ: 7,40 (2H, д, J=8,0 Гц), 7,28 (1H с), 7,11-7,04 (3H, м), 7,05 (2H, д, J= 8,0 Гц), 6,81-6,74 (2H, м), 5, 93 (1H, т, J=2,9 Гц), 5,82-5,79 (1H, м), 5,11 (2H, с), 3,72-3,67 (2H, м), 3,47-3,39 (2H, м), 2,36-2,30 (2H, м), 2,05 (3H, с), 1,79-1,68 (2H, м).
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ИМИДАЗОЛА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 1994 |
|
RU2126004C1 |
| ПРОИЗВОДНЫЕ МАННОЗЫ ДЛЯ ЛЕЧЕНИЯ БАКТЕРИАЛЬНЫХ ИНФЕКЦИЙ | 2014 |
|
RU2678327C2 |
| ГЕМИНАЛЬНО-ЗАМЕЩЕННЫЕ ЦИАНОЭТИЛПИРАЗОЛОПИРИДОНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ JANUS КИНАЗ | 2014 |
|
RU2664533C2 |
| СОЕДИНЕНИЯ ИМИДАЗОТРИАЗИНОНА | 2011 |
|
RU2603140C2 |
| АРИЛОКСИЦИКЛОАЛКЕНИЛ- И АРИЛОКСИИМИНОЦИКЛОАЛКЕНИЛГИДРОКСИМОЧЕВИНЫ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ИНГИБИРУЮЩАЯ 5-ЛИПОКСИГЕНАЗУ | 1995 |
|
RU2119479C1 |
| ИСПОЛЬЗОВАНИЕ ЛИГАНДОВ РЕЦЕПТОРА ЕР4 ДЛЯ ЛЕЧЕНИЯ ОПОСРЕДОВАННЫХ IL-6 ЗАБОЛЕВАНИЙ | 2003 |
|
RU2285527C2 |
| N-ГИДРОКСИЛМОЧЕВИНЫ В КАЧЕСТВЕ ПРОТИВОВОСПАЛИТЕЛЬНЫХ СРЕДСТВ | 1995 |
|
RU2152935C2 |
| ПИРАЗОЛОПИРИМИДИНЫ И ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 1993 |
|
RU2124016C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИНГИБИТОРОВ 5-ЛИПОКСИГЕНАЗЫ, ИМЕЮЩИХ РАЗЛИЧАЮЩИЕСЯ ГЕТЕРОЦИКЛИЧЕСКИЕ СИСТЕМЫ | 2000 |
|
RU2177005C1 |
| ПРОИЗВОДНЫЕ 5-АРИЛИНДОЛА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АГОНИСТОВ СЕРОТОНИНА (5-НТ) | 1993 |
|
RU2134266C1 |
Описывается новое гетероциклическое производное общей формулы I или его фармацевтически приемлемые соли, где Ar1 означает имидазолил, пиразолил, 1,2,3-триазолил, 1,2,4-триазолил, которые связаны с X1 посредством кольцевого атома азота и которые могут быть необязательно замещены одним или двумя C1-4алкилами; X1 обозначает прямую связь или C14 алкилен; Ar2 означает фенилен, необязательно замещенный одним или двумя атомами галогена; X2 означает -A-X- или -X-A-, где A означает прямую связь или C1-4алкилен и X означает окси или тио; Ar3 означает фенилен, необязательно замещенный одним или двумя заместителями, выбранными из галогена или циано; R1 и R2 вместе образуют группу формулы -D1-Z-D2-, которая вместе с атомом углерода, к которому она присоединена, образует кольцо, имеющее 3 - 8 атомов, где D1 и D2 означают C1-4алкилен, и Z означает прямую связь, окси или винилен, D1 и D2 могут быть замещены C1-3алкилом; и Y означает CONR3R4, CN, C(R3)=N-OR4, COOR3 или COR3, где R3 и R4 означают каждый H или C1-4-алкил. Соединение формулы I ингибируют действие фермента липоксигеназы и могут использоваться при лечении или облегчении воспалительных заболеваний, аллергии и сердечно-сосудистых заболеваний у млекопитающих. Описываются также фармацевтическая композиция на основе соединений формулы I и способ ингибирования 5-липоксигеназы. 3 с. и 9 з.п. ф-лы.

или его фармацевтические приемлемые соли,
где Ar1 означает имидазолил, пиразолил, 1,2,3-триазолил, 1,2,4-триазолил, которые связаны с X1 посредством кольцевого атома азота и которые могут быть необязательно замещены одним или двумя C1-4 алкилами;
X1 означает прямую связь или C1-4 алкилен;
Ar2 означает фенилен, необязательно замещенный одним или двумя атомами галогена;
X2 означает -A-X- или -X-A-, где A означает прямую связь или C1-4 алкилен и X означает окси или тио;
Ar3 означает фенилен, необязательно замещенный одним или двумя заместителями, выбранными из галогена или циано;
R1 и R2 вместе образуют группу формулы -D1-Z-D2-, которая вместе с атомом углерода, к которому она присоединена, образует кольцо, имеющее 3 - 8 атомов, где D1 и D2 означают C1-4 алкилен, и Z означает прямую связь, окси или винилен, D1 и D2 могут быть замещены C1-3 алкилом; и
Y означает CONR3R4, CN, C(R3)=N-OR4, COOR3 или COR3, где R3 и R4 означают каждый H или C1-4 алкил.
4-[5-фтор-3-[4-(2-метилимидазол-1-ил)бензилокси] фенил] -3,4,5,6-тетрагидро-2H-пиран-4-карбоксамида;
4-[3-[4-(2-метилимидазол-1-ил)фенилтио] фенил] -3,4,5,6-тетрагидро-2H-пиран-4-карбоксамида;
4-[3-[4-(пиррол-1-илметил)фенилтио] фенил]-3,4,5,6-тетрагидро-2H-пиран-4-карбоксамида;
(2SR, 4RS)-2-метил-4-[3-[4-(2-метилимидазол-1-ил)фенилтио] фенил] -3,4,5,6-тетрагидро-2H-пиран-4-карбоксамида; и 4-метоксииминометил-4-[3-[4-(2-метилимидазол-1-ил)фенилтио]фенил]-3,4,5,6-тетрагидро-2H-пирана.
| Устройство для очистки воздуха | 1971 |
|
SU488602A1 |
| Резиновая смесь | 1971 |
|
SU462831A1 |
| УСТРОЙСТВО для СВАРКИ ТРЕНИЕМ | 0 |
|
SU397290A1 |
| Способ получения производных фенилимидазолилалкила | 1971 |
|
SU451244A3 |
| Способ получения 1-арил-2/1-имидазолил/алкильных эфиров,тиоэфиров или их солей | 1976 |
|
SU622405A3 |
| Способ получения производных имидазола | 1985 |
|
SU1530093A3 |
| US 4843165 A, 27.06.89 | |||
Авторы
Даты
1999-09-10—Публикация
1995-05-29—Подача