Настоящее изобретение относится к получению галогенированных соединений, в частности галогенированных гетероциклических соединений. Более конкретно, изобретение относится к фторированию гетероциклических соединений.
Получение галогенированных гетероциклов получило большое внимание вследствие многих синтетических и промышленных процессов, в которых используют такие субстраты, например, в фармацевтической промышленности, в промышленности средств защиты растений и красителей.
Имеется немного способов введения атома фтора в положения 2 и/или 6 пиридина. Традиционно, способы получения 2-фторпиридинов основывались на многостадийных разложениях типа Бальца-Шимана (Balz-Schieman) тетрафторборатных солей пиридиндиазония. Способы обмена галогена, включающие взаимодействие источника фторид-иона, такого как SbF5, KF, HF и т.д. с хлорированным пиридином при повышенных температурах, часто использовали для получения фторпиридинов. Электрохимическое фторирование пиридина в присутствии источника фторид-иона дает 2-фторпиридин только с выходом 22%. Дифторид ксенона в реакции с пиридином дает смесь фторпиридинов, а фтороксисульфат цезия реагирует с пиридином в эфире при комнатной температуре, давая 2-фторпиридин с выходом 61%.
Получение родственных фторсодержащих гетероциклов, таких как 2-фторхинолин, может быть проведено по подобной методике, т.е. способами обмена галогена, фтордедиазотизации и т.д.
Способ прямого фторирования органических соединений раскрыт в патенте США N 2013030. Однако, метод направлен, главным образом, на негетероциклические производные и, в любом случае, привносит нежелательные побочные реакции и, как следствие, выходы целевых продуктов обычно низкие, а полученные материалы имеют низкую степень чистоты. Способы получения 2-фторпиридинов прямой реакцией с элементарным фтором были раскрыты в патенте США N 4786733. В этом случае реакции кинетически конкурируют с фторированием боковой цепи и, следовательно, выходы целевых 2-фторпиридинов снова являются низкими. Кроме того, указанная реакция элементарного фтора с хинолином приводит к преобладающему фторированию сконденсированного ароматического кольца и пространственной фрагментации гетерокольца. Удивительно, но сейчас найдено, что гетероциклические соединения могут быть селективно фторированы элементарным фтором, если другой галоген присутствует в реакционной среде.
Согласно настоящему изобретению предложен способ получения гетероциклического органического соединения, имеющего по меньшей мере один фтор-заместитель в гетероциклическом кольце, и способ, включающий стадию взаимодействия гетероциклического соединения с элементарным фтором в присутствии по меньшей мере одного из хлора, брома, иода и интергалогенного соединения.
Примерами интергалогенных соединений являются монобромид иода и монохлорид иода.
Гетероциклическим соединением, фторируемым способом настоящего изобретения, может быть азотсодержащее гетероциклическое соединение. Гетероциклическое соединение может включать пяти- или шестичленное кольцо, которое может содержать необязательные заместители. Кольцо может быть присоединено или конденсировано с другим одним или более кольцами, которые могут быть или не быть гетероциклическими. Предпочтительно кольцо присоединено или сконденсировано с бензольным кольцом к одному или более другим ароматическим кольцам.
Гетероциклическое соединение предпочтительно включает шестичленное ароматическое кольцо, содержащее один или более атомов азота, такое как пиридин, или родственный гетероцикл, такой как пиримидин, пиридазин или триазин, или родственный гетероцикл с конденсированным бензольным кольцом, такой как хинолин, изохинолин, хиноксалин или хиназолин, или би- или полициклическое соединение, такое как бипиридин.
Положения кольца или колец гетероциклического соединения, фторированного по способу настоящего изобретения, которые не заняты гетероатомами, могут нести заместители. Таким образом, если гетероциклом является пиридин, он может быть замещен по от одного до пяти положениям кольца. Если гетероциклом является пиримидин, он может быть замещен по от одного до четырех положениям кольца. Если гетероциклом является хинолин или изохинолин, он может быть замещен по от одного до шести положениям кольца. Необязательные заместители в кольце (которые сами могут содержать необязательные заместители) могут быть независимо выбраны из алкила, алкоксигруппы, галогена, -CN, -ОН, -NO2 -NH2, NHалкила, -N(алкил)2, -NHCOалкила, -COOалкила, -COOH, -COалкила, -CONH2, -CONH(алкила), CON(алкил)2, -COY, -CY1 3 и SO2Y2, в которых
Y представляет -H, -F, -Cl, -Br, алкил, -OH или -Oалкил;
Y1 представляет -F или -Cl;
Y2 представляет -F, -Cl, -Br, -NH2, -NHалкил или -N(алкил)2.
В каждом из этих заместителей алкил представляет предпочтительно C1-C4-алкил, алкоксигруппа представляет предпочтительно C1-C4-алкоксигруппу и галоген представляет предпочтительно -F или -Cl.
Когда ароматическим соединением является пиридин, то он предпочтительно является незамещенным, монозамещенным или дизамещенным. Если пиридин является монозамещенным, то он предпочтительно замещен в положении 4. Если пиридин дизамещен, то он предпочтительно замещен в положениях 2 и 4.
Предпочтительные заместители для гетероциклического соединения выбирают из -OH, -CN, -NO2, -NHCOCH3, -OCH3, -COOCH3, -COOH, COCH3, -CH3, -F, -Cl, Br, CF3 и -CONH3 и их комбинаций.
Все водороды на атомах углерода, связанных с гетероатомом, могут быть замещены фтором при изменении стехиометрии эксперимента. Например, в гетероциклы можно селективно ввести два атома фтора, например, пиридин давал 2,6-дифторпиридин при использовании двух эквивалентов каждого из фтора и галогена. Подобным способом хиноксалин давал 2,3-дифторхиноксалин, а пиримидин давал дифторированные пиримидины.
В предпочтительном способе настоящего изобретения к реакционной среде добавляют основание. Основанием может быть органическое основание, такое как триэтиламин, или неорганическое основание, такое как фторид натрия. Удивительно, но найдено, что такое добавление основания в реакционную среду приводит к значительно более высокой конверсии исходного гетероцикла во фторированные продукты в заданное время.
Примеры фторирований, которые можно выполнить способом настоящего изобретения, даны на фиг. 1 сопровождающих рисунков. Группы R1-R4 независимо выбраны из водорода и различных заместителей для водорода, определенных выше.
Фиг. 2 сопровождающих рисунков дает примеры фторирований способом настоящего изобретения, в котором в гетероцикл вводят два атома фтора. Снова группы R1-R4 независимо выбраны из водорода и различных заместителей для водорода, определенных выше.
Примерами органических оснований, которые могут быть использованы, являются триэтиламин, трибутиламин и N-метил- пиперидин. Примерами неорганических оснований являются фторид натрия и фторид калия.
Отношение основания к гетероциклическому соединению может изменяться в широких пределах, хотя предпочтительно мольное отношение находится в пределах 0,2-8,0:1, особенно 1,0-1,4:1 (основание: гетероциклическое соединение).
Способ согласно настоящему изобретению можно проводить пропусканием газообразного фтора в жидкость, содержащую гетероциклическое соединение, галоген и, если используют, основание. Реакцию можно проводить в сосуде, в котором присутствует жидкость, или, альтернативно, поток жидкости можно вводить в контакт с потоком газообразного фтора противоточным методом. Жидкость может содержать обычный инертный органический растворитель, такой как ацетонитрил или фторированная органическая жидкость, такая как фторированный алкан (например, CF2ClCFCl2), перфторалкан, перфтордекалин, фторированный простой эфир, перфорированный простой эфир или частично фторированный алкан.
Способ может быть проведен при температуре от -20 до 80oC, предпочтительно при температуре от -10 до 30oC и особенно при температуре от -5 до 25oC.
Газообразный фтор предпочтительно разбавляют перед использованием путем смешения с инертным газом, таким как азот или гелий. Концентрация фтора предпочтительно составляет 1- 50% об., более предпочтительно 2-25%, и особенно 5-15% об.
Отношение фтора к гетероциклическому соединению может изменяться в широких пределах, хотя предпочтительно мольное отношение фтора к ароматическому соединению составляет от 0,5:1 до 6:1 и особенно от 1:1 до 4:1. Использование более высокого отношения фтора к гетероциклическому соединению гарантирует, что более чем один атом фтора можно селективно ввести в гетероциклическое соединение.
После завершения фторирования фторированные продукты можно выделять продувкой реакционной смеси азотом для удаления любого остаточного газообразного фтора с последующим разбавлением избытком воды и нейтрализацией с последующей экстракцией в подходящий растворитель с последующей перегонкой. Фторированные гетероциклические продукты можно отделять фракционной перегонкой, хроматографией или кристаллизацией от подходящего растворителя.
Способ согласно настоящему изобретению предлагает простой и удобный путь получения фторированных гетероциклов непосредственно из родительского гетероцикла и элементарного фтора, следовательно, в способе настоящего изобретения не требуется получать хлорированные гетероциклы для реакций обмена галогена или аминированные гетероциклы для реакций дедиазотизации.
Таким образом, настоящий способ предлагает простой одностадийный метод получения фторированных гетероциклов.
Введение основания в реакционную смесь гарантирует быструю конверсию исходного материала в продукт и, следовательно, является особенно полезным вариантом настоящего изобретения.
Способ настоящего изобретения далее иллюстрируется следующими примерами.
Пример 1. Получение 2-фторпиридина.
Раствор, содержащий пиридин (9,5 г, 120 ммоль) и иод (30,0 г, 118 ммоль) в Арклоне (Торговая марка) (CFCl2CFCl2) (150 мл), помещают в аппарат фторирования, снабженный осушительной трубкой, наполненной натриевой известью. Элементарный фтор (165 ммоль) в виде 10% смеси в сухом азоте затем пропускают через перемешиваемый раствор с использованием трубки с узким диаметром отверстия из политетрафторэтилена (PTFE) со скоростью примерно 40 мл/мин. После добавления фтора раствор выливают в 10% водный раствор метабисульфита натрия (300 мл), нейтрализуют твердым бикарбонатом натрия и непрерывно экстрагируют дихлорметаном. Органические экстракты сушат и упаривают до состояния желтого масла, идентифицированного как 2-фторпиридин (6,5 г, 56%) с чистотой > 95% по данным ГХ;
δH (200 МГц, CDCl3, Me4Si) 6,9 м.д. (1H, м), 7,2 (1H, м), 7,8 (1H, м), 8,2 (1H, м)), (δC (50 МГц, CDCl3, Me4Si) 109,4 м.д. (d, 2JC-F 37,1, 3-C); 121,3 (d, 4JC-F 4,2, 5-C), 141,2 (d, 3JC-F 7,7, 4-C), 147,5 (d, 2JC-F 14,5, 6-C), 163,5 (d, 1JC-F 237,4, 2-C); (δF (235 МГц, CDCl3, CFCl3)-67,9 м.д. (с, 2-F); m/z (E1+) 97, (М+, 100%), 70 (68), 69 (12), 57 (18), 50 (29), 39 (22).
Пример 2. Получение 2-фтор-4,7-дихлорхинолина без применения основания.
Раствор, содержащий 4,7-дихлорхинолин (1,0 г, 5 ммоль) и иод (1,28 г, 5 ммоль) в CF2ClCFCl2 (30 мл), помещают в аппарат фторирования, снабженный осушительной трубкой, наполненной натриевой известью. Элементарный фтор (7 ммоль) в виде 10% об. смеси в сухом азоте затем пропускают через перемешиваемый раствор с использованием трубки из PTFE узкого внутреннего диаметра со скоростью примерно 15 мл/мин. После добавления фтора раствор выливают в 10% водный раствор метабисульфита натрия (30 мл) и экстрагируют дихлорметаном. Органические экстракты сушат и упаривают до состояния масла (0,98 г). ГХ/МС анализ показал 34% конверсии исходного материала. Колоночная хроматография на силикагеле с дихлорметаном в качестве элюента дала 2-фтор-4,7-дихлорхинолин (0,33 г, 87%) в виде белых кристаллов; другие данные были идентичны описанным в последующей реакции.
Пример 3. Фторирование 4,7-дихлорхинолина с использованием основания.
Раствор, содержащий 4,7-дихлорхинолин (1,0 г, 5 ммоль), иод (1,28 г, 5 ммоль) и триэтиламин (0,51 г, 5,1 ммоль) в CF2ClCFCl2 (30 мл), помещают в аппарат фторирования, снабженный осушительной трубкой, наполненной натриевой известью. Элементарный фтор (7 ммоль) в виде 10% смеси в сухом азоте затем пропускают через перемешиваемый раствор с использованием трубки из PTFE узкого внутреннего диаметра со скоростью примерно 15 мл/мин. После добавления фтора раствор выливают в 10% водный раствор метабисульфита натрия (30 мл) и экстрагируют дихлорметаном. Органические экстракты сушат и упаривают до состояния коричневого масла (1,06 г). ГХ/МС анализ показал 69% конверсии исходного материала. Колоночная хроматография на силикагеле с дихлорметаном в качестве элюента дала 2-фтор-4,7-дихлорхинолин (0,66 г, 88%) в виде белых кристаллов: т.пл. 105-106oC (сублимация в вакууме на масляной бане, 60oC/ < 1 мм рт.ст.); RF 0,72; (Найдено: C, 49,7; H, 1,7; N, 6,3. C9H4Cl2FN требует: C, 50,0; H, 1,85; N, 6,5%); δH (400 МГц, CDCl3, Me4Si) 7,20 м.д. (1H, д, JH3,F 2,4, H-3), 7,58 (1H, ДД, JHS,H6, 9,0, JH6,H8 2,2, H-6), 7,95 (1H, д, JH6,H8 2,0, (H-8), 8,13 (1H, д, JH5,H6 9,2, Н-5); δF (235 МГц, CDCl3, Me4Si) -60,0 м. д. (C); δC (100 МГц, CDCl3, Me4Si) 110,38 (д, 2J 45,8, C-3), 123,6 (д, 4J 2,3, C-4a), 125,5 (с, C-6), 127,6 (д, 5J 1,2, C-5), 128,1 (д, 4J 2,6, C-8), 137, 9 (с, C-7), 146,4 (д, 3J 24,6, C-4), 146,6 (д, 3J 18,5, C-8a), 160,9 (д, 1J 244,1, C-2); m/z (E1+) 215 (M+, 100%), 217 (61, M++2), 219 (11, M++4), 182 (14), 180 (40), 145 (18).
Пример 4. Фторирование 3-бромхинолина с использованием основания.
Раствор, содержащий 3-бромхинолин (1,0 г, 4,8 ммоль), иод (1,22 г, 4,8 ммоль) и триэтиламин (0,48 г, 4,8 ммоль) в CF2ClCFCl2 (30 мл), помещают в аппарат фторирования, снабженный осушительной трубкой, наполненной натриевой известью. Элементарный фтор (5 ммоль) в виде 10% смеси в сухом азоте затем пропускают через перемешиваемый раствор с использованием трубки из PTFE узкого внутреннего диаметра со скоростью примерно 15 мл/мин. После добавления фтора раствор выливают в 10% водный раствор метабисульфита натрия (30 мл) и экстрагируют дихлорметаном. Органические экстракты сушат и упаривают до состояния коричневого масла (0,95 г). ГХ/МС анализ показал 56% конверсии исходного материала. Колоночная хроматография на силикагеле с дихлорметаном в качестве элюента дала 2-фтор-3-бромхинолин (0,52 г, 85%) в виде белых игл: т.пл. 75-76oC (сублимация в вакууме на масляной бане, 50oC/ < 1 мм рт.ст.);
RF 0,69 (CH2Cl2); (Найдено: C, 47,5; H, 2,1; N, 6,2. C9H5NBrF требует: C, 47,8; H, 2,2; N, 6,2%); δH (400 МГц, CDCl3, Me4Si) 7,55 м.д. (1H, дд, JH5,H6, = JH6,H7 8,0, Н-6), 7,74 (1H, ддд, JH7,H8 8,4, JH6,H7 7,2, JH5,H7 1,2 Н-7), 7,76 (1H, д, JH5,H6 8,0, Н-5), 7,91 (1H, дд, JH7,H8 8,4, JH6,H8 0,8, H-8), 8,42 (1H, д, JH4,F 8,4, Н-4); δC (100 МГц, CDCl3, Me4Si) 104,0 (д, 2J 43,2, C-3), 126,6 (с, C-6), 127,0 (д, 4J 2,7, C-8), 128,0 (д, 5J 1,9, C-5) 128,0 (д, 4J 2,2, C-4a), 130,9 (д, 5J 1,1, C-7), 143,5 (д, 3J 3,7, C-4), 144,2 (д, 3J 15,1, C-8a), 157,3 (д, 1J 238,1, C-2); δF (235 МГц, CDCl3, CFCl3)-60,8 м. д. (C); m/z (E1+ 225 (М+, 100%), 227 (М+, 74), 146 (56), 126 (23), 101 (18), 75 (14).
Пример 5. Фторирование 4-хлорхинолина.
Раствор, содержащий 4-хлорхинолин (1,0 г, 6 ммоль), иод (1,55 г, 6 ммоль) и триэтиламин (0,60 г, 6 ммоль) в CF2ClCFCl2 (30 мл), помещают в аппарат фторирования, снабженный осушительной трубкой, наполненной натриевой известью. Элементарный фтор (7 ммоль) в виде 10% смеси в сухом азоте затем пропускают через перемешиваемый раствор при комнатной температуре с использованием трубки из PTFE узкого внутреннего диаметра со скоростью примерно 20 мл/мин. После добавления фтора раствор выливают в 10% водный раствор метабисульфита натрия (30 мл) и экстрагируют дихлорметаном. Органические экстракты сушат и упаривают до состояния коричневого масла (1,01 г). ГХ/МС анализ показал 76% конверсии исходного материала. Колоночная хроматография на силикагеле с дихлорметаном в качестве элюента дала 2-фтор-4-хлорхинолин (0,76 г, 90%) в виде белых игл: т.пл. 60-61oC (сублимация в вакууме на масляной бане, 50oC/ < 1 мм рт.ст.); RF 0,78 (CH2Cl2); (Найдено: C, 59,7; H, 2,9; N, 7,6. C9H5NClF требует: C, 59,5; H, 2,75; N, 7,7%); δH (400 МГц, CDCl3, Me4Si) 7,20 м.д. (1H, д, JH3,F 2,4, H-3), 7,62 (1H, ддд, JH5,H6 = JH6,H7 7,4, JH6,H8 1,2, H-6), 7,78 (1H, ддд, JH6,H7 = JH7,H8 7,8, JH5,H7 1,2, Н-7), 7,96 (1H, д, JH7,H8 8,4, H-8), 8,19 (1H, д, JH5,H6 8,4, Н-5); δF (235 МГц, CDCl3, CFCl3)-61,5 м.д. (c) δC (100 МГц, CDCl3, Me4Si) 110,2 м.д. (д, 2J 45,8, C-3), 124,2 (д, 5J 0,8, C-5), 125,1 (д, 4J 2,6, C-4a), 127,0 (д, 6J 2,7, C-6), 128,5 (д, 4J 1,5, C-8), 131,6 (с, C-7), 145,9 (д, 3J 18, C-8a), 146,6 (д, 3J 12,5, C-4), 160,2 (д, 1J 242,3, C-2); m/z (E1+) 183 (M+, 26%), 181 (M+, 100%), 146 (35), 126 (15), 75 (12), 50 (11).
Пример 6. Фторирование 6-хлорхинолина.
Раствор, содержащий 6-хлорхинолин (1,0 г, 6,1 ммоль), иод (1,55 г, 6,1 ммоль) и триэтиламин (0,62 г, 6,2 ммоль) в CF2ClCFCl2 (30 мл), помещают в аппарат фторирования, снабженный осушительной трубкой, наполненной натриевой известью. Элементарный фтор (7 ммоль) в виде 10% смеси в сухом азоте затем пропускают через перемешиваемый раствор с использованием трубки из PTFE узкого внутреннего диаметра со скоростью примерно 15 мл/мин. После добавления фтора раствор выливают в 10% водный раствор метабисульфита натрия (30 мл) и экстрагируют дихлорметаном. Органические экстракты сушат и упаривают до состояния коричневого твердого вещества (1,03 г). ГХ/МС анализ показал 79% конверсии исходного материала. Колоночная хроматография на силикагеле с дихлорметаном в качестве элюента дала 2-фтор-6-хлорхинолин (0,82 г, 93%), RF 0,78 (CH2Cl2); δH (400 МГц, CDCl3, Me4Si) 7,12 м.д. (1H, дд, JH3,H4 8,8, JH3,F 2,8, H-3), 7,67 (1H, дд, JH7,H8 9,2, JH5,H7 2,4, H-7), 7,82 (1H, д, JH5,H7 2,4, H-5), 7,87 (1H, д, JH7,H8 9,0, H-8), 8,16 (1H, дд, JH3,H4 = JH4,F 8,8, Н-4); δC (100 МГц, CDCl3, Me4Si) 111,1 м.д. (д, 2J 42,3, C-3), 126,3 (с, C-5), 127,3 (с, C-4a), 129,6 (с, C-8), 131,4 (с, C-7), 131,9 (с, C-6), 141,0 (д, 3J 9,9, C-4), 144,1 (д, 3J 16,8, C-8a), 161,2 (д, 1J 243,8, C-2); δF (235 МГц, CDCl3, CFCl3)-61,5 м.д. (c); m/z (E1+) 181 (M+, 100%), 183 (M+ 32%), 146 (34), 126 (11).
Пример 7. Фторирование фенантридина с использованием основания.
Раствор, содержащий фенантридин (1,0 г, 5,6 ммоль), иод (1,4 г, 5,6 ммоль) и триэтиламин (0,56 г, 5,6 ммоль) в CF2ClCFCl2 (30 мл), помещают в аппарат фторирования, снабженный осушительной трубкой, наполненной натриевой известью. Элементарный фтор (7 ммоль) в виде 10% смеси в сухом азоте затем пропускают через перемешиваемый раствор с использованием трубки из PTFE узкого внутреннего диаметра со скоростью примерно 15 мл/мин. После добавления фтора раствор выливают в 10% водный раствор метабисульфита натрия (30 мл) и экстрагируют дихлорметаном. Органические экстракты сушат и упаривают до состояния коричневого масла (0,92 г). ГХ/МС анализ показал 53% конверсии исходного материала. Колоночная хроматография на силикагеле с дихлорметаном в качестве элюента дала 6-фторфенантридин (0,39 г, 67%). RF 0,78 (CH2Cl2); δH (400 МГц, CDCl3, Me4Si) 7,61 м.д. (1H, ддд, JH1,H2 = JH2,H3 = 7,8, JH2,H4 1,2, Н-2), 7,69 (2H, м, H-3 и Н-9), 7,88 (1H, ддд, JH7,H8 8,4, JH8,H9 7,2, JH8,H10 1,4, Н-8), 7,97 (1H, дд, JH3,H4 8,0, JH2,H4 1,2, H-4), 8,21 (1H, дд, JH9,H10 8,0, JH8,H10 1,4, H-10), 8,45 (1H, дд, JH1,H2 8,0, JH1,H3 0,8, H-1), 8,52 (1H, дд, JH7,H8 8,4, JH7,H9 1,2, H-7); δF (376 МГц, CDCl3, CFCl3), 68,2 м. д. (c); δC (100 МГц, CDCl3, Me4Si) 117,3 м.д. (д, 3J 35,1, C-6a), 122,2 (д, 3J 3,8, C-7), 122,2 (с, C-1), 123,9 (д, 4J 1,9, C-10b), 124,2 (с, C-10), 126,5 (д, 6J 2,3, C-2), 127,9 (с, C-9), 128,7 (д, 4J 1,6, C-4), 129,4 (с, C-3), 132,1 (с, C-8), 136,5 (д, 3J 7,2, C-10a), 141,5 (д, 3J 17,9, C-4a), 158,1 (д, 1J 248,7, C-6); m/z (E1+) 197 (M+, 100%).
Пример 8. Фторирование 4-этилпиридина.
Раствор, содержащий 4-этилпиридин (12,8 г, 120 ммоль) и иод (30,5 г, 120 ммоль) в CF2ClCFCl2 (150 мл), помещают в аппарат фторирования, снабженный осушительной трубкой, наполненной натриевой известью. Элементарный фтор (165 ммоль) в виде 10% смеси в сухом азоте затем пропускают через перемешиваемый раствор с использованием трубки из PTFE узкого внутреннего диаметра со скоростью примерно 40 мл/мин. После добавления фтора раствор выливают в 10% водный раствор метабисульфита натрия (300 мл), нейтрализуют твердым бикарбонатом натрия и экстрагируют дихлорметаном. Органические экстракты сушат и упаривают до состояния желтого масла (9,54 г), которое содержало этилпиридин (78% конверсии), 2-фторпиридин и незначительные количества других продуктов по данным ГХ/МС анализа. Масло повторно растворяют в дихлорметане и промывают раствором 2H HCl, сушат (MgSO4) и упаривают до состояния прозрачного масла с получением 2-фтор-4-этилпиридина с чистотой > 95% (6,3 г, 54%, основанные на конверсии 78%); δH (200 МГц, CDCl3 Me4Si) 1,26 м.д. (3H, т, J 7,6, CH3), 2,69 (2H, к, J 7,6, CH2), 6,75 (1H, с, H-3), 7,02 (1H, дм, J 5,1, Н-5), 8,09 (1H, д, J 5,1, Н-6); δC (50 МГц, CDCl3, Me4Si) 14,1 м.д. (с, CH3), 28,2 (д, 4JC-F 2,7, CH2), 108,5 (д, 2JC-F 36,5, C-3), 121,3 (д, 4JC-F 3,9, C-5), 147,3 (д, 3JC-F 15,2, C-6), 159,3 (д, 3JC-F 7,8, C-4), 164,2 (д, 1JC-F 236,3, C-2); δF (235 МГц, CDCl3, CFCl3) 69,9 м.д. (c); m/z (E1+) 125 (М+, 100%), 110 (47), 97 (15), 83 (13).
Пример 9. Фторирование хинолина.
Раствор, содержащий хинолин (10,6 г, 82,5 ммоль) и иод (21,0 г, 82,5 ммоль) в CF2ClCFCl2 (150 мл), помещают в аппарат фторирования, снабженный осушительной трубкой, наполненной натриевой известью. Элементарный фтор (165 ммоль) в виде 10% смеси в сухом азоте затем пропускают через перемешиваемый раствор с использованием трубки из PTFE узкого внутреннего диаметра со скоростью примерно 40 мл/мин. После добавления фтора раствор выливают в 10% водный раствор метабисульфита натрия (300 мл), нейтрализуют бикарбонатом натрия и экстрагируют дихлорметаном. Органические экстракты сушат (MgSO4) и упаривают до состояния масла (7,2 г). Перегонка дала 2-фторхинолин (6,5 г, 54%) в виде бледно-желтого масла: т.кип. 134-136oC/ 30 мм рт.ст. (лит., 133oC/ 30 мм рт. ст.) δH (400 МГц, CDCl3, Me4Si) 7,05 м.д. (1H, дд, JH3,H4 8,8 JH3,F 2,8, Н-3), 7,51 (1H, ддд, JH5,H6 8,0, JH6,H7 6,8, JH6,H8 0,8 Н-6), 7,71 (1H, ддд, JH7,H8 8,0, JH6,H7 7,6, JH5,H7 1,2, Н-7), 7,81 (1H, д, JH5,H6 8,0, Н-5), 7,94 (1H, д, JH7,H8 8,4, H-8), 8,20 (1H, дд, JH3,H4 = JH4,F 8,4, H-4); δF (250 МГц, CDCl3, Me4Si)-63,2 м.д.; δC (100 МГц, CDCl3, Me4Si) 110,0 м. д. (д, 2J 42,1, C-3), 126,1 (д, 4J 2,6, C-8), 126,8 (д, 4J 1,9, C-4a), 127,5 (с, C-6), 128,0 (д, 5J 1,2, C-5), 130,6 (д, 5J 0,8, C-7), 141,9 (д, 3J 9,9, C-4), 145,7 (д, 3J 16,7, C-8a), 161,1 (д, 1J 240,5, C- 2); m/z (E1+) 147 (M+, 100%).
Пример 10. Фторирование 3-бромхинолина без использования основания.
Раствор, содержащий 3-бромхинолин (1,0 г, 4,8 ммоль) и иод (1,22 г, 4,8 ммоль) в CF2ClCFCl2 (30 мл), помещают в аппарат фторирования, снабженный осушительной трубкой, наполненной натриевой известью. Элементарный фтор (5 ммоль) в виде 10% смеси в сухом азоте затем пропускают через перемешиваемый раствор с использованием трубки из PTFE узкого внутреннего диаметра со скоростью примерно 15 мл/мин. После добавления фтора раствор выливают в 10% водный раствор метабисульфита натрия (30 мл) и экстрагируют дихлорметаном. Органические экстракты сушат и упаривают до состояния коричневого масла (0,92 г). ГХ/МС анализ показал 43% конверсии исходного материала. Колоночная хроматография на силикагеле с дихлорметаном в качестве элюента дала 2-фтор-3-бромхинолин (0,35 г, 74%) в виде белых игл: т.пл. 75-76oC (сублимация в вакууме на масляной бане, 50oC/ < 1 мм рт.ст.); RF 0,69 (CH2Cl2); (Найдено: C, 47,5; H, 2,1; N, 6,2. C9H5NBrF требует: C, 47,8; H, 2,2; N, 6,2%); δH (400 МГц, CDCl3, Me4Si) 7,55 м.д. (1H, дд, JH5,H6 = JH6,H7 8,0, Н-6), 7,74 (1H, ддд, JH7,H8 8,4, JH6,H7 7,2, JH5,H7 1,2 H-7), 7,76 (1H, д, JH5,H6 8,0, Н-5), 7,91 (1H, дд, JH7,H8 8,4, JH6,H8 0,8, H-8), 8,42 (1H, д, JH4,F 8,4, H-4); δC (100 МГц, CDCl3, Me4Si) 104,0 (д, 2J 43,2, C-3), 126,6 (с, C-6), 127,0 (д, 4J 2,7, C-8), 128,0 (д, 5J 1,9, C-5), 128,0 (д, 4J 2,2, C-4a), 130,9 (д, 5J 1,1, C-7), 143,5 (д, 3J 3,7, C-4), 144,2 (д, 3J 15,1, C-8a), 157,3 (д, 1J 238,1, C-2); δF (235 МГц, CDCl3, CFCl3)-60,8 м.д. (с); m/z (E1+) 225 (М+, 100%), 227 (М+, 74), 146 (56), 126 (23), 101 (18), 75 (14).
Пример 11. Фторирование 4-хлор-7-трифторметилхинолина.
Раствор, содержащий 4-хлор-7-трифторметилхинолин (1,0 г, 4,3 ммоль) и иод (1,1 г, 4,3 ммоль) в CF2ClCFCl2 (30 мл), помещают в аппарат фторирования, снабженный осушительной трубкой, наполненной натриевой известью. Элементарный фтор (5 ммоль) в виде 10% смеси в сухом азоте затем пропускают через перемешиваемый раствор с использованием трубки из PTFE узкого внутреннего диаметра со скоростью примерно 15 мл/мин. После добавления фтора раствор выливают в 10% водный раствор метабисульфита натрия (30 мл), нейтрализуют твердым бикарбонатом натрия и экстрагируют дихлорметаном. Органические экстракты сушат и упаривают до состояния желтого твердого вещества (1,09 г). ГХ/МС анализ показал 5% конверсии исходного материала. Колоночная хроматография на силикагеле с дихлорметаном в качестве элюента дала 2-фтор-4-хлор-7-трифторметилхинолин (0,05 г, 86%) в виде белых игл: т. пл. 94-95oC (сублимация в вакууме на масляной бане, 50oC/ < 1 мм рт. ст.); RF 0,69 (CH2Cl2); (Найдено: C, 47,7; H, 1,3; N, 5,5. Cl10H4NClF4 требует: C, 48,1; H, 1,6; N, 5,6%) δH (400 МГц, CDCl3, Me4Si) 7,32 м.д. (1H, д, JH,F 2,4, H-3), 7,79 (1H, дд, JH5,H6 8,8, JH6,H8 1,6, Н-6), 8,23 (1H, м, Н-8), 8,32 (1H, д, JH5,H6 8,8, Н-5); δC (50 МГц, CDCl3, Me4Si) 112,3 м.д. (Д, 2JC-F 45,5, C-2), 122,9 (м, C-6), 123,4 (к, 1JC-F 272,7, CF3), 125,6 (с, C-5), 126,2 (м, C-8), 126,7 (c, C-4a), 133,4 (к, 2JC-F 33,2, C-7), 145,2 (д, 3JC-F 18,7, C-8a), 146,7 (д, 3JC-F 12,9, C-4), 160,9 (д, 1JC-F 245,3, C-2); δF (235 МГц, CDCl3, CFCl3)-55,0 м.д. (1F, с, F-2), -59,2 (3F, C, CF3); m/z (E1+) 249 (М+, 100%), 251 (М+, 33), 230 (26), 214 (18), 201 (11), 199 (33), 194 (12), 145 (26), 99 (19).
Пример 12. Фторирование фенантридина без использования основания.
Раствор, содержащий фенантридин (1,0 г, 5,6 ммоль) и иод (1,4 г, 5,6 ммоль) в CF2ClCFCl2 (30 мл), помещают в аппарат фторирования, снабженный осушительной трубкой, наполненной натриевой известью. Элементарный фтор (7 ммоль) в виде 10% смеси в сухом азоте затем пропускают через перемешиваемый раствор с использованием трубки из PTFE узкого внутреннего диаметра со скоростью примерно 15 мл/мин. После добавления фтора раствор выливают в 10% водный раствор метабисульфита натрия (30 мл) и экстрагируют дихлорметаном. Органические экстракты сушат и упаривают до состояния оранжевого масла (0,91 г). ГХ/МС анализ показал 17% конверсии исходного материала. Колоночная хроматография на силикагеле с дихлорметаном в качестве элюента дала 6-фторфенантридин (0,09 г, 48%); RF 0,78 (CH2Cl2); δH (400 МГц, CDCl3, Me4Si) 7,61 м. д. (1H, ддд, JH1,H2 = JH2,H3 = 7,8, JH2,H4 1,2, Н-2), 7,69 (2H, м, H-3 и Н-9), 7,88 (1H, ддд, JH7,H8 8,4, JH8,H9 7,2, JH8,H10 1,4, Н-8), 7,97 (1H, дд, JH3,H4 8,0, JH2,H4 1,2, Н-4), 8,21 (1H, дд, JH9,H10 8,0, JH8,H10 1,4, H-10), 8,45 (1H, дд, JH1,H2 8,0, JH1,H3 0,8, Н-1), 8,52 (1H, дд, JH7,H8 8,4, JH7,H9 1,2, Н-7); δF (376 МГц, CDCl3, CFCl3), -68,2 м.д. (с); δC (100 МГц, CDCl3, Me4Si) 117,3 м.д. (д, 2J 35,1, C-6a), 122,2 (д, 3J 3,8, C-7), 122,2 (с, C-1), 123,9 (д, 4J 1,9, C-10b), 124,2 (с, C-10), 126,5 (д, 6J 2,3, C-2), 127,9 (с, C-9), 128,7 (д, 4J 1,6, C-4), 129,4 (с, C-3), 132,1 (с, C-8), 136,5 (д, 3J 7,2, C-10a), 141,5 (д, 3J 17,9, C-4a), 158,1 (д, 1J 248,7, C-6); m/z (E1+) 197 (M+, 100%).
Пример 13. Фторирование хиноксалина.
Раствор, содержащий хиноксалин (15,6 г, 120 ммоль) и иод (30,5 г, 120 ммоль) в CF2ClCFCl2 (150 мл), помещают в аппарат фторирования, снабженный осушительной трубкой, наполненной натриевой известью. Элементарный фтор (165 ммоль) в виде 10% смеси в сухом азоте затем пропускают через перемешиваемый раствор с использованием трубки из PTFE узкого внутреннего диаметра со скоростью примерно 40 мл/мин. После добавления фтора раствор выливают в 10% водный раствор метабисульфита натрия (300 мл), нейтрализуют бикарбонатом натрия и непрерывно экстрагируют дихлорметаном в течение 24 часов. Органические экстракты сушат и упаривают до состояния масла (13,6 г). ГХ/МС анализ показал 49% конверсии хиноксалина. Масло очищают колоночной хроматографией на силикагеле, используя дихлорметан в качестве элюента, с получением чистого 2-фторхиноксалина в виде бледно-желтого масла (5,30 г, 62%, основанные на 49% конверсии); RF 0,53; δH (200 МГц, CDCl3, Me4Si) 7,7 м.д. (2H, м), 7,9 (1H, м), 8,1 (1H, м), 8,67 (1H, д, JH,F 7,9, H-3); δF (250 МГц, CDCl3, Me4Si) - 75,1 м. д. (с); δC (50,3 МГц, CDCl3, Me4Si) 128,4 м.д. (д, 4JC,F 1,6, C-8), 129,4 (с, C-7), 129,45 (с, C-6), 131,6 (с, C-5), 136,5 (д, 2JC,F 42,6, C-3), 139,72 (д, 3JC,F 10,9, C-8a), 141,52 (д, 4JC,F 1,8, C-4a), 156,74 (д, 1JC-F, 256,0, C-2); m/z (E1+) 148 (M+, 100), 129 (20), 121 (12), 103 (17), 76 (24), 50 (17); и 2,3-дифторхиноксалина (0,27 г, 3%) в виде бледно-желтого твердого вещества; RF 0,75; δH/ (400 МГц, CDCl3, Me4Si) 7,79 м. д. (2H, м, Ar-H), 7,99 (2H, м, Ar-H); δC (50 МГц, CDCl3, Me4Si) 127,8 (с, C-8), 130,4 (с, C-7), 138,4 (дд, 3JC-F 5,4, C-4a), 146,1 (дд, 1JC-F 261,3, 2JC-F 39,5, C-2); δF (235 МГц, CDCl3, CFCl3)-82,8 м.д. (с); m/z (E1+) 166 (М+, 100%), 139 (11).
| название | год | авторы | номер документа |
|---|---|---|---|
| ИСПОЛЬЗОВАНИЕ ТРИЦИКЛИЧЕСКИХ ПРИЗВОДНЫХ 1,4-ДИГИДРО-1,4-ДИОКСО-1Н-НАФТАЛИНА И НОВЫЕ ЕГО СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И ПРОИЗВОДНЫЕ ЗАМЕЩЕННЫХ НАФТАЛИНОВ В КАЧЕСТВЕ ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ | 1996 |
|
RU2178791C2 |
| Фосфониевые соли на основе алантолактона, обладающие противоопухолевой активностью, и способ их получения | 2023 |
|
RU2818095C1 |
| НОВЫЕ ГЕМ-ДИФТОРИРОВАННЫЕ СОЕДИНЕНИЯ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, И ИХ ПРИМЕНЕНИЕ | 2003 |
|
RU2369612C2 |
| ПРОТИВОГРИБКОВЫЕ СОЕДИНЕНИЯ НА ОСНОВЕ ПРОИЗВОДНЫХ 3,5,8-ТРИОКСАБИЦИКЛО[5.1.0]ОКТАНА | 2013 |
|
RU2538962C1 |
| ПРОИЗВОДНЫЕ 2-ДЕЗОКСИ-2,3-ДИДЕГИДРО-N-АЦЕТИЛНЕУРАМИНОВОЙ КИСЛОТЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ЛЕЧЕНИЯ | 1991 |
|
RU2119487C1 |
| ПРОИЗВОДНЫЕ ТРИ- ИЛИ ТЕТРА-ЗАМЕЩЕННОГО-3-АМИНОПИРРОЛИДИНА | 2006 |
|
RU2420524C2 |
| ГЕТЕРОЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ | 2006 |
|
RU2382781C2 |
| СОЕДИНЕНИЯ | 2008 |
|
RU2461559C2 |
| ЦИКЛОАЛКАНОВОЕ ПРОИЗВОДНОЕ | 2013 |
|
RU2635354C2 |
| 2-АМИНОЗАМЕЩЕННЫЕ 6-МЕТОКСИ-4-ТРИФТОРМЕТИЛ-9Н-ПИРИМИДО[4,5b]ИНДОЛЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ПРИМЕНЕНИЕ И ПРЕДШЕСТВЕННИКИ | 2016 |
|
RU2625316C1 |
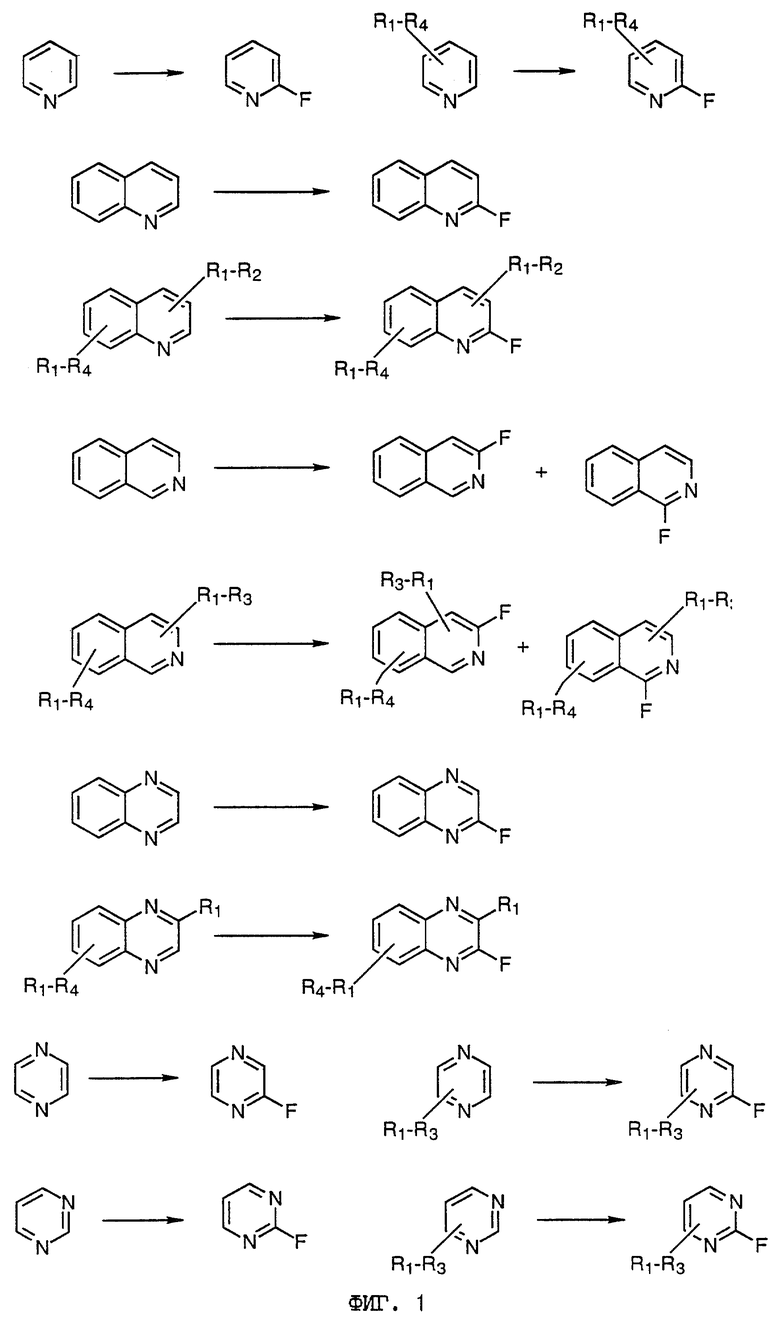
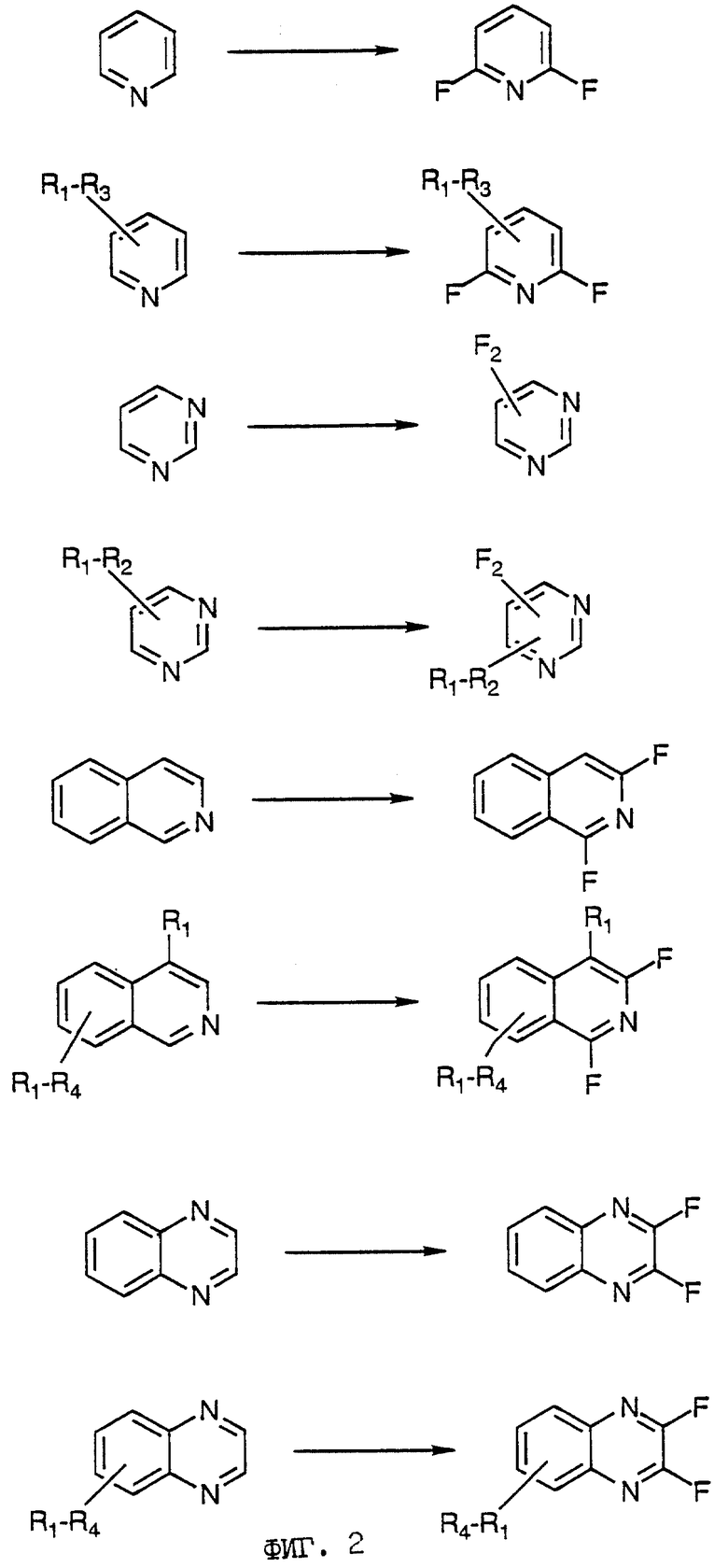
Предложен способ получения азотсодержащих гетероциклических соединений, имеющих по меньшей мере один фтор-заместитель в гетероциклическом кольце, который включает стадию взаимодействия азотсодержащего гетероциклического соединения с газообразным элементарным фтором в присутствии по меньшей мере одного из хлора, брома, иода или интергалогенного соединения. Реакцию можно проводить в присутствии основания. В качестве исходного может быть использовано гетероциклическое соединение, включающее предпочтительно пяти- или шестичленное гетероциклическое кольцо, которое может содержать необязательные заместители, такие как, например, пиридин, пиримидин, пиридазин, пиразин, триазин, хинолин, изохинолин, хиноксалин, хиназолин и бипиридин. Технический результат - прямое селективное фторирование гетероциклического кольца. 8 з. п. ф-лы, 2 ил.
| US 4786733 A, 22.11.1988 | |||
| Способ получения бета-фторпиридинов | 1984 |
|
SU1376942A3 |
| Способ получения производных фторметилхинолина | 1983 |
|
SU1299507A3 |
Авторы
Даты
2000-11-20—Публикация
1995-12-18—Подача