Изобретение относится к генной инженерии, в частности к получению трансгенных животных.
Известен стандартный буфер ТЕ (10 мМ Трис-HCl, pH 7,4, 0,1 мМ ЭДТА, pH 8,0), который используется для приготовления микроинъекционных растворов генных конструкций с целью получения трансгенных животных (Hammer R.Е., Pursel V.G., Rexroad С.Е. Jr. е.a. Production of transgenic rabbits, sheep and pigs by microinjection. Nature, 1985, 315, 680-683). Буфер ТЕ характеризуется очень низким осмотическим давлением (~25 мосм) по сравнению с большинством сред для культивирования эмбрионов, что является одной из причин относительно низкой жизнеспособности инъецированных эмбрионов.
Известна синтетическая среда яйцеводов на буферной основе МОПС (MSOF) для микроинъекции эмбрионов крупного рогатого скота и исследования их выживаемости in vitro (Hagemann L.J. Pronuclear injection of MOPS-buffered medium does not affect bovine embryo development. Theriogenology, 1995, 43 (1): 229), взятая в качестве прототипа. Инъекция физиологического буфера MSOF не влияла на развитие бластоцист in vitro. Доля эмбрионов, развившихся до стадии бластоцисты при инъекции MSOF, была в два раза выше по сравнению с инъекцией буфера ТЕ (соответственно 27,5% и 13,9%) и не отличалась от контрольных неинъецированных эмбрионов (27,6%). Возможность использования среды MSOF для получения трансгенных животных не была установлена.
Целью настоящего изобретения является применение синтетической среды яйцеводов MSOF в качестве основы микроинъекционного буфера для получения трансгенных животных.
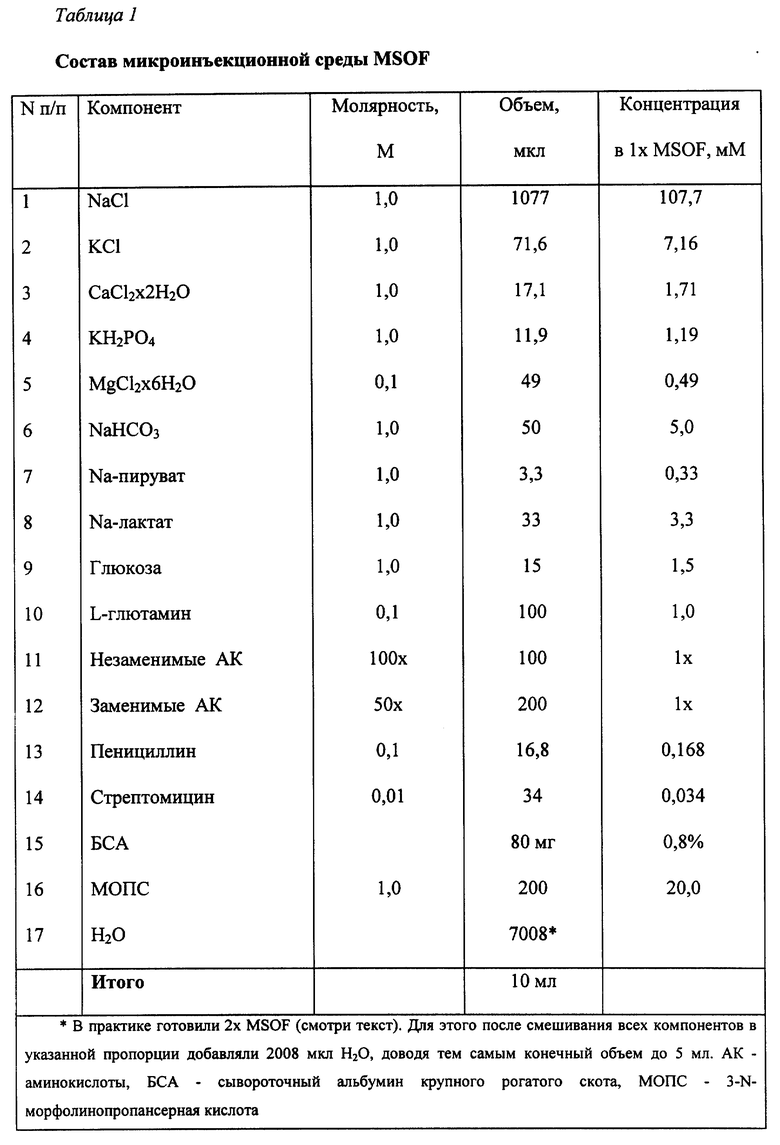
Для приготовления микроинъекционных растворов MSOF и ТЕ использовали профильтрованную (0,22 мкм) бидистиллированную воду. Буфер ТЕ (10 мМ Трис-HCl, pH 7,4; 0,1 мМ ЭДТА, pH 8,0) готовили и хранили в виде 2-кратного раствора (2х). При приготовлении инъекционного раствора генных конструкций концентрацию буфера доводили до 1х.
Состав MSOF с указанием молярности исходных растворов и их конечных концентраций в 1х буфере приводится в таблице 1. Концентрированные растворы отдельных компонентов этого буфера готовили заранее и хранили при +4oC или при -20oC (L-глютамин, стрептомицин, пенициллин) в течение трех месяцев. За день до эксперимента готовили 2х MSOF, выполняли контроль и установку pH на уровне 7,4. Затем добавляли концентрированный раствор генных конструкций и доводили концентрацию MSOF до 1х. Концентрацию ДНК в инъекционных растворах MSOF и ТЕ устанавливали на уровне 1000 копий/пкл. Микроинъекционные растворы хранили при +4oC и использовали в течение суток.
Пример. Опыт проводили на кроликах. На этих животных хорошо отработаны методы суперовуляции, извлечения, микроинъекции и пересадки эмбрионов. Кролики имеют короткий период беременности, поэтому результаты могут быть получены в течение небольшого периода времени (месяца). Закономерности, выявленные на кроликах, могут быть перенесены на другие виды сельскохозяйственных животных.
Зиготы кроликов получали от суперовулированных самок кроликов породы Zika. Подготовку доноров и реципиентов, извлечение и пересадку эмбрионов проводили известным способом (Зиновьева Н.А., Безенфельдер У., Брем Г. Получение яйцеклеток и пересадка микроинъецированных зигот у кроликов. Онтогенез, 1996, 27(3): 214-217). Микроинъекцию осуществляли в мужской пронуклеус под микроскопом при увеличении х400. В каждый эмбрион инъецировали 1-2 пкл раствора ДНК. До момента пересадки микроинъецированные эмбрионы культивировали в капле питательной среды (PBS+20% сыворотки) при +37oC в течение 1-2 часов. В качестве контроля части реципиентов пересаживали неманипулированные эмбрионы.
На 14-й день выполняли пальпацию реципиентов с целью предварительной диагностики беременности. Окролы ожидали на 31-й день после пересадки эмбрионов. В случае задержки реципиентам вводили 0,3 ME окситоцина внутримышечно. Пробы тканей (ухо) отбирали на 4-5-й день после окрола, при этом метя крольчат с помощью маркера. Такая маркировка сохранялась в течение 1-2-х недель, что было достаточно для выполнения анализа и диагностики трансгенности. Выявленных трансгенных животных повторно метили маркером в возрасте 2-3-х недель и затем окончательно (ушной маркер) в возрасте 1-1,5 месяцев.
ДНК из проб тканей выделяли с использованием модифицированного метода фенольно-хлороформовой экстракции (Ausubel F.М., Brent R., Kingston R.E. e. a. Current protocols in molecular biology. New York, 1987). Диагностику трансгенности выполняли методом капиллярной полимеразной цепной реакции (ПЦР) (Зиновьева Н. А., Эрнст Л. К., Брем Г. Метод капиллярной полимеразной цепной реакции как быстрая и более дешевая альтернатива доказательства различных вариантов ДНК. В сб.: Генноинженерные сельскохозяйственные животные. М., 1995: 244-248). Продукты ПЦР разделяли в 1,6% агарозном геле в буфере ТВЕ (0,1 М Трис-HCl, pH 7,5; 0,1 М борная кислота; 2 мМ ЭДТА, pH 8,0) с добавлением бромида димидия до конечной концентрации 30 нг/мкл, просматривали в ультрафиолетовом свете и фотографировали.
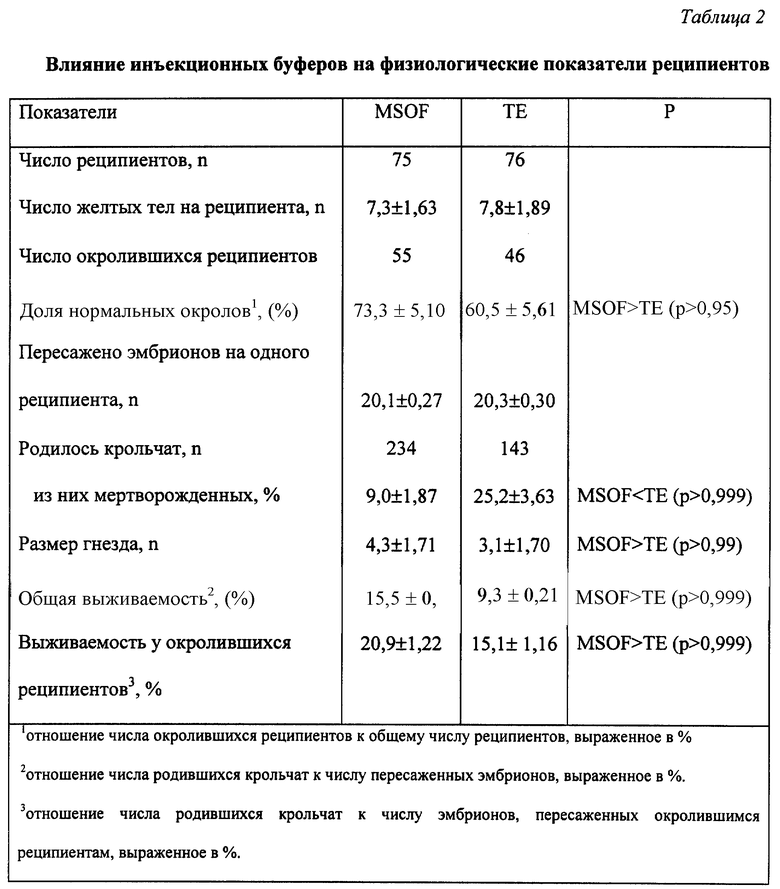
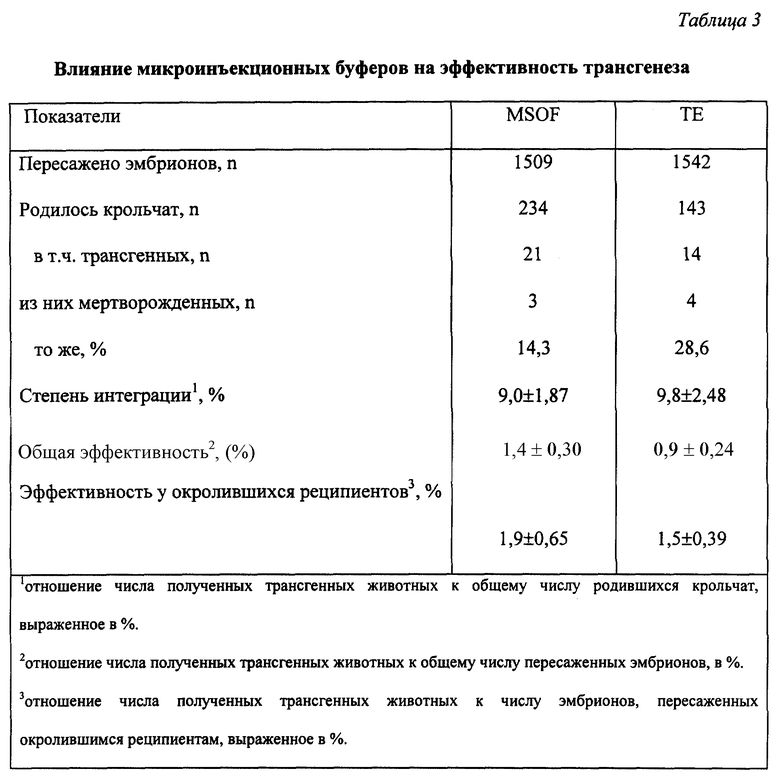
Результаты анализа влияния микроинъекционных буферов на физиологические показатели реципиентов представлены в таблице 2. Из полученных данных (табл. 2) следует, что применение буфера MSOF повышало долю нормальных окролов на 12,8% по сравнению с буфером ТЕ (p < 0,95). В среднем от каждого окролившегося реципиента в группе MSOF было получено на 1,2 крольчонка больше по сравнению с группой ТЕ (p > 0,99), в то время как число эмбрионов, в среднем пересаживаемых реципиентам в опытных группах, не различалось (20,1 и 20,3). Таким образом, MSOF был менее вреден для эмбрионов по сравнению с ТЕ. В группе MSOF было лишь 20% реципиентов, принесших по 1-2 крольчонка, в то время как в группе ТЕ их было 50%. Доля мертворожденных в группе MSOF была на 16,2% ниже по сравнению с группой ТЕ (p > 0,999). Основным физиологическим показателем, который напрямую позволяет выявить влияние инъекционного буфера на жизнеспособность эмбрионов, является показатель выживаемости эмбрионов. В группе MSOF отмечалась в 1,7 раза более высокая общая выживаемость эмбрионов по сравнению с группой ТЕ (p > 0,999). Расчет этого показателя у окролившихся реципиентов показал, что выживаемость эмбрионов, инъецированных MSOF, была выше по сравнению с ТЕ в 1,4 раза (p > 0,999). Следовательно, инъекционный буфер на основе MSOF отличается от стандартного инъекционного буфера ТЕ лучшей физиологической пригодностью. Показатели эффективности трансгенеза в исследовательских группах приводятся в таблице 3. Из данных таблицы следует, что между исследовательскими группами не наблюдалось различий в степени интеграции (9,0 и 9,8%), поскольку интеграция зависит прежде всего от метода, используемого для введения ДНК в эмбриональные линии млекопитающих, и от вида животных. Физиологические показатели со степенью интеграции трансгена характеризует показатель общей эффективности. Известно, что у кроликов он составляет величину порядка 1%. При пересадке одинакового числа эмбрионов за счет их лучшей выживаемости рождается большее количество животных, среди которых при равной степени интеграции присутствует большее число трансгенных животных. В настоящих исследованиях за счет использования физиологически более пригодного буфера MSOF общая эффективность переноса генов увеличилась в 1,6 раза (p < 0,95) и составила 1,4% по сравнению с 0,9% при использовании ТЕ.
Показатель эффективности переноса генов у окролившихся реципиентов исключает влияние тех реципиентов, которые на момент проведения опытов были не способны к имплантации эмбрионов и их дальнейшему развитию. Расчет этого показателя выявил различия в 1,3 раза (p < 0,95) в пользу MSOF. Кроме того, что в группе MSOF было получено больше трансгенных животных, лишь 14,3% из них были нежизнеспособны. В группе ТЕ из общего числа полученных трансгенных животных нежизнеспособными оказались в 2 раза больше особей (28,6%).
На основе полученных данных можно заключить, что среда MSOF как основа микроинъекционного буфера является более пригодной для использования в получении трансгенных кроликов по сравнению со стандартным буфером ТЕ. MSOF оказывает меньшее влияние на жизнеспособность эмбрионов и в результате способствует более высокой эффективности трансгенеза у кроликов. Известно, что аналогичные закономерности изменения физиологических показателей выявлены при культивировании in vitro эмбрионов крупного рогатого скота. В этой связи можно предположить лучшую пригодность раствора MSOF для получения трансгенного крупного рогатого скота и других видов животных.
Изобретение применимо в биотехнологии.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ТРАНСГЕННОГО ЖИВОТНОГО, ЭКСПРЕССИРУЮЩЕГО В МОЛОЧНОЙ ЖЕЛЕЗЕ ГРАНУЛОЦИТАРНЫЙ КОЛОНИЕСТИМУЛИРУЮЩИЙ ФАКТОР ЧЕЛОВЕКА И ГИБРИДНЫЙ ГЕН h-GM-1 ДЛЯ ОСУЩЕСТВЛЕНИЯ СПОСОБА | 1999 |
|
RU2157846C1 |
| СПОСОБ ПОВЫШЕНИЯ ПРИЖИВЛЯЕМОСТИ ЗИГОТ, МИКРОИНЪЕЦИРОВАННЫХ ГЕННО-ИНЖЕНЕРНОЙ КОНСТРУКЦИЕЙ У СВИНЕЙ-РЕЦИПИЕНТОВ | 2000 |
|
RU2199290C2 |
| СПОСОБ ПОЛУЧЕНИЯ ТРАНСГЕННЫХ СВИНЕЙ | 1991 |
|
RU2095412C1 |
| Способ получения кролика с нокаутом гена CSN2 | 2023 |
|
RU2834016C1 |
| ТРАНСГЕНЕЗ У МЛЕКОПИТАЮЩИХ ПУТЕМ ИНТРАЦИТОПЛАЗМАТИЧЕСКОЙ ИНЪЕКЦИИ СПЕРМЫ | 1999 |
|
RU2267270C2 |
| СПОСОБ ВВЕДЕНИЯ ЭКЗОГЕННОЙ ДНК ПЛАЗМИД В КЛЕТКИ МЛЕКОПИТАЮЩИХ, КУЛЬТИВИРУЕМЫЕ IN VITRO | 1993 |
|
RU2094464C1 |
| Способ получения генно-модифицированных кроликов с нокаутом гена LEPR с помощью системы CRISPR/Cas9 | 2023 |
|
RU2836438C1 |
| СПОСОБ ПОЛУЧЕНИЯ КЛОНИРОВАННОГО ПРЕДСТАВИТЕЛЯ СЕМЕЙСТВА ПСОВЫХ | 2006 |
|
RU2391817C2 |
| СПОСОБ ВВЕДЕНИЯ РЕТРОВИРУСНЫХ ВЕКТОРОВ В КЛЕТКИ БЛАСТОДЕРМЫ ПРИ ПОЛУЧЕНИИ ТРАНСГЕННЫХ КУР | 2005 |
|
RU2303068C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТРАНСГЕННЫХ КРОЛИКОВ, ПРОДУЦИРУЮЩИХ БЕЛКИ В МОЛОЧНУЮ ЖЕЛЕЗУ | 2007 |
|
RU2402211C2 |
Изобретение относится к генной инженерии, в частности к получению трансгенных животных. Предложено применение синтетической среды яйцеводов MSOF в качестве основы микроинъекционного буфера для получения трансгенных животных. Микроинъекционный раствор на основе MSOF является более физиологичным, он оказывает меньшее влияние на жизнеспособность эмбрионов. 3 табл.
Применение синтетической среды яйцеводов MSOF в качестве основы микроинъекционного буфера для получения трансгенных животных.
| Nature, 1985, 315, p.680 - 683 | |||
| Theriogenology, 1995, 43(1), p.229. |
Авторы
Даты
2000-12-20—Публикация
1999-04-21—Подача