Изобретение относится к биотехнологии, в частности к генетической инженерии.
Известен кальций-фосфатный способ генетической трансформации клеток млекопитающих. Принцип способа заключается в соосаждении ДНК с фосфатом кальция и обработки клеток образующимся преципитатом. Способ позволяет значительно повысить устойчивость ДНК в составе преципитата к действию внутриклеточных и внеклеточных дезоксирибонуклеаз. При этом кальций-фосфатный преципитат ДНК образуется в широком диапазоне концентраций ДНК и значений pH раствора (Глебов О.К. Абрамян Д.С. Томилин Н.В. Генетическая трансформация соматических клеток. 1. Клон клеток китайского хомячка дефектных по тимидинкиназе, отличающийся высокой эффективностью трансформации. -Цитология, 1985, т.27, N 4, с.467-476). Стандартный кальций-фосфатный метод трансфекции обеспечивает частоту стабильной трансформации в пределах 10-5. Этот метод мало эффективен. Кроме того, эффективность этого способа зависит от образования ДНК-преципитата, который очень чувствителен к значению pH растворов.
При улучшении обычной кальций-фосфатной процедуры путем добавления в среду сразу после глициринового шока бутирата натрия число клеток, экспрессирующих вводимый ген, увеличивается в среднем в четыре раза (Томилин Н.В. Новые системы генетической трансформации соматических клеток млекопитающих. Биотехнология, 1987, т. 3, N 3, с. 343-354).
При замене стандартного буфера HEPES на BBS и сдвига pH с 7,15 на 6,95 эффективность стабильной трансформации ДНК кальций-фосфатного метода повышается до 50% (Chen C. Okayma H. High-effiency transformation of mammalian cells by plasmid DNA. Mol. and Cell Biology. 1987, v. 8, N 8, p. 2745-2752).
Известны способы введения изолированной ДНК в клетки млекопитающих ДЕАД-декстран (Holter Wolfgang, Fordis C.Michael et.al.Efficient gene transfer by sequentiel treatment of mammalian cells with DEAE-dextran. Exp.cell.Res. 1989, v. 184, N 2, p. 546-551), а также с помощью фосфат-стронция (Brash D. E. Redel R. R. Strontium phosphate transfection of human cell in primary culture: stable expression of the simian virus 4C large-T-antigen gene in primary human bronchial epithelial cell.-Mol.Cell.Biol. 1987, v. 7, N 5, p. 2031-2034) и слияния мембран (Felgner P.L. Ringold G.M. Cationic liposome-mediated transfection. Nature, 1989, v. 337, N 6205, p. 387-388.). Эти способы используются в практике, но недостаточно эффективны.
Известны способы микроинъекции (Cappecchi M.R. High efficiency transformation by direct microinjection of DNA into cultured mammalian cells.-Cell, 1980, v. 22, N 2, p. 479-488) и микроукалывания клеток (Такада Синдзи, Обината Масуа. Введение генов с помощью микроинъекций и уколов клетки. Био индастри. Bio Industry, 1986, v. 3, N 10, p. 821-826). Эти способы эффективны, но очень трудоемки и требуют наличия дорогого оборудования.
Способы с использованием физических агентов: импульсов электрического тока (Latsuca Masaaki, Orita Satoshi. An improved method of electroporation for introducing biologically active foreign genes into cultured mammalian cells. Exp.Cell.Res. 1988, v. 178, N 1, p. 154-162), лазерного облучения и ультразвука (Fechheimer M. Boylan J.F. Parker S. et al. Transfections of mammalian cells with plasmid DNA by scrape loading and sonification loading. - Proc. Natl. Acad. Sci. USA, 1987, v. 84, p. 8463-8471) не во всех лабораториях могут быть использованы.
Способ введения ДНК путем инфицирования клеток рекомбинантными вирусами и вирусными частицами, собранными in vitro (Edlitis M.A. Kantoff P.W. Retroviral-mediated gene transfer into hemopoiietic cells. Mol. Biol. Hemopoiesis. Proc. 3rd Annu Symp. Rye. Brook, N.Y. Nov. 6-7, 1987, New York: London, 1988, p. 19-27) обеспечивает высокий уровень (до 100%) заражения клеток. Его существенным недостатком является возможность активизации клеточного онкогена при интеграции ретровируса, что может привести к злокачественной трансформации.
Наиболее близким по технической сущности и достигаемому результату является способ, взятый в качестве прототипа, сущность которого заключается в том, что ДНК механически вводят в ядра культивируемых клеток путем прокалывания клеток. Непосредственно перед трансфекцией на клетки наслаивают буфер PBS, содержащий экзогенную ДНК в концентрации 5-1000 мкг/мл. Все клетки прокалывают по возможности один раз в области ядра стеклянной микроиглой, пока кончик иглы не коснется подложки. Сразу после прокалывания среду (ДНК в буфере PBS) меняют на нормальную ростовую среду (Спандидос Д. Уюки Н. Эксспрессия экзогенной ДНК в клетках млекопитающих. В кн. Транскрибция и трансляция. Методы. М. Мир, 1987, с. 48).
Этот способ обеспечивает сравнительно высокую эффективность введения ДНК в клетки млекопитающих. Однако он требует наличия дорогой и часто недоступной микроманипуляционной техники, очень трудоемок и требует хороших навыков исследователя в области "прокалывания". Даже опытный специалист может проколоть за 1 ч не более 100 клеток.
Цель изобретения создание простого, не требующего дорогого специального оборудования (микроскопов, микроманипуляторов и т.д.), быстрого способа получения клеток с трансформированным фенотипом, обладающего достаточно высокой эффективностью.
Поставленная цель достигается тем, что предложен способ, согласно которому клетки млекопитающих, культивируемые in vitro, придавливают покровным стеклом перпендикулярно поверхности монослоя в PBS-буфере, содержащем экзогенную ДНК в концентрации 10-40 мкг/мл, стекло убирают, а клетки инкубируют (в буфере с донорной ДНК) в течение 40-60 мин при 37oC.
Пример. Для введения трансгена, т.е. экзогенной ДНК плазмид, в клетки, культивируемые in vitro, использовали ДНК плазмид: pCMV-lacZ, содержащую ген lacZ; pSV-neo; ДНК спермы лосося (Sigma). В опыте использовали клетки почки эмбриона свиньи (СПЭВ); клетки трахеи эмбриона коров (FBT) и клетки эмбриональных фибробластов мыши (ЗТЗ Bald/C).
За день перед трансфекцией клетки рассеивают в чашки Петри с d=3,5 см в концентрации 105 см2 и инкубируют при 37oC в течение ночи. Непосредственно перед трансфекцией клетки промывают 2-3 раза буфером PBS pH 7,2. Переосаждают двухкратно в 70o этаноле при 5 тыс. оборотов в течение 15 мин донорную ДНК и растворяют в буфере (0,1 мМ ЭДТА, 1 мМ трис-HCl, pH 8,0) а затем добавляют к клеткам, находящимся в PBS, до конечной концентрации ДНК 10-40 мкг/мл. Клетки в растворе с донорной ДНК накрывают стерильным покровным стеклом и придавливают перпендикулярно поверхности монослоя равномерными, круговыми движениями. Затем покровное стекло удаляют, а клетки инкубируют при 37oC с 5%-ным CO2 в этом же растворе в течение 40-60 мин. После клетки тщательно промывают буфером PBS 3 раза и среду меняют на нормальную ростовую среду.
Температура 37oC и наличие CO2 является одним из основных общепринятых условий, необходимых для культивирования клеток in vitro.
Временная экспрессия гена lacZ, связанная с выявлением β-gal активности в трансформированных клетках, была обнаружена на второй день после проведения трансфекции.
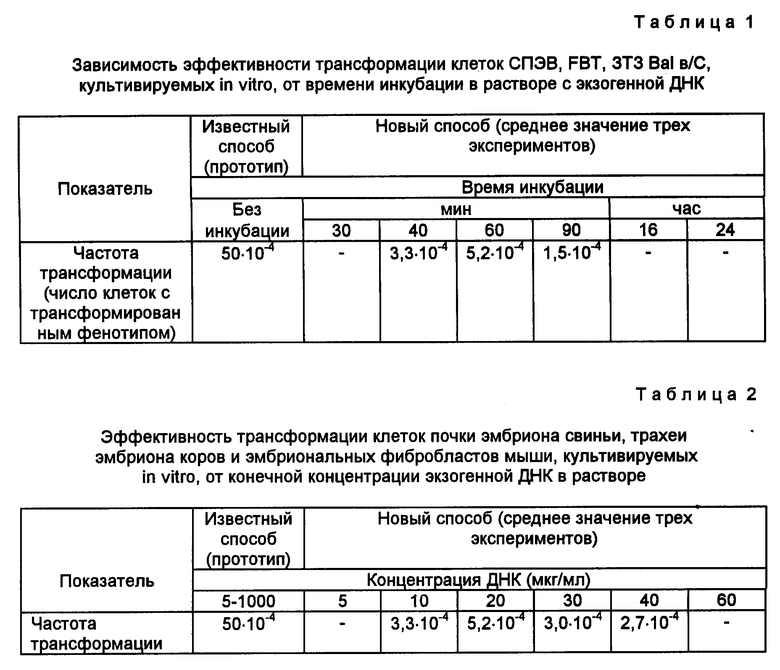
Установлено, что оптимальное время инкубирования культивируемых клеток в растворе экзогенной ДНК, при котором наблюдается экспрессия трансгена, составило от 40 до 60 мин (табл. 1). Ниже этого значения экспрессия трансгена не наблюдалась, при более длительной инкубации клеток в растворе с ДНК наблюдалась гибель клеток.
Результаты опытов показали также, что оптимальный уровень концентрации экзогенной (донорной) ДНК в буфере PBS составил 10-40 мкг/мл (табл. 2). При величине этого показателя ниже и выше отмеченного уровня экспрессия трансгена не была установлена.
Частота трансформации, т. е. число трансформантов на использованное в опыте количество клеток, составила 2,7 • 10-4-5,2 • 10-4 клеток. Эффективность трансформации, выраженная числом трансформантов в расчете на 1 мкг/мл плазмидной ДНК, составляла 1,3 • 10-4-2,8 • 10-4.
Изобретение применимо в генно-инженерных лабораториях для быстрого анализа и характеристики клонированных генов. Это удобный способ для изучения генетических элементов (промоторов, энхансеров), участвующих в регуляции экспрессии гена, в научных исследованиях, направленных на изучение экспрессии трансгена (в частности тканеспецифичности). Изобретение может быть использовано для получения генетически трансформированных клеток млекопитающих, в том числе сельскохозяйственных животных в культуре, продуцирующих биологически активные белки, используемые в народном хозяйстве, медицине, ветеринарии.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ТРАНСФОРМАЦИИ СТВОЛОВЫХ КЛЕТОК СЕМЕННИКОВ ЖИВОТНЫХ IN VIVO | 2005 |
|
RU2290442C2 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК рКЕР-9, КОДИРУЮЩАЯ ЭРИТРОПОЭТИН ЧЕЛОВЕКА, ШТАММ КУЛЬТИВИРУЕМЫХ КЛЕТОК ЯИЧНИКА КИТАЙСКОГО ХОМЯЧКА СНОрЕ-9 - ПРОДУЦЕНТ ЭРИТРОПОЭТИНА ЧЕЛОВЕКА | 1997 |
|
RU2118662C1 |
| СПОСОБ СОЗДАНИЯ ТРАНСГЕННЫХ ЛИНИЙ КЛЕТОК МЛЕКОПИТАЮЩЕГО СО СТАБИЛЬНЫМ И ВЫСОКИМ УРОВНЕМ ЭКСПРЕССИИ ТРАНСГЕННОГО БЕЛКА | 2009 |
|
RU2425882C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТРАНСГЕННЫХ МЫШЕЙ | 2009 |
|
RU2425880C2 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК РС VА ДЛЯ ЭКСПРЕССИИ РИБОЗИМА В ЭУКАРИОТИЧЕСКОЙ КЛЕТКЕ | 1995 |
|
RU2097429C1 |
| МОЛЕКУЛЯРНЫЕ КОНЪЮГАТЫ С ПОЛИКАТИОННЫМ УЧАСТКОМ И ЛИГАНДОМ ДЛЯ ДОСТАВКИ В КЛЕТКУ И ЯДРО КЛЕТКИ ДНК И РНК | 2009 |
|
RU2537262C2 |
| ОСНОВА МИКРОИНЪЕКЦИОННОГО БУФЕРА ДЛЯ ПОЛУЧЕНИЯ ТРАНСГЕННЫХ ЖИВОТНЫХ | 1999 |
|
RU2160569C1 |
| СПОСОБ ОСУЩЕСТВЛЕНИЯ ЭКСПРЕССИИ | 1994 |
|
RU2126045C1 |
| Способ трансфекции и культивирования клеток, синтезирующих рекомбинантный белок глутаматдекарбоксилазу | 2019 |
|
RU2746162C2 |
| ПЕПТИДНЫЙ ВЕКТОР, СПОСОБ ЕГО ПОЛУЧЕНИЯ, НУКЛЕОТИДНАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ, РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК И ШТАММ ESCHERICHIA COLI B-8389 ВКПМ ДЛЯ ЕГО ПОЛУЧЕНИЯ, СПОСОБ ГЕНЕТИЧЕСКОЙ МОДИФИКАЦИИ КЛЕТОК МЛЕКОПИТАЮЩИХ И ЧЕЛОВЕКА | 2003 |
|
RU2248983C1 |
Изобретение относится к биотехнологии, в частности к генетической инженерии. Сущность изобретения: создан простой, не требующий дорогого оборудования (микроскопов, микроманипуляторов и т.д.) быстрый способ получения клеток с трансформированным фенотипом, обладающий достаточно высокой эффективностью. Клетки млекопитающих, культивируемые in vitro, придавливают покровным стеклом перпендикулярно поверхности монослоя в PBS-буфере, содержащем экзогенную ДНК в концентрации 10-40 мкг/мл, стекло удаляют, а клетки инкубируют в этом же растворе в течение 40-60 мин при 37oC. Изобретение применимо в генно-инженерных лабораториях для быстрого анализа и характеристики клонированных генов. Это удобный способ для изучения генетических элементов (промоторов, энхансеров), участвующих в регуляции экспрессии гена, в научных исследованиях, направленных на изучение экспрессии трансгена (в частности тканеспецифичности). Изобретение может быть использовано для получения генетически трансформированных клеток млекопитающих, в том числе сельскохозяйственных животных в культуре, продуцирующих биологически активные белки, используемые в народном хозяйстве, медицине, ветеринарии. 2 табл.
Способ введения экзогенной ДНК плазмид в клетки млекопитающих, культивируемые in vitro, включающий механическую обработку клеток, содержащихся в PBS буфере, с ДНК, отличающийся тем, что механическую обработку клеток осуществляют придавливанием клеток покровным стеклом перпендикулярно поверхности монослоя в буфере, содержащем экзогенную ДНК в концентрации 10 - 40 мкг/мл, затем стекло удаляют, а клетки инкубируют в том же растворе в течение 40 60 мин при 370oC.
| Спандидос Д., Уюки Н | |||
| Экспрессия экзогенной ДНК в клетках млекопитающих | |||
| В кн | |||
| Транскрипция и трансляция | |||
| Методы | |||
| - М.: Мир, 1987, с.48. |
Авторы
Даты
1997-10-27—Публикация
1993-07-26—Подача