Изобретение относится к химии фосфорорганических соединений, а именно к способу получения фосфористой кислоты, которая может найти применение в производстве фосфорсодержащих комплексонов, солей фосфористой кислоты, восстановителей, стабилизаторов полимеров, биологически активных соединений.
Известны способы получения фосфористой кислоты гидролизом трихлорида фосфора в различных условиях (авт. свид. СССР 470491, кл. C 01 B 25/16, опубл. 27.08.75; пат. ФРГ 2200653, кл. 12 i 25/16 (C 01 b 25/16), опубл. 19.07.73), обработкой серной кислотой фосфита кальция - побочного продукта производства гипофосфита кальция (авт. свид. СССР 227310, кл. 12 i 25/16 (C 01 b), опубл. 4.02.69. В работах: Журнал прикладной химии, т. 40(2), 1967, с. 274-284; Журнал прикладной химии, т. 36(5), 1963, с. 953-963; Журнал прикладной химии, т. 36(9), 1969, с. 1873-1882; Журнал прикладной химии, т. 40(8), 1967, с. 1660, посвященных взаимодействию элементного фосфора с гидроксидами металлов, фосфит не является основным продуктом, а выступая в качестве примеси, составляет 17-20% от элементного фосфора, кроме того реакции сопровождаются выделением ядовитого фосфина. Американской компанией "Монсанто" разработан способ электролитического получения фосфористой кислоты из белого фосфора (пат. США 4021321, кл. 204-103 (C 25 B 1/22), опубл. 3.05.77).
Недостатками вышеописанных способов является то, что образующаяся в процессе фосфористая кислота загрязнена примесями фосфорной кислоты и хлора и требует дополнительной очистки, а образующаяся при гидролизе в качестве побочного продукта соляная кислота обладает коррозионной активностью, либо фосфористая кислота загрязнена примесями галогенов, органических соединений и фосфатов, либо метод требует значительной затраты электроэнергии.
Перечисленные работы являются аналогами настоящего изобретения. Прототипом к заявляемому способу является авт.свид. N 227310, кл. 12 i 25/16 (C 01 b), опубл. 4.02.69 со всеми недостатками, перечисленными выше.
Задачей изобретения является расширение ассортимента известных способов получения фосфористой кислоты путем создания нового экологически безопасного, т.к. не происходит образование ядовитого фосфина, метода получения фосфористой кислоты высокой степени чистоты исходя из простых и доступных реагентов (P4, (СH3)3N, окись этилена, Me(OH)2, H2O) с хорошим выходом (80-89%).
Поставленная задача получения фосфористой кислоты решается путем взаимодействия элементного фосфора с триметиламином, окисью этилена с гидроксидами бария или кальция и водой, либо взаимодействием элементного фосфора, гидроксида β-оксиэтилтриметиламмония с гидроксидами бария или кальция и водой при 50-100oC до полной конверсии фосфора. С последующей обработкой образующегося фосфита избытком серной кислоты и выделением фосфористой кислоты высокой степени чистоты известными приемами.
Строение фосфористой кислоты доказано на основании ЯМР31 P-спектроскопии. В спектрах ЯМР31 P наблюдается сигнал δ 3.2 м.д., Jр-н 675 Гц.
Предлагаемый нами способ экологически безопасен, так как не происходит образование ядовитого фосфина и в случае применения гидроксида бария безотходен за счет рецикла образующегося в процессе реакции гидроксида β-оксиэтилтриметиламмония. При этом получается фосфористая кислота высокой степени чистоты и дополнительной очистки не требует, что делает способ экономичным.
Способ заключается во взаимодействии:
1) элементного фосфора, триметиламина, окиси этилена, Ba(OH)2 (технический) и воды, взятых в мольном соотношении 1:5-25:5-20:5,5-6:20-30 соответственно, при нагревании в интервале 50 - 100oC до полной конверсии фосфора. Далее образовавшийся фосфит бария разлагают избытком 11-12% серной кислоты. Полученный раствор фосфористой кислоты очищают от следов сульфат-ионов и упаривают до требуемой концентрации;
2) элементного фосфора, гидроксида β- оксиэтилтриметиламмония (холин), Ba(OH)2 (технический) и воды в мольном соотношении 1:5-15:5,5-6:20-30 соответственно при нагревании в интервале 50 - 100oC до полной конверсии фосфора. Далее образовавшийся фосфит бария разлагают избытком 11-12% серной кислоты. Полученный раствор фосфористой кислоты очищают от следов сульфат-ионов и упаривают до требуемой концентрации;
3) элементного фосфора, триметиламина, окиси этилена, Ca(OH)2 и воды, взятых в мольном соотношении 1:5-25:5-20:6,5-7:20-30 соответственно, при нагревании в интервале 50-100oC до полной конверсии фосфора. Далее образовавшийся фосфит кальция разлагают избытком 11-12% серной кислоты. Полученный раствор фосфористой кислоты очищают от следов сульфат-ионов и упаривают до требуемой концентрации.
4) элементного фосфора, гидроксида β- оксиэтилтриметиламмония (холин), Ca(OH)2 и воды в мольном соотношении 1:5-15:6,5-7: 20-30 соответственно при нагревании в интервале 50 - 100oC до полной конверсии фосфора. Далее образовавшийся фосфит кальция разлагают избытком 11-12% серной кислоты. Полученный раствор фосфористой кислоты очищают от следов сульфат-ионов и упаривают до требуемой концентрации.
В ходе эксперимента нами установлены оптимальные соотношения реагентов: элементный фосфор: триметиламин: окись этилена: вода: Me(OH)2 = 1:(5-25): (5-20):(20-30):(5,5-7);
элементный фосфор: гидроксид β-оксиэтилтриметиламмония (холин): вода: Me(OH)2 = 1:(5-15):(20-30):(5,5-7).
При уменьшении количества окиси этилена, триметиламина и гидроксида β-оксиэтилтриметиламмония (холина) менее 5 моль и воды менее 20 молей остается непрореагировавший фосфор и увеличивается доля примесей - фосфатов. Применение амина более 25 моль, оксида этилена более 20 молей и воды более 30 моль приводит к необходимости их удаления. Указанные количества (5,5-7) Me(OH)2 достаточны для получения данного продукта с наибольшим выходом.
При температуре ниже 50oC снижается скорость реакции, а верхний предел - 100oC вполне достаточен для достижения полной конверсии фосфора.
Получение фосфита, а из него фосфористой кислоты на основе элементного фосфора, окиси этилена, амина, воды и гидроксидов бария или кальция, или на основе элементного фосфора, холина, воды и гидроксидов бария или кальция - в литературе неизвестно, поэтому данное изобретение является новым.
Нельзя было из известного уровня знаний с очевидностью допустить возможность получения фосфита (а из него фосфористой кислоты), что свидетельствует о соответствии изобретения критерию изобретательский уровень.
Данное изобретение является экологически безопасным, безотходным (в случае использования гидроксида бария) методом получения фосфористой кислоты, пригодным для промышленной технологии, которая может найти применение в производстве фосфорсодержащих комплексонов, восстановителей, стабилизаторов полимеров, биологически активных полимеров.
Следующие примеры иллюстрируют изобретение.
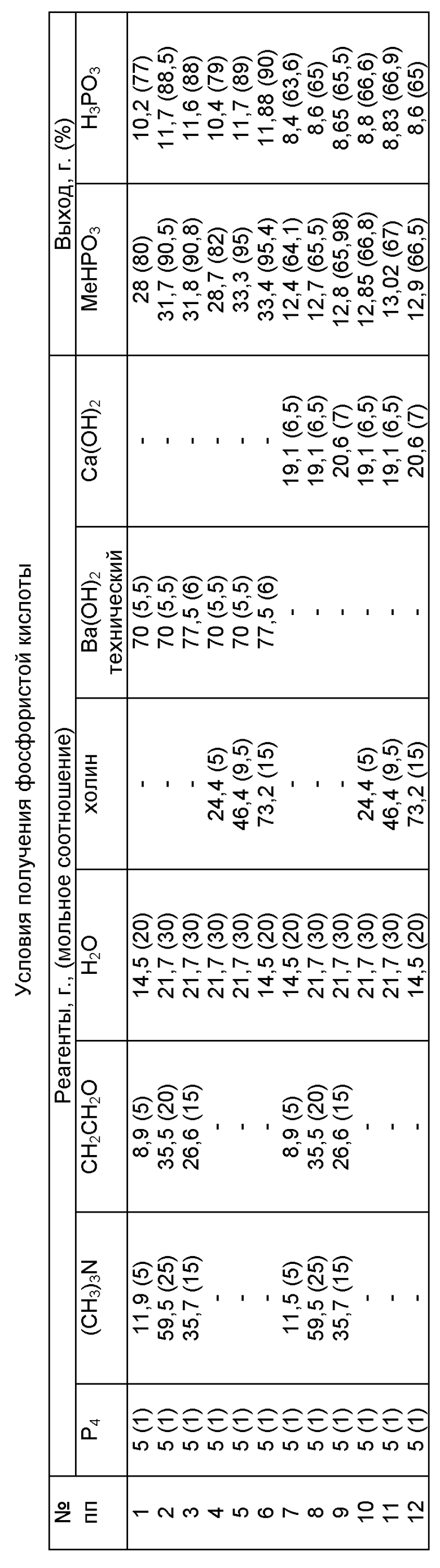
Пример 1. Берут элементный белый (желтый) фосфор (P4) в количестве 5 г, триметиламин (CH3)3N в количестве 11,9 г, окись этилена в количестве 8,9 г, воду в количестве 14,5 г. Гидроксид бария Ba(OH)2 (технический) в количестве 70 г добавляется при температуре расплава фосфора (40-45oС), мольное соотношение реагентов 1:5:5:5,5:20 соответственно. Взаимодействие указанных реагентов ведут при перемешивании при 50 - 100oC до полной конверсии фосфора. Образовавшийся осадок фосфита бария BaHPO3 (δ31 P 1,7 м.д.; Jр-н 609 Гц) отделяют и промывают водой. Выход фосфита бария 28 г (80%). Маточный раствор, содержащий гидроксид β-оксиэтилтриметиламмония (холин), может быть повторно использован в синтезе. Выделенный осадок фосфита бария при энергичном перемешивании присыпают в 11 - 12% раствор серной кислоты. Последнюю берут в избытке (1,2-1,3 от стехиометрического количества). Сульфат бария отфильтровывают, промывают водой и выводят из реакции. Полученный 6-7% раствор фосфористой кислоты очищают от следов сульфат-ионов гидроксидом бария. Очищенный раствор фосфористой кислоты упаривают до требуемой концентрации. Выход фосфористой кислоты (δ31 P 3,2 м.д.; Jр-н 675 Гц) составляет 10,2 г (77% от взятого фосфора).
Аналогично в условиях примера 1 проводят реакции по примерам 2, 3 (см. таблицу).
Пример 4. Берут элементный белый (желтый) фосфор (P4) в количестве 5 г, гидроксид β-оксиэтилтриметиламмония (холин) в количестве 24,4 г, воды в количестве 21,7 г, гидроксида окиси бария Ba(OH)2 (технический) - 70 г, мольное соотношение реагентов 1: 5: 30:5,5 соответственно. Взаимодействие указанных реагентов ведут при перемешивании при температуре 50 - 100oC до полной конверсии фосфора. Образовавшийся осадок фосфита бария отделяют и промывают водой. Выход фосфита бария 28,7 г (82%). Маточный раствор, содержащий гидроксид β-оксиэтилтриметиламмония (холин), может быть повторно использован в синтезе. Выделенный осадок фосфита бария присыпают при энергичном перемешивании в 11-12% раствор серной кислоты. Последнюю берут в избытке (1,2-1,3 от стехиометрического количества). Сульфат бария отфильтровывают, промывают водой и выводят из реакции. Полученный 6-7% раствор фосфористой кислоты очищают от следов сульфат-ионов гидроксидом бария. Очищенный раствор фосфористой кислоты упаривают до требуемой концентрации. Выход фосфористой кислоты 10,4 г (79% от взятого фосфора).
Аналогично в условиях примера 4 проводят реакции по примерам 5, 6 (см. таблицу).
Пример 7. Берут элементный белый (желтый) фосфор (P4) в количестве 5 г, триметиламин в количестве 11,9 г, окись этилена в количестве 8,9 г, воду в количестве 14,5 г, затем добавляют гидроксид кальция в количестве 19,1 г. Мольное соотношение реагентов 1:5:5:30:6,5 соответственно. Реакцию ведут в сильнощелочной среде при 50 - 100oC до полной конверсии фосфора. Образовавшийся осадок фосфита кальция CaHPO3 (δ31 P 1,6 м.д.; Jр-н 623 Гц) отделяют и промывают водой. Выход фосфита кальция 12,4 г, (64,1% от взятого фосфора). Отмытый осадок фосфита кальция разлагают 11-12% раствором серной кислоты, которую берут в избытке (1,2-1,3 от стехиометрического). Сульфат кальция промывают водой, отфильтровывают и выводят из реакции. Полученный 5-6% раствор фосфористой кислоты очищают от следов сульфат-ионов гидроксидом кальция, очищенный раствор упаривают до нужной концентрации. Выход фосфористой кислоты 8,5 г (64,5% от взятого фосфора). Аналогично в условиях примера 7 проводят реакции по примерам 8, 9 (см. таблицу).
Пример 10. Берут элементный белый фосфор в количестве 5 г, гидроксид β-оксиэтилтриметиламмония (холин) в количестве 24,4 г, воду в количестве 21,7 г, добавляют гидроксид кальция в количестве 19,1 г. Мольное соотношение реагентов 1: 5:30:6,5. Реакцию ведут в сильнощелочной среде при температуре 50 - 100oC до полной конверсии фосфоpa. Образовавшийся фосфит кальция отделяют, промывают водой. Выход фосфита кальция 12,6 г (65,8%). Отмытый фосфит кальция разлагают 11-12% раствором серной кислоты, которую берут в избытке (1,2-1,25 от стехиометрического). Сульфат кальция промывают водой, отфильтровывают и выводят из реакции. Полученный 5-6% раствор фосфористой кислоты очищают от следов сульфат-ионов гидроксидом кальция, затем упаривают до нужной концентрации. Выход фосфористой кислоты 8,9 г (68% от взятого фосфора). Аналогично в условиях примера 10 проводят реакции по примерам 11, 12 (см. таблицу).
Таким образом, предлагаемый способ позволяет расширить арсенал имеющихся способов и дает возможность получить фосфористую кислоту на основе чистых продуктов.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ФОСФОРИСТОЙ КИСЛОТЫ ИЗ БЕЛОГО ФОСФОРА | 2011 |
|
RU2460687C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭФИРОВ КИСЛОТ ФОСФОРА | 2001 |
|
RU2199545C1 |
| НОВЫЙ НИКЕЛЬОРГАНИЧЕСКИЙ СИГМА-КОМПЛЕКС-ПРЕКАТАЛИЗАТОР ОЛИГОМЕРИЗАЦИИ ЭТИЛЕНА | 2009 |
|
RU2400488C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГИПОФОСФИТА НАТРИЯ | 1989 |
|
SU1616036A1 |
| СПОСОБ ПОЛУЧЕНИЯ АМИННЫХ СОЛЕЙ ДИЭФИРОВ ДИТИОФОСФОРНЫХ КИСЛОТ | 1998 |
|
RU2136690C1 |
| СПОСОБ ВЫДЕЛЕНИЯ НИЗКОМОЛЕКУЛЯРНЫХ АЛИФАТИЧЕСКИХ КИСЛОТ ИЗ ВОДНЫХ РАСТВОРОВ, СОДЕРЖАЩИХ МУРАВЬИНУЮ КИСЛОТУ | 2001 |
|
RU2197471C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЙМАЛИНА | 2000 |
|
RU2174555C1 |
| КИСЛОТНЫЙ ФОСФОРСОДЕРЖАЩИЙ КОМПЛЕКСООБРАЗУЮЩИЙ РЕАГЕНТ И СПОСОБ ЕГО ПОЛУЧЕНИЯ (ВАРИАНТЫ) | 2007 |
|
RU2331651C1 |
| МЕЛАМИНОВАЯ СОЛЬ БИС(ОКСИМЕТИЛ)ФОСФИНОВОЙ КИСЛОТЫ(МЕЛАФЕН) В КАЧЕСТВЕ РЕГУЛЯТОРА РОСТА И РАЗВИТИЯ РАСТЕНИЙ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1999 |
|
RU2158735C1 |
| СПОСОБ РАЗДЕЛЕНИЯ НА ЭНАНТИОМЕРЫ РАЦЕМИЧЕСКИХ 3-(2-МЕТОКСИФЕНОКСИ)-1,2-ПРОПАНДИОЛА И 3-(2-МЕТИЛФЕНОКСИ)-1,2-ПРОПАНДИОЛА | 2002 |
|
RU2213724C1 |
Изобретение относится к способу получения фосфористой кислоты, которая находит применение в производстве фосфорсодержащих комплексонов, солей фосфористой кислоты, восстановителей, стабилизаторов полимеров, биологически активных полимеров. Сущность способа заключается во взаимодействии элементного фосфора (белый, желтый), триметиламина, окиси этилена с гидроксидами бария или кальция и водой, либо взаимодействием элементного фосфора, гидроксида β-оксиэтилтриметиламмония с гидроксидами бария или кальция и водой при температуре 50-100oС и молярном соотношении реагентов: элементный фосфор : триметиламин : окись этилена : вода : Ме(ОН)2 = 1:(5-25):(5-20): (20-30):(5,5-7); или элементный фосфор : гидроксид β-оксиэтилтриметиламмония (холин) : вода : Ме(ОН)2 = 1:(5-15):(20-30):(5,5-7) с последующей обработкой образовавшегося фосфита кальция или бария разбавленной серной кислотой, взятой с избытком, и выделением фосфористой кислоты. Данное изобретение позволяет расширить ассортимент известных способов получения фосфористой кислоты путем создания нового экологически безопасного (не происходит образование ядовитого фосфина) метода получения фосфористой кислоты высокой степени чистоты, исходя из простых и доступных реагентов с хорошим выходом (80-90%). 4 с. и 2 з.п. ф-лы, 1 табл.
| SU 227310 А, 25.09.1968 | |||
| СПОСОБ ПОЛУЧЕНИЯ ГИПОФОСФИТА НАТРИЯ | 1989 |
|
SU1616036A1 |
| СПОСОБ ПОЛУЧЕНИЯ ГИПОФОСФИТА НАТРИЯ | 1989 |
|
SU1616037A1 |
| Химический энциклопедический словарь | |||
| - М.: Советская энциклопедия, 1983, с.630 | |||
| US 3458281 А, 29.07.1969 | |||
| СПОСОБ ПОЛУЧЕНИЯ ФОСФИТА НАТРИЯ | 1996 |
|
RU2105712C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФОСФОРИСТОЙ КИСЛОТЫ | 1991 |
|
RU2022918C1 |
| ШЛИФОВАЛЬНЫЙ КРУГ | 2001 |
|
RU2200653C2 |
| DE 4025937 А1, 20.02.1992 | |||
| Регулируемый преобразователь переменного напряжения в переменное | 1984 |
|
SU1264275A1 |
Авторы
Даты
2002-02-10—Публикация
2000-01-31—Подача