Изобретение относится к способу получения смеси сульфатированных эстрогенов, более точно - к сульфатированию смеси, содержащей 3-гидрокси-эстра-1; 3; 5(10), 8(9)-тетра-ен-17-он [дельта-(8,9)-дегидроэстрон; дельта-(8,9)-ДГЭ; дельта-8-эстрон; 8,9-дегидроэстрон; CAS 616 12-83-7].
Натрий сульфат дельта-(8,9) производного эстрона [дельта-(8,9)ДГЭС] в небольших количествах (примерно 3-4%) присутствует в натуральных композициях сопряженных (конъюгированных) эстрогенов, например, в коммерчески доступном продукте Premarin®, который используется в заместительной гормональной терапии.
Помимо эстрон-натрий-сульфата в натуральных композициях сопряженных эстрогенов было идентифицированно несколько компонентов, а именно натрий сульфат эквилина (в количествах 22,5-30,5%), 17-альфа-дигидроэквилин (13,3-19,5%), 17-бэта-дигидроэквилин (0,5-4,0%), 17-альфа-эстрадиол (2,5-9,5%), 17-бэта-эстрадиол (<4,5%) и дельта-(8,9)-дегидроэстрон (<12,5%) (US Pharmacopeia, 1995, р.627).
В публикации SCRIP 2049 (1995) р.15 было высказано предположение, что минимальные количества дельта-(8,9)-ДГЭС могут вносить значительный вклад в действие сопряженных эстрогенов. Дополнительно было высказано предположение, что дельта-(8,9)-ДГЭС, который обладает относительно низким сродством к рецептору эстрогена, обладает высокой функциональной активностью, которая может играть роль в описанных свойствах, снижении содержания LDL-холестерина, в действии сопряженных эстрогенов на сердечно-сосудистую деятельность, в частности препарата Premarin®. Данные показывают, что дельта-(8,9)-ДГЭС обеспечивает приблизительно до 18% циркулирующих эстрогенов препарата Premarin. Следовательно, очень важно разработать легкий способ получения сульфатированных смесей дельта-(8,9)-ДГЭ.
Помимо громоздкого общего синтеза в публикации - J.С. Jacquesy et al, (Chem. Abstr. 76 (1972), 154000f) описана изомеризация эквилина в среде с избыточной кислотностью. Химическое превращение в дельта-(8,9)-ДГЭ было осуществлено с применением фтористого водорода или фтористого водорода/фторида сурьмы при - 30oС. Очевидно, что такие опасные условия реакции являются абсолютно неподходящими и неприемлемы для получения дельта-(8,9)-ДГЭ в большом количестве. Кроме того, в патенте США 5395831, где применяется разработанный Jacquesy способ, показано, что указанный способ с применением фтористого водорода не обеспечивает получения чистого дельта-(8,9)-ДГЭ, но приводит, кроме того, к получению 10% нежелательного дельта-(9,11)-изомера. Таким образом, способы получения через изомеризацию эквилина или без нее, которые являлись бы коммерчески приемлемыми, описаны не были.
Синтез сульфатированных сложных эфиров стероидов описан в литературе. В соответствии с выводом, сделанным авторами - Jenkins и Sandberg (Methods in Enzymology, 15, 351-358, 1969), один из способов включает сульфатирование моно- и дигидрокси С-18 и С-19 стероидных соединений с использованием комплексов пиридина с серной кислотой. Этот способ, однако, был применен к индивидуальным, то есть не содержащим других, стероидным соединениям. Способ в соответствии с данным изобретением обладает тем преимуществом, что в одной реакционной смеси сульфатированные эстрогены могут быть получены в конкретном соотношении. Неожиданно было установлено, что хотя эстрогены, присутствующие в натуральных препаратах сопряженных эстрогенов обладают различными физическими свойствами, такими как поведение при кристаллизации и растворимость, соотношение сульфатированных продуктов в реакционной смеси отражает количества введенных компонентов. Следовательно, одной реакционной емкости достаточно для получения смеси сульфатированных эстрогенов. Кроме того, эта реакция, когда это удобно, может быть непосредственно соединена с реакцией изомеризации, посредством которой получают дельта-(8,9)-ДГЭ, т.е. изомеризацией эквилина или его производного в указанное производное. В этой реакции эквилин или его производное обрабатывают литиевой солью этилендиамина или амидом лития в диметилсульфоксиде.
Таким образом, данное изобретение предлагает первый простой и недорогой способ получения смеси сульфатированных стероидов, содержащей дельта-(8,9)-ДГЭ, через сульфатацию смеси эстрогенов, содержащей дельта-(8,9)-ДГЭ или его производных, которые могут быть получены посредством изомеризации эквилина или его производного.
Соответственно, смеси эстрогенов, содержащие соединение, соответствующее общей формуле I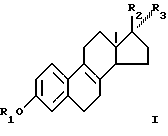
где R1 представляет собой Н,
R2 представляет собой Н и R3 - O-ацил; или
R3 представляет собой Н и R2 - O-ацил; или
R2 и R3 вместе представляют собой О могут быть сульфатированы в смеси с одним или большим количеством соединений, выбранных из группы, включающей соединения общей формулы II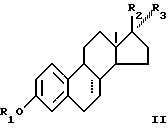
где R1, R2 и R3 имеют определенные выше значения и пунктирная линия в положении 7-8 представляет необязательную двойную связь.
В предпочтительном воплощении изобретения R2 и R3 в формуле I и/или II представляют собой О. Более предпочтительно, дельта-8,9-эстрон сульфатируют в смеси с эквилином.
В соответствии с другим воплощением изобретения соединения общей формулы II представляют собой один или большее количество предшественников компонентов, представленных в натуральных смесях сопряженных эстрогенов в небольших количествах, таких как сложные сульфатированные эфиры 17-альфа-дигидроэквилина, 17-бэта-дигидроэквилина, 17-альфа-эстрадиола и 17-бэта-эстрадиола.
Соотношение соединений в реакционной смеси не является определяющим фактором, но по экономическим причинам предпочтительным соотношением является соотношение, которое представлено в натуральных смесях.
Соединения общей формулы I могут быть получены изомеризацией эквилина и указанных производных, которые представлены формулой III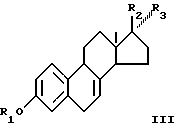
где R1 - силил(алкил)3 или тетрагидропиранил, R2 и R3 вместе представляют собой О; или R2 и R3 вместе представляют собой ацеталь или циклический ацеталь.
Термин алкил, который используется в определениях формул, означает разветвленную или неразветвленную алкильную группу, содержащую предпочтительно 1-7 атомов углерода, такую как гексил, изобутил, третичный бутил, пропил, изопропил, этил или метил. Предпочтительно, силил(алхил)3 представляет собой Si(Me)2 трет-бутил. Термин ацил означает ацильную группу, полученную из алкилкарбоновой кислоты, причем алкильный фрагмент принимает перечисленные выше значения, или группу, полученную из муравьиной кислоты. Ацетали получают из спиртов, содержащих предпочтительно 1-6 атомов углерода.
Термину тетрагидропиранил также эквиваленты смешенные ацетали или смешенные полутиоацетали, которые означают такие группы, как, например, этоксиэтил, метоксиэтил (MOM), нетилметоксиэтил, метоксиэтоксиметил (MEM), тетрагидрофуранил, метилтиометил, тетрагидротиопиранил, тетрагидротиофуранил или простые эфиры, такие как метиловый или трет-бутиловый, как описано в публикации Greene Th., Wuts P., Protective Groups in Organic Synthesis, chapter 2, p.14-87.
Изомеризация может быть выполнена с использованием литиевых солей этилендиамина. Этот способ приводит к получению очень чистого дельта-(8,9)-ДГЭ. Такие литиевые соли могут быть получены обработкой этилендиамина литием или алкиллитием, предпочтительно метиллитием. Могут добавляться сорастворители, подобные тетрагидрофурану, диметилсульфоксиду и т.п. Обычно смеси производных дельта-(8,9)-ДГЭ и эквилина получают при добавлении совместных растворителей. Амид лития в диметилсульфоксиде (ДМСО) также обеспечивает получение смесей дельта-(8,9)-ДГЭ и эквилина или его производных, которые могут быть превращены в соответствии с данным изобретением в их натрий сульфаты для применения при производстве фармацевтических композиций, содержащих сопряженные эстрогены.
Предпочтительно С3 положение занимается эфиром тетрагидропиранила, поскольку такой эфир может быть легко получен на ароматической группе, стабилен в условиях изомеризации и после изомеризации может легко удаляться с получением гидроксильной группы для сульфатирования.
Если R1 в формуле III представляет собой силил (алкил)3, изомеризацию предпочтительно проводят при температуре в интервале приблизительно от 0 до 90oС, более предпочтительно при приблизительно 30oС, если эквилин или его производное обрабатывают литиевой солью этилендиамина, или при приблизительно 65oС, если эквилин или его производное обрабатывают амидом лития в диметилсульфоксиде. С другой стороны, если R1 представляет собой тетрагидропиранил, смесь субстрата и упомянутого выше растворителя обрабатывают литиевой солью этилендиамина при температуре в интервале примерно от - 78oС до 50oС, предпочтительно в интервале приблизительно от 0oС до - 20oС с использованием THF в качестве сорастворителя.
Если реакцию изомеризации проводят только частично, образуется смесь соединений общей формулы III и дельта-8,9- производных, которые могут быть подвергнуты дополнительной обработке для получения смесей сульфатированных сопряженных эстрогенов. Необязательно могут быть также добавлены производные общей формулы II и все соединения могут быть одновременно сульфатированы в одной реакции. Предпочтительно соединения, которые подлежат изомеризации и сульфатированию в соответствии с данным изобретением, представляют собой соединения, в которых R2 и R3 в формулах вместе представляют собой О.
Если в соединении формулы III R1 представляет собой силил (алкил)3 или тетрагидропиранил, производные могут быть изомеризованы и последовательно гидролизованы с получением соединений, соответствующих формуле I, или смеси соединений, соответствующих формуле I или III, где R1 представляет собой Н, посредством обработки мягкой кислотой, такой как разбавленная (≤0,2 н) соляная кислота, 50% уксусная кислота, с сорастворителями, подобными тетрагидрофурану, ацетону, метиленхлориду, этанолу, или обработкой производными в нейтральной среде, такими как триметилсилил йодид/триметилсилил бромид в метиленхлориде; метил йодид в ацетоне, Н2О, NAHCO3; п-толуолсульфонат, пиридиния, трет-бутанол; тетрабутиламмонийфторид в метиленхлориде; АgNО3 в ацетоне, как описано в публикации Greene Th., Wuts P., Protective Groups in Organic Synthesis, chapter 2, p. 14-87.
Полученная таким образом смесь производных эстрогена может быть сульфатирована в соответствии с данным изобретением в смеси с одним или более моноацилпроизводным соединений, выбранных из группы, включающей: 17-альфа-дигидроэквилин, 17-бэта-дигидроэквилин, 17-альфа-эстрадиол и 17-бэта-эстрадиол.
Приведенные далее примеры являются иллюстративными для изобретения и не должны рассматриваться как ограничивающие объем данного изобретения.
Пример 1. Литий (13 г) порциями добавляют к 920 мл этилендиамина в атмосфере азота при 95oС и смесь перемешивают в течение 30 мин при 100oС. Реакционную смесь охлаждают при 23oС, после чего 100 г эквилина добавляют при температуре ≤30oС. Смесь перемешивают еще 2 ч при 30oС. Суспензию выливают в 2,5 л ледяной воды и при температуре ≤25oС, добавляют уксусную кислоту до тех пор, пока значение рН не достигнет 7. Водный слой три раза экстрагируют 2,5 л этилацетата. Органический слой промывают водой, добавляют 5 г активированного угля (NoritR) и суспензию перемешивают при 21oС в течение 30 мин. Суспензию фильтруют через дикалит (dicalite) и фильтрат упаривают в вакууме до объема примерно 50 мл. Суспензию перемешивают в течение 1 ч при 0oС, после чего кристаллический продукт отфильтровывают, промывают этилацетатом и сушат в вакууме при 40oС, в результате получают 81 г дельта-(8,9)-дегидроэстрона с чистотой примерно 95%.
Содержание дельта-(8,9)-ДГЭ и эквилина определяют с использованием 1Н-ЯМР спектроскопии, характеристическими пиками которой являются 0,90 м.д. (С18) для дельта-(8,9)-ДГЭ и 5,53 м.д. (С7) и 0,79 м.д. (С18) для эквилина.
Пример 2. Амид лития (5 г) добавляют к смеси 5 г эквилина в 150 мл ДМСО. Смесь нагревают до 65oC и перемешивают при этой температуре в течение 70 мин. Реакционную смесь выливают в 500 мл воды и подкисляют до рН 6,5, используя 4 н соляную кислоту. Кристаллы отфильтровывают, промывают водой и сушат в вакууме при 40oС, в результате получают 5 г смеси эквилина и дельта-(8,9)-дегидроэстрона с соотношением 4:5 соответственно.
Пример 3. 6%-ный раствор комплекса метиллитий-литийбромид в диэтиловом эфире (23,5 мл) добавляют в течение приблизительно 15 мин к 46 мл этилендиамина в атмосфере азота при приблизительно 25oС. Температуру смеси повышают до 55oС и диэтиловый эфир отгоняют. После этого смесь перемешивают в течение 1 ч при 55oС. Смесь охлаждают до 20oС и добавляют 2,5 г эквилина. Смесь перемешивают в течение еще 90 мин при 30oС.
Суспензию выливают в ледяную воду и смесь экстрагируют этилацетатом. После упаривания этилацетатного экстрата до объема 20 мл и охлаждения до 0oС выделяют 2 г кристаллического дельта-8-эстрона.
Пример 4. Литий (1,1 г) порциями добавляют к 80 мл этилендиамина в атмосфере азота при 100oС и смесь перемешивают в течение 30 мин при 100oС. Реакционную смесь охлаждают до 23oС, после чего при температуре ≤30oС добавляют 4 г 17β -дигидроэквилина. Смесь дополнительно перемешивают в течение 4 ч при 30oС. Суспензию выливают в 250 мл ледяной воды и при температуре ≤25oС добавляют уксусную кислоту для доведения рН до 7. Суспензию охлаждают до 5oС и кристаллы отфильтровывают. Кристаллы суспендируют в 150 мл воды и добавляют 100 мл этилацетата. Фракции разделяют и этилацетатный раствор упаривают под вакуумом до объема 20 мл. Суспензию перемешивают при -15oС в течение 1 ч, после чего кристаллы отфильтровывают, промывают этилацетатом и сушат в вакууме при 40oС, в результате получают 2,5 г 8,9-дегидро-17β-эстрадиола с чистотой >95%.
Пример 5. Раствор метиллитий-литийбромида (20 мл, 2,1 М) в диэтиловом эфире добавляют в течение 10 мин к 40 мл этилендиамина в атмосфере азота при 36oС. Температуру смеси доводят до 55oС и диэтиловый эфир отгоняют. Смесь перемешивают в течение 1 ч при 55oС. Реакционную смесь охлаждают до 3oС, после чего при температуре ≤10oС добавляют 2 г эквилин-3-метилового эфира. Смесь перемешивают в течение 2 ч при 12oС, после чего добавляют 200 мл ледяной воды. К смеси добавляют уксусную кислоту для доведения рН до 8. Суспензию перемешивают в течение 1 ч при 15oС, после чего кристаллы отфильтровывают, промывают водой и сушат в вакууме при 45oС, в результате получают 2,0 г 8,9-дегидроэстрон-3-метилового эфира с чистотой приблизительно 80%.
Пример 6. В соответствии с методикой, описанной в примере 5, 17β-дигидроэквилин-3,17-диацетат обрабатывают метиллитий/этилендиамином при 30oС, в результате получают с количественным выходом 8,9-дегидро-17β-эстрадиол с чистотой приблизительно 90%.
Пример 7. В соответствии с методикой, описанной в примере 4, эквилин-17-неопентилацеталь обрабатывают литий/этилендиамином при 20oС, в результате получают 8,9-дегидроэстрон-17-неопентилацеталь (выход 90%) с чистотой приблизительно 90%.
Пример 8. В соответствии с методикой, описанной в примере 4, 17β-дигидроэквилин-3,17-ди(триметилсилилэфир) обрабатывают литий/этилендиамином, в результате получают с количественным выходом 8,9-дегидро-17β-эстрадиол с чистотой приблизительно 90%.
Пример 9. К суспензии эквилина (5 г) в 80 мл метиленхлорида добавляют 13,3 мл 3,4-дигидро-2Н-пирана и 36 мг п-толуолсульфокислоты при 0oС. Смесь перемешивают в течение 90 мин при 0oС, после чего добавляют 1,3 мл триэтиламина. Реакционную смесь промывают водой, сушат сульфатом натрия и упаривают досуха. Неочищенный эквилин-3-тетрагидропираниловый эфир (6,5 г) используют для изомеризации.
Пример 10. Раствор метиллитий-литийбромида (8,1 мл, 2,1 М) в диэтиловом эфире добавляют в течение 10 минут к 16,2 мл этилендиамина в атмосфере азота при 36oС. Температуру смеси повышают до 55oС и диэтиловый эфир отгоняют. Смесь дополнительно перемешивают в течение 1 ч при 55oС, затем охлаждают до 3oС. После добавления 34,4 мл тетрагидрофурана смесь охлаждают до -10oС и при температуре ≤-5oС добавляют эквилин-3-тетрагидропира-ниловый эфир (1,15 г). Смесь дополнительно перемешивают в течение 3 ч при -10oС, после чего добавляют 45 мл ледяной воды. Затем тетрагидрофуран отгоняют под вакуумом и оставшуюся суспензию перемешивают в течение 1 ч при 15oС. Кристаллы отфильтровывают, промывают водой и сушат под вакуумом при 45oС, в результате получают дельта-(8,9)-дегидроэстрон-3-тет-рагидропираниловый эфир (1,0 г).
Пример 11. Суспензию 0,73 г дельта-(8,9)-дегидроэстрон-3-тетрагидропиранилового эфира в смеси уксусная кислота/ацетон/ вода (4:2:1, 35,7 мл) нагревают до температуры кипения смеси и перемешивают при температуре кипения с обратным холодильником в течение 90 мин. После охлаждения до 20oС добавляют 36,5 мл воды и кристаллический продукт отфильтровывают, промывают водой и сушат под вакуумом, в результате получают 0,46 г дельта-(8,9)-дегидроэстрона.
Пример 12. Серную кислоту (8,2 мл) и уксусный ангидрид (14,5 мл) добавляют к пиридину (80 мл) при температуре <30oС в атмосфере азота. Смесь перемешивают в течение 1 часа при 50oС, затем добавляют трометамол (2-амино-2-гидроксиметил-1,3-пропандиол) (0,6 г) и смесь перемешивают до получения прозрачного раствора. Добавляют дельта-(8,9)-дегидроэстрон (4 г) и 17α-дигидроэквилин моноацетат (20,2 г) с последующим добавлением пиридина (21 мл) и смесь перемешивают в течение 3 ч при 50oС. После завершения реакции смесь охлаждают до 5oС и растирают с диэтиловым эфиром (300 мл), что приводит к образованию масла и верхнего слоя. Верхний слой декантируют и остаток растворяют в метаноле (375 мл). Добавляют раствор гидроксида натрия (12,8 г) в метаноле (0,3 л) и смесь перемешивают в течение 2,5 ч при температуре кипения. После завершения реакции смесь охлаждают до 20oС и добавляют смесь н-бутанола (0,65 л) и воды (0,15 л). Метанол упаривают под вакуумом и органический слой промывают 5%-ным водным раствором хлорида натрия и водой. После выпаривания органического слоя досуха остаток растворяют в 100% этаноле (0,29 л) при 60oС и смесь перемешивают в присутствии активированного угля (0,6 г) в течение 30 мин при 60oС. Суспензию фильтруют и фильтрат частично концентрируют в вакууме. Раствор охлаждают до 10oС, растирают в порошок с диэтиловым эфиром (0,27 л). Осадок фильтруют, промывают диэтиловым эфиром и сушат в вакууме в результате получают 15,5 г смеси натрийсульфата дельта-(8,9)-дегидроэстрона и натрийсульфата 17α-дигидроэквилина в соотношении 1:5. Анализ методом газожидкостной хроматографии (ГЖХ) показывает полное выделение всех загруженных стероидов.
Пример 13. В соответствии с методикой, описанной в примере 12, смесь дельта-(8,9)-дегидроэстрона (12,5 г) и эквилина (12,5 г) сульфатируют смесью серная кислота/уксусный ангидрид/пиридин. Смесь сырых пиридинсульфатов омыляют и превращают в соответствующую смесь натрийсульфатов обработкой гидроксидом натрия в метаноле, как описано в примере 12, в результате получают 27,5 г смеси дельта-(8,9)-дегидроэстрона натрийсульфата и эквилина натрийсульфата в соотношении 1:1, ГЖХ анализ показывает полное выделение всех загруженных стероидов.
Пример 14. В соответствии с методикой, описанной в примере 12, смесь дельта-(8,9)-дегидроэстрона (6,1 г), 17α-дигидроэквилина моноацетата (35,8 г), 17β-дигидроэквилина моноацетата (3,5 г), 17α-эстрадиола моноацетата (9,5 г) и 17β-эстрадиола моноацетата (1,2 г) сульфатируют смесью серная кислота/уксусный ангидрид/пиридин. Смесь сырых пиридинсульфатов обрабатывают гидроксидом натрия в метаноле и обрабатывают, как описано в примере 12, в результате получают 44,4 г смеси дельта-(8,9)-дегидроэстрона натрийсульфата; 17α-дигидроэквилина натрийсульфата, 17β-дигидроэквилина натрийсульфата, 17α-эстрадиола натрийсульфата и 17β-эстрадиола натрийсульфата в соотношении 6: 8: 1:31:3. ГЖХ анализ показывает полное выделение всех загруженных стероидов.
Изобретение относится к способу получения смеси сульфатированных эстрогенов, содержащей дельта - (8,9)-дегидроэстрон формулы I [дельта-(8,9)-ДГЭ] или его производные, где R1 - H, R2 - Н и R3 - O-ацил или R3 - Н и R2 - O-ацил, или R2 и R3 вместе - O и в формуле III R1- силил (алкил)3 или тетрагидропиранил, R2 и R3 вместе - O или R2 и R3 вместе - ацеталь. Способ включает (частичную) изомеризацию соединений формулы III обработкой литиевой солью этилендиамина или амидом лития в диметилсульфоксиде. Способ экономичен и прост в исполнении. 4 с. и 5 з.п. ф-лы.


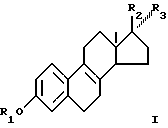
где R1 - Н;
R2 - Н и R3 - O-ацил, или
R3 - Н и R2 - O-ацил, или
R2 и R3 вместе - О,
в смеси с одним или большим количеством соединений, выбранных из группы соединений общей формулы II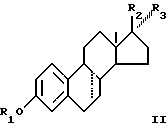
где R1, R2 и R3 принимают определенные выше значения;
пунктирная линия в положении 7-8 представляет необязательную двойную связь.
где R1 - силил(алкил)3 или тетрагидропиранил;
R2 и R3 вместе представляют собой О, или R2 и R3 вместе - ацеталь,
с помощью литиевой соли этилендиамина или с помощью амида лития в диметилсульфоксиде в соединения общей формулы I
где R1, R2 и R3 принимают значения, определенные выше;
b. конверсии соединений, полученных на стадии а, посредством которой заместитель R1 становится водородом, а заместители R2 и R3 вместе становятся О; с. сульфатирования соединений, полученных на стадии b, необязательно в смеси с одним или большим количеством моноацилпроизводных соединений из группы, включающей 17-альфа-дигидроэквилин, 17-бета-дигидроэквилин, 17-альфа-эстрадиол и 17-бета-эстрадиол.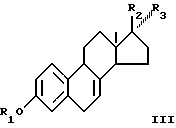
где R1 - силил(алкил)3 или тетрагидропиранил;
R2 и R3 вместе - О, или R2 и R3 вместе - ацеталь или циклический ацеталь,
с помощью литиевой соли этилендиамина или с помощью амида лития в диметилсульфоксиде в соединения общей формулы I
где R1, R2 и R3 принимают значения, определенные выше,
b. конверсии соединений, полученных на стадии а, посредством которой заместитель R1 становится водородом, а заместители R2 и R3 вместе становятся О; с. сульфатирования соединения, полученного на стадии b, в смеси с одним или большим количеством моноацилпроизводных соединений из группы, включающей 17-альфа-дигидроэквилин, 17-бета-дигидроэквилин, 17-альфа-эстрадиол и 17-бета-эстрадиол.
| ФИЗЕР Л., ФИЗЕР М | |||
| Стероиды | |||
| - М.: Мир, 1964, с.474-477 | |||
| Аппарат, предназначенный для летания | 0 |
|
SU76A1 |
| Methods in Enzymology | |||
| Прибор для нагревания перетягиваемых бандажей подвижного состава | 1917 |
|
SU15A1 |
| Protective Groups in Organic Synthesis | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Гребенчатая передача | 1916 |
|
SU1983A1 |
Авторы
Даты
2002-07-10—Публикация
1998-04-28—Подача